Содержание
Онлайн калькулятор: Уравнивание химических реакций
Калькулятор ниже предназначен для уравнивания химических реакций.
Как известно, существует несколько методов уравнивания химических реакций:
- Метод подбора коэффициентов
- Математический метод
- Метод Гарсиа
- Метод электронного баланса
- Метод электронно-ионного баланса (метод полуреакций)
Последние два применяются для окислительно-восстановительных реакций
Данный калькулятор использует математический метод — как правило, в случае сложных химических уравнений он достаточно трудоемок для ручных вычислений, но зато прекрасно работает, если все за вас рассчитывает компьютер.
Математический метод основан на законе сохранения массы. Закон сохранения массы гласит, что количество вещества каждого элемента до реакции равняется количеству вещества каждого элемента после реакции. Таким образом, левая и правая части химического уравнения должны иметь одинаковое количество атомов того или иного элемента. Это дает возможность балансировать уравнения любых реакций (в том числе и окислительно-восстановительных). Для этого необходимо записать уравнение реакции в общем виде, на основе материального баланса (равенства масс определенного химического элемента в исходных и полученных веществах) составить систему математических уравнений и решить ее.
Это дает возможность балансировать уравнения любых реакций (в том числе и окислительно-восстановительных). Для этого необходимо записать уравнение реакции в общем виде, на основе материального баланса (равенства масс определенного химического элемента в исходных и полученных веществах) составить систему математических уравнений и решить ее.
Рассмотрим этот метод на примере:
Пусть дана химическая реакция:
Обозначим неизвестные коэффициенты:
Составим уравнения числа атомов каждого элемента, участвующего в химической реакции:
Для Fe:
Для Cl:
Для Na:
Для P:
Для O:
Запишем их в виде общей системы:
В данном случае имеем пять уравнений для четырех неизвестных, причем пятое можно получить умножением четвертого на четыре, так что его можно смело отбросить.
Перепишем эту систему линейных алгебраических уравнений в виде матрицы:
Эту систему можно решить методом Гаусса. Собственно, не всегда будет так везти, что число уравнений будет совпадать с числом неизвестных. Однако прелесть метода Гаусса в том, что он как раз и позволяет решать системы с любым числом уравнений и неизвестных. Специально для этого был написан калькулятор Решение системы линейных уравнений методом Гаусса с нахождением общего решения, который и используется при уравнивании химических реакций.
Однако прелесть метода Гаусса в том, что он как раз и позволяет решать системы с любым числом уравнений и неизвестных. Специально для этого был написан калькулятор Решение системы линейных уравнений методом Гаусса с нахождением общего решения, который и используется при уравнивании химических реакций.
То есть калькулятор ниже разбирает формулу реакции, составляет СЛАУ и передает калькулятору по ссылке выше, решающему СЛАУ методом Гаусса. Решение потом используется для отображения сбалансированного уравнения.
Химические элементы следует писать так, как они написаны в таблице Менделеева, т. е. учитывать большие и маленькие буквы (Na3PO4 — правильно, na3po4 — неправильно).
Уравнение химической реакции
Сбалансированное уравнение
content_copy Ссылка save Сохранить extension Виджет
App Store: Химия
Решайте химические уравнения, Таблица Менделеева 2021, Таблица Растворимости и другие — и всё в одном приложении! Незаменимый помощник по химии! Химия — это просто!
Приложение находит Химические Реакции и химические уравнения с одним и несколькими неизвестными. У вас всегда будет под рукой Таблица Менделеева и Таблица Растворимости. И даже калькулятор молярных масс!
У вас всегда будет под рукой Таблица Менделеева и Таблица Растворимости. И даже калькулятор молярных масс!
Добавляйте виджеты с химическими элементами на рабочий стол – запоминайте полезную информацию подсознательно.
Находит уравнения химических реакций, даже если неизвестна правая или левая часть, поможет с органической и неорганической химией. Вам будут отображен список найденных реакций в обычном и ионном виде и нарисованы формулы органической химии.
Удобная интерактивная Таблица Менделеева с поиском и информацией о всех химических элементах доступной оффлайн. Нажмите на химический элемент в таблице, чтобы посмотреть справочную информацию.
Запоминайте химические элементы подсознательно с использованием виджетов для рабочего стола. Разместите один или несколько виджетов и время от времени смотрите информацию о химических элементах: порядковый номер и расположение в Таблице Менделеева, фотографии химических веществ, даты открытия элементов.
Калькулятор молярных масс. Введите правильно химическое соединение и калькулятор покажет молярные массы и процентные содержания элементов в заданном химическом веществе.
Введите правильно химическое соединение и калькулятор покажет молярные массы и процентные содержания элементов в заданном химическом веществе.
Таблица растворимости будет всегда под рукой, и вы сможете понять какая реакция идет, а какая нет. Теперь не придется открывать учебник, чтобы узнать нужную информацию.
Самый лучший решатель химических уравнений для iPhone и iPad.
* Таблица Менделеева
* Таблица растворимости
* Поиск химических реакций
* Оффлайн доступ к информации о химических элементах
* Калькулятор молярных масс химических веществ
* Ряд электроотрицательности элементов
* Молекулярные массы органических веществ
* Электрохимический ряд активности металлов
* Ряд активности кислот
* Названия кислот и кислотных остатков
* Виджеты для легкого изучения Химии
И все эти таблицы и калькуляторы в бесплатном приложении Химия.
Подробнее про условия использовани приложения можно прочитать по следующим ссылкам:
Terms of Use: http://getchemistry. io/terms-and-conditions/ios/
io/terms-and-conditions/ios/
Privacy policy: http://getchemistry.io/privacy-policy/ios/
Решение химических уравнений реакций онлайн. Онлайн решебник
Warning: include(reklama.php): failed to open stream: No such file or directory in /home/p520689/www/100formul.ru/himia.php on line 26
Warning: include(): Failed opening ‘reklama.php’ for inclusion (include_path=’.:’) in /home/p520689/www/100formul.ru/himia.php on line 26
составить реакцию
составить другую реакцию
Нажмите на элементы, чтобы подобрать вещества для составления реакции:
Неметаллы:
H
C
N
S
P
O
Cl
Si
Br
Se
I
F
B
As
Te
At
Металлы:
Na
Fe
K
Ca
Al
Cu
Mg
Zn
Ba
Ag
Li
Cr
Mn
Pb
Co
Ni
Hg
Be
Sn
Se
Au
Sr
Cd
V
Bi
Pd
Rb
Ti
Cs
W
Mo
Ga
Zr
Ge
Tl
Pt
Sb
Sc
Fr
Po
Y
Ra
Nb
In
Re
Rh
Ta
Ru
Os
Ir
Hf
Tc
Для составления реакции сначала нужно выбрать вещества. Например:
Например:
Допустим, Вы хотите составить реакцию
NH4OH + BeCl2 → ?
Для этого Вам сначала нужно нажать на N (азот), затем из предложенного списка веществ выбрать NH4OH. Вам будет представлен список веществ, с которыми может реагировать NH4OH. Находите в нем BeCl2, нажимаете на него, а потом «Составить реакцию». Если вы не нашли нужного вам вещества, значит с ним NH4OH либо не риагирует, либо пока еще этой реакции нет в нашей базе. Сожалеем об этом, в скором времени она обязательно появится.
Расставить коэффициенты в уравнении химической реакции онлайн.
Рекомендации по пользованию сервисом
1) Для того,чтобы расставить расставить коэффициенты в уравнении химической реакции онлайн вставьте уравнение и нажмите «Уравнять»
2) Символы химических элементов следует записывать строго в том виде, в котором они фигурируют в таблице Менделеева. Т.е. первая буква в обозначении символа любого химического элемента должна быть заглавной, а вторая строчной. Например, символ химического элемента марганца следует записать как Mn, но не ни в коем случае как mn и mN;
Т.е. первая буква в обозначении символа любого химического элемента должна быть заглавной, а вторая строчной. Например, символ химического элемента марганца следует записать как Mn, но не ни в коем случае как mn и mN;
3) Изредка возникают ситуации, когда формулы реагентов и продуктов записаны абсолютно верно, но коэффициенты все равно не расставляются. Такое может возникать в тех случаях, если коэффициенты в уравнении могут быть расставлены двумя или более способами. Наиболее вероятно возникновение такой проблемы с реакциями окисления органических веществ при которых рвется углеродный скелет. В таком случае попробуйте заменить неизменяемые фрагменты органических молекул на какой-нибудь произвольный символ, например радикал фенил C6H5 можно обозначить как Ph или X. Например, следующее уравнение:
C6H5CH2CH3 + KMnO4 + H2SO4 → C6H5COOH + CO2 + K2SO4 + MnSO4 + H2O
не будет сбалансировано, так как возможна разная расстановка коэффициентов. Однако, введя обозначение C6H5 = Ph, расстановка коэффициентов происходит корректно:
Однако, введя обозначение C6H5 = Ph, расстановка коэффициентов происходит корректно:
5PhCH2CH3 + 12KMnO4 + 18H2SO4 → 5PhCOOH + 5CO2 + 6K2SO4 + 12MnSO4 + 28H2O
Примечание
В уравнении допускается для разделения формул реагентов от формул продуктов использовать как знак равенства (=), так и стрелку (→), а также случайная запись отдельных букв символов химических элементов не латиницей, а кириллицей в случае их идентичного написания, как, например, символов C, H, O, P.
В случае, если программа оказалась полезной для Вас вы можете поделиться ссылкой на нее с друзьями в социальных сетях (кнопка внизу).
Уравнения химических реакций
Цикл занятий “Уравнения химических реакций” (программа 15 ч , 10 занятий) для учеников 8-9 классов. К курсу также могут присоединиться ученики 10-12-х классов, которые хотят улучшить свои знания основ химии.
Почему у многих школьников возникают проблемы с изучением химии? Химия — это не просто наука с яркими и эффектными экспериментами, но и та область, в которой используются свои символы, формулы и обозначения. По своей сути, химия — тот же иностранный язык со своими терминами и законами. В результате химических реакций происходят именно те процессы, которые так часто описываются в учебниках. Именно поэтому уравнения химических реакций — одна из основ химии.
В течение цикла занятий “Уравнения химических реакций” мы узнаем, как правильно записать химические реакции в уравнениях и как выполнять последующие действия с ними. Полученные знания и навыки помогут систематизировать школьные знания и справляться с химическими уравнениями в заданиях различной сложности, а также сэкономят Ваши средства и время, потраченные на репетиторов.
Автор программы: Мартыньш Гулбис — руководитель “Laboratorium zinātnes skola”.
Цель программы: ученики способны самостоятельно составлять и записывать уравнения химических реакций различной сложности.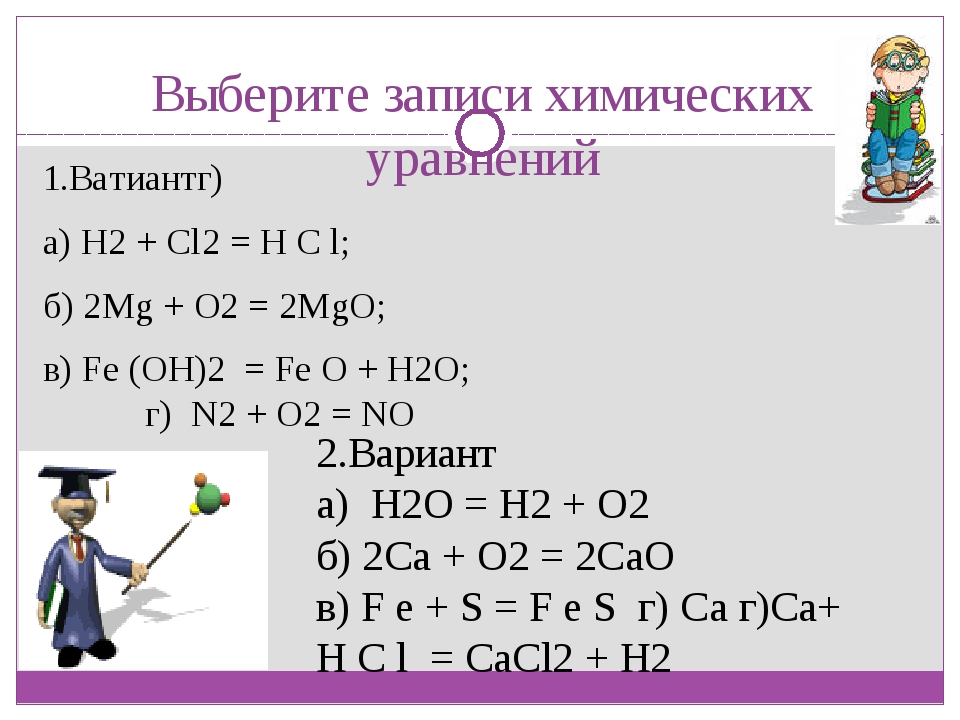
Темы занятий:
- Влияние атомной структуры на степень окисления.
- Индексы и составление молекулярных формул.
- Закон сохранения массы в уравнении реакции.
- Классификация веществ.
- Типы реакций.
- Таблица растворимости.
- Взаимодействие веществ и цепочки превращений.
- Количество вещества в уравнениях реакций.
- Задачи с уравнениями реакций.
- Закрепление знаний и тестирование.
Наша цель, чтобы в результате данных занятий участники приобрели следующие навыки и умения:
- Подсчитывать атомы элементов в соединениях и уравнениях реакций
- Находить коэффициенты в уравнениях реакции и самостоятельно проверять полученный результат
- Верно подбирать вещества для получения конкретной реакции и продукта
- Определять степень окисления элементов и писать химические формулы
- Определять классы веществ и типы реакций
- Использовать таблицу растворимости для составления уравнения реакции
- Выстраивать цепочки из уравнений реакций
- Использовать уравнения реакции для дальнейших вычислений
ЗАПИСАТЬСЯ
ОПЛАТА И ДРУГАЯ ВАЖНАЯ ИНФОРМАЦИЯ
Занятия будут проходить 1 раз в неделю, 10 раз.
Длительность одного занятия — 1,5 часа.
Количество участников: до 16 учеников
Взять с собой: тетрадь для записей, ручка, калькулятор.
Занятия будут проходить удаленно через платформу Google Classroom
В программу включены теория, демонстрации и практические задания разного уровня сложности: начиная с основ и вплоть до заданий “с орешком”. Именно поэтому абсолютно каждый участник программы, несмотря на уровень своей подготовки, получит новые знания и навыки. На каждом занятии присутствуют педагог и 1 или 2 ассистента, чтобы уделить внимание каждому ученику и сделать обучение еще более эффективным. В конце каждого занятия ребята проходят тест по пройденному материалу, а в конце курса их ожидает проверочная работа на все пройденные темы.
Цена: 99 Eur за всю программу (10 занятий) при оплате всей суммы сразу, 118 Eur при оплате 2 частями (5 занятий + 5 занятий).
Оплатить занятия необходимо до начала первого занятия по Счету, который будет вам выставлен и выслан после заполнения заявки — анкеты.
ЗАПИСАТЬСЯ
ДАТЫ БЛИЖАЙШИХ КУРСОВ
ДРУГИЕ КУРСЫ:
РЕШЕНИЕ ЗАДАЧ ПО ХИМИИ / ФИЗИКЕ
закончить уравнение реакций онлайн калькулятор
Вы искали закончить уравнение реакций онлайн калькулятор? На нашем сайте вы можете получить ответ на любой математический вопрос здесь. Подробное
решение с описанием и пояснениями поможет вам разобраться даже с самой сложной задачей и ионное уравнение онлайн, не
исключение. Мы поможем вам подготовиться к домашним работам, контрольным, олимпиадам, а так же к поступлению
в вуз.
И какой бы пример, какой бы запрос по математике вы не ввели — у нас уже есть решение.
Например, «закончить уравнение реакций онлайн калькулятор».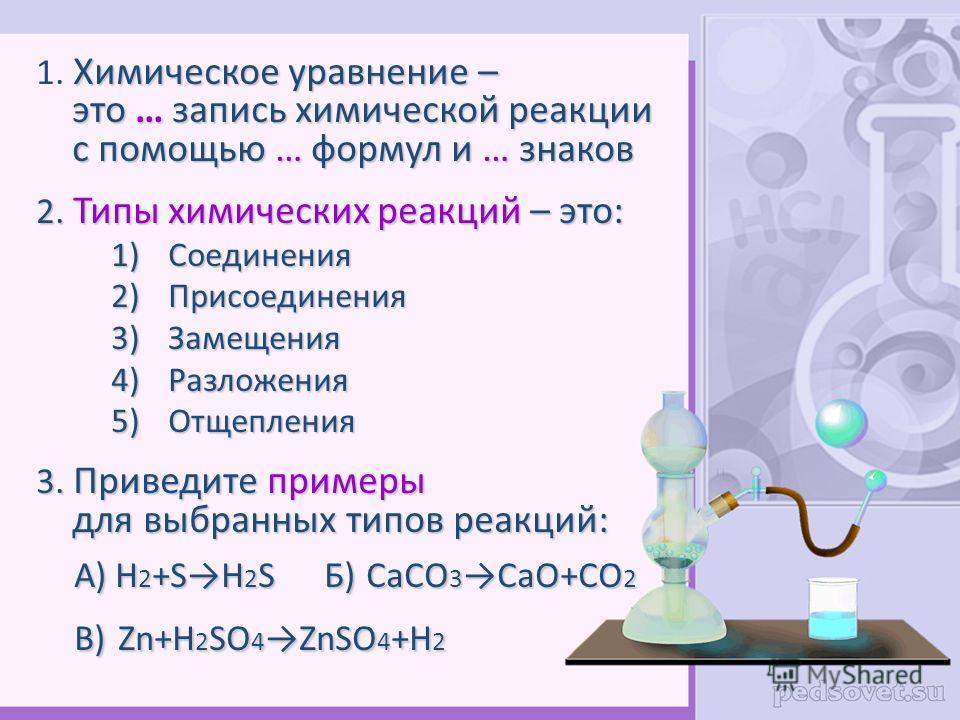
Применение различных математических задач, калькуляторов, уравнений и функций широко распространено в нашей
жизни. Они используются во многих расчетах, строительстве сооружений и даже спорте. Математику человек
использовал еще в древности и с тех пор их применение только возрастает. Однако сейчас наука не стоит на
месте и мы можем наслаждаться плодами ее деятельности, такими, например, как онлайн-калькулятор, который
может решить задачи, такие, как закончить уравнение реакций онлайн калькулятор,ионное уравнение онлайн,ионное уравнение онлайн калькулятор,ионное уравнение решить онлайн,ионное уравнение составить онлайн,ионные уравнения онлайн решение,ионные уравнения решение онлайн,калькулятор ионных уравнений,калькулятор коэффициентов онлайн химия,калькулятор коэффициентов химия онлайн,калькулятор овр онлайн,калькулятор онлайн уравнений по химии,калькулятор уравнений по химии,калькулятор уравнений по химии онлайн,калькулятор уравнений реакций,калькулятор уравнения по химии онлайн,калькулятор хим уравнений онлайн,калькулятор химических уравнений онлайн,калькулятор химических уравнений онлайн с решением,калькулятор химических уравнений онлайн с решением в полном виде,коэффициенты онлайн,метод полуреакций онлайн решение калькулятор,молекулярное уравнение онлайн,молекулярные уравнения онлайн,овр калькулятор онлайн,овр онлайн калькулятор,овр онлайн решение,окислительно восстановительные реакции решение онлайн,онлайн калькулятор ионное уравнение,онлайн калькулятор коэффициентов химия,онлайн калькулятор по химии уравнения,онлайн калькулятор уравнений по химии,онлайн калькулятор уравнения по химии,онлайн коэффициенты,онлайн овр решить,онлайн расставление коэффициентов,онлайн решатель химических уравнений,онлайн решение ионных уравнений,онлайн решение уравнений по химии,онлайн решение уравнений химия,онлайн решение хим уравнений,онлайн решение химический уравнений,онлайн решения уравнений по химии,онлайн решить овр,онлайн решить уравнение по химии,онлайн решить уравнения по химии,расставление коэффициентов онлайн,решатель уравнений по химии,решатель уравнений химических онлайн,решатель химических уравнений онлайн,решать химические уравнения онлайн,решение ионных уравнений онлайн,решение онлайн ионных уравнений,решение уравнение реакции онлайн,решение уравнений онлайн по химии,решение уравнений онлайн химия,решение уравнений химия онлайн,решение хим уравнений онлайн,решение химический уравнений онлайн,решение химических уравнений онлайн,решения уравнений онлайн по химии,решения химических уравнений онлайн,решить ионное уравнение онлайн,решить овр онлайн,решить онлайн ионное уравнение,решить онлайн уравнения по химии,решить уравнение онлайн по химии онлайн,решить уравнение онлайн химия,решить уравнение по химии онлайн,решить уравнение по химии онлайн бесплатно,решить уравнение химия онлайн,решить уравнения химические онлайн,решить химические уравнения онлайн,решить химическое уравнение онлайн,составление ионных уравнений онлайн,составление хим уравнений онлайн,уравнение реакции онлайн решение,уравнение реакции решение онлайн,уравнения молекулярные онлайн,уравнения онлайн калькулятор по химии,химические уравнения онлайн калькулятор,химические уравнения онлайн решить,химический калькулятор онлайн,химический калькулятор уравнений,химическое уравнение онлайн решение,химия калькулятор уравнений,химия онлайн решение уравнений,химия онлайн решения уравнений,химия онлайн решить уравнение,химия решение уравнений онлайн,химия решить уравнение онлайн,хімічні рівняння онлайн розв язок. На этой странице вы найдёте калькулятор,
На этой странице вы найдёте калькулятор,
который поможет решить любой вопрос, в том числе и закончить уравнение реакций онлайн калькулятор. Просто введите задачу в окошко и нажмите
«решить» здесь (например, ионное уравнение онлайн калькулятор).
Где можно решить любую задачу по математике, а так же закончить уравнение реакций онлайн калькулятор Онлайн?
Решить задачу закончить уравнение реакций онлайн калькулятор вы можете на нашем сайте https://pocketteacher.ru. Бесплатный
онлайн решатель позволит решить онлайн задачу любой сложности за считанные секунды. Все, что вам необходимо
сделать — это просто
ввести свои данные в решателе. Так же вы можете посмотреть видео инструкцию и узнать, как правильно ввести
вашу задачу на нашем сайте. А если у вас остались вопросы, то вы можете задать их в чате снизу слева на странице
калькулятора.
|
1. |
Химическая реакция
|
1 |
|
2. |
Реагенты и продукты реакции
|
1 |
|
3. 
|
Сколько атомов в формуле?
|
1 |
|
4. |
Пропущенный коэффициент
|
2 |
|
5. 
|
Найди ошибку в уравнении реакции
|
2 |
|
6. |
Характеристика реакции
|
3 |
|
7. 
|
Допиши уравнение
|
3 |
|
8. |
Соответствие между реагентами и продуктами реакции
|
3 |
|
9. 
|
Запиши уравнение реакции
|
4 |
Баланс химического уравнения — онлайн-балансировщик
Используя этот веб-сайт, вы тем самым подтверждаете свое согласие с Условиями использования и Политикой конфиденциальности. |
Онлайн-калькулятор: Калькулятор химических реакций
Этот онлайн-калькулятор балансирует уравнения химических реакций. Есть несколько методов уравновешивания химических уравнений:
- Метод проверки или метод «пробного и пробного»
- Алгебраический метод
- Метод, предложенный Аркесио Гарсия
- Метод изменения окислительного числа
- Ионно-электронный метод, или метод полуреакции
Последние два используются для окислительно-восстановительных реакций.
В этом балансировщике химических уравнений используется алгебраический метод, который обычно довольно сложен для ручных вычислений, однако он идеально подходит для компьютерной программы.
Алгебраический метод основан на Законе сохранения массы — материю нельзя ни создать, ни разрушить. Следовательно, количество атомов каждого типа на каждой стороне химического уравнения должно быть одинаковым. Уравновешивание химических уравнений — это процесс сохранения материи. Итак, вам просто нужно создать набор алгебраических уравнений, выражающих количество атомов каждого элемента, участвующего в реакции, и решить его.Поэтому этот метод можно использовать для любых химических реакций (включая окислительно-восстановительные реакции).
Позвольте мне проиллюстрировать этот метод на примере.
Рассмотрим реакцию:
Начнем с введения неизвестных коэффициентов:
Затем мы запишем уравнения баланса для каждого элемента в терминах неизвестных:
Для Fe:
Для Cl:
Для Na:
Для P:
Для O:
Они образуют систему линейных уравнений:
Здесь у нас есть пять уравнений для четырех неизвестных, однако последнее зависит от четвертого, поэтому его можно опустить.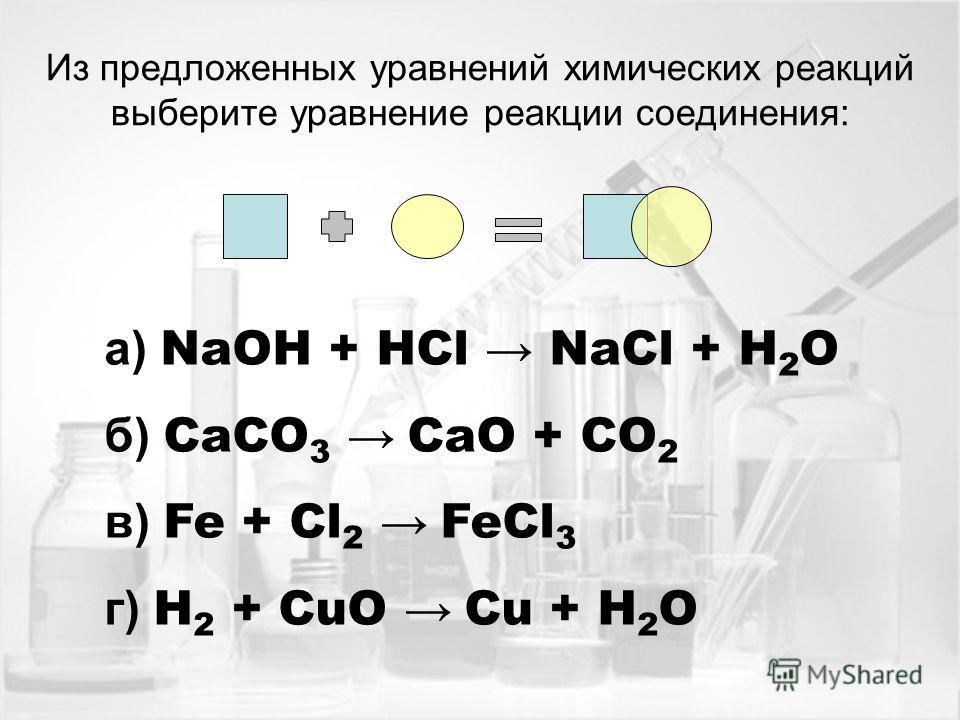
Теперь мы можем переписать эту систему в матричном виде:
Эта система может быть решена с помощью метода исключения Гаусса. Конечно, нельзя было ожидать, что количество неизвестных всегда будет равно количеству уравнений. Однако метод исключения Гаусса действительно мог найти решение для любого количества уравнений и неизвестных. Я создал специальный калькулятор, который реализует метод исключения Гаусса — / 6200 / — в форме, пригодной для химических реакций.Короче говоря, он просто сохраняет все дроби и в конце переходит к целому решению.
Таким образом, представленный ниже калькулятор просто анализирует химическую реакцию, создает систему линейных уравнений и передает ее в вышеупомянутый калькулятор исключения Гаусса. Возвращенное решение затем используется для отображения сбалансированного уравнения.
Примечание: Всегда используйте верхний регистр для первого символа в имени элемента и нижний регистр для второго символа, как в периодической таблице. Сравните: Co — кобальт и CO — окись углерода. Таким образом, Na3PO4 — правильная форма, na3po4 — неправильная форма.
Сравните: Co — кобальт и CO — окись углерода. Таким образом, Na3PO4 — правильная форма, na3po4 — неправильная форма.
Калькулятор химических уравнений
content_copy Ссылка сохранить Сохранить extension Widget
Калькулятор балансировки химического уравнения | Онлайн-балансировщик
Что такое химическое уравнение?
Химическое уравнение показывает общее химическое превращение реагентов в продукты. Реагенты — это то, с чего вы начинаете, а продукты — это то, что образуется.Есть два способа записать химические уравнения — словесное уравнение и символьное уравнение.
$$ \ text {NaOH} \; \; + \; \; \ text {HCl} \; \ rightarrow \; $$
$$ \ text {NaCl} \; \; + \; \; H_2O $$
Гидроксид натрия (NaOH)
Соляная кислота (HCl)
Хлорид натрия (NaCl)
Вода (H 2 O)
Как записывается химическое уравнение?
При написании химического уравнения реагенты находятся слева перед стрелкой, а продукты — справа. Стрелка —> показывает, что реакция необратима. Он показывает направление реакции. Знак плюс указывает на то, что на каждой стороне уравнения присутствует более одного реагента или продукта.
Стрелка —> показывает, что реакция необратима. Он показывает направление реакции. Знак плюс указывает на то, что на каждой стороне уравнения присутствует более одного реагента или продукта.
Словесное уравнение дает хорошее резюме, а символьное уравнение дает более подробную информацию. Он показывает больше информации и позволяет нам увидеть, сколько атомов и молекул участвует в каждой реакции.
Чтобы узнать больше о молекулах, воспользуйтесь нашим калькулятором из граммов в моли.Или, если вы хотите узнать долю молей, попробуйте Калькулятор молей.
Введение в балансировщик химических уравнений
Калькулятор химических уравнений балансировки работает разумно, так как есть искусственный интеллект. Калькулятор уравновешивающих уравнений выполняет функцию уравновешивания данного уравнения, вычисляя коэффициенты.
Используется алгоритм исключения Гаусса-Жордана, но с небольшими изменениями. Калькулятор химических уравнений балансировки бесплатный и простой в использовании.
Как работает калькулятор балансировки химических уравнений?
Если мы смешаем железо (Fe) с двумя молекулами кислорода (O 2 ) вместе, вы получите соединение (Fe 2 O 3 ) и то, что обычно называют ржавчиной. Итак, это хороший пример, показывающий, что происходит, когда вы оставляете свой велосипед под дождем.
Велосипед в основном состоит из стали. Сталь чиста на 95%, но железо смешивается с дождем, который представляет собой просто воду, а вода содержит кислород. Итак, железо и кислород соединяются вместе, и тогда на вашем велосипеде появляется раздражающее коричневое вещество Fe 2 O 3 , которое вы знаете как ржавчину.
$$ \ text {Fe} \; \; + \; \; O_2 \; \; \ rightarrow \; \; Fe_2O_3 $$
Чтобы сбалансировать это уравнение вручную без использования балансировщика уравнений, нам нужно иметь такое же количество железа в левой части, что и в правой части. Итак, с левой стороны у него один атом железа, а с правой стороны — два атома железа. Чтобы сделать их равными, добавьте количество двух молекул в левой части.
Чтобы сделать их равными, добавьте количество двух молекул в левой части.
$$ \ text {2Fe} \; \; + \; \; O_2 \; \; \ rightarrow \; \; Fe_2O_3 $$
Итак, сделаем то же самое с кислородом.С левой стороны у нас есть два атома кислорода, но с правой стороны у нас есть три атома кислорода. Нам нужно сделать это равным, но калькулятор произведения химического уравнения автоматически сделает это. Итак, в левой части нанесены два атома кислорода с полуторными молекулами.
$$ \ text {2Fe} \; \; + \; \; 1.5O_2 \; \; \ rightarrow \; \; Fe_2O_3 $$
Теперь у нас есть то же точное количество железа и кислорода в левой части, что и в правой части. Но мы возвращаемся с проблемой, потому что никогда не бывает половины молекулы.
Но мы заметили, что здесь есть полторы молекулы кислорода. Так как же нам избавиться от этой половины молекулы? Ответ на этот вопрос — умножить обе части на два.
Теперь у нас есть сбалансированное химическое уравнение. Калькулятор химического уравнения продукта работает с той же формулой и процедурой. Чтобы узнать о периоде полураспада, попробуйте Half Life Calculator, чтобы вы могли практиковаться во время выполнения.
Калькулятор химического уравнения продукта работает с той же формулой и процедурой. Чтобы узнать о периоде полураспада, попробуйте Half Life Calculator, чтобы вы могли практиковаться во время выполнения.
Как использовать калькулятор балансировки химического уравнения?
Наш калькулятор уравнения баланса бесплатный и простой в использовании.С помощью нашего калькулятора химической реакции вы легко сможете сбалансировать любое уравнение. Просто введите свое несбалансированное уравнение в заданном месте и нажмите «Баланс». Избегайте ненужных пробелов.
У нас есть периодическая таблица, помещенная в наш калькулятор химических уравнений, просто нажмите на значения и нажмите кнопку «Баланс» нашего калькулятора химического балансира, чтобы получить необходимые результаты.
Мы надеемся, что вам понравился наш калькулятор балансировки химических уравнений. Помимо нашего калькулятора балансировки химических уравнений, у нас также есть другие онлайн-калькуляторы, связанные с химией.
Если вы хотите рассчитать теоретическую доходность по ее формуле, просто воспользуйтесь нашим калькулятором теоретической доходности. Или, если вы хотите узнать, что такое процентная доходность и как ее рассчитать, попробуйте калькулятор процентной доходности.
Пожалуйста, поделитесь с нами своими ценными отзывами, чтобы мы могли постоянно улучшаться.
| Химия калькуляторы |
| Калькулятор атомной массы |
| Калькулятор атомной массы xls файл |
| Балансировка химических реакций, когда реакции неизвестны MATLAB Опубликованы M-файлы |
| Калькулятор точки кипения Калькулятор точки кипения |
| Буфер калькулятор Калькулятор рецептов термодинамически правильных буферов для контроль pH |
| Дизайн буфера Дизайн буфера для контроля pH |
| Расчет K: химическое равновесие Эта страница представляет собой упражнение по вычислению константы равновесия |
Расчет количества реагентов и продуктов в химическом |
| Калькулятор углерода используйте калькулятор для оценки выбросов углерода в вашей семье, сообщает вам сколько углерода вы добавляете в атмосферу каждый год и позволяет вам обязательство уменьшить его |
| Химическая промышленность расчеты, проверка экспериментальных данных, таблица Менделеева, молекулярная масса расчет, молекулярная формула, кинетика, Михаэлис Ментен, Больцманн, уравнение Эйринга, расчет кинетического разрешения, точки кипения, оптические расчет вращения, симулятор Rotavap, молекулы |
| Химическая Калькуляторы Молярная масса, эмпирическая формула, конвертер единиц измерения, d-d спектр, Квадратичное уравнение, кубическое уравнение, уравнение четвертой степени, уравнение пятой степени, Доза излучения, Энергетические потребности в продуктах питания, Кристаллические структуры, Молекулярные Орбитальная диаграмма |
| Химическая Балансир по уравнениям Химический балансир по уравнениям, Химические уравнения Калькулятор, Простой калькулятор для расчета коэффициентов химических реакций |
| Химическое уравнение Балансир |
| Chemputer интерактивные калькуляторы для химии: структура изотопов, процентное содержание элементов, выход реакции, степень окисления d-блочные металлы в комплексе, электронный учет металлов в комплексе, классификация атома в соединении |
| Калькулятор CO2 Калькулятор углекислого газа |
| Калькулятор CO2 Простой калькулятор углерода |
Калькулятор сжимаемости |
| Калькулятор концентрации |
| Калькулятор преобразования «мг / м 3 в ppm» или «ppm в мг / м 3 » |
| Дистилляция, давление пара, парожидкостное равновесие |
| Балансировщик уравнений Сбалансируйте сложные химические уравнения одним нажатием кнопки |
| Равновесие Calculator Этот калькулятор равновесия вычислит равновесные концентрации для шести реагентов и шести продуктов.Просто дайте ему константа равновесия |
| Равновесие калькулятор этот калькулятор равновесия найдет равновесные концентрации для системы с 2 равновесиями |
| Формула массы до апплет формулы |
| Грамм в Моли Конвертер Введите название соединения или элемента, введите массу в граммов, затем введите количество каждого элемента в соединении в таблицу |
| Калькулятор массы, Версия для одного изотопа Калькулятор точной массы, Версия для одного изотопа, Зная формулу химического вещества, калькулятор определяет точное масса одного изотопа этого вида и относительное содержание этого изотоп |
| Молярная масса Калькулятор рассчитает молярную массу любой молекулы, используя стандартную среднюю массу встречающихся в природе изотопов |
| MoleCalc Mole Calc рассчитывает молекулярную массу всех ваших химикатов |
Калькулятор молекулярной массы Калькулятор молекулярной массы |
| Молекулярный вес Тип расчета в химической молекулярной формуле |
| Калькулятор молекулярной массы Аплет-калькулятор молекулярной массы |
| Калькулятор молекулярной массы Калькулятор молекулярной массы |
| Калькулятор молекулярной массы |
| Калькулятор молекулярной массы |
| Молекулярный вес расчет |
Калькулятор молей, граммов, числа атомов для 4 металлов Моли, граммы, числа |
| Моли в Граммы Конвертер |
| Структура ЯМР определение изомеров C4h20O |
Калькулятор свойств олигонуклеотидов |
| Органические соединения База данных органических соединений |
| Свойства пептидов калькулятор |
| pH калькулятор эта программа рассчитает pH раствора известной концентрации, Калькулятор pH |
| Давление / Объем Калькулятор Закон газов Бойля |
| Закон Рауля Эта страница решает проблемы, связанные со смесями летучих материалов |
Калькулятор окислительно-восстановительных реакций Рассчитайте потенциал электрода для |
| Стехиометрический уравнения Этот сервлет занимается определением коэффициентов химического уравнения.Эти уравнения описывают взаимодействие между химические соединения / элементы качественно, а также количественно |
| Стехиометрия |
| Стехиометрия химические уравнения. Этот Java-апплет проверяет, происходит ли химическая реакция. правильно сбалансированный |
Калькулятор термодинамики Калькулятор энтальпии и свободной энергии Гиббса, |
| Horizontaal |
Дом Карта сайта Электронная почта: support [at] karadimov.инфо Последнее обновление: http://educypedia.karadimov.info |
Уравновешивание окислительно-восстановительных реакций ионно-электронным методом
У вас есть уравнение окислительно-восстановительного потенциала, которое вы не знаете, как сбалансировать? Помимо простой балансировки рассматриваемого уравнения, эти программы также предоставят вам подробный обзор всего процесса балансировки с помощью выбранного вами метода.
- Ионно-электронный метод (также называемый методом полуреакции)
- Метод изменения окислительного числа
- Метод агрегированных окислительно-восстановительных видов (или метод ARS) — Новое на сайте periodni.com [1]
ионно-электронным методом
В ионно-электронном методе (также называемом методом полуреакции) уравнение окислительно-восстановительного потенциала разделено на два полууравнения — одно для окисления, а другое — для восстановления. Каждую из этих полуреакций уравновешивают отдельно, а затем объединяют, чтобы получить сбалансированное окислительно-восстановительное уравнение.2+
Почему необходимо сбалансировать химические уравнения?
Сбалансированное химическое уравнение точно описывает количества реагентов и продуктов в химических реакциях. Закон сохранения массы гласит, что масса не создается и не разрушается при обычной химической реакции.Это означает, что химическое уравнение должно иметь одинаковое количество атомов каждого элемента с обеих сторон уравнения. Также сумма зарядов на одной стороне уравнения должна быть равна сумме зарядов на другой стороне. Когда эти два условия выполняются, уравнение считается сбалансированным.
Руководство по уравновешиванию уравнений окислительно-восстановительного потенциала
- Шаг 1. Запишите неуравновешенное уравнение
- Шаг 2. Разделите окислительно-восстановительную реакцию на половину реакции.
- a) Назначьте степени окисления для каждого атома
- б) Определите и запишите все окислительно-восстановительные пары в реакции
- c) Объединить эти окислительно-восстановительные пары в две полуреакции
.
- Шаг 3.Сбалансируйте атомы в каждой половине реакции
- a) Уравновесить все остальные атомы, кроме H и O
- б) Уравновесить атомы кислорода с H 2 O
- c) Уравновесить атомы водорода с помощью H +
- d) В основной среде добавьте по одному OH — с каждой стороны на каждые H +
.
- Шаг 4. Уравновесить заряд с помощью e —
- Шаг 5: Сделайте усиление электронов эквивалентным потере электронов в полуреакциях
- Шаг 6: сложите полуреакции вместе
- Шаг 7. Упростите уравнение
- Наконец, убедитесь, что элементы и заряды сбалансированы.
Пример уравнений окислительно-восстановительного потенциала
Ионное уравнение в сравнении с молекулярным уравнением
Когда уравнение записано в молекулярной форме, программа будет иметь проблемы с балансировкой атомов в полуреакциях (шаг 3.). Этого можно избежать, записав уравнение в ионной форме.
Разные решения
- KSCN + 4I 2 + 4H 2 O → KHSO 4 + 7HI + ICN
- SCN — + 5I 2 + 4H 2 O → HSO 4 — + 8I — + CN — + 2I + + 7H +
Уравновешивание химических уравнений с помощью алгебры
В последней из моих серий о балансировании химических уравнений мы рассмотрим алгебраический метод, который полезен для уравновешивания самых сложных уравнений
Хотя сочетание алгебры и уравновешивающих химических уравнений может показаться ужасающим, это не так плохо, как кажется.Часть алгебры довольно проста, нет ничего сложнее, чем одновременные уравнения, с которыми вы столкнетесь на математике уровня GCSE, если это так.
При этом этот математический подход подходит только для математически мыслящих студентов A Level или IB . Если вы его изучите, это может быть очень быстрый способ сбалансировать сложные уравнения, которые трудно сбалансировать при проверке, но нет формального требования для изучения этого метода , и вам никогда не нужно использовать его для балансировки химического уравнения на экзамене A Level или IB Diploma.
Существует два алгебраических метода: нормальный алгебраический метод и упрощенная версия, которая является лучшим способом взломать самые сложные уравнения. Давайте сначала рассмотрим алгебраический метод.
Алгебраический метод уравновешивания химических уравнений
Стратегия алгебраической балансировки химических уравнений выглядит следующим образом:
- Укажите разные буквенные коэффициенты перед каждым составным элементом в уравнении
- Напишите алгебраические выражения или правила для каждого элемента, которые уравнивают его атомы на левой и правой сторонах.
- Подставьте и упростите, чтобы получить правило, которое приравнивает только два буквенных коэффициента, которые вы можете решить.
- Подставьте значения в другие правила, чтобы получить коэффициенты балансировки
В этом нет никакого смысла, я уверен без примера, поэтому вот уравнение для баланса с использованием этой стратегии:
_KMnO 4 + _HCl → _MnCl 2 + _KCl + _Cl 2 + _H 2 O
Первое, что мы делаем, это присваиваем каждому соединению буквенный коэффициент:
.
a KMnO 4 + b HCl → c MnCl 2 + d KCl + e Cl 2 + f H 2 O
Затем, применяя закон сохранения массы, который говорит нам, что общее количество атомов каждого элемента должно быть одинаковым с обеих сторон, напишите алгебраические правила для каждого элемента.
K: a = d
Mn: a = c
O: 4 a = f
H: b = 2 f
Cl: b = 2 c + d + 2 e
Чтобы объяснить логику этого на примере Cl, мы знаем, что количество атомов хлора должно быть одинаковым с обеих сторон уравнения. Со стороны реагента у нас будет всего b атомов хлора.Что касается продукта, MnCl 2 содержит два атома хлора, поэтому, если его коэффициент равен c , он должен содержать 2c атомов хлора, в то время как KCl содержит d атомов хлора и так далее, суммируя общее количество атомы хлора на правой стороне.
Здесь слишком много неизвестных, но мы можем заменить правила для K и Mn на правило для Cl, чтобы избавиться от c и d :
b = 2 a + a + 2 e
b = 3 a + 2 e
Мы также можем избавиться от b , используя правило для H:
2 f = 3 a + 2 e
И, наконец, избавьтесь от f , используя правило для O:
2 (4 a ) = 3 a + 2 e
8 a = 3 a + 2 e
5a = 2e, следовательно, a = 2 и e = 5
Найдя теперь два коэффициента, подставив в правила для Cl и O и используя тот факт, что a = c = d = 2, решает для b и f :
b = 2 c + d + 2 e
b = 3 a + 2 e
b = 3 x 2 + 2 x 5
∴ b = 16
4 a = f
∴ f = 8
2KMnO 4 + 16HCl → 2MnCl 2 + 2KCl + 5Cl 2 + 8H 2 O
В том маловероятном случае, если это обнаружится в экзаменационной работе как вопрос о балансировке, вы обычно будете использовать метод балансировки окислительно-восстановительного потенциала, но я думаю, вы согласитесь, что этот метод быстрее.
Обратите внимание, что когда вы используете алгебраический метод, вы можете выполнить различные замены, чтобы исключить неизвестные. Это прекрасно, нет правильного или неправильного подхода.
Простой алгебраический метод уравновешивания химических уравнений
Теперь, если в приведенном выше примере вы думали: « держитесь, если a = c = d, зачем вообще вводить c и d? Почему бы не упростить все это? », вы были бы правы, и здесь на помощь приходит упрощенный алгебраический метод.Этот метод делает именно это — он использует логику, чтобы уменьшить количество неизвестных, которые вам нужно решить.
Это лучший из известных мне методов балансировки чрезвычайно сложных уравнений, а также очень быстрый метод балансировки сложных окислительно-восстановительных уравнений, если вы освоите его. Обратной стороной является то, что этот метод требует немного интуиции. Под этим я подразумеваю, что некоторые уравнения требуют от вас применения определенной балансировки по принципам проверки, чтобы упростить алгебраические выражения, которые вам в конечном итоге придется решать.
Процедура использования простого алгебраического метода приведена ниже, но, честно говоря, она будет выглядеть как gobbledegook, и единственный способ разобраться в этом — это проработать множество практических вопросов, которые, к счастью, я предоставил.
- Укажите элементы, появляющиеся только один раз на левой и правой сторонах уравнения.
- Если элемент (-ы) уже сбалансирован, укажите тот же буквенный коэффициент перед его соединениями
- Если элемент (ы) не сбалансирован, укажите буквенный коэффициент перед соединением, содержащим большее количество его атомов, затем уравновесите элемент с другой стороны уравнения, используя тот же буквенный коэффициент (с применением Сохранения массы).
- Поместите буквенные коэффициенты перед остальными составными частями.
- Минимизируйте необходимое количество букв, применяя принцип сохранения массы и логику, чтобы коэффициенты, представляющие элемент с одной стороны, выражались в терминах существующих коэффициентов, представляющих элемент с другой стороны. Идея состоит в том, чтобы уменьшить количество неизвестных.
- Стремитесь использовать не менее двух буквенных коэффициентов .
- Напишите алгебраическое правило для оставшихся элементов, которое уравнивает их с каждой стороны уравнения, замените и упростите, чтобы получить решения для каждого буквенного коэффициента.
- По возможности используйте принцип сохранения заряда, так как это может значительно уменьшить количество неизвестных (пример приведен ниже).
Мы воспользуемся тем же уравнением, что и выше, чтобы показать, как это работает:
_KMnO 4 + _HCl → _MnCl 2 + _KCl + _Cl 2 + _H 2 O
На этот раз мы начнем с того, что заметим, что кислород появляется только один раз с каждой стороны. Применяя приведенные выше правила, мы будем использовать тот же буквенный коэффициент перед KMnO 4 и H 2 O, поместив a перед KMnO 4 и 4a перед H 2 O , поскольку логически число перед H 2 O должно быть в четыре раза больше числа перед KMnO 4 , чтобы уравновесить кислород:
a KMnO 4 + _HCl → _MnCl 2 + _KCl + _Cl 2 + 4a H 2 O
Калий и марганец также появляются только по одному разу с каждой стороны, как и водород.Используя то, что я назвал правилом «принудительных коэффициентов» в этом блоге о балансировании химических уравнений, мы знаем, что коэффициент перед KCl и MnCl 2 также должен быть a :
a KMnO 4 + _HCl → a MnCl 2 + a KCl + _Cl 2 + 4a H 2 O
Для водорода коэффициент перед HCl должен быть в два раза больше коэффициента перед H 2 O, что составляет 8a :
a KMnO 4 + 8a HCl → a MnCl 2 + a KCl + _Cl 2 + 4a H 2 O
Остается только хлор, и мы дадим ему коэффициент b :
a KMnO 4 + 8a HCl → a MnCl 2 + a KCl + b Cl 2 + 4a H 2 O
Теперь можно написать алгебраическое правило для хлора:
8 a = 2 a + a + 2 b
5 a = 2 b , что дает a = 2 и b = 5
2KMnO 4 + 16HCl → 2MnCl 2 + 2KCl + 5Cl 2 + 8H 2 O
Вот еще один пример, на этот раз тот, в котором мы можем использовать принцип сохранения заряда, чтобы легко его решить:
_IO 3 + _I — + _H + → _I 2 + _H 2 O
Первый шаг — отметить, что кислород появляется по одному разу с каждой стороны уравнения, поэтому, следуя приведенным выше рекомендациям, мы начнем с помещения буквенного коэффициента a перед IO 3 и 3a перед H 2 O:
a IO 3 + _I — + _H + → _I 2 + 3a H 2 O
Водород также появляется по одному разу с каждой стороны уравнения, и если в H 2 O присутствует 3a , то на левой стороне должно быть 6a H + ионов:
a IO 3 + _I — + 6a H + → _I 2 + 3a H 2 O
Остается йод.Если мы поставим b перед I 2 на правой стороне, то общее количество атомов йода на правой стороне составит 2b , а общее количество атомов йода на левой стороне (с применением принципа сохранения массы) должно быть 2b -a ( a — количество атомов, присутствующих в IO 3 ):
a IO 3 + 2b-a I — + 6a H + → b I 2 + 3a H 2 O
Вот где приходит на помощь сохранение заряда.У RHS нет нетто-заряда, что означает, что у LHS также не должно быть нетто-заряда. Это означает, что коэффициент перед I — и H + должен быть равен, поэтому мы можем написать выражение, представляющее это:
2b-a = 6a
2b = 7a , следовательно, a = 2 и b = 7
Подстановка этих значений дает сбалансированное уравнение:
2 IO 3 + 12 I — + 12 H + → 7 I 2 + 6 H 2 O
Онлайн-калькулятор балансировки окислительно-восстановительных реакций
Реакция, в которой восстановитель теряет электроны при окислении, а окислитель приобретает электроны при восстановлении, называется окислительно-восстановительной реакцией (окисление-восстановление).С помощью этого калькулятора можно уравновесить несбалансированную окислительно-восстановительную реакцию.
Калькулятор балансировки окислительно-восстановительных реакций
Окислительно-восстановительная реакция — это химическая реакция, в которой окисление и восстановление происходят одновременно, а вещество, которое приобретает электроны, называется окислителем.
См. Следующую таблицу, в которой указаны степени окисления.
Таблица общих ионов
положительных ионов
| Валентность 1 | Валентность 2 | Валентность 3 | |||
|---|---|---|---|---|---|
| Литий | Ли + | Магний | мг 2+ | Алюминий | Al 3+ |
| Натрий | Na + | Кальций | Ca 2+ | Железо III | Fe 3+ |
| Калий | К + | Стронций | Sr 2+ | Хром | Кр 3+ |
| Серебро | Ag + | Барий | Ba 2+ | ||
| Гидроний | H 3 O + | Медь II | Cu 2+ | ||
| Водород | H + | Свинец II | Пб 2+ | ||
| Аммоний | NH 4 + | Цинк | Zn 2+ | ||
| Медь I | Cu + | Марганец II | млн 2+ | ||
| Меркурий I | Hg + | Утюг II | Fe 2+ | ||
| Олово II | Sn 2+ | ||||
Отрицательные ионы
| Валентность 1 | Валентность 2 | Валентность 3 | |||
|---|---|---|---|---|---|
| Фторид | Ф. — | Оксид | O 2- | Фосфат | PO 4 3- |
| Хлорид | Класс — | Сульфид | С 2- | ||
| Бромид | руб. — | Карбонат | CO 3 2- | ||
| Йодид | Я — | Сульфат | СО 4 2- | ||
| Гидроксид | ОН — | Сульфит | СО 3 2- | ||
| Нитрат | НЕТ 3 — | Дихромат | Cr 2 O 7 2- | ||
| Бикарбонат | HCO 3 — | Хромат | CrO 4 2- | ||
| Бисульфат | HSO 3 — | Оксалат | С 2 О 4 2- | ||
| Нитриты | НЕТ 2 — | Тиосульфат | S 2 O 3 2- | ||
| Хлорат | ClO 3 — | Тетратионат | S 4 O 6 2- | ||
| Перманганат | MnO 4 — | Моногидрофосфат | HPO 4 2- | ||
| Гипохлорит | OCl — | ||||
| Дигидрофосфат | H 2 PO 4 — | ||||
Пример: 1
Сбалансировать данную окислительно-восстановительную реакцию:
H 2 + + O 2 2- -> H 2 O
Принимая во внимание приведенное выше уравнение, у нас есть 2 водорода (H) с общим зарядом +1 [см. Заряды элементов в таблице выше] и 2 кислорода (O) с общим зарядом -2 на L.H.S и 2 водорода (H) с общим зарядом +2 и только 1 кислород (O) с общим зарядом -2 на R.H.S. Следовательно, из-за неравного количества зарядов молекул кислорода химическое уравнение считается несбалансированным.
Как уравновесить несбалансированное химическое уравнение?
Давайте узнаем здесь, как сбалансировать вышеприведенное несбалансированное уравнение, используя метод половинной реакции с пошаговой процедурой.
Дан,
H +1 2 + O -2 2 -> H +1 2 O -2
Чтобы сбалансировать несбалансированные заряды молекул кислорода, мы добавляем 2 перед произведением на R.H.S.
Получаем,
H +1 2 + O -2 2 -> (2) H +1 2 O -2
Теперь у нас есть 2 кислорода с общим зарядом -2 и 4 атома водорода с общим зарядом +4 на R.H.S.
Чтобы сбалансировать то же самое, мы добавляем еще 2 перед Hydrogen на L.H.S
.
(2) H +1 2 + O -2 2 -> (2) H +1 2 O -2
Теперь уравнение уравновешено с 4 атомами водорода (H) с общим зарядом +4 и 4 атомами кислорода с общим зарядом -4 с обеих сторон.
Пример: 2
Cr +3 + Cl -1 = Cr +3 + Cl -1 2
Принимая во внимание приведенное выше уравнение, у нас есть 1 хром (Cr) с общим зарядом +3 [см. Заряды элементов в приведенной выше таблице] и 1 хлорид (Cl) с общим зарядом -1 на LHS и 1 хром ( Cr) с общим зарядом +3 и только 2 хлорида (Cl) с общим зарядом -1 на правой стороне Следовательно, при неравном количестве зарядов молекулы кислорода химическое уравнение считается несбалансированным.
Как уравновесить несбалансированное химическое уравнение?
Давайте узнаем здесь, как сбалансировать вышеприведенное несбалансированное уравнение с помощью пошаговой процедуры.

 Химия, 8–9 класс: уроки, тесты, задания.
Химия, 8–9 класс: уроки, тесты, задания. Ответ появится ниже
Ответ появится ниже Введите количество молей или вес для одного из соединений, чтобы вычислить остальные.
Введите количество молей или вес для одного из соединений, чтобы вычислить остальные.