Содержание
Гидроксиды щелочных металлов (щелочи) | CHEMEGE.RU
Гидроксиды щелочных металлов (щелочи)
Способы получения
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гид-ридов и некоторых других бинарных соединений с водой также образуют-ся щелочи.
Например, натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
Na2O2 + H2O → 2NaOH + H2O2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например, карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Химические свойства
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид калия с фосфорной кислотой реагирует с образова-нием фосфатов, гидрофосфатов или дигидрофосфатов:
3KOH + H3PO4 → K3PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
KOH + H3PO4 → KH2PO4 + H2O
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Гидроксиды щелочных металлов реагируют с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
2NaOH(избыток) + CO2 → Na2CO3 + H2O
NaOH + CO2(избыток) → NaHCO3
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т. к. азот +4 только повышает степень окисления:
к. азот +4 только повышает степень окисления:
2KOH + 2NO2 + O2 = 2KNO3 + H2O
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например, гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
2NaOH + Al2O3 → 2NaAlO2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
2NaOH + Al2O3 + 3H2O → 2Na[Al(OH)4]
Еще пример: гидроксид натрия с гидроксидом алюминия в растворе образует также комплексную соль:
NaOH + Al(OH)3 → Na[Al(OH)4]
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например: гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
KOH + KHCO3 → K2CO3 + H2O
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
2NaOH + Si + H2O → Na2SiO3 + H2
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
4NaOH + 2F2 → 4NaF + O2 (OF2)+ 2H2O
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
3KOH + P4 + 3H2O = 3KH2PO2 + PH3↑
2KOH(холодный) + Cl2 = KClO + KCl + H2O
6KOH(горячий) + 3Cl2 = KClO3 + 5KCl + 3H2O
Сера взаимодействует с щелочами только при нагревании:
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
6. Щелочи взаимодействуют с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
Щелочи взаимодействуют с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
2KOH + Zn → K2ZnO2 + H2
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями.
С щелочами взаимодействуют соли тяжелых металлов.
Например, хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например, при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения, гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований. В воде практически нацело диссоциируют, образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na+ + OH—
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу. При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
ICSC 0357 — ГИДРОКСИД КАЛИЯ
ICSC 0357 — ГИДРОКСИД КАЛИЯ
| ГИДРОКСИД КАЛИЯ | ICSC: 0357 |
| ЕДКИЙ КАЛИ | Май 2010 |
| CAS #: 1310-58-3 | |
| UN #: 1813 | |
| EINECS #: 215-181-3 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. При контакте с влагой или водой может выделяться достаточное количество тепла, чтобы воспламенить горючие материалы. Риск взрыва при контакте с несовместимыми веществами. См. Химические Опасности. При контакте с влагой или водой может выделяться достаточное количество тепла, чтобы воспламенить горючие материалы. Риск взрыва при контакте с несовместимыми веществами. См. Химические Опасности. | НЕ допускать контакта с водой. НЕ допускать контакта с несовместимыми материалами: См. Химические Опасности | В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! ВО ВСЕХ СЛУЧАЯХ ОБРАТИТЬСЯ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Боли в горле. Ощущения жжения. Сбивчивое дыхание. | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Немедленно обратиться за медицинской помощью. Немедленно обратиться за медицинской помощью. |
| Кожа | Покраснение. Боль. Серьезные ожоги кожи. Волдыри. | Защитные перчатки. Защитная одежда. | Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ в течение не менее 15 минут. Обратиться за медицинской помощью. |
| Глаза | Покраснение. Боль. Помутнение зрения. Сильные ожоги. | Использовать маску для лица или средства защиты глаз в комбинации со средствами защиты органов дыхания.. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Боль в животе. Ожоги в полости рта и горле. Ощущение жжения в горле и груди. Тошнота. Рвота. Шок или сильная слабость. | Не принимать пищу, напитки и не курить во время работы.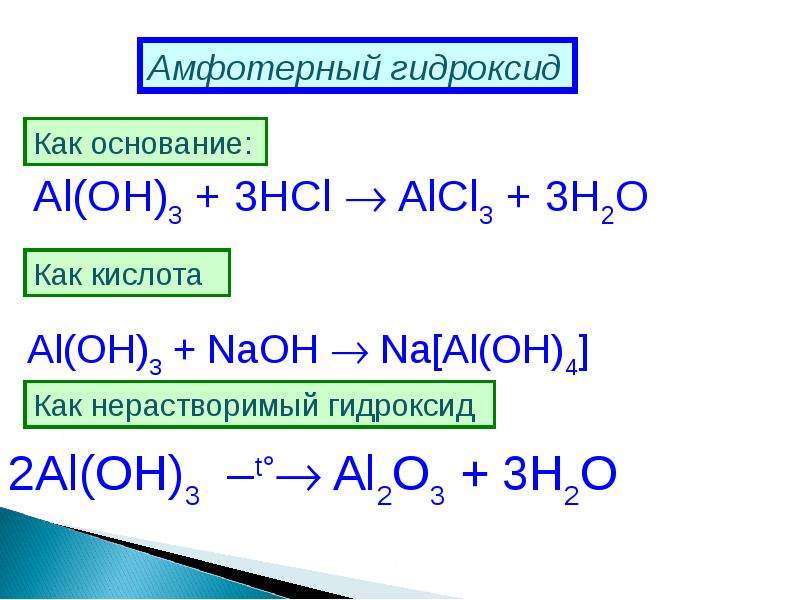 | Прополоскать рот. НЕ вызывать рвоту. Через несколько минут после проглатывания можно дать выпить один небольшой стакан воды. Обратиться за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: костюм химической защиты, включая автономный дыхательный аппарат. НЕ допускать попадания этого химического вещества в окружающую среду. ПластиковыеСмести просыпанное вещество в закрытые контейнеры. Тщательно собрать оставшееся. Затем хранить и утилизировать в соответствии с местными правилами. |
Согласно критериям СГС ООН
Транспортировка |
| ХРАНЕНИЕ | |
Отдельно от пищевых продуктов и кормов, сильных кислот и металлов. Хранить только в оригинальной упаковке. Хранить сухим. Хорошо закрывать. Хранить в местах не имеющих сливов или доступа к канализации Хранить только в оригинальной упаковке. Хранить сухим. Хорошо закрывать. Хранить в местах не имеющих сливов или доступа к канализации | |
| УПАКОВКА | |
| Не перевозить с продуктами питания и кормами для животных. |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ГИДРОКСИД КАЛИЯ | ICSC: 0357 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: KOH |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
TLV: 2 mg/m3 как STEL |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
Это вещество может быть опасным для окружающей среды. Особое внимание следует уделять водным организмам. |
| ПРИМЕЧАНИЯ |
|---|
| The applicable occupational exposure limit value should not be exceeded during any part of the working exposure. NEVER pour water into this substance; when dissolving or diluting always add it slowly to the water. Other UN number: UN1814 Potassium hydroxide solution, hazard class 8, packing group II-III. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: C; R: 22-35; S: (1/2)-26-36/37/39-45 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Химические свойства оснований
Щелочи реагируют с кремнием, галогенами, кислотами, кислотными и амфотерными оксидами, амфотерными металлами и растворимыми солями, если выпадает осадок или выделяется газ аммиак.
Щелочи при нагревании не разлагаются.
Нерастворимые основания реагируют с кислотами и разлагаются при нагревании на оксид металла и воду.
Амфотерные основания реагируют с кислотами, щелочами и разлагаются при нагревании.
Давайте порассуждаем вместе
1. Гидроксид кальция не взаимодействует с
1) оксидом углерода (IV)
2) карбонатом натрия
3) сульфатом меди (II)
4) хлоридом натрия
Ответ: №4, т.к. Ca(OH)2 — щелочь, щелочь не реагирует с солью (NaCl), если в результате реакции не выпадает осадок.
2. Гидроксид натрия реагирует с
1) хлоридом натрия
2) хлоридом меди (II)
3) сульфатом калия
4) аммиаком
Ответ: №2, т.
к. 2NaOH + CuCl2 = Cu(OH)2 + 2NaCl в результате реакции выпадает осадок Cu(OH)2
3. Какое основание при нагревании не разлагается?
1) гидроксид меди (II)
2) гидроксид алюминия
3) гидроксид магния
4) гидроксид натрия
Ответ: №4, т.к. щелочи при нагревании не разлагаются
4. Какое из веществ не реагирует с водным раствором щелочи?
1) алюминий
2) хлор
3) водород
4) хлороводород
Ответ: №3, т.к. из неметаллов со щелочью реагируют только галогены и кремний, водород со щелочью не реагирует
5. Какая из солей не реагирует с водным раствором гидроксида бария?
1) хлорид алюминия
2) нитрат натрия
3) карбонат натрия
4) сульфат железа (II)
Ответ: №2, т.
к. Ba(OH)2 — щелочь, щелочь не реагирует с солью (NaNO3), если в результате реакции не выпадает осадок.
6. Какая из солей реагирует с водным раствором гидроксида калия?
1) нитрат алюминия
2) хлорид бария
3) нитрат натрия
4) сульфат бария
Ответ: №1, т.к. Al(NO3)3 + 3KOH = Al(OH)3 + 3KNO3 в результате реакции выпадает осадок Al(OH)3
7. Вещество, которое разлагается при нагревании и взаимодействует и с серной, и с соляной кислотой
1) оксид цинка
2) сульфат калия
3) едкий натр
4) гидроксид меди (II)
Ответ: №4, т.к. Cu(OH)2 = CuO + H2O нерастворимое основание при нагревании разлагается и реагирует с кислотами
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Cu(OH)2 + 2 HCl = CuCl2 + 2H2O
Химические свойства оснований – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
Подробннее по ссылке
Основаниями называют класс химических соединений, которые состоят из катиона металла или иона аммония и одной или нескольких гидроксильных групп, способных к замещению на анионы. Классификация оснований и основные способы их получения описаны ранее в уроке 6.
Все основания легко реагируют с кислотами (реакция нейтрализации) и кислотными оксидами с образованием солей и воды:
Основания реагируют с кислыми солями с образованием солей и воды:
Щёлочи при сплавлении с амфотерными оксидами дают соль и воду:
Щёлочи могут вступать в реакции обмена с солями, если в результате этой реакции образуется осадок, например:
Нерастворимые в воде основания, а также гидроксид лития при нагревании разлагаются на оксид и воду:
Проиллюстрируем химические свойства амфотерных гидроксидов на примере реакций гидроксида цинка:
Тренировочные задания
1. Гидроксид лития вступает в реакцию с
1) гидроксидом аммония
2) гидроксидом натрия
3) гидроксидом алюминия
4) гидроксидом бария
2. Гидроксид лития реагирует со всеми веществами набора
Гидроксид лития реагирует со всеми веществами набора
1) NO, P2O5
2) CO, NO
3) N2O, FeO
4) SO2, SO3
3. Верны ли следующие суждения о гидроксиде лития?
А. Это вещество нерастворимо в воде.
Б. Гидроксид лития не вступает в реакцию с хлоридом натрия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
4. Гидроксид натрия вступает в реакцию с
1) сульфатом калия
2) сульфитом калия
3) хлоридом лития
4) хлоридом магния
5. Гидроксид натрия реагирует со всеми веществами набора
1) P2O5, SO3
2) KCl, FeCl3
3) NO, HNO3
4) N2O, Al(OH)3
6. Верны ли следующие суждения о гидроксиде натрия?
А. Гидроксид натрия является более слабым основанием по сравнению с гидроксидом магния.
Б. Гидроксид натрия не вступает в реакцию с хлоридом цинка.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Гидроксид калия вступает в реакцию с
1) сульфатом натрия
2) хлоридом меди
3) хлоридом лития
4) оксидом азота (II)
8. Гидроксид калия реагирует со всеми веществами набора
1) SO2, SiO2
2) P2O5, LiOH
3) NaCl, H3PO4
4) Ca3(PO4)2, NO
9. Верны ли следующие суждения о гидроксиде калия?
А. Гидроксид калия является более сильным основанием по сравнению с гидроксидом магния.
Б. Гидроксид калия вступает в реакцию с хлоридом железа (II).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
10. Гидроксид цинка вступает в реакцию с
1) сульфатом калия
2) хлоридом натрия
3) оксидом железа (II)
4) гидроксидом бария
11. Гидроксид цинка реагирует со всеми веществами набора
Гидроксид цинка реагирует со всеми веществами набора
1) NO, P2O5
2) CO, NO
3) N2O, FeO
4) HNO3, SO3
12. Верны ли следующие суждения о гидроксиде цинка?
А. Это вещество нерастворимо в воде.
Б. Гидроксид цинка не вступает в реакцию с сульфатом калия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
13. Гидроксид алюминия вступает в реакцию с
1) сульфатом натрия
2) хлороводородом
3) фосфатом калия
4) оксидом азота (I)
14. Гидроксид алюминия реагирует со всеми веществами набора
1) K2SO3, SiO2
2) P2O5, LiOH
3) NaCl, H3PO4
4) CaSO4, NO
15. Верны ли следующие суждения о гидроксиде алюминия?
А. Гидроксид алюминия является более сильным основанием по сравнению с гидроксидом натрия.
Б. Гидроксид вступает в реакции с основаниями и основными оксидами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
16. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) NaOH + HI →
Б) NaOH + NaHSO4 →
В) NaOH + Al2O3 ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ
1) NaAlO2
2) Na2SO4
3) NaI + H2O
4) NaAlO2 + H2O
5) Na2SO4 + H2O
17. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Zn(OH)2 + NaOH (водн. р-р) →
Б) Zn(OH)2 + NaOH ⎯⎯сплавление→
В) Zn(OH)2 ⎯⎯t→
ПРОДУКТЫ РЕАКЦИИ
1) ZnO
2) ZnO + H2O
3) Na2ZnO2
4) Na2[Zn(OH)4]
5) Na2ZnO2 + H2O
18. Установите соответствие между реагирующими веществами и продуктами реакций.
Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) LiOH + HNO3 →
Б) LiOH + S →
В) LiOH + Al(OH)3 →
ПРОДУКТЫ РЕАКЦИИ
1) LiNO3 + H2↑
2) Li2S
3) Li2S + Li2SO3 + H2O
4) LiNO3 + H2O
5) Li[Al(OH)4]
19. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Zn(OH)2 + H2SO4 →
Б) Zn(OH)2 + Na2CO2 ⎯⎯сплавление→
В) Zn(OH)2 + Na2O ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ
1) ZnSO4 + H2O
2) ZnSO4 + H2↑
3) Na2[Zn(OH)4] + H2↑
4) Na2ZnO2 + H2O 5) Na2ZnO2 + CO2↑
20. Установите соответствие между реагирующими веществами и продуктами реакций.
Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) NaOH + ZnCl2 →
Б) NaOH + FeCl2 →
В) NaOH + Al2O3 ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ
1) NaAlO2
2) Fe(OH)2 + NaCl
3) Na2[Zn(OH)4] + H2O
4) NaAlO2 + H2O
5) Na2[Zn(OH)4] + NaCl
21. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
22. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
23. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Для второго превращения составьте сокращённое ионное уравнение реакции.
24. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Ответы
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Гидроксид лития (литий гидроокись, литий едкий)
CAS Number: 1310-65-2
Гидроксид лития – неорганическое основание щелочного металла лития.
Физические свойства гидроксида лития
Гидроксид лития представляет собой бесцветное кристаллическое твердое вещество при обычных температурах. Он является сильным основанием, и с ним следует обращаться осторожно, чтобы избежать ожогов. Выпаривание раствора гидроксида лития при нормальных условиях температуры и давления приводит к осаждению моногидрата, который может быть легко обезвожен путем нагревания в вакууме или под прикрытием инертного газа.
Химические свойства гидроксида лития
Гидроксид лития поглощает воду из воздуха и образует моногидрат гидроксида лития, за исключением сухих атмосферных условий. Как безводный, так и моногидрат гидроксида лития поглощают углекислый газ из воздуха с образованием карбоната лития. Растворимость гидроксида лития в воде ниже, чем у других гидроксидов щелочных металлов. Однако гидроксид лития является сильным основанием и полностью реагирует как со слабыми, так и с сильными кислотами в водных растворах.
Получение гидроксида лития
Моногидрат может быть получен, когда гидроксид лития реагирует с водяным паром в воздухе или образует кристаллы в водном растворе. Он может реагировать с кислотным газом, таким как диоксид серы, хлористый водород, цианистый водород и т. д. Он также может реагировать с сильными или слабыми кислотами в водном растворе. Поглощение углекислого газа в воздухе может привести к образованию карбоната лития.
Применение гидроксида лития
Гидроксид лития используется в качестве присадки к смазке (загустители, антиоксиданты, противозадирные присадки) для улучшения термостойкости, водостойкости, стабильности и механических свойств. Смазочные добавки можно использовать в подшипниках автомобилей, самолетов и кранов; сырье из литиевого аккумулятора электролит.
Смазочные добавки можно использовать в подшипниках автомобилей, самолетов и кранов; сырье из литиевого аккумулятора электролит.
Обожженный твердый гидроксид лития может быть использован в качестве абсорбента углекислого газа для членов экипажа космического корабля и подводной лодки. Только 750 г безводного гидроксида лития могут поглощать углекислый газ, выдыхаемый одним человеком каждый день.
Кроме того, гидроксид лития также широко используется в качестве сырья для приготовления других веществ, в частности таких как: соединение лития, соль лития, литиевые мыла, литиевая смазка, алкидные смолы, проявитель спектрального анализа, добавки щелочной аккумуляторной батареи, фотографические проявители и катализатор. и т.д. Он может увеличить емкость батареи на 12% ~ 15% и увеличить срок службы батареи в 2 ~ 3 раза, когда она используется в качестве добавки для щелочной аккумуляторной батареи. Щелочная аккумуляторная батарея в качестве добавки к электролиту.
Моногидрат гидроксида лития является исходным материалом для многих других литиевых химикатов, таких как фторид лития, хлорид лития, бромид лития и йодид лития.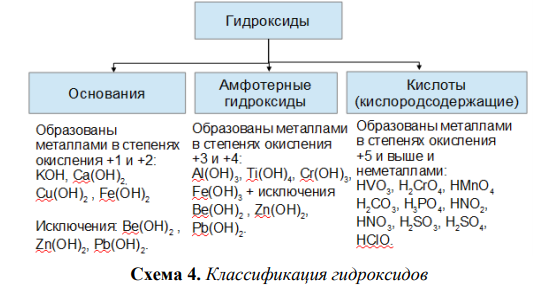 Поскольку эти материалы получают в водных растворах, нет особого преимущества в использовании безводного гидроксида для приготовления. Другие соли слабых и сильных кислот могут быть получены с использованием гидроксида лития в качестве исходного материала.
Поскольку эти материалы получают в водных растворах, нет особого преимущества в использовании безводного гидроксида для приготовления. Другие соли слабых и сильных кислот могут быть получены с использованием гидроксида лития в качестве исходного материала.
Основным применением моногидрата гидроксида лития является приготовление литиевых солей жирных кислот (литиевых мыл), которые вместе с минеральным маслом и другими добавками используются для изготовления смазок на основе лития. Такие смазки производят смазки на основе других ионов металлов. Литиевые смазки являются хорошими смазками при высоких температурах и особенно хороши при низких температурах.
Хранение
Гидроксид лития хранят в складских помещениях с естественной вентиляцией в условиях, исключающих конденсацию влаги на поверхности тары.
Гарантийный срок хранения – 10 лет со дня изготовления.
Безопасность
Лития гидроокись техническая пожаро- и взрывобезопасна, по степени воздействия на организм относится к веществам 1-го класса опасности.
Купить гидроксид лития (литий гидроокись, литий едкий)
Компания Химпродукт предлагает купить гидроксид лития (литий гидроокись, литий едкий) в Украине с наших складов в городах Киев, Харьков, Днепр, Одесса и Львов.
Подробную информацию, а также цену гидроксид лития (литий гидроокись, литий едкий) Вы можете узнать у наших менеджеров по телефонам:
+ 38 (098) 882–15–15 (Viber, Telegram, WhatsApp)
+ 38 (093) 880–15–15
+ 38 (066) 306–10–50
+ 38 (044) 228–08–72
либо задать вопрос на email: [email protected]
Также заказать гидроксид лития (литий гидроокись, литий едкий) Вы можете на нашем сайте chem.ua
Отправка заказов по Украине осуществляется службами доставки и собственным транспортом.
Химические свойства оснований и амфотерных гидроксидов ЕГЭ 2021 / Блог / Справочник :: Бингоскул
Химические свойства оснований
- Основания способны реагировать с кислотами и кислотными оксидами. В ходе взаимодействия происходит образование солей и воды
- Щелочи, гидроксид аммония всегда реагируют с растворами солей, только в случае образования нерастворимых оснований.
- Реакция кислоты с основанием именуется нейтрализацией. В ходе данной реакции, катионы кислот Н+ и анионы оснований ОН— образуют молекулы воды. После чего, среда раствора становится нейтральной. В результате начинается выделение тепла. В растворах, это ведет к постепенному нагреву жидкости. В случае крепких растворов, тепла более чем достаточно, чтобы жидкость начала кипеть. Необходимо помнить, что реакция нейтрализации происходит достаточно быстро.
| Сильные основания |
|
| Слабые основания |
|
Химические свойства амфотерных гидроксидов
- Амфотерные основания реагируют и с кислотами и со щелочами.
 В ходе взаимодействия происходит образование соли и воды. При прохождении какой — либо реакции с кислотами, амфотерные основания всегда проявляют свойства типичных оснований.
В ходе взаимодействия происходит образование соли и воды. При прохождении какой — либо реакции с кислотами, амфотерные основания всегда проявляют свойства типичных оснований. - В ходе реакции со щелочами, амфотерные основания способны проявлять свойства кислот. В процессе сплавления со щелочами, образуется соль и вода.
- При взаимодействии с растворами щелочей, всегда будут образовываться комплексные соли.
- Щелочи растворяют амфотерные металлы. В ходе данной реакции выделяется водород. В результате данной химической реакции, при опускании в раствор щелочи алюминия, выделяется газ. Так же это можно увидеть при его поджигании.
Гидроксиды и их классификация
Основания образуются атомами металлов и гидроксогруппой (ОН—), поэтому их называют гидроксидами.
1. По отношению к воде основания подразделяются на:
- растворимые — гидроксиды щелочных и щелочноземельных металлов, поэтому их называют щелочами, гидроксид аммония, но он слабый электролит.
 Основания, образованные остальными металлами в воде не растворяются. Щелочи в водном растворе диссоциируются полностью до катионов металла и анионов гидроксид — ионов ОН—.
Основания, образованные остальными металлами в воде не растворяются. Щелочи в водном растворе диссоциируются полностью до катионов металла и анионов гидроксид — ионов ОН—. - нерастворимые
2. По взаимодействию с иными химическими веществами гидроксиды делятся на:
- основные гидроксиды — заряд катиона равен +1 или +2
- кислотные гидроксиды (кислородсодержащие кислоты),
- амфотерные гидроксиды — заряд катиона равен +3 или +4
Ряд исключений:
- La(OH)3, Bi(OH)3, Tl(OH)3 – основания;
- Be (OH)2, Sn (OH)2, Pb(OH)2, Zn(OH)2, Ge(OH)2 — амфотерными основания.
Смотри химические свойства
Решай с ответами:
Химические реакции алюминия – aluminium-guide.
 com
com
Химические свойства алюминия
Химические свойства алюминия определяются его положением в периодической системе химических элементов.
Ниже представлены основные химические реакции алюминия с другими химическими элементами. Эти реакции определяют основные химические свойства алюминия.
С чем реагирует алюминий
Простые вещества:
- галогены (фтор, хлор, бром и иодин)
- сера
- фосфор
- азот
- углерод
- кислород (горение)
Сложные вещества:
- вода
- минеральные кислоты (соляная, фосфорная)
- серная кислота
- азотная кислота
- щелочи
- окислители
- оксиды менее активных металлов (алюмотермия)
С чем не реагирует алюминий
Алюминий не реагирует:
- с водородом
- в обычных условиях – с концентрированной серной кислотой (из-за пассивации – образования плотной оксидной пленки)
- в обычных условиях – с концентрированной азотной кислотой (также из-за пассивации)
См. подробнее по химии алюминия
подробнее по химии алюминия
Алюминий и воздух
Обычно поверхность алюминия всегда покрыта тонким слоем оксида алюминия, который защищает ее от воздействия воздуха, точнее, кислорода. Поэтому считается, что алюминий не вступает в реакцию с воздухом. Если же этот оксидный слой повреждается или удаляется, то свежая поверхность алюминия реагирует с кислородом воздуха. Алюминий может гореть в кислороде ослепительно белым пламенем с образованием оксида алюминия Al2O3.
Реакция алюминия с кислородом:
Алюминий и вода
Алюминий реагирует с водой по следующим реакциям [2]:
- 2Al + 6H2O = 2Al(OH)3 + 3H2 (1)
- 2Al + 4H2O = 2AlO(OH) + 3H2 (2)
- 2Al + 3H2O = Al2O3 + 3H2 (3)
В результате этих реакций образуются, соответственно, следующие соединения алюминия:
- модификация гидроксида алюминия байерит и водород (1)
- модификация гидроксида алюминия богемит и водород (2)
- оксид алюминия и водород (3)
Эти реакции, кстати, представляют большой интерес при разработке компактных установок для получения водорода для транспортных средств, которые работают на водороде [2].
Все эти реакции являются термодинамически возможными при температуре от комнатной до температуры плавления алюминия 660 ºС. Все они являются также экзотермическими, то есть происходят с выделением тепла [2]:
- При температуре от комнатной до 280 ºС наиболее устойчивым продуктом реакции является Al(OH)3.
- При температуре от 280 до 480 ºС наиболее устойчивым продуктом реакции является AlO(OH).
- При температуре выше 480 ºС наиболее устойчивым продуктом реакции является Al2O3.
Таким образом, оксид алюминия Al2O3 становится термодинамически более устойчивым, чем Al(OH)3 при повышенной температуре. Продуктом реакции алюминия с водой при комнатной температуре будет гидроксид алюминия Al(OH)3.
Реакция (1) показывает, что алюминий должен самопроизвольно реагировать с водой при комнатной температуре. Однако на практике кусок алюминия, опущенный в воду, не реагирует с водой в условиях комнатной температуры и даже в кипящей воде. Дело в том, что алюминий имеет на поверхности тонкий когерентный слой оксида алюминия Al2O3. Эта оксидная пленка прочно удерживается на поверхности алюминия и предотвращает его реакцию с водой. Поэтому, чтобы начать и поддерживать реакцию алюминия с водой при комнатной температуре необходимо постоянно удалять или разрушать этот оксидный слой [2].
Дело в том, что алюминий имеет на поверхности тонкий когерентный слой оксида алюминия Al2O3. Эта оксидная пленка прочно удерживается на поверхности алюминия и предотвращает его реакцию с водой. Поэтому, чтобы начать и поддерживать реакцию алюминия с водой при комнатной температуре необходимо постоянно удалять или разрушать этот оксидный слой [2].
Алюминий и галогены
Алюминий бурно реагирует со всем галогенами – это:
- фтор F
- хлор Cl
- бром Br и
- иодин (йод) I,
с образованием соответственно:
- фторида AlF3
- хлорида AlCl3
- бромида Al2Br6 и
- иодида Al2Br6.
Реакции водорода со фтором, хлором, бромом и иодином:
- 2Al + 3F2 → 2AlF3
- 2Al + 3Cl2 → 2AlCl3
- 2Al + 3Br2 → Al2Br6
- 2Al + 3l2 → Al2I6
Алюминий и кислоты
Алюминий активно вступает в реакцию с разбавленными кислотами: серной, соляной и азотной, с образованием соответствующих солей: сернокислого алюминия Al2SO4, хлорида алюминия AlCl3 и нитрата алюминия Al(NО3)3.
Реакции алюминия с разбавленными кислотами:
- 2Al + 3H2SO4 —> Al2(SO4)3 + 3H2
- 2Al + 6HCl —> 2AlCl3 + 3H2
- 2Al + 6HNO3 —> 2Al(NO3)3 + 3H2
С концентрированными серной и соляной кислотами при комнатной температуре не взаимодействует, при нагревании реагирует с образованием соли, окислов и воды.
Алюминий и щелочи
Алюминий в водном растворе щелочи – гидроксида натрия – реагирует с образованием алюмината натрия.
Реакция алюминия с гидроксидом натрия имеет вид:
- 2Al + 2NaOH + 10H2O —> 2Na[Al(H2O)2(OH)4] + 3H2
Все важнейшие реакции с алюминием
Для полноты информации приводим перечень основных реакций с участием алюминия из фундаментальной книги про алюминий [3]:
Важнейшие реакции с участием алюминия [3]
Источники:
1. Chemical Elements. The first 118 elements, ordered alphabetically / ed. Wikipedians – 2018
Chemical Elements. The first 118 elements, ordered alphabetically / ed. Wikipedians – 2018
2. Reaction of Aluminum with Water to Produce Hydrogen /John Petrovic and George Thomas, U.S. Department of Energy, 2008
3. Тринадцатый элемент: Энциклопедия / А. Дроздов – Библиотека РУСАЛа, 2007.
С чем вступает в реакцию гидроксид натрия?
Гидроксид натрия (NaOH) — это сильнощелочное органическое соединение, которое также очень гигроскопично. Также известный как каустическая сода или щелок, он вступает в реакцию с рядом соединений, давая очень разные результаты.
Растворение в воде
Гидроксид натрия ионизируется при растворении в воде. Хотя это не обязательно может быть химическая реакция, это важная характеристика того, как это основное соединение ведет себя в водном растворе.
В воде гидроксид натрия может полностью диссоциировать, распадаясь на ионы натрия (Na +) и ионы гидроксида (OH-). При таком растворении раствор становится очень щелочной средой с высоким pH.
Водный раствор также будет очень скользким, но важно избегать контакта с кожей, поскольку гидроксид натрия является наиболее агрессивным при растворении в воде. Это происходит из-за избытка ионов OH-, которые делают раствор чрезвычайно щелочным и едким.
Реакции с кислотами
Гидроксид натрия подвергается реакции нейтрализации при соединении с кислотой. Это делает его подходящим в качестве регулятора pH во многих отраслях промышленности, таких как водоподготовка, из-за его способности нейтрализовать или контролировать кислотность.
NaOH реагирует с кислотой с образованием воды и ионного соединения. Например, когда гидроксид натрия реагирует с соляной кислотой (HCl), ион гидроксида из NaOH реагирует с ионом водорода в HCl с образованием воды (H 2 O).
Затем остальная кислота соединяется с оставшимися ионами натрия с образованием ионного соединения хлорида натрия (NaCl). Происходящая здесь реакция нейтрализации затем может быть проверена фенолфталеином, обычным индикатором, используемым при кислотно-основном титровании. Реакция между гидроксидом натрия и соляной кислотой может быть представлена следующим уравнением:
Реакция между гидроксидом натрия и соляной кислотой может быть представлена следующим уравнением:
NaOH + HCl → NaCl + H 2 O
Аналогичным образом серная кислота (H 2 SO 4 ) нейтрализуется гидроксидом натрия.Как и раньше, в этой реакции нейтрализации образуется вода и ионное соединение, на этот раз сульфат натрия (Na 2 SO 4 ).
Реакции с растворенными металлами
Когда гидроксид натрия реагирует с некоторыми растворенными металлами, он образует твердое вещество. Эта реакция обычно используется для удаления растворенных металлов из раствора, особенно если они токсичны.
Когда реакция включает преобразование растворимых ионов в нерастворимое твердое вещество, это называется реакцией осаждения.Гидроксид натрия можно использовать для облегчения этой реакции со многими переходными металлами, такими как сульфат меди (CuSO 4 ).
Переходные металлы хорошо растворяются в воде и при растворении образуют окрашенные растворы. Сульфат меди, например, придает раствору характерный светло-голубой цвет. С другой стороны, цинк дает белый цвет.
Если гидроксид натрия вводится в водный раствор, содержащий растворимый переходный металл, переходный металл вытесняется из его соединения.Этот процесс называется реакцией замещения, и он происходит потому, что натрий является гораздо более химически активным металлом.
После замещения переходного металла образуется нерастворимый гидроксид переходного металла. В случае сульфата меди гидроксид натрия замещает медь, и образуется гидроксид меди (Cu (OH) 2 ). Вместо растворения это соединение осаждается и появляется в жидкости в виде светло-голубого твердого вещества. В этот момент раствор становится бесцветным, и на дне находится твердый гидроксид меди.
Эту реакцию можно использовать для определения того, какой ион переходного металла существует в растворе, по цвету конечного осадка. Светло-голубое твердое вещество показывает присутствие ионов Cu 2+ . Зеленое твердое вещество показывает присутствие ионов Fe 2+ , тогда как красно-коричневое твердое вещество указывает на наличие ионов Fe 3+ . Гидроксид натрия можно использовать со всеми этими соединениями, чтобы вызвать осаждение.
Светло-голубое твердое вещество показывает присутствие ионов Cu 2+ . Зеленое твердое вещество показывает присутствие ионов Fe 2+ , тогда как красно-коричневое твердое вещество указывает на наличие ионов Fe 3+ . Гидроксид натрия можно использовать со всеми этими соединениями, чтобы вызвать осаждение.
Реакции с алюминием
Гидроксид натрия реагирует с порошком алюминия (Al) с образованием алюмината натрия и водорода (H).Это был распространенный метод, используемый для наполнения дирижаблей и воздушных шаров из-за быстрого выделения водородного газа, который он производит. Он также был предложен в качестве источника топлива для автомобилей, работающих на водороде.
Реакция может быть проведена в лаборатории путем смешивания алюминиевого порошка с концентрированным раствором NaOH в колбе. Затем образовавшийся газ можно уловить, плотно надев над колбой баллон. Общее уравнение этой реакции:
2Al (s) +6 NaOH (водн. ) → 2Na 3 AlO 3 (водн.) + 3H 2 (г)
) → 2Na 3 AlO 3 (водн.) + 3H 2 (г)
При проведении этого эксперимента важно принять необходимые меры безопасности.Реакция между алюминием и гидроксидом натрия чрезвычайно быстрая, экзотермическая и едкая. Газообразный водород также взрывоопасен, поэтому следует соблюдать особую осторожность.
Побочный продукт, образующийся в этой реакции, алюминат натрия, сам по себе является важным соединением и обычно используется в качестве источника гидроксида алюминия. Он также используется в очистке воды, строительной технике и бумажной промышленности.
С чем еще вступает в реакцию гидроксид натрия?
Реакции с участием гидроксида натрия на этом не заканчиваются.Некоторые другие примеры того, с чем реагирует гидроксид натрия, включают, но не ограничиваются:
- Необратимая реакция омыления жирами, которая используется при производстве мыла, шампуней и других косметических продуктов
- Взаимодействие с многоатомными спиртами с образованием алкоголятов, белых кристаллических веществ, хорошо растворяющихся в воде
- Реакция диспропорционирования с неметаллами, такими как сера или хлор, при которой происходит окисление и восстановление одного вещества
ReAgent поставляет гидроксид натрия в мешках по 1 кг и 25 кг, а также в различных концентрациях. Все наши продукты имеют 100% гарантию качества, поэтому вы можете с уверенностью покупать NaOH. Закажите онлайн сегодня или свяжитесь с нашей дружной командой для получения дополнительной информации.
Все наши продукты имеют 100% гарантию качества, поэтому вы можете с уверенностью покупать NaOH. Закажите онлайн сегодня или свяжитесь с нашей дружной командой для получения дополнительной информации.
Гидроксид | химическое соединение | Britannica
Hydroxide , любое химическое соединение, содержащее одну или несколько групп, каждая из которых содержит по одному атому кислорода и водорода, связанных вместе и функционирующая как отрицательно заряженный ион OH —. Положительно заряженная часть соединения обычно представляет собой ион металла ( e.g., натрия, магния или алюминия), хотя это может быть органическая группа (, например, гуанидиния или тетраметиламмония). Предпочтительно характеризовать присутствие неионизированной ковалентно связанной гидроксильной группы OH с помощью приставки гидрокси, как в органическом соединении гидроксиуксусной кислоты, CH 2 OHCOOH, или суффиксом ol, как в метаноле, CH 3 OH, а в координационных соединениях с префиксом гидроксо, как в тетрагидроксоаурате калия, KAu (OH) 4 .
Гидроксиды включают щелочи, известные в лабораторных и промышленных процессах. Гидроксиды щелочных металлов, лития, натрия, калия, рубидия и цезия, являются самыми сильными основаниями, наиболее стабильными и наиболее растворимыми из гидроксидов. Гидроксид натрия, NaOH, также известный как каустическая сода или щелочь, имеет большое промышленное значение. Кальций, барий и стронций — все щелочноземельные металлы — образуют растворимые гидроксиды, которые являются сильными основаниями, но менее стабильны, чем гидроксиды щелочных металлов.Из них гидроксид кальция Ca (OH) 2 , широко известный как гашеная известь, является наиболее распространенным. За исключением гидроксида таллия (TlOH), гидроксиды других металлов, таких как магний, железо, висмут, никель, кобальт и медь, плохо растворяются в воде, но нейтрализуют кислоты. Гидроксиды бериллия, свинца, цинка, алюминия, хрома (трехвалентный), олова (двухвалентный), золота (трехвалентный) и некоторых других металлов проявляют как кислотные, так и основные свойства; то есть они растворяются в водных растворах оснований или кислот. Гидроксиды и другие вещества, такие как оксиды и сульфиды, с этими двойными свойствами, называются амфотерными.
Гидроксиды и другие вещества, такие как оксиды и сульфиды, с этими двойными свойствами, называются амфотерными.
Реакция алкилгалогенидов с гидроксид-ионами
На этой странице рассматриваются реакции между галогеноалканами (галогеналканы или алкилгалогениды) и гидроксид-ионами из раствора гидроксида натрия или калия. Он охватывает как реакции замещения, так и реакции исключения.
Реакции замещения и исключения
В зависимости от используемых условий и типа галогеноалкана, вы можете получить два разных типа реакции.Первичные, вторичные и третичные галогеноалканы в этом отношении ведут себя по-разному.
Реакции замещения
В реакции замещения атом галогена заменяется группой -ОН с образованием спирта. Например:
Или в виде ионного уравнения:
В этом примере 2-бромпропан превращается в пропан-2-ол.
Галогеноалкан нагревают с обратным холодильником с раствором гидроксида натрия или калия. Нагревание с обратным холодильником означает нагрев с конденсатором, установленным вертикально в колбе для предотвращения потери летучих веществ из смеси.
Нагревание с обратным холодильником означает нагрев с конденсатором, установленным вертикально в колбе для предотвращения потери летучих веществ из смеси.
Растворитель обычно представляет собой смесь этанола и воды 50/50, потому что в ней все растворяется. Галогеноалкан не растворяется в воде. Если вы использовали только воду в качестве растворителя, галогеноалкан и раствор гидроксида натрия не смешались, и реакция могла бы произойти только там, где два слоя встречаются.
Реакции элиминирования
Галогеноалканы также подвергаются реакциям элиминирования в присутствии гидроксида натрия или калия.
2-Бромпропан прореагировал с образованием алкена — пропена.
Обратите внимание, что атом водорода удален с одного из концевых атомов углерода вместе с бромом из центрального. Во всех простых реакциях отщепления удаляемые вещества находятся на соседних атомах углерода, и между этими атомами углерода устанавливается двойная связь.
Галогеноалкан нагревают с обратным холодильником с концентрированным раствором гидроксида натрия или калия в этаноле. Образуется пропен, и, поскольку это газ, он проходит через конденсатор и может собираться.
Образуется пропен, и, поскольку это газ, он проходит через конденсатор и может собираться.
От чего зависит, получите ли вы замену или выбывание?
Реагенты, которые вы используете, одинаковы как для замещения, так и для удаления — галогеналкан и раствор гидроксида натрия или калия. Во всех случаях вы получите смесь обеих реакций — некоторого замещения и некоторого исключения. То, что вы получите, зависит от ряда факторов.
Тип галогеноалкана
Это самый важный фактор.
| тип галогеноалкана | замена или исключение? |
|---|---|
| первичный | в основном замена |
| вторичный | и замена, и выбывание |
| высшее | в основном ликвидация |
Например, что бы вы ни делали с третичными галогеноалканами, вы, как правило, получите реакцию отщепления, тогда как с первичными вы, скорее всего, получите реакцию замещения. Однако вы можете до некоторой степени повлиять на ситуацию, изменив условия.
Однако вы можете до некоторой степени повлиять на ситуацию, изменив условия.
Растворитель
Отношение воды к этанолу в растворителе имеет значение.
- Вода способствует замещению.
- Этанол способствует выведению из организма.
Температура
Более высокие температуры способствуют выведению.
Концентрация раствора гидроксида натрия или калия
Более высокие концентрации способствуют выведению.
Итого
Для данного галогеноалкана, чтобы способствовать удалению, а не замещению, используйте:
- более высокие температуры
- концентрированный раствор гидроксида натрия или калия
- чистый этанол в качестве растворителя
Чтобы способствовать замене, а не исключению, используйте:
- более низкие температуры
- более разбавленные растворы гидроксида натрия или калия
- больше воды в смеси растворителей
Что такое гидроксид натрия? — Формула и реакции — Научный класс [Видео 2021]
Реакции с участием гидроксида натрия
Растворение в воде
В воде гидроксид натрия полностью распадается, образуя один ион натрия и один ион гидроксида. Этот процесс представлен уравнением, показанным здесь. Хотя этот процесс не является химической реакцией, он все же является очень важным свойством гидроксида натрия.
Этот процесс представлен уравнением, показанным здесь. Хотя этот процесс не является химической реакцией, он все же является очень важным свойством гидроксида натрия.
Реакции с кислотами
Гидроксид натрия реагирует с кислотами с образованием воды и ионного соединения. В этом типе реакции гидроксид из гидроксида натрия реагирует с ионом водорода в кислоте, образуя воду. Остальная кислота соединяется с ионом натрия из гидроксида натрия с образованием ионного соединения.Здесь можно увидеть реакцию между гидроксидом натрия и соляной кислотой, а также реакцию, показывающую, как гидроксид натрия взаимодействует с кислотами в целом.
Реакции с растворенными металлами
Гидроксид натрия реагирует с некоторыми растворенными металлами с образованием твердого вещества. Этот тип реакции очень полезен, если растворенные металлы токсичны или их нужно удалить из раствора. Твердые химические вещества можно отфильтровать из раствора несколькими способами.В этой реакции растворенная медь реагирует с гидроксидом натрия с образованием твердого гидроксида меди (II) и ионов натрия. Затем из раствора можно удалить гидроксид меди (II) синего цвета.
Твердые химические вещества можно отфильтровать из раствора несколькими способами.В этой реакции растворенная медь реагирует с гидроксидом натрия с образованием твердого гидроксида меди (II) и ионов натрия. Затем из раствора можно удалить гидроксид меди (II) синего цвета.
Реакции с оксидами неметаллов
Иногда такие загрязнители, как диоксид серы или диоксид углерода, необходимо удалить из раствора или окружающей среды. Гидроксид натрия можно использовать для реакции с оксидами неметаллов, подобными этим. Оксид неметалла — это соединение, которое содержит неметаллы, такие как углерод или сера, связанные с кислородом.В этих реакциях гидроксид натрия будет реагировать с оксидом неметалла с образованием ионного соединения и воды. Реакция между диоксидом углерода и гидроксидом натрия показана в этой формуле химической реакции.
Итоги урока
Давайте рассмотрим! Гидроксид натрия — коррозионно-активный химикат, иногда известный как щелочь или каустическая сода. Его химическая формула — NaOH. Это ионное соединение , потому что оно состоит из иона металла, натрия (Na +), который притягивается к нементальному иону, гидроксиду (OH-).Когда это твердое вещество, оно белого цвета и имеет высокую температуру плавления 604,4 ° F. Несмотря на высокую температуру плавления, гидроксид натрия очень хорошо растворяется в воде. При растворении в воде он прозрачен. В твердой форме гидроксид натрия имеет белый цвет и очень высокую температуру плавления.
Его химическая формула — NaOH. Это ионное соединение , потому что оно состоит из иона металла, натрия (Na +), который притягивается к нементальному иону, гидроксиду (OH-).Когда это твердое вещество, оно белого цвета и имеет высокую температуру плавления 604,4 ° F. Несмотря на высокую температуру плавления, гидроксид натрия очень хорошо растворяется в воде. При растворении в воде он прозрачен. В твердой форме гидроксид натрия имеет белый цвет и очень высокую температуру плавления.
Гидроксид натрия — это сильное основание , которое может растворяться в воде. Растворенные в воде растворы гидроксида натрия имеют высокие значения pH и могут вызвать серьезную коррозию или повреждение материалов. Гидроксид натрия способен вступать во многие химические реакции.
Растворение в воде
В воде гидроксид натрия полностью распадается, образуя один ион натрия и один ион гидроксида. Хотя этот процесс не является химической реакцией, он все же является очень важным свойством гидроксида натрия.
Реакции с кислотами
Гидроксид натрия реагирует с кислотами с образованием воды и ионного соединения. Гидроксид из гидроксида натрия реагирует с ионом водорода в кислоте, образуя воду. Остальная кислота соединяется с ионом натрия из гидроксида натрия с образованием ионного соединения.
Реакции с растворенными металлами
Гидроксид натрия реагирует с некоторыми растворенными металлами с образованием твердого вещества, что полезно, если растворенные металлы токсичны или их необходимо удалить из раствора. Твердые химические вещества можно отфильтровать из раствора несколькими способами.
Реакции с оксидами неметаллов
Иногда такие загрязнители, как диоксид серы или диоксид углерода, необходимо удалить из раствора или окружающей среды. Гидроксид натрия можно использовать для реакции с оксидом неметалла , который представляет собой соединение, содержащее неметаллы, такие как углерод или серу, связанные с кислородом.Гидроксид натрия реагирует с оксидом неметалла с образованием ионного соединения и воды.
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Класс 7A
Марка 7Б
7 класс (A и B вместе)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 8A
Марка 8Б
Оценка 8 (вместе A и B)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
9 класс (A и B вместе)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4A
Класс 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5А
Марка 5Б
Оценка 5 (вместе A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 6A
Марка 6Б
6 класс (A и B вместе)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственным ограничением является то, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственным ограничением является то, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного знака)
Эти небрендовые версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, изменять или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Гидроксид натрия
Что такое гидроксид натрия (NaOH)?
Гидроксид натрия иногда называют каустической содой или щелоком.Это обычный ингредиент в чистящих средствах и мыле.
При комнатной температуре гидроксид натрия представляет собой белое твердое вещество без запаха. Жидкий гидроксид натрия бесцветен и не имеет запаха. Может бурно реагировать с сильными кислотами и водой. Гидроксид натрия вызывает коррозию. NaOH может реагировать с влагой из воздуха и при растворении выделять тепло. Этого тепла может быть достаточно, чтобы вызвать пожар, если он находится рядом с легковоспламеняющимися материалами.
Гидроксид натрия полезен своей способностью изменять жиры.Из него делают мыло, а также в качестве основного ингредиента в бытовых продуктах, например, в жидких очистителях канализации. Гидроксид натрия обычно продается в чистом виде в виде белых гранул или в виде раствора в воде.
Какие виды использования гидроксида натрия?
Гидроксид натрия используется в кусковом мыле и моющих средствах. Гидроксид натрия также используется в качестве очистителя канализации для прочистки труб.
Около 56% производимого гидроксида натрия используется в промышленности, а 25% NaOH используется в бумажной промышленности.Некоторые другие применения включают производство топливных элементов, для обработки пищевых продуктов, удаления кожицы с овощей для консервирования, отбеливания, очистителя слива, очистителя для духовки, мыла, моющих средств, изготовления бумаги, переработки бумаги, обработки алюминиевой руды, оксидного покрытия, обработки хлопчатобумажной ткани, травления , обезболивающие, антикоагулянты для предотвращения образования тромбов, лекарства, снижающие уровень холестерина, и водные процедуры.
Как вы можете подвергнуться воздействию гидроксида натрия?
В домашних условиях некоторые предметы домашнего обихода, такие как мыло или чистящие средства, содержат гидроксид натрия. Случайное проглатывание или контакт этих чистящих средств с кожей может вызвать опасное воздействие.
Случайное проглатывание или контакт этих чистящих средств с кожей может вызвать опасное воздействие.
На некоторых промышленных предприятиях используется гидроксид натрия. Вот некоторые пределы воздействия NaOH в воздухе на рабочем месте.
Пределы воздействия воздуха на рабочем месте:
OSHA: Законный допустимый предел воздействия (PEL)
в воздухе составляет 2 мг / м 3 , усредненное за 8-часовую рабочую смену
NIOSH: Рекомендуемый предел воздействия в воздухе
(REL) составляет 2 мг / м 3 , который не должен превышаться в любое время
ACGIH: пороговое значение
(TLV) составляет 2 мг / м 3 , которое не должно превышаться в любое время
Как можно защитить свою семью от разоблачения?
• Соблюдайте все меры предосторожности и инструкции, указанные на этикетках продукта.
• Храните чистящие средства в недоступном для детей месте.
• Храните чистящие средства в их оригинальной упаковке.
• Надевайте латексные или нитриловые перчатки при использовании продуктов, содержащих высокие концентрации NaOH.
• Для защиты кожи носите брюки с длинными рукавами и брюки, которые не разрушаются под действием гидроксида натрия. Осторожно снимите одежду, если она намокнет, чтобы гидроксид натрия не попал на кожу.
Каковы потенциально вредные последствия воздействия гидроксида натрия?
Гидроксид натрия — потенциально опасное вещество.Он может причинить вам вред, если он коснется вашей кожи, если вы его выпьете или если вы его вдохнете. Еда или питье гидроксида натрия может вызвать сильные ожоги и немедленную рвоту, тошноту, диарею или боль в груди и желудке, а также затруднение глотания. Немедленное повреждение рта, горла и желудка. Вдыхание может вызвать сильное раздражение верхних дыхательных путей с кашлем, ожогами и затрудненным дыханием.
Вредное воздействие гидроксида натрия зависит от нескольких факторов, включая концентрацию гидроксида натрия, продолжительность воздействия, а также от того, прикасались ли вы к нему, пили или вдыхали. Контакт с гидроксидом натрия в очень высоких концентрациях может вызвать серьезные ожоги глаз, кожи, пищеварительной системы или легких, что приведет к необратимым повреждениям или смерти. Продолжительный или повторяющийся контакт с кожей может вызвать дерматит. Повторное вдыхание паров гидроксида натрия может привести к необратимому повреждению легких.
Контакт с гидроксидом натрия в очень высоких концентрациях может вызвать серьезные ожоги глаз, кожи, пищеварительной системы или легких, что приведет к необратимым повреждениям или смерти. Продолжительный или повторяющийся контакт с кожей может вызвать дерматит. Повторное вдыхание паров гидроксида натрия может привести к необратимому повреждению легких.
Первая помощь
В экстренных случаях звоните 911.
Попадание в глаза
- Промыть глаза водой в течение 30 минут.
- Поднимите верхнее и нижнее века.
- Снимите контактные линзы.
Контакт с кожей
- Снимите загрязненную одежду.
- Промывайте водой в течение 15 минут.
Вдыхание
- Уберите человека из зоны воздействия, если это безопасно для вас.
- Если человек не отвечает и не дышит нормально, начните СЛР.
Прием пищи
- НЕ ВЫЗЫВАЙТЕ РВОТУ ЧЕЛОВЕКА.

- Никогда не давайте ничего через рот человеку, находящемуся без сознания.
- Если человек находится в полном сознании и не страдает респираторной недостаточностью, дайте ему выпить чашку воды, чтобы разбавить гидроксид натрия.
Свяжитесь с токсикологическим центром по телефону 1-800-222-1222 для получения дополнительной информации о воздействии гидроксида натрия.
Инциденты с гидроксидом натрия в Теннесси
Еще в 2010-2011 годах гидроксид натрия входил в десятку наиболее часто разлитых или выбрасываемых химических веществ в Теннесси. Около 50% этих разливов и выбросов произошло на складах или во время транспортировки.Около 75% из них были вызваны человеческим фактором.
Обращение и хранение
Разливы и чрезвычайные ситуации — Если сотрудники обязаны устранять разливы, они должны быть надлежащим образом обучены и оснащены. Может применяться стандарт OSHA по работе с опасными отходами и реагированию на чрезвычайные ситуации (29 CFR 1910. 120).
120).
Если гидроксид натрия пролился или протек, выполните следующие действия:
Эвакуируйте персонал и охраняйте и контролируйте вход на территорию.
Устранить все источники возгорания.
Для раствора гидроксида натрия: абсорбировать жидкости в сухом песке, земле или подобном материале и поместить в герметичные контейнеры для утилизации.
Соберите твердый материал наиболее удобным и безопасным способом и поместите в герметичные контейнеры для утилизации.
НЕ используйте воду, воду или какой-либо ВЛАЖНЫЙ МЕТОД для очистки NaOH.
Проветрите и промойте зону после завершения очистки.
НЕ смывать в канализацию.
Может возникнуть необходимость утилизировать гидроксид натрия как опасные отходы.
Гидроксид натрия реагирует с сильными кислотами (соляной, серной или азотной), водой и влагой с быстрым выделением тепла.
Гидроксид натрия реагирует с металлами (алюминием, свинцом, оловом или цинком) с образованием горючего и взрывоопасного газообразного водорода.
Гидроксид натрия может образовывать чувствительные к удару соли при контакте с азотсодержащими соединениями.
Гидроксид натрия несовместим с окислителями, хлорированными растворителями, аммиаком и органическими материалами.
Хранить в оригинальных плотно закрытых емкостях в прохладном, хорошо вентилируемом помещении, вдали от воды и влаги.
Гидроксид натрия может разрушать железо, медь, пластмассы, резину и покрытия.
Гидроксид натрия
Автор: Ганс Лоннингер, Википедия
Гидроксид натрия полностью ионный, он содержит катионы натрия и анионы гидроксида. Анион гидроксида делает гидроксид натрия сильным основанием, которое реагирует с кислотами с образованием воды и соответствующих солей, например, с соляной кислотой, хлоридом натрия:
NaOH (водн.) + HCl (водн.) NaCl (водн.) + H 2 O (л)
Обычно такие реакции нейтрализации представлены одним простым чистым ионным уравнением:
OH — (водн. ) + H 3 O + (водн.) 2 H 2 O
) + H 3 O + (водн.) 2 H 2 O
Этот тип реакции с сильной кислотой выделяет тепло и поэтому называется экзотермической.Такие кислотно-основные реакции также можно использовать для титрования, что является обычным методом определения концентрации кислот. Другой тип реакции, в которой участвует гидроксид натрия, — с кислыми оксидами. О реакции диоксида углерода уже упоминалось, но другие кислые оксиды, такие как диоксид серы (SO 2 ), также полностью вступают в реакцию. Такие реакции часто используются для «очистки» от вредных кислых газов (например, SO 2 и H 2 S) и предотвращения их выброса в атмосферу.
2 NaOH + CO 2 Na 2 CO 3 + H 2 O
Гидроксид натрия медленно вступает в реакцию со стеклом с образованием силиката натрия, поэтому стыки стекла и запорные краны, подвергающиеся воздействию NaOH, имеют тенденцию «замерзать». Колбы и стеклянные химические реакторы повреждаются при длительном воздействии горячего гидроксида натрия, и стекло становится матовым. Гидроксид натрия не разрушает железо, так как железо не обладает амфотерными свойствами. Однако некоторые переходные металлы могут активно реагировать с гидроксидом натрия.
В 1986 году алюминиевый автоцистерна в Великобритании была ошибочно использована для перевозки 25% раствора гидроксида натрия, что вызвало повышение давления в содержимом и повреждение цистерны. Повышение давления происходило из-за газообразного водорода, который образуется в реакции между гидроксидом натрия и алюминием:
2 Al (т.) + 6 NaOH (водн.) 3 H 2 (г) + 2 Na 3 AlO 3 (водн.)
В отличие от NaOH гидроксиды большинства металлов нерастворимы, поэтому гидроксид натрия можно использовать для осаждения гидроксидов металлов.Одним из таких гидроксидов является гидроксид алюминия, используемый в качестве гелеобразных хлопьев для фильтрации твердых частиц при очистке воды. Гидроксид алюминия получают на очистных сооружениях из сульфата алюминия путем взаимодействия с NaOH. Эта реакция очень прибыльна и, следовательно, является важной реакцией синтеза.
Гидроксид натрия легко реагирует с карбоновыми кислотами с образованием их солей и даже является достаточно сильным основанием для образования солей с фенолами. NaOH можно использовать для гидролиза сложных эфиров (как при омылении), амидов и алкилгалогенидов под действием оснований.Однако ограниченная растворимость NaOH в органических растворителях означает, что часто предпочтительнее более растворимый КОН.
Производство
В 1998 году общее мировое производство составляло около 45 миллионов тонн. В совокупности Северная Америка и Азия произвели около 14 миллионов тонн, в то время как Европа произвела около 10 миллионов тонн.
Гидроксид натрия производится (вместе с хлором и водородом) с помощью хлорно-щелочного процесса. Это включает электролиз водного раствора хлорида натрия.Гидроксид натрия накапливается на катоде, где вода восстанавливается до газообразного водорода и гидроксид-иона:
2 Na + + 2 H 2 O + 2 e — H 2 + 2 NaOH
Для получения NaOH необходимо предотвратить реакцию NaOH с хлором. Обычно это делается одним из трех способов, из которых мембранно-клеточный процесс является наиболее экономически выгодным.
Процесс с ртутным элементом (также называемый процессом Кастнера-Келлнера).Ионы натрия восстанавливаются до металлического натрия, который образует амальгаму с ртутным катодом; этот натрий затем реагирует с водой с образованием NaOH. Были опасения по поводу выбросов ртути, хотя современные заводы утверждают, что они безопасны в этом отношении.
Процесс мембранной ячейки . Используется стальной катод, и реакция NaOH с Cl 2 предотвращается с помощью пористой диафрагмы, часто сделанной из волокон асбеста. В процессе мембранной ячейки область анода отделена от области катода проницаемой диафрагмой.Рассол вводится в анодное отделение и проходит через диафрагму в катодное отделение. Из ячейки покидает разбавленный едкий рассол. Гидроксид натрия обычно должен быть сконцентрирован до 50%, а соль удалена. Это делается с использованием испарительного процесса с примерно тремя тоннами пара на тонну гидроксида натрия. Соль, отделенную от щелочного рассола, можно использовать для насыщения разбавленного рассола. Хлор содержит кислород и очищается путем сжижения и испарения.
Мембранно-клеточный процесс .Подобно процессу мембранной ячейки, с мембраной Nafion для разделения катодной и анодной реакций. Через мембрану проходят только ионы натрия и немного воды. Производит NaOH более высокого качества. Из трех процессов процесс с мембранной ячейкой требует наименьшего потребления электроэнергии, а количество пара, необходимого для концентрирования щелочи, относительно невелико (менее одной тонны на тонну гидроксида натрия).
Более ранним методом производства гидроксида натрия был процесс Leblanc , который производил карбонат натрия с последующим обжигом для получения диоксида углерода и оксида натрия.


