Содержание
Химическое соединение — это… Что такое Химическое соединение?
Стереоскопическое изображение химического соединения
Хими́ческое соедине́ние — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов (гетероядерные молекулы). Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью (азот, кислород, иод, бром, хлор, фтор, предположительно астат).[1] Инертные (благородные) газы и атомарный водород нельзя считать химическими соединениями.
История
Для формулирования понятия про химическое соединение важное значение имел закон постоянства состава, открытый Жозефом Прустом в 1799 году[2]. Этот закон утверждает, что независимо от того, каким образом было получено определенное соединение, оно всегда состоит из одних и тех же химических элементов, причем отношение масс этих элементов выражается малыми целыми числами. Через несколько лет, в 1803 году Джон Дальтон сформулировал закон кратных отношений, согласно которому в случае, когда из определенных элементов могут образовываться два соединения, с определённой массой первого из них сочетаются такие массы другого, что отношение их тоже даёт целое число[3][4][5]. Эти два утверждения подготовили путь к пониманию атомного строения вещества.
Через несколько лет, в 1803 году Джон Дальтон сформулировал закон кратных отношений, согласно которому в случае, когда из определенных элементов могут образовываться два соединения, с определённой массой первого из них сочетаются такие массы другого, что отношение их тоже даёт целое число[3][4][5]. Эти два утверждения подготовили путь к пониманию атомного строения вещества.
Понятие структурной формулы ввёл в 1850-тые годы немецкий химик Фридрих Август Кекуле фон Штрадониц[6][7].
Качественный и количественный состав
Состав химического соединения записывается в виде химических формул, а строение часто изображается структурными формулами. Систематическое название (номенклатура ИЮПАК) также указывает состав соединения.
В подавляющем большинстве случаев химические соединения подчиняются закону постоянства состава и закону кратных отношений. Однако известны довольно многочисленные соединения переменного состава (бертоллиды), например:
- PaO2,18—PaO2,21.

Для установления качественного и количественного состава химического соединения, используются различные методы химического анализа (например, колориметрия, хроматография). Эти методы являются предметом изучения аналитической химии.
Отличия соединений и смесей
Физические и химические свойства соединений отличаются от свойств смеси простых веществ — это один из главных критериев отличия соединения от смесей простых или сложных веществ, так как свойства смеси обычно тесным образом связаны со свойствами компонентов. Другим критерием отличия является то, что смесь обычно может быть разделена на составляющие нехимическими процессами, такими, как просеивание, фильтрация, выпаривание, использование магнитов, тогда как компоненты химического соединения могут быть разделены только при помощи химической реакции. И наоборот, смеси могут быть созданы без использования химической реакции, а соединения — нет.
Некоторые смеси так тесно связаны, что некоторые их свойства сходны со свойствами химических соединений, и их легко спутать. Наиболее частым примером таких смесей являются сплавы. Сплавы изготавливаются при помощи физических процессов, обычно — путём расплавления и смешивания компонентов с последующим остыванием. Другим примером смесей, не являющихся сплавами, являются интерметаллиды.
Наиболее частым примером таких смесей являются сплавы. Сплавы изготавливаются при помощи физических процессов, обычно — путём расплавления и смешивания компонентов с последующим остыванием. Другим примером смесей, не являющихся сплавами, являются интерметаллиды.
Химические реакции
Химические соединения получают в результате химических реакций. Сложные вещества могут разлагаться с образованием нескольких других веществ. Образование химических соединений сопровождается выделением (экзотермическая реакция) или поглощением (эндотермическая реакция) энергии. Физические и химические свойства химических соединений отличаются от свойств веществ, из которых они получены. Химические соединения разделяются на неорганические и органические. Известно более 100 тыс. неорганических и более 3 млн органических соединений. Каждое химическое соединение, которое описано в литературе, имеет уникальный идентификатор — CAS-номер.
Классы химических соединений
Химические соединения делят на классы: неорганические и органические. Последние в широком смысле включают в себя элементоорганические соединения: борорганические, кремнийорганические, фосфорорганические и др.
Последние в широком смысле включают в себя элементоорганические соединения: борорганические, кремнийорганические, фосфорорганические и др.
Некоторые виды cложных неорганических соединений:
Органические вещества
Органические соединения, органические вещества — класс химических соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов).[8]
Неорганические вещества
Неорганическое вещество или неорганическое соединение — это химическое соединение, которое не является органическим, то есть оно не содержит углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к неорганическим). Неорганические соединения не имеют характерного для органических углеродного скелета.
Регистрационный номер CAS
Всем химическим веществам, а значит, всем химическим соединениям, описанным в научной литературе, присваивается номер CAS, химической реферативной службы, по которому вещество можно идентифицировать в базах данных, например в PubChem.
Литература
- Robert Siegfried From elements to atoms: a history of chemical composition. — American Philosophical Society, 2002. — ISBN 978-0-87169-924-4
См. также
Примечания
- ↑ Соединение химическое — БСЭ — Яндекс. Словари
- ↑ Proust, J.-L. (1799). Researches on copper, Ann. chim., 32:26-54. Excerpt, in Henry M. Leicester and Herbert S. Klickstein, A Source Book in Chemistry, 1400—1900, Cambridge, MA: Harvard, 1952. Accessed 2008-05-08.
- ↑ Helmenstine, Anne Law of Multiple Proportions Problem. 1. Архивировано из первоисточника 8 декабря 2012. Проверено 31 января 2012.
- ↑ law of multiple proportions definition
- ↑ law of multiple proportions (chemistry) (англ.). — статья из Encyclopædia Britannica Online.
- ↑ Aug. Kekulé (1857). «Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale».
 Annalen der Chemie und Pharmacie 104 (2): 129–150. DOI:10.1002/jlac.18571040202.
Annalen der Chemie und Pharmacie 104 (2): 129–150. DOI:10.1002/jlac.18571040202. - ↑ Aug. Kekulé (1858). «Ueber die Constitution und die Metamorphosen der chemischen Verbindungen und über die chemische Natur des Kohlenstoffs». Annalen der Chemie und Pharmacie 106 (2): 129–159. DOI:10.1002/jlac.18581060202.
- ↑ Хомченко Г. П. Пособие по химии для поступающих в вузы. — 3-е изд. испр. и доп. — М.: ООО «Издательство Новая Волна», ЗАО «Издательский Дом ОНИКС», 2000. с. 334. ISBN 5-7864-0103-0, ISBN 5-249-00264-1
Ссылки
Как легко определять свойства элементов и их соединений — Российская газета
Не так уж часто удается написать заметку о том, что не просто войдет в школьные учебники будущего, а станет одной из базовых картинок-иллюстраций. Химики из Сколковского института науки и технологий Артем Оганов и Захед Алахъяри придумали и рассчитали, как расположить химические элементы в порядке постепенного изменения их химических свойств. Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, «Коту» рассказал профессор Сколтеха Артем Оганов.
Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, «Коту» рассказал профессор Сколтеха Артем Оганов.
Артем Оганов — кристаллограф-теоретик, создатель ряда новых материалов, а главное, методов, которые позволяют открывать новые материалы. Решил считавшуюся нерешаемой задачу предсказания кристаллической структуры вещества на основе его химического состава. Создал программу USPEX, способную предсказывать устойчивые химические соединения по набору исходных элементов. Один из самых цитируемых в мире ученых.
Я хорошо помню, как мне пришло в голову решение этой задачи. Мы с семьей садились в самолет. У меня четверо детей, и все они расположились у меня на голове и прочих частях тела и к тому же продолжали непрерывно двигаться. Опытные родители знают, что сопротивляться этому бессмысленно, а беспокоиться неразумно. Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
Эта проблема волновала меня последние 15 лет. В 1984 году британский физик Дэвид Петтифор опубликовал работу, в которой ввел понятие менделеевских чисел, — с их помощью он сгруппировал элементы в порядке изменения их химических свойств. В таблице Менделеева свойства элементов меняются скачками. Так, после самого химически активного неметалла фтора идет инертный неон, а сразу за ним — активнейший металл натрий. Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
Петтифор предложил решение — выстроил элементы в некоторой последовательности, приписав им некие числа Менделеева.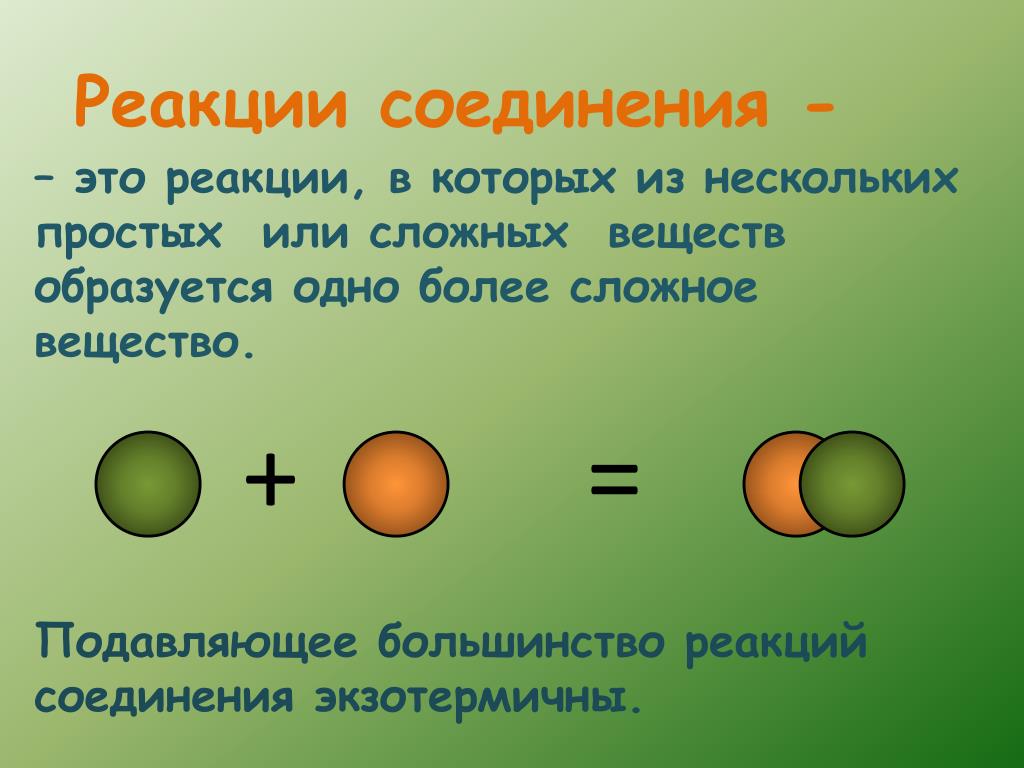 Но как приписал, не объяснил. И тем более не объяснил, какой у них физический смысл. Эти числа не расчет, а произвол, хотя и основанный на наблюдениях за свойствами бинарных соединений — веществ, состоящих из двух разных атомов. Скажем, если NaCl и KCl похожи, то и натрий с калием должны стоять рядом. Все это время ученые модифицировали и улучшали менделеевские числа, но что это такое, так никто и не объяснил.
Но как приписал, не объяснил. И тем более не объяснил, какой у них физический смысл. Эти числа не расчет, а произвол, хотя и основанный на наблюдениях за свойствами бинарных соединений — веществ, состоящих из двух разных атомов. Скажем, если NaCl и KCl похожи, то и натрий с калием должны стоять рядом. Все это время ученые модифицировали и улучшали менделеевские числа, но что это такое, так никто и не объяснил.
У химических элементов есть разные характеристики, которые влияют на их свойства. Прежде всего размер атома (его радиус), валентность, поляризуемость*, электроотрицательность**. Но валентность — параметр непостоянный, у разных элементов могут быть разные валентности, а мы неоднократно открывали химические соединения, которые с точки зрения привычных представлений о валентности не могли бы существовать. Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
*Поляризуемость — способность атома или молекулы становиться электрически полярными во внешнем электромагнитном поле. Поляризуемость показывает, насколько легко может возникнуть заряженная частица (ион) или новая химическая связь.
Поляризуемость показывает, насколько легко может возникнуть заряженная частица (ион) или новая химическая связь.
**Электроотрицательность — способность атома оттягивать электроны других атомов в химических соединениях. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (F, O, N, Cl), низкая — у активных металлов (Li, Na, K).
Получается, что для определения фундаментальных свойств атомов можно использовать только атомный радиус и электроотрицательность. И если по оси Х — радиус, а по оси Y — электроотрицательность, мы получаем плоскость, на которой сильно вытянутым облаком располагаются элементы. Внутри этого облака, воспользовавшись несложным математическим приемом, можно провести линию, вдоль которой элементы встанут в порядке максимально плавного изменения свойств.
Так мы открыли физический и химический смысл менделеевских чисел: это наилучшее представление всех химических свойств атома одним числом. Но мы предложили не только объяснение, но и улучшенную версию чисел Менделеева, в которой нет места субъективности — только расчеты на основе фундаментальных характеристик атомов. Мы назвали это «Универсальной последовательностью элементов», по-английски Universal Sequence Of Elements, сокращенно USE. И действительно, наша последовательность удобна в применении: она предсказывает свойства химических соединений лучше, чем петтифоровские менделеевские числа и их позднейшие модификации.
Мы назвали это «Универсальной последовательностью элементов», по-английски Universal Sequence Of Elements, сокращенно USE. И действительно, наша последовательность удобна в применении: она предсказывает свойства химических соединений лучше, чем петтифоровские менделеевские числа и их позднейшие модификации.
Если расположить элементы на осях, то на плоскости будут бинарные соединения — молекулы и кристаллы, состоящие из двух типов атомов. Мы обнаружили, что на этом поле — его можно назвать химическим пространством — возникают области соединений с близкими свойствами, например твердостью кристаллов, магнетизмом, энергией связи. Известно, например, что алмаз, состоящий только из углерода, — самый твердый из кристаллов. А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
Улучшенные менделеевские числа помогут находить новые соединения с полезными свойствами и смогут прояснить некоторые вопросы, связанные с привычной таблицей Менделеева. Например, уже сейчас можно ставить точку в споре, где должен находиться водород: над литием или над фтором. Согласно менделеевским числам, водород ближе к галогенам, чем к щелочным металлам.
Согласно менделеевским числам, водород ближе к галогенам, чем к щелочным металлам.
Ссылка: Zahed Allahyari and Artem R. Oganov, Nonempirical Definition of the Mendeleev Numbers: Organizing the Chemical Space: J. Phys. Chem. C 2020, 124, 43, 23867-23878.
Универсальная последовательность элементов (USE)
Журнал «Кот Шрёдингера»
Как вычисляются числа Менделеева
Универсальная последовательность элементов определяется их проекцией на линию, обозначенную синим цветом. Журнал «Кот Шрёдингера»
Ученые МГУ описали новый класс химических соединений
Ранее мы уже сообщалось о том, что сотрудники лаборатории открыли новые химические соединения – полииодиды метиламмония. На основе этих соединений учёные предложили принципиальной новый подход к созданию перовскитных солнечных батарей неограниченной площади и создали солнечные батареи с КПД > 17%, опубликовав результаты работы в журнале Nature Nanotechnology. Кроме того, авторы недавно показали, что такие соединения могут при определённых условиях образовываться при работе солнечных батарей и уменьшать срок их службы.
«Полииодиды метиламмония, которые нам удалось синтезировать, привлекли наше внимание по двум причинам: во-первых, это очень простые с точки зрения химии соединения, их легко получить и поэтому они являются удобным реагентом для получения светопоглощающего материала солнечных батарей, во-вторых, они проявляют очень необычные свойства – они жидкие при комнатной температуре и очень интенсивно реагируют с металлическим свинцом. Именно такая реакция – взаимодействие полиидоидов метиламмония со свинцом и легла в основу разработанных нами методов получения главного компонента солнечных батарей», — рассказал руководитель исследования Алексей Тарасов, кандидат химических наук, заведующий лабораторией новых материалов для солнечной энергетики факультета наук о материалах МГУ и старший научный сотрудник химического факультета МГУ.
Учёные выяснили, что открытые ими полииодиды метиламмония являются простейшим представителем большого класса соединений – полииодидов моноалкиламмония, которые проявляют аналогичные свойства. Ранее считалось, что жидкими при комнатной температуре могут быть только полииодиды с большим катионом (например, тетраоктиламмоний), однако обнаруженные соединения явно противоречили существующим представлениям.
Ранее считалось, что жидкими при комнатной температуре могут быть только полииодиды с большим катионом (например, тетраоктиламмоний), однако обнаруженные соединения явно противоречили существующим представлениям.
Чтобы разобраться в причинах такой низкой температуры полииодидов метиламмония, учёные провели подробный физико-химический анализ системы, содержащей иодид метиламмония и йод. В ходе исследования учёные заморозили систему и обнаружили, что при этом образуются ранее неизвестные кристаллы четырёх видов. С помощью квантово-химических расчётов авторы работы изучили устойчивость кристаллов и объяснили низкую температуру их плавления. На основе полученных данных была построена фазовая диаграмма исследованной системы и определён диапазон составов, при которых соединения являются жидкостью.
Источник: Andrey A. Petrov et. al. / J. Phys. Chem. Lett., 2019
Жидкое состояние полииоидов моноалкиламмония имеет важное технологическое значение, поскольку позволяет получить кристаллы с редкими оптическими и электронными свойствами при низкой температуре. Таким образом, проведённое исследование может дать толчок к разработке новой группы синтетических способов роста материалов из расплавов при комнатной температуре.
Таким образом, проведённое исследование может дать толчок к разработке новой группы синтетических способов роста материалов из расплавов при комнатной температуре.
Работа поддержана грантом РНФ.
elsevierscience
Пользовательский интерфейс Reaxys предназначен для того, чтобы предоставить ученым, которым нужны химические ответы, максимальные поисковые возможности. Quick Search и Query Builder могут быть использованы для любого химического поиска, что позволяет легко находить нужные физико-химические и биологически активные свойства и реакции, а также рецензируемую литературу и патенты.
Уникальный охват содержания
Экономя ваши время и усилия, Reaxys предоставляет доступ к нескольким источникам информации о химии в одном простом интерфейсе. Reaxys предоставляет данные и литературу по химии из тщательно отобранной коллекции контента, которая глубоко проиндексирована для максимальной доступности.
Reaxys содержит огромную базу экспериментально подтвержденных данных, ценных для химиков, и включает химические структуры и их свойства из более чем 130 предметных областей, реакции и их условия проведения. Все эти данные были тщательно отобраны специалистами из авторитетных источников информации. В основе Reaxys лежит универсальная и унифицированная модель химических данных, что позволяет хранить любые химические данные, интегрировать контент из баз данных, делиться полезной информацией с соавторами, а также использовать данные в будущем. Система обновления и индексации объединяет в себе ручную индексацию и извлечение данных, производимые для ключевой химической литературы и патентов, с автоматической индексацией и извлечением для дополнительной литературы. База данных Reaxys обновляется 2–3 раза в неделю.
Специализированные фильтры и инструменты анализа
Для максимально четкого представления ответов в области химии окно результатов поиска Reaxys предлагает оптимизированное отображение, соответствующее содержанию, фильтры и множество возможностей углубиться в базовую информацию. Reaxys предоставляет реакции, свойства веществ, экспериментальные процедуры, литературу и многое другое.
Reaxys предоставляет реакции, свойства веществ, экспериментальные процедуры, литературу и многое другое.
Автоматизированное планирование синтеза и (СКОРО!) функция предиктивного ретросинтеза
Reaxys не только мгновенно создает несколько путей для синтеза соединения, но также содержит ссылки на базы данных поставщиков реагентов с информацией об их доступности.
Начиная с 2019 г., Reaxys представит новый подход к проведению ретросинтеза. Это стало возможным благодаря партнерству с Доктором Марком Уоллером. Wallerlab использует глубокие нейронные сети и символический искусственный интеллект для планирования синтеза. В отличие от существующих функций ручного синтеза и AutoPlan, новый подход будет распространяться на предиктивное моделирование неопубликованных путей синтеза.
Простые в управлении инструменты интеграции
Для того чтобы обеспечить ученым максимальную эффективность работы, Reaxys предлагает несколько вариантов интеграции полученных химических данных с собственными данными организации или лаборатории в основных процессах исследований. Эти функции возможность экспорта с несколькими вариантами форматирования и совместимость с электронными лабораторными тетрадями от крупных поставщиков. Reaxys также интегрирован с дополнительными источниками информации, такими как Scopus и ScienceDirect (уровень интеграции зависит от коммерческой доступности этих информационных ресурсов для пользователей).
Эти функции возможность экспорта с несколькими вариантами форматирования и совместимость с электронными лабораторными тетрадями от крупных поставщиков. Reaxys также интегрирован с дополнительными источниками информации, такими как Scopus и ScienceDirect (уровень интеграции зависит от коммерческой доступности этих информационных ресурсов для пользователей).
Информационный буклет Reaxys (в формате PDF)
Инструкция по настройке удаленного доступа (для пользователей)
Информационный буклет “Что нового в Reaxys” (в формате PDF)
Практический пример: Reaxys в одном из ведущих российских вузов
Руководство по базовым функциям Reaxys (в формате PDF на русском языке)
Cтраница поддержки пользователей Reaxys
Запись вебинара на русском языке по использованию Reaxys
Примеры использования Reaxys
Модуль Reaxys Medicinal Chemistry
Reaxys Medicinal Chemistry – крупнейшая структурированная база данных биологических свойств веществ и медицинской химии, обладающая инструментами для оперативного экспорта данных. Она предназначена для установления связей между химическими соединениями, мишенями и биологической активностью, что позволяет находить информацию о токсичности, воздействию на организм человека и животных, оценивать возможность использования веществ для лечения заболеваний, определять побочные эффекты и эффективность. Reaxys Medicinal Chemistry позволяет оценить перспективы использования веществ в качестве лекарственных препаратов с точки зрения эффективности, безопасности и возможности доставки на самых ранних стадиях разработки.
Она предназначена для установления связей между химическими соединениями, мишенями и биологической активностью, что позволяет находить информацию о токсичности, воздействию на организм человека и животных, оценивать возможность использования веществ для лечения заболеваний, определять побочные эффекты и эффективность. Reaxys Medicinal Chemistry позволяет оценить перспективы использования веществ в качестве лекарственных препаратов с точки зрения эффективности, безопасности и возможности доставки на самых ранних стадиях разработки.
Reaxys Medicinal Chemistry позволяет визуализировать данные, а также быстро и эффективно найти ответы на следующие вопросы
- Какие соединения взаимодействуют с моей мишенью?
- Какие взаимодействия происходят между моим соединением и моей мишенью?
- Какова биологическая активность соединений с похожей структурой по отношению к различным биологическим видам, мишеням, клеточным линиям?
- Какое из моих лекарств-кандидатов имеет наибольшие шансы на успех?
- Какие исследователи работают над схожими соединениями и мишенями?
Информационный буклет Reaxys Medicinal Chemistry (в формате PDF на английском языке)
Руководство пользователя Reaxys Medicinal Chemistry (в формате PDF на английском языке)
Руководство пользователя Heat map в Reaxys Medicinal Chemistry (в формате PDF на английском языке)
Примеры использования Reaxys Medicinal Chemistry
Урок 16.
 генетическая связь неорганических и органических веществ — Химия — 11 класс
генетическая связь неорганических и органических веществ — Химия — 11 класс
Химия, 11 класс
Урок № 16. Генетическая связь неорганических и органических веществ
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению взаимосвязи неорганических и органических соединений: свойствам органических и неорганических веществ, взаимосвязи различных классов соединений, уравнениям химических реакций, отражающих её.
Глоссарий
Генетическая связь – это связь между классами соединений, отражающая возможность превращения вещества одного класса в вещество другого класса.
Генетический ряд – это цепочка превращений веществ, которые имеют в составе один и тот же химический элемент.
Витализм – это устаревшее учение о существовании сверхъестественной «жизненной силы», которая наполняет органическую природу и определяет её свойства.
Фридрих Вёлер – великий немецкий врач и химик, синтезировал мочевину и щавелевую кислоту из неорганических соединений, первым получил карбид кальция, из которого под действием воды синтезировал ацетилен.
Синтез-газ – это смесь монооксида углерода и водорода, получают паровой конверсией или частичным окислением метана, газификацией угля. Используется для синтеза метанола, синтеза Фишера-Тропша.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.
 06.2018).
06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
До девятнадцатого века в химии господствовал витализм – учение о «жизненной силе». Виталисты считали, что «жизненная сила» отличает живое вещество от неживого. Поэтому синтез органических соединений из неорганических казался им принципиально невозможным.
В начале девятнадцатого века немецкий врач и химик Фридрих Вёлер опроверг теорию витализма. Из неорганических веществ он получил мочевину и щавелевую кислоту.
В 1828 году Ф. Вёлер при нагревании цианида аммония неожиданно для себя получил мочевину – вещество, которое образуется при метаболизме белков у млекопитающих и рыб. Ранее, в 1824 году, Ф. Вёлер получил щавелевую кислоту из дициана. Дициан – бесцветный ядовитый газ со слабым запахом. Его получают в электрической дуге при взаимодействии углерода с азотом. При гидролизе дициана в кислой среде образуется щавелевая кислота.
В лабораторной практике для получения метана и ацетилена используют карбиды – соединения углерода с металлами. Их получают при реакции оксидов кальция и алюминия с коксом. Карбид алюминия получают также прямой реакцией алюминия с углеродом. При взаимодействии с водой карбида кальция выделяется ацетилен, а карбида алюминия – метан. Реакции взрывоопасны!
Их получают при реакции оксидов кальция и алюминия с коксом. Карбид алюминия получают также прямой реакцией алюминия с углеродом. При взаимодействии с водой карбида кальция выделяется ацетилен, а карбида алюминия – метан. Реакции взрывоопасны!
В промышленных масштабах получают метанол из неорганических веществ – смеси монооксида углерода, углекислого газа и водорода. Эта смесь носит название синтез-газ. Процесс ускоряют катализаторы из оксида цинка или меди.
На основе полученных органических веществ можно синтезировать неисчислимое множество соединений. Из ацетилена получают бензол, ацетальдегид, акрилонитрил, виниловые эфиры, винилхлорид, винилацетилен. Метан является предшественником нитрометана, ацетилена, хлороформа, фреонов, метанола и синтез-газа. Из метанола синтезируют формальдегид, метилтион, метиламин, диметиланилин, винилацетат, диметиловый эфир, винилметиловый эфир.
Вышеприведенные синтезы иллюстрируют генетическую связь между классами органических веществ. Термин генетическая связь означает, что вещество одного класса может превращаться в вещество другого класса.
Термин генетическая связь означает, что вещество одного класса может превращаться в вещество другого класса.
Генетическая связь записывается в виде генетических рядов – цепочек превращений веществ, имеющих в составе один и тот же химический элемент. Генетические ряды органических веществ очень разветвленные и сложные, в чем вы убедились на примере ацетилена, метанола, метана.
Генетические ряды неорганических веществ намного проще, потому что неорганические вещества делятся на меньшее число классов.
Генетический ряд металлов, образующих растворимые гидроксиды, представлен последовательностью реакций: из простого вещества получают основный оксид, затем гидроксид, затем соль. Помните, что у металлов, образующих нерастворимые в воде гидроксиды, генетический ряд выглядит несколько иначе: за оксидом следует соль, и только затем гидроксид.
Генетический ряд неметаллов аналогичен таковому металлов. Простое вещество образует кислотный оксид, затем кислоту и, наконец, соль.
Теперь вы знаете, что между генетическими рядами органических и неорганических соединений нет чётких границ, и можете обосновать это на примере синтеза мочевины, щавелевой кислоты, метана, ацетилена, метанола.
Не стоит забывать, что существует и обратный путь от органических веществ к неорганическим. Так, в реакции горения все органические вещества окисляются до углекислого газа и воды. При окислении щавелевой кислоты перманганатом калия в кислой среде она образует углекислый газ. Под действием высоких температур метан разлагается на углерод и водород. Последняя реакция – способ получения водорода.
В клетках живых организмов постоянно происходит синтез и распад органических соединений. В ходе фотосинтеза в хлоропластах растений из воды и углекислого газа образуется глюкоза. В клетках млекопитающих углеводы и жиры окисляются до воды и углекислого газа, а белки распадаются с образованием мочевины.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на множественный выбор.
Решение задачи на множественный выбор.
Условие задачи: Выберите верные генетические ряды и запишите их номера.
- Cu -> CuO -> Cu(OH)2 -> CuSO4
- Al -> Al4C3 -> CH4 -> CH3Cl -> CH3OH
- Ag2O -> [Ag(NH3)2]OH -> CH3COOAg
- CaC2 -> CH4 -> CH3Cl -> CH3CH2CH3
Решение:
Первый вариант неверный, потому что гидроксид меди нерастворим в воде и может быть получен только реакцией обмена соли меди и щелочи.
Второй вариант верный.
Третий вариант верный.
Четвертый вариант неверный, потому что метан получают гидролизом карбида алюминия. Карбид кальция под действием воды образует ацетилен.
2.Решение задачи на вписывание формул.
Условие задачи: Введите формулы пропущенных веществ в генетическом ряду.
Al4C3 -> (1) -> CH3Cl -> (2) -> C2H4 -> (3) -> OHCH2CH2OH
Решение:
При гидролизе карбида алюминия образуется метан (1). Галогенированный метан взаимодействует с металлическим натрием (синтез Вюрца) и образует этан (2). Этилен получают дегидрированием этана. Далее под действием пероксибензойной кислоты этилен превращается в окись этилена (3). При гидролизе этиленоксида образуется этиленгликоль.
Комбинаторная химия – Bayer Pharmaceuticals Россия
Благодаря внедрению автоматизированного синтеза новых соединений, комбинаторная химия перевернула традиционный химический подход к разработке новых лекарственных препаратов. Ускорение химического синтеза позволяет быстро создавать большие организованные коллекции соединений.
Молекулы, получаемые в результаты автоматизированного синтеза, пополняют наш запас соединений
В ходе поиска новых кандидатов на роль лекарственных препаратов ученые-исследователи Bayer начинают отбор с внутренней библиотеки соединений, которая содержит более чем 4 миллиона молекул. Синтез новых веществ обеспечивает постоянное расширение этой коллекции. С появлением автоматизированных процессов комбинаторной химии этот процесс в корне изменился, что является характерной особенностью медицинской химии на рубеже тысячелетия.
Синтез новых веществ обеспечивает постоянное расширение этой коллекции. С появлением автоматизированных процессов комбинаторной химии этот процесс в корне изменился, что является характерной особенностью медицинской химии на рубеже тысячелетия.
До тех пор, применяя классические методы синтеза, медицинские химики были способны произвести только одно вещество с точно заданными характеристиками за единицу времени. Эти методы позволяли создавать максимум по 150 – 200 соединений в год. Роботизированные системы, которые в настоящее время осуществляют синтезы такого рода параллельно, способны увеличить это количество во много раз.
Избирательный подход к созданию вариантов основной структуры
Автоматизированный синтез основан на принципе комбинаторной химии. Путем присоединения различных химических групп к исходной родительской молекуле (соединение-лидер) осуществляется систематическое производство ее вариантов в соответствии с характеристиками, предварительно заданными медицинским химиком. В результате получается ряд аналогичных соединений, которые отличаются друг от друга только дополнительными боковыми группами.
В результате получается ряд аналогичных соединений, которые отличаются друг от друга только дополнительными боковыми группами.
В ходе дальнейшего биологического анализа исследователи определяют, какие из вариантов молекулы в наибольшей степени способны обеспечить желаемый эффект. Это позволяет получить информацию о связях между молекулярной структурой и эффектом, которая является ключевой для последующей оптимизации соединения.
Благодаря комбинаторной химии в современной лаборатории можно синтезировать и в дальнейшем усовершенствовать значительное количество новых соединений, добавляя их в библиотеку соединений. Все процессы при этом являются автоматизированными. Молекулы, хранящиеся в таких библиотеках, доступны для дальнейшего высокопроизводительного скрининга, проводимого с целью выявления лекарственных препаратов.
Химические соединения алюминия – aluminium-guide.com
Ниже представлен краткий обзор важнейших химических соединений алюминия, которые находятся в природных условиях, а также их промышленного применения.
Что такое химическое соединение?
Химическое соединение алюминия – это вещество, которое образовано из двух или более химических элементов, одним из которых является алюминий. Эти элементы связаны между собой химически, то есть путем ковалентных, ионных или металлических связей. Химическое соединение имеет фиксированный химический состав и постоянную химическую формулу.
Алюминиевые сплавы обычно не являются химическими соединениями. Они являются гомогенными или гетерогенными смесями входящих в них химических элементов или соединений. Поэтому они не имеют фиксированного химического состава и не имеют химической формулы.
Классификация соединений алюминия
Современная классификация соединений алюминия из Энциклопедии Алюминия [4] представлена ниже.
Классификация соединений алюминия [4]
Алюминий в природе
Алюминий является самым распространенным (более 8 % по массе) природным металлическим элементом, а также третьим природным элементом среди всех химических элементов (после кислорода и кремния). Однако из-за высокой химической активности алюминия он почти всегда находится в соединениях с другими элементами и очень редко встречается в природе в виде чистого металла.
Однако из-за высокой химической активности алюминия он почти всегда находится в соединениях с другими элементами и очень редко встречается в природе в виде чистого металла.
Таблица – Доля химических элементов в земной коре
Металлический алюминий
Чистый алюминий – это серебристо-белый, ковкий, пластичный металл с атомным номером 13 и относительной атомной массой 26,98. За небольшими исключениями он находится в химических соединениях в виде Al+3.
Этот металл обладает амфотерными свойствами. Он реагирует с минеральными кислотами и сильными щелочами. Хотя алюминий является одним из самых химически активных промышленных металлов, он имеет очень высокое сопротивление коррозии. При контакте свежей алюминиевой поверхности с кислородом, водой или другими окислителями на ней мгновенно вырастает плотная оксидная пленка (Al2O3), которая обеспечивает металлу высокую стойкость к коррозии. Эта оксидная пленка растворяется в щелочных растворах с выделением водорода и образованием растворимых щелочноземельных алюминатов [1].
Эта оксидная пленка является стойкой к некоторым кислотам (например, азотной кислоте) и предотвращает дальнейшее химическое воздействие на металл. Однако она растворяется в некоторых кислотах (например, в соляной кислоте или горячей серной кислоте), а также в щелочных растворах, что делает возможным дальнейшие химические реакции на поверхности алюминия.
При повышенных температурах алюминий реагирует:
- с водой (выше 180 ºС) с образованием гидроксида Al(OH)3 и водорода H2;
- со многими оксидами металлов с образованием оксида Al2O3 и металла, восстановленного из его оксида.
Последняя реакция применяется при производстве некоторых металлов (алюмотермия), например, марганца и некоторых сплавов, например, ферротитана.
Природные соединения
Минералы
Природные минералы являются химическими соединениями. Алюминий присутствует во многих минералах – более 270 видов – в комбинациях с кислородом, кремнием, щелочными и щелочноземельными металлами и фтором, а также в виде гидроксидов, сульфатов и фосфатов.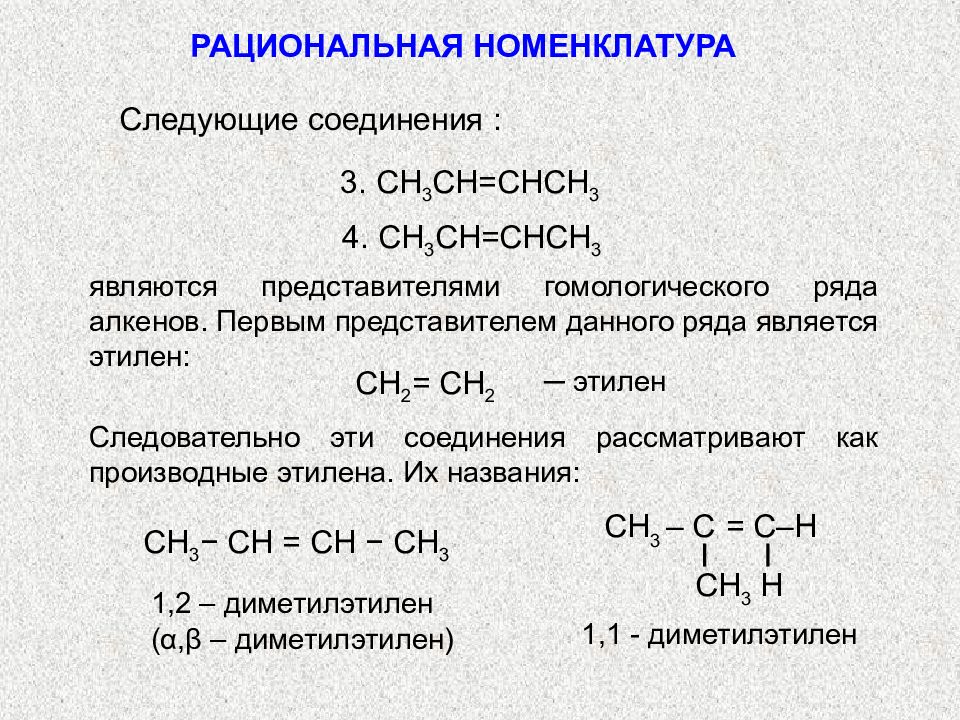 Например, полевые шпаты – наиболее распространенные минералы земной коры (около 50 %) – являются алюминосиликатами [1]. Ниже представлены важнейшие минералы алюминия из фундаментальной энциклопедии про алюминий [4]
Например, полевые шпаты – наиболее распространенные минералы земной коры (около 50 %) – являются алюминосиликатами [1]. Ниже представлены важнейшие минералы алюминия из фундаментальной энциклопедии про алюминий [4]
Важнейшие минералы алюминия [4]
Металлический алюминий в природе
Природный металлический алюминий иногда находят как минорную фазу в условиях недостатка кислорода, например, внутри некоторых вулканов. Он также встречается в таких минералах, как берилл, криолит, гранат, шпинель и бирюза [1].
Драгоценные камни
Примеси в кристаллах оксида Al2O3, такие как хром или кобальт дают драгоценные камни рубин и сапфир, соответственно. Чистый оксид Al2O3 известен как корунд – один из самых твердых материалов.
Рубин
Бокситы
Хотя алюминий и является очень распространенным природным элементом, большинство алюминиевых минералов не могут быть экономически выгодными источниками этого металла. Почти весь металлический первичный алюминий производится из руды, которая называется бокситом (или бокситами) с обобщенной химической формулой (AlOx(OH)3-2x) [1].
Почти весь металлический первичный алюминий производится из руды, которая называется бокситом (или бокситами) с обобщенной химической формулой (AlOx(OH)3-2x) [1].
Бокситы происходят в природе как продукты выветривания коренных пород с низким содержанием железа и кремния в тропических климатических условиях. Природные бокситы содержат различные гидратированные формы оксида алюминия, которые имеют различные кристаллические системы, а также различаются по степени гидратации (количеству молекул воды на одну молекулу Al2O3).
Производство глинозема
Около 90 % алюминиевых руд – бокситов – идет на производство первичного алюминия, остальные 10 % – на другие промышленные применения.
Промышленное производство первичного алюминия имеет две основных стадии:
- производство из исходной бокситной руды чистого оксида алюминия – глинозема;
- электрохимическое восстановление этого оксида до металлического алюминия в ванне расплавленного криолита.

Бокситы
Боксит не является минералом и химическим соединением. Это наименование – боксит (или, чаще, бокситы) – применяется для обозначения различных типов алюминиевых руд, которые содержат соединения алюминия, в основном – различные виды гидроксидов.
Промышленные бокситы содержит три основных типа гидроксидных минералов:
- гибсит: Al2O3·3H2O
- богемит – Al2O3·H2O
- диаспор – Al2O3·H2O.
Эти типы гидроксидов значительно различаются по таким физическим свойствам, как:
- содержание воды,
- кристаллическая система
- твердость,
- плотность,
- температура дегидратации
- растворимость в технологических растворах.
Обычно природные залежи бокситов состоят из одного из этих типов гидроксидов, хотя в некоторых случаях одна и та же алюминиевая руда может содержать смешанные гидроксиды.
Бокситы различаются по цвету от кремового до темно коричневого при высоком содержании железа.
Типичный боксит
В состав типичного боксита для промышленного производства алюминия входят следующие соединения:
- оксид алюминия – Al2O3: 40-60 %
- оксид кремния – SiO2: 1-6 %
- оксид железа – Fe2O3: 2-25 %
- оксид титана – TiO2: 1-5 %
- оксиды кальция и магния – CaO + MgO: 0,2-0,6 %
- оксиды других элементов: от 0,01 до 0,4 % (каждого).
Глинозем
Почти весь глинозем получают из бокситов, которые содержат около 50 % оксида Al2O3 в виде гидроксидов. Эту алюминиевую руду обрабатывают в растворе каустической соды под давлением, чтобы растворить оксид алюминия в виде алюмината, и отделить его от красного осадка, содержащего оксиды железа и другие основные примеси. Затем из этого раствора алюмината осаждают кристаллы гидроксида алюминия.
При температуре ниже 700 ºС в технологической массе содержатся следующие различные типы соединений алюминия – его гидроксидов:
- гиббсит
- байерит
- нордстрандид
- диаспор
- богемит.
Завершающей технологической операцией производства глинозема является обжиг полученной на предыдущих этапах смеси гидроксидов. Обжиг (кальцинация) производится при температуре 1200 ºС с получением на выходе чистого глинозема с содержанием оксида Al2O3 более 99 %.
Глинозем
Для промышленного производства 1 тонны алюминия требуется около 2 тонн глинозема.
Соединениями алюминия, которые являются наиболее важными для неметаллургических отраслей промышленности – являются его:
- оксид;
- сульфат и
- силикат.
Оксид алюминия
Кислородное соединение алюминия
Оксид алюминия – это одно из его кислородных соединений. Чистый оксид – это белый порошок в виде частиц различной формы и размеров. Из-за своих амфотерных свойств этот оксид растворяется в минеральных кислотах и сильных щелочах. Он может иметь различные модификации. Наиболее стабильным является его альфа-модификация «корунд» (альфа-Al2O3).
Из-за своих амфотерных свойств этот оксид растворяется в минеральных кислотах и сильных щелочах. Он может иметь различные модификации. Наиболее стабильным является его альфа-модификация «корунд» (альфа-Al2O3).
Типы оксидов
При дегидратации гидроксидов образуется серия типов оксида Al2O3, которые еще содержат небольшую долю гидроксильных групп и сохраняют некоторую химическую активность. Все оксиды, которые получены при пониженных температурах называют переходными модификациями. При температуре 1400 ºС все переходные модификации превращаются в альфа-модификацию [1].
Анодный оксид
Анодный оксид получают путем электрохимического оксидирования алюминия. Это соединение представляет собой наноструктурированный материал с уникальной структурой. Анодный алюминиевый оксид состоит из цилиндрических пор, которые обеспечивают ему широкое применение в технике. Он является термически и механически устойчивым, оптически прозрачным и обладает высокими электроизоляционными свойствами.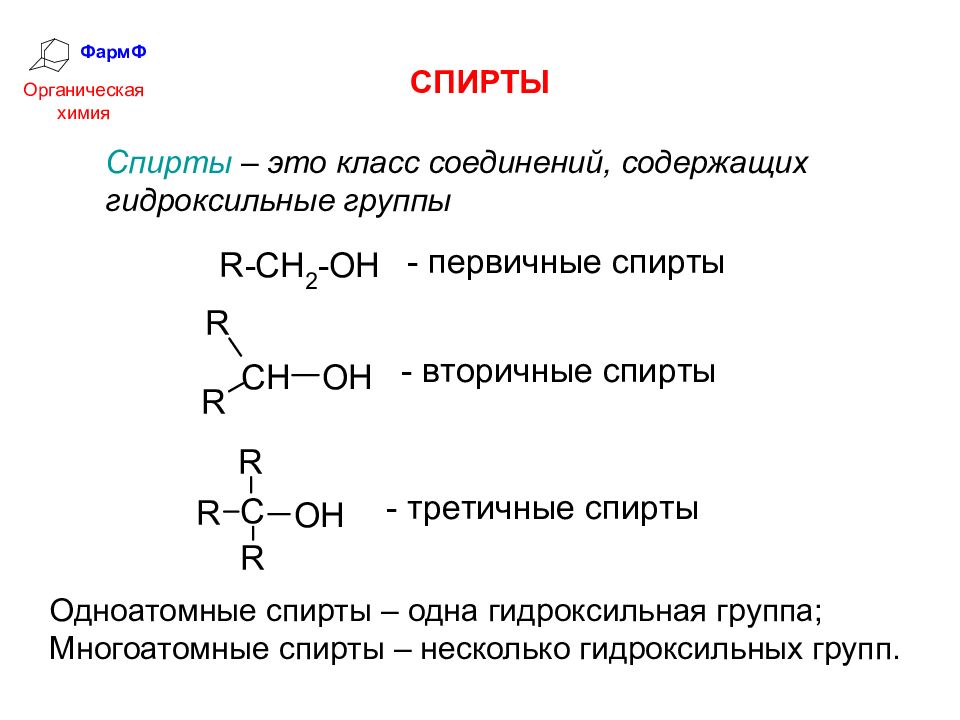 Размер пор и толщина анодного оксидного слоя легко регулируется параметрами технологии, что дает возможность его применения не только как защитного декоративного покрытия для алюминиевых изделий, но и как основу для нанотехнологий.
Размер пор и толщина анодного оксидного слоя легко регулируется параметрами технологии, что дает возможность его применения не только как защитного декоративного покрытия для алюминиевых изделий, но и как основу для нанотехнологий.
Структура анодного оксидного покрытия
Гидроксиды
Известны различные формы гидроксидов алюминия. Наиболее изученными формами являются тригидроксид Al(OH)3 и оксид-гидроксид AlO(OH). Кроме этих кристаллических форм известны еще несколько других типов [1].
Гидроксид Al(OH)3 применяется в больших объемах для очистки сточных вод, а также для производства других соединений алюминия, в том числе его солей.
Сульфат алюминия
Структура и состав
Сульфат алюминия может существовать с различными пропорциями воды. Обычной формой этого соединения является Al2(SO4)3·18H2O. Он почти нерастворим в обезвоженном спирте, но хорошо растворяется в воде. При температуре выше 770 ºС разлагается до оксида алюминия.
Применение
Находит применение в следующих отраслях промышленности и областях жизни [1, 2]:
- системы очистки воды и обработки сточных вод;
- производство бумаги;
- противопожарная защитная одежда;
- очистка масел и жиров;
- гидроизоляция бетона;
- производство антиперспирантов;
- выделка кож;
- производство красок;
- в сельскохозяйственных пестицидах;
- производство химикатов;
- средство для повышения кислотности почв;
- производство косметики и мыла;
- в медицинских препаратах.
Квасцы
Сульфат алюминия входит в комбинацию с сульфатами одновалентных металлов с образованием двойных солей, которые называются квасцами. Наиболее важным из этих солей является алюминиевый сульфат калия. Это химическое соединение также известно как калиевые квасцы. Эти квасцы имеют широкое применение с глубокой древности в производстве кожи, лекарств, тканей и красок.
Глины
Глины состоят в основном из алюмосиликатов.
Хлорид
При взаимодействии газообразного хлора с расплавленным алюминием образуется хлорид алюминия. Это соединение наиболее часто применяется как катализатор в реакциях синтеза различных органических соединений. Гидратированный хлорид AlCl3∙H2O, применяется как антипреспирант или дезодорант. Это соединение является одной из нескольких алюминиевых солей, которые применяются к косметической промышленности.
Гексагидратная форма хлорида алюминия применяется:
- для защитной обработки древесины,
- как дезинфицирующее средство в животноводстве и при производстве мяса;
- очистке сырой нефти
- производство бумаги
Гидрид алюминия
С водородом алюминий образует гидрид AlH3, который широко применяется в органической химии, в том числе, в виде литиевого гидрида алюминия (LiAlH4). Это соединение получают при взаимодействии хлорида алюминия с хлоридом лития.
Интерметаллические соединения
Интерметаллид (интерметаллическое соединение) — это химическое соединение двух или более металлов. Интерметаллиды, как это и должно быть у химических соединений, имеют фиксированное соотношение между своими компонентами. Обычно в интерметаллических соединениях связь между атомами – металлическая.
Интерметаллиды, как это и должно быть у химических соединений, имеют фиксированное соотношение между своими компонентами. Обычно в интерметаллических соединениях связь между атомами – металлическая.
Интерметаллические соединения имеет большое значение для микроструктуры и свойств алюминиевых сплавов. Например, железо и кремний являются примесями, которые всегда присутствуют в алюминии. Поскольку растворимость железа в твердом алюминии очень мала, то фазы Al-Fe или Al-Fe-Si можно найти в микроструктуре даже сверхчистого алюминия. Этими фазами могут быть интерметаллические соединения FeAl3, Fe3SiAl12, Al2Si2Al9 или FeAl6.
В алюминиевых сплавах насчитывается несколько десятков фаз, которые являются интерметаллическими соединениями. В сложных сплавах типа 2014 (система Al-Cu-Mg-Mn-Fe-Si) эти соединения имеют вид типа (Mn,Fe)3SiAl12 [3].
Таблица – Интерметаллические соединения алюминия [2]
Источники:
1. http://www.inchem.org/documents/ehc/ehc/ehc194.htm
http://www.inchem.org/documents/ehc/ehc/ehc194.htm
2. Handbook of Aluminum: Vol. 1: Physical Metallurgy and Processes / ed. G. E. Totten, D. S. MacKenzie – 2003.
3. Aluminium and Aluminium Alloys /ed. J.R. Davis – ASM International, 1993.
4. Тринадцатый элемент: Энциклопедия /А. Дроздов – Библиотека РУСАЛа, 2007
Что такое соединение в химии? Определение и примеры
Соединение состоит из двух или более элементов, химически связанных в фиксированном соотношении. Все соединения являются примерами молекул, но молекулы также включают вещества, состоящие только из одного элемента, химически связанного с самим собой.
В химии соединение — это вещество, состоящее из двух или более элементов, химически связанных друг с другом в фиксированном соотношении. Химические связи между атомами элементов включают передачу или разделение валентности электронов.Это придает соединению свойства, отличные от его элементов. Соединение может быть представлено химической формулой, которая показывает символы элементов атомов и их пропорции.
Примеры соединений
Примеры соединений включают любое вещество с более чем одним элементом и фиксированным соотношением между ними. Например, соотношение атомов водорода и кислорода в молекуле воды (H 2 O) всегда 2: 1. Независимо от того, есть ли у вас миллилитр или 50 литров воды, каждая частица имеет одинаковое соотношение 2: 1 между атомами водорода и кислорода.Это соотношение важно, потому что одни и те же элементы могут сочетаться в разных пропорциях, образуя соединения с совершенно разными свойствами. Например, вода (H 2 O) сильно отличается от пероксида водорода (H 2 O 2 ), хотя оба они состоят из атомов водорода и кислорода.
Примеры соединений и их названия включают:
- Вода (H 2 O)
- Пероксид водорода (H 2 O 2 )
- Окись углерода (CO)
- Двуокись углерода (CO 2 )
- Метан (CH 4 )
- Хлорид натрия (NaCl)
- Глюкоза (C 6 H 12 O 6 )
- Бикарбонат натрия (NaHCO 3 )
- Уксусная кислота ( C 2 H 4 O 2 )
- Серная кислота (H 2 SO 4 )
- Аммиак (NH 3 )
- Закись азота (N 2 O)
- Галлий арсенид (GaAs)
Примеры веществ, которые являются соединениями , а не , включают ион водорода (H + ) и элементы благородного газа (например,г. , Ar, Kr, Ne). Поскольку существует только один элемент, чистые металлы и двухатомные неметаллы часто не считаются соединениями (например, золото, медь, H 2 , F 2 ).
, Ar, Kr, Ne). Поскольку существует только один элемент, чистые металлы и двухатомные неметаллы часто не считаются соединениями (например, золото, медь, H 2 , F 2 ).
Разница между соединением и молекулой
Все соединения являются примерами молекул, но не все молекулы являются соединениями.
Согласно Международному союзу чистой и прикладной химии (IUPAC), молекула определяется как электрически нейтральное вещество, состоящее из более чем одного атома.Сюда входят соединения, а также двухатомные и трехатомные элементы, такие как кислород (O 2 ), хлор (Cl 2 ) и озон (O 3 ). Согласно этому определению, многие сверхпроводники являются молекулами, но не соединениями, потому что их химическая формула не имеет фиксированного соотношения. Примером является сверхпроводник YBCO, который имеет формулу YBa 2 Cu 3 O 7-x . (x может быть 0,15).
Типы соединений
Соединения классифицируются по типу химических связей, образующихся между атомами. Эти связи могут быть ионными, ковалентными, металлическими или смесью ионных и ковалентных связей.
Эти связи могут быть ионными, ковалентными, металлическими или смесью ионных и ковалентных связей.
- Ковалентные или молекулярные соединения удерживаются вместе ковалентными связями.
- Ионные соединения удерживаются вместе ионными связями.
- Комплексы удерживаются вместе координационными ковалентными связями.
- Интерметаллические соединения удерживаются вместе металлическими связями.
Как записывать формулы соединений
В названиях и формулах соединений перечисляются сначала атом или группа атомов, действующих как катион, а затем атом или группа атомов, действующих как анион.Поскольку атомы элементов имеют разные степени окисления, элемент может находиться либо в начале, либо в конце формулы, в зависимости от других элементов. Например, углерод (C) представляет собой катион в диоксиде углерода (CO 2 ) и анион в углеродном кремнии (SiC).
Число атомов элемента указывается с помощью нижних индексов. Если в элементе только один атом, нижний индекс опускается. Вода — это соединение, состоящее из двух атомов водорода (H) и одного атома кислорода (O). H 2 O правильно, а H 2 O 1 — нет.Поваренная соль (хлорид натрия) состоит из одного атома натрия, связанного с одним атомом хлора. Его химическая формула — NaCl, а не Na 1 Cl 1 .
Вода — это соединение, состоящее из двух атомов водорода (H) и одного атома кислорода (O). H 2 O правильно, а H 2 O 1 — нет.Поваренная соль (хлорид натрия) состоит из одного атома натрия, связанного с одним атомом хлора. Его химическая формула — NaCl, а не Na 1 Cl 1 .
Ссылки
- Brown, Theodore L .; ЛеМэй, Х. Юджин; Bursten, Bruce E .; Мерфи, Кэтрин Дж .; Вудворд, Патрик (2013). Химия: Центральная наука (3-е изд.), Френчс Форест, Новый Южный Уэльс: Пирсон / Прентис Холл. ISBN 9781442559462.
- IUPAC (1997). «Молекула». Сборник химической терминологии (2-е изд.) («Золотая книга»). Оксфорд: Научные публикации Блэквелла. ISBN 0-9678550-9-8. DOI: 10.1351 / goldbook
- Hill, John W .; Петруччи, Ральф Х .; МакКрири, Терри У .; Перри, Скотт С. (2005). Общая химия (4-е изд.). Река Аппер Сэдл, Нью-Джерси: Пирсон / Прентис-Холл. ISBN 978-0-13-140283-6.
- Whitten, Kenneth W .
 ; Дэвис, Раймонд Э .; Пек, М. Ларри (2000). Общая химия (6-е изд.). Форт-Уэрт, Техас: Издательство колледжа Сондерс / Издательство колледжа Харкорт.ISBN 978-0-03-072373-5.
; Дэвис, Раймонд Э .; Пек, М. Ларри (2000). Общая химия (6-е изд.). Форт-Уэрт, Техас: Издательство колледжа Сондерс / Издательство колледжа Харкорт.ISBN 978-0-03-072373-5.
Химическое соединение
2
Открытие нетоксичных полупроводников с прямой запрещенной зоной в ближнем инфракрасном диапазоне
23 марта 2021 г. — Ученые обнаружили потенциально многообещающий инфракрасный светодиод и инфракрасный детектор. Это соединение, состоящее из кальция, кремния и кислорода, дешево в производстве и нетоксично. Многие из …
ChemMaps позволяет исследователям перемещаться по химической Вселенной
4 июня 2018 г. — Новый онлайн-сервис ChemMaps позволяет пользователям интерактивно перемещаться по химическому пространству более 8000 лекарств и 47000 соединений окружающей среды в трехмерном и реальном …
Химики используют синергетический эффект галлия
21 января 2021 г. — Химики продемонстрировали ценность «командной работы», успешно используя взаимодействие между двумя атомами галлия в новом соединении, чтобы разделить особенно прочную связь между ними. ..
..
Новые азотные продукты в воздухе
12 августа 2020 г. — Исследователи нашли способ объединить атмосферный азот с бензолом, чтобы получить химическое соединение под названием анилин, которое является предшественником материалов, используемых для производства различных синтетических …
Чеснок ингредиент из лабораторного стенда
23 августа 2018 г. — Экстракты свежего чеснока содержат множество полезных для здоровья сероорганических соединений, среди которых аджоен является одним из основных компонентов, экстрагируемых маслом.Теперь химики синтезировали аджоен из легкодоступных …
Обнаружено соединение, нацеленное на раковые клетки, лишенные защитного гена-хранителя P53
15 августа 2018 г. — Разработано новое химическое соединение, способное разрушать трудноизлечимые раковые клетки, и …
Искусственные ферменты действуют на живые клетки
26 июля 2018 г. — Природа разработала тысячи ферментов для облегчения многих химических реакций, протекающих внутри организмов для поддержания жизни. Теперь исследователи разработали искусственные ферменты, которые находятся на …
Теперь исследователи разработали искусственные ферменты, которые находятся на …
В поисках светового материала будущего
1 мая 2020 г. — Исследователи узнали о многообещающем материале для органических светодиодов (OLED). Вещество обеспечивает высокий световой выход и будет недорогим в производстве в больших масштабах — …
Синтез дикарбоновых кислот и водорода одновременно из диолов
30 июля 2020 г. — Исследователи разрабатывают более безопасный и эффективный способ производства дикарбоновой кислоты.Используя иридиевый катализатор, связанный с бипиридонатным лигандом, исследователи смогли синтезировать дикарбоновые кислоты из …
Пористые материалы проливают свет на очистку окружающей среды
5 июля 2018 г. — Ученые разработали стабильные монокристаллические пористые органические каркасы с водородными связями, которые термически и химически стойкие, обладают большой площадью поверхности и флуоресцентными свойствами. …
…
3.1. Типы химических соединений и их формулы
Цели обучения
- Чтобы понять разницу между ковалентной и ионной связью.
Атомы во всех веществах, содержащих несколько атомов, удерживаются вместе за счет электростатических взаимодействий — взаимодействий между электрически заряженными частицами, такими как протоны и электроны. Электростатическое притяжение между противоположно заряженными видами (положительными и отрицательными) приводит к возникновению силы, которая заставляет их двигаться друг к другу, как притяжение между противоположными полюсами двух магнитов.Напротив, электростатическое отталкивание между двумя видами с одинаковым зарядом (как положительными, так и отрицательными) приводит к силе, которая заставляет их отталкивать друг друга, как и те же полюса двух магнитов. Атомы образуют химические соединения, когда притягивающие электростатические взаимодействия между ними сильнее, чем отталкивающие. В совокупности притягивающие взаимодействия между атомами называются химическими связями.
Химические связи обычно делятся на два принципиально разных типа: ионные и ковалентные.В действительности, однако, связи в большинстве веществ не являются ни чисто ионными, ни чисто ковалентными, а лежат в спектре между этими крайностями. Хотя чисто ионные и чисто ковалентные связи представляют собой крайние случаи, которые редко встречаются в каких-либо, кроме очень простых веществ, краткое обсуждение этих двух крайностей помогает объяснить, почему вещества с разными типами химических связей имеют очень разные свойства. Ионные соединения состоят из положительно и отрицательно заряженных ионов, удерживаемых вместе сильными электростатическими силами, тогда как ковалентные соединения обычно состоят из молекул, которые представляют собой группы атомов, в которых одна или несколько пар электронов совместно используются связанными атомами.В ковалентной связи атомы удерживаются вместе за счет электростатического притяжения между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, которые они разделяют. Это обсуждение структур и формул начинается с описания ковалентных соединений. Энергетические факторы, участвующие в образовании связи, более подробно описаны ниже.
Примечание
Ионные соединения состоят из ионов с противоположными зарядами, удерживаемых вместе сильными электростатическими силами, тогда как пары электронов разделяются между связанными атомами в ковалентных соединениях.
Ковалентные молекулы и соединения
Так же, как атом — простейшая единица, обладающая фундаментальными химическими свойствами элемента, так и молекула — простейшая единица, обладающая фундаментальными химическими свойствами ковалентного соединения. Некоторые чистые элементы существуют в виде ковалентных молекул. Водород, азот, кислород и галогены встречаются в природе в виде двухатомных («двухатомных») молекул H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 , и I 2 (часть (a) на рисунке \ (\ PageIndex {1} \)).Точно так же несколько чистых элементов существуют в виде многоатомных («многоатомных») молекул, таких как элементарный фосфор и сера, которые встречаются как P 4 и S 8 (часть (b) на рисунке \ (\ PageIndex {1}) \)).
Каждое ковалентное соединение представлено молекулярной формулой, которая дает атомный символ для каждого составляющего элемента в заданном порядке, сопровождаемый нижним индексом, указывающим количество атомов этого элемента в молекуле. Нижний индекс пишется только в том случае, если количество атомов больше 1.Например, вода с двумя атомами водорода и одним атомом кислорода на молекулу записывается как \ (H_2O \). Точно так же диоксид углерода, который содержит один атом углерода и два атома кислорода в каждой молекуле, записывается как \ (CO_2 \).
Рисунок \ (\ PageIndex {1} \): элементы, которые существуют как ковалентные молекулы. (a) Несколько элементов естественным образом существуют в виде двухатомных молекул, в которых два атома (E) соединены одной или несколькими ковалентными связями с образованием молекулы с общей формулой E2. (б) Некоторые элементы естественным образом существуют в виде многоатомных молекул, которые содержат более двух атомов.Например, фосфор существует в виде тетраэдров P4 — правильных многогранников с четырьмя треугольными сторонами — с атомом фосфора в каждой вершине. Элементарная сера состоит из сморщенного кольца из восьми атомов серы, соединенных одинарными связями. Селен не показан из-за сложности его структуры.
Ковалентные соединения, содержащие преимущественно углерод и водород, называются органическими соединениями. При представлении формул органических соединений принято писать сначала углерод, затем водород, а затем любые другие элементы в алфавитном порядке (например,g., CH 4 O — метиловый спирт, топливо). Соединения, которые состоят в основном из элементов, отличных от углерода и водорода, называются неорганическими соединениями; они включают как ковалентные, так и ионные соединения. В неорганических соединениях составные элементы перечислены, начиная с самого левого в периодической таблице, как в CO 2 или SF 6 . Те, кто находится в той же группе, перечислены, начиная с нижнего элемента и постепенно увеличиваясь, как в ClF. Однако по соглашению, когда неорганическое соединение содержит и водород, и элемент из групп 13-15, водород обычно указывается в формуле последним.Примерами являются аммиак (NH 3 ) и силан (SiH 4 ). Такие соединения, как вода, состав которых был установлен задолго до принятия этого соглашения, всегда сначала пишется с водородом: вода всегда пишется как H 2 O, а не как OH 2 . Условные обозначения для неорганических кислот, таких как соляная кислота (HCl) и серная кислота (H 2 SO 4 ), описаны в другом месте.
Примечание
Для органических соединений: сначала напишите C, затем H, а затем остальные элементы в алфавитном порядке.Для молекулярных неорганических соединений: начните с крайнего левого элемента периодической таблицы; перечислить элементы в одной группе, начиная с нижнего элемента и далее.
Пример \ (\ PageIndex {1} \)
Напишите молекулярную формулу каждого соединения.
- Соединение фосфор-сера, которое отвечает за воспламенение так называемых спичек в любом месте, имеет 4 атома фосфора и 3 атома серы на молекулу.
- Этиловый спирт, спирт для алкогольных напитков, имеет 1 атом кислорода, 2 атома углерода и 6 атомов водорода на молекулу.
- Фреон-11, когда-то широко используемый в автомобильных кондиционерах и участвовавший в повреждении озонового слоя, имеет 1 атом углерода, 3 атома хлора и 1 атом фтора на молекулу.
Дано : идентичность присутствующих элементов и количество атомов в каждом
Запрошено : молекулярная формула
Стратегия :
A Определите символ для каждого элемента в молекуле. Затем идентифицируйте вещество как органическое или неорганическое соединение.
B Если вещество является органическим соединением, расположите элементы по порядку, начиная с углерода и водорода, а затем перечислите другие элементы в алфавитном порядке. Если это неорганическое соединение, перечислите элементы, начиная с самого левого в периодической таблице. Перечислите элементы в одной группе, начиная с нижнего элемента и постепенно увеличивая его.
C На основе предоставленной информации добавьте нижний индекс для каждого типа атомов, чтобы записать молекулярную формулу.
Решение :
а.
- A В молекуле 4 атома фосфора и 3 атома серы. Поскольку соединение не содержит в основном углерода и водорода, оно неорганическое.
- B Фосфор находится в группе 15, а сера — в группе 16. Поскольку фосфор находится слева от серы, он записывается первым.
- C Запись номера каждого типа атомов в виде правого нижнего индекса дает P 4 S 3 в качестве молекулярной формулы.
г.
- A Этиловый спирт содержит преимущественно углерод и водород, поэтому он является органическим соединением.
- B Формула органического соединения записывается сначала с числом атомов углерода, затем с числом атомов водорода, а остальные атомы располагаются в алфавитном порядке: CHO.
- C Добавление нижних индексов дает молекулярную формулу \ (\ ce {C2H6O} \).
г.
- A Фреон-11 содержит углерод, хлор и фтор.Его можно рассматривать либо как неорганическое соединение, либо как органическое соединение (в котором фтор заменил водород). Таким образом, формула для фреона-11 может быть записана с использованием любого из двух соглашений.
- B Согласно соглашению для неорганических соединений, углерод пишется первым, потому что он находится дальше слева в периодической таблице. Фтор и хлор находятся в одной группе, поэтому они перечислены, начиная с нижнего элемента и постепенно увеличиваясь: CClF. Добавление нижних индексов дает молекулярную формулу CCl 3 F.
- C Мы получаем ту же формулу для фреона-11, используя условные обозначения для органических соединений. Сначала записывается количество атомов углерода, затем количество атомов водорода (ноль), а затем другие элементы в алфавитном порядке, что также дает CCl 3 F.
Упражнение \ (\ PageIndex {1} \)
Напишите молекулярную формулу для каждого соединения.
- Закись азота, также называемая «веселящий газ», содержит 2 атома азота и 1 атом кислорода на молекулу.Закись азота используется в качестве мягкого анестетика при небольших хирургических вмешательствах и в качестве пропеллента в банках со взбитыми сливками.
- Сахароза, также известная как тростниковый сахар, имеет 12 атомов углерода, 11 атомов кислорода и 22 атома водорода.
- Гексафторид серы, газ, используемый для создания давления «негерметичных» теннисных мячей и в качестве хладагента в ядерных реакторах, содержит 6 атомов фтора и 1 атом серы на молекулу.
Ответ :
- N 2 O
- C 12 H 22 O 11
- SF 6
Представления молекулярных структур
Молекулярные формулы дают только элементный состав молекул.Напротив, структурные формулы показывают, какие атомы связаны друг с другом, а в некоторых случаях — примерное расположение атомов в пространстве. Знание структурной формулы соединения позволяет химикам создать трехмерную модель, которая предоставляет информацию о том, как это соединение будет вести себя физически и химически.
Рисунок \ (\ PageIndex {2} \): молекулы, содержащие одинарные, двойные и тройные связи. Водород (H 2 ) имеет одинарную связь между атомами. Кислород (O 2 ) имеет двойную связь между атомами, обозначенную двумя линиями (=).Азот (N 2 ) имеет тройную связь между атомами, обозначенную тремя линиями (≡). Каждая связь представляет собой электронную пару.
Структурная формула для H 2 может быть представлена как H – H, а формула для I 2 — как I – I, где линия указывает на одну пару общих электронов, одинарную связь. Две пары электронов связаны двойной связью, что обозначено двумя линиями, например, O 2 — это O = O. Три электронные пары объединены тройной связью, которая обозначена тремя линиями — например, N 2 — это N≡N (рисунок \ (\ PageIndex {2} \)).Углерод уникален тем, что он образует одинарные, двойные и тройные связи с самим собой и другими элементами. Число связей, образованных атомом в его ковалентных соединениях, не является произвольным. Водород, кислород, азот и углерод имеют очень сильную тенденцию к образованию веществ, в которых они имеют одну, две, три и четыре связи с другими атомами соответственно (Таблица \ (\ PageIndex {1} \)).
| Атом | Количество облигаций |
|---|---|
| H (группа 1) | 1 |
| О (группа 16) | 2 |
| N (группа 15) | 3 |
| C (группа 14) | 4 |
Структурная формула воды может быть представлена следующим образом:
Поскольку последняя аппроксимирует экспериментально определенную форму молекулы воды, она более информативна.Точно так же аммиак (NH 3 ) и метан (CH 4 ) часто записывают в виде плоских молекул:
Однако, как показано на рисунке \ (\ PageIndex {3} \), реальная трехмерная структура NH 3 выглядит как пирамида с треугольным основанием из трех атомов водорода. Структура CH 4 с четырьмя атомами водорода, расположенными вокруг центрального атома углерода, как показано на рисунке \ (\ PageIndex {3} \), является тетраэдрической: атомы водорода расположены в каждой второй вершине куба.Многие соединения, в частности соединения углерода, имеют четыре связанных атома, расположенных вокруг центрального атома, образуя тетраэдр.
Рисунок \ (\ PageIndex {3} \): Трехмерные структуры воды, аммиака и метана. (а) Вода представляет собой молекулу V-образной формы, в которой все три атома лежат в одной плоскости. (b) Напротив, аммиак имеет пирамидальную структуру, в которой три атома водорода образуют основание пирамиды, а атом азота находится в вершине. (c) четыре атома водорода метана образуют тетраэдр; атом углерода находится в центре.
Рисунки \ (\ PageIndex {3} \) — \ (\ PageIndex {3} \) иллюстрируют различные способы представления структур молекул. Должно быть ясно, что не существует единственного «наилучшего» способа изобразить структуру молекулы; используемый метод зависит от того, какой аспект конструкции следует выделить и сколько времени и усилий потребуется. На рисунке \ (\ PageIndex {4} \) показаны некоторые из различных способов изобразить структуру немного более сложной молекулы: метанола. Эти представления сильно различаются по своему информационному содержанию.Например, молекулярная формула метанола (часть (а) на рисунке \ (\ PageIndex {4} \)) дает только номер каждого типа атомов; запись метанола в виде CH 4 O ничего не говорит о его структуре. Напротив, структурная формула (часть (b) на рисунке \ (\ PageIndex {4} \)) указывает, как атомы связаны, но при этом метанол выглядит так, как если бы он был плоским (а это не так). Как модель с мячом и клюшкой (часть (c) на рисунке \ (\ PageIndex {4} \)), так и перспективный рисунок (часть (d) на рисунке \ (\ PageIndex {4} \)) демонстрируют три вида размерная структура молекулы.Последнее (также называемое представлением в виде клина и тире) — это самый простой способ нарисовать структуру молекулы в трех измерениях. Он показывает, какие атомы находятся выше и ниже плоскости бумаги, с помощью клиньев и штрихов соответственно; центральный атом всегда предполагается находящимся в плоскости бумаги. Модель заполнения пространства (часть (e) на рисунке \ (\ PageIndex {4} \)) иллюстрирует приблизительные относительные размеры атомов в молекуле, но не показывает связи между атомами. Кроме того, в модели заполнения пространства атомы на «передней стороне» молекулы могут закрывать атомы на «задней стороне».”
Рисунок \ (\ PageIndex {4} \): различные способы представления структуры молекулы. (а) Молекулярная формула метанола дает только количество присутствующих атомов каждого типа. (б) Структурная формула показывает, какие атомы связаны. (c) Модель шара и палки показывает атомы как сферы, а связи как палочки. (d) Перспективный рисунок (также называемый изображением клина и тире) пытается показать трехмерную структуру молекулы. (e) Модель заполнения пространства показывает атомы в молекуле, но не связи.(е) Структурная формула в сжатом виде — это, безусловно, самый простой и распространенный способ представления молекулы.
Хотя структурная формула, шарообразная модель, перспективный рисунок и модель заполнения пространства предоставляют значительный объем информации о структуре молекулы, каждая из них требует времени и усилий. Следовательно, химики часто используют сжатую структурную формулу (часть (f) на рисунке \ (\ PageIndex {4} \)), в которой опускаются линии, представляющие связи между атомами, и просто перечисляются атомы, связанные с данным атомом рядом с ним.Несколько групп, присоединенных к одному и тому же атому, показаны в скобках с нижним индексом, указывающим количество таких групп. Например, конденсированная структурная формула метанола — CH 3 OH, что указывает на то, что молекула содержит звено CH 3 , которое выглядит как фрагмент метана (CH 4 ). Таким образом, метанол можно рассматривать либо как молекулу метана, в которой один атом водорода заменен группой –ОН, либо как молекулу воды, в которой один атом водорода заменен фрагментом –CH 3 .Из-за простоты использования и содержания информации мы используем сжатые структурные формулы для молекул по всему тексту. Шариковые модели используются, когда необходимо проиллюстрировать трехмерную структуру молекул, а модели заполнения пространства используются только тогда, когда необходимо визуализировать относительные размеры атомов или молекул, чтобы понять важный момент.
Пример \ (\ PageIndex {2} \)
Напишите молекулярную формулу для каждого соединения. Приведена сокращенная структурная формула.
- Монохлорид серы (также называемый дихлоридом дисеры) представляет собой едкую жидкость желтого цвета с неприятным запахом, используемую при производстве синтетического каучука. Его сжатая структурная формула — ClSSCl.
- Этиленгликоль является основным ингредиентом антифриза. Его сжатая структурная формула: HOCH 2 CH 2 OH.
- Триметиламин — одно из веществ, ответственных за запах испорченной рыбы. Его сжатая структурная формула: (CH 3 ) 3 N.
Дано : сжатая структурная формула
Запрошено : молекулярная формула
Стратегия :
- Определите каждый элемент в сжатой структурной формуле, а затем определите, является ли соединение органическим или неорганическим.
- При необходимости используйте условные обозначения «органические» или «неорганические» для перечисления элементов. Затем добавьте соответствующие индексы, чтобы указать количество атомов каждого элемента, присутствующего в молекулярной формуле.
Решение :
В молекулярной формуле перечислены элементы в молекуле и количество атомов в каждом.
- A Каждая молекула монохлорида серы имеет два атома серы и два атома хлора. Поскольку он не содержит в основном углерода и водорода, это неорганическое соединение. B Сера находится слева от хлора в периодической таблице, поэтому она записывается в формуле первой. Добавление нижних индексов дает молекулярную формулу S 2 Cl 2 .
- A Подсчитав количество атомов в этиленгликоле, мы получим шесть атомов водорода, два атома углерода и два атома кислорода на молекулу. Соединение состоит в основном из атомов углерода и водорода, поэтому оно органическое. B Как и все органические соединения, C и H записываются первыми в молекулярной формуле. Добавление соответствующих индексов дает молекулярную формулу C 2 H 6 O 2 .
- A Сводная структурная формула показывает, что триметиламин содержит три звена CH 3 , поэтому на молекулу приходится один атом азота, три атома углерода и девять атомов водорода.Поскольку триметиламин содержит в основном углерод и водород, это органическое соединение. B Согласно соглашению для органических соединений, C и H пишутся первыми, что дает молекулярную формулу C 3 H 9 N.
Упражнение \ (\ PageIndex {2} \)
Напишите молекулярную формулу для каждой молекулы.
- Хлороформ, который был одним из первых анестетиков и до недавнего времени использовался во многих сиропах от кашля, содержит один атом углерода, один атом водорода и три атома хлора.Его сжатая структурная формула — CHCl 3 .
- Гидразин используется в качестве топлива в реактивных двигателях космического корабля «Шаттл». Его сжатая структурная формула: H 2 NNH 2 .
- Путресцин — соединение с резким запахом, впервые выделенное из экстрактов гниющего мяса. Его сжатая структурная формула: H 2 NCH 2 CH 2 CH 2 CH 2 NH 2 . Это часто записывается как H 2 N (CH 2 ) 4 NH 2 , чтобы указать, что существует четыре фрагмента CH 2 , связанных вместе.
- Ответьте на
CHCl 3
- Ответ б
N 2 H 4
- Ответ c
C 4 H 12 N 2
Ионные соединения
Вещества, описанные в предыдущем обсуждении, состоят из электрически нейтральных молекул; то есть количество положительно заряженных протонов в ядре равно количеству отрицательно заряженных электронов.Напротив, ионы — это атомы или сборки атомов, которые имеют общий электрический заряд. Ионы, которые содержат меньше электронов, чем протоны, имеют общий положительный заряд и называются катионами. И наоборот, ионы, которые содержат больше электронов, чем протонов, имеют общий отрицательный заряд и называются анионами. Ионные соединения содержат как катионы, так и анионы в соотношении, которое не приводит к отсутствию чистого электрического заряда.
Примечание
Ионные соединения содержат как катионы, так и анионы в соотношении, которое дает ноль электрический заряд.
Рисунок \ (\ PageIndex {5} \): Ковалентная и ионная связь. (a) В молекулярном водороде (H 2 ) два атома водорода имеют два общих электрона, образуя ковалентную связь. (b) Ионное соединение NaCl образуется, когда электроны от атомов натрия переносятся на атомы хлора. Образующиеся ионы Na + и Cl — образуют трехмерное твердое тело, которое удерживается вместе за счет притягивающих электростатических взаимодействий.
В ковалентных соединениях электроны распределяются между связанными атомами и одновременно притягиваются более чем к одному ядру.Напротив, ионные соединения содержат катионы и анионы, а не отдельные нейтральные молекулы. Ионные соединения удерживаются вместе за счет притягивающих электростатических взаимодействий между катионами и анионами. В ионном соединении катионы и анионы расположены в пространстве, чтобы сформировать расширенный трехмерный массив, который максимизирует количество притягивающих электростатических взаимодействий и минимизирует количество отталкивающих электростатических взаимодействий (Рисунок \ (\ PageIndex {5} \)). Как показано в уравнении 3.1.1, электростатическая энергия взаимодействия между двумя заряженными частицами пропорциональна произведению зарядов на частицах и обратно пропорциональна расстоянию между ними:
\ [\ text {электростатическая энергия} \ propto {Q_1Q_2 \ over r} \ label {3.1.1} \]
где
- ,
- \ (Q_1 \) и \ (Q_2 \) — электрические заряды на частицах 1 и 2, а
- \ (r \) — расстояние между ними.
Когда \ (Q_1 \) и \ (Q_2 \) оба положительны, что соответствует зарядам катионов, катионы отталкиваются друг от друга и электростатическая энергия положительна. Когда \ (Q_1 \) и \ (Q_2 \) оба отрицательны, что соответствует зарядам анионов, анионы отталкиваются друг от друга, и электростатическая энергия снова становится положительной.Электростатическая энергия отрицательна только тогда, когда заряды имеют противоположные знаки; то есть положительно заряженные виды притягиваются к отрицательно заряженным и наоборот. Как показано на рисунке \ (\ PageIndex {6} \), сила взаимодействия пропорциональна величине зарядов и уменьшается по мере увеличения расстояния между частицами. Эти энергетические факторы более подробно обсуждаются позже.
Рисунок \ (\ PageIndex {6} \): Влияние заряда и расстояния на силу электростатических взаимодействий.По мере увеличения заряда на ионах или уменьшения расстояния между ионами увеличивается сила притягивающего (-… +) или отталкивающего (-… — или +… +) взаимодействий. Сила этих взаимодействий представлена толщиной стрелок.
Примечание
Если электростатическая энергия положительна, частицы отталкиваются друг от друга; если электростатическая энергия отрицательна, частицы притягиваются друг к другу.
Одним из примеров ионного соединения является хлорид натрия (NaCl), образованный из натрия и хлора.При образовании химических соединений многие элементы имеют тенденцию приобретать или терять достаточно электронов, чтобы достичь того же количества электронов, что и ближайший к ним благородный газ в периодической таблице. Когда натрий и хлор вступают в контакт, каждый атом натрия отдает электрон, чтобы стать ионом Na + , с 11 протонами в его ядре, но только 10 электронами (как неон), и каждый атом хлора получает электрон, чтобы стать Cl. Ион – с 17 протонами в ядре и 18 электронами (как аргон), как показано в части (b) на рисунке \ (\ PageIndex {5} \).Твердый хлорид натрия содержит равное количество катионов (Na + ) и анионов (Cl — ), таким образом сохраняя электрическую нейтральность. Каждый ион Na + окружен 6 ионами Cl — , а каждый ион Cl — окружен 6 ионами Na + . Из-за большого количества притягивающих взаимодействий Na + Cl — общая притягивающая электростатическая энергия в NaCl велика.
В соответствии с тенденцией иметь такое же количество электронов, что и ближайший благородный газ, при образовании ионов элементы в группах 1, 2 и 3 имеют тенденцию терять один, два и три электрона, соответственно, с образованием катионов, таких как Na + и Mg 2 + .Тогда у них такое же количество электронов, как и у ближайшего благородного газа: неона. Точно так же K + , Ca 2 + и Sc 3 + имеют по 18 электронов, как и ближайший благородный газ: аргон. Кроме того, элементы в группе 13 теряют три электрона с образованием катионов, таких как Al 3 + , снова достигая того же количества электронов, что и ближайший к ним благородный газ в периодической таблице. Поскольку лантаноиды и актиниды формально принадлежат к группе 3, наиболее распространенный ион, образованный этими элементами, — это M 3 + , где M представляет собой металл.И наоборот, элементы в группах 17, 16 и 15 часто реагируют с получением одного, двух и трех электронов, соответственно, с образованием таких ионов, как Cl —, S 2- и P 3-. Такие ионы, которые содержат только один атом, называются одноатомными ионами. Заряды большинства одноатомных ионов, происходящих от элементов основной группы, можно предсказать, просто взглянув на периодическую таблицу и посчитав, сколько столбцов находится в крайнем левом или правом углу. Например, барий (в Группе 2) образует Ba 2 + , чтобы иметь то же количество электронов, что и его ближайший благородный газ, ксенон; кислород (в группе 16) образует O 2-, чтобы иметь такое же количество электронов, как неон; а цезий (в Группе 1) образует Cs + , который имеет такое же количество электронов, как ксенон.Обратите внимание, что этот метод неэффективен для большинства переходных металлов, как обсуждалось в разделе 2.3. Некоторые общие одноатомные ионы перечислены в Таблице \ (\ PageIndex {2} \).
Примечание
элементов в группах 1, 2 и 3 имеют тенденцию образовывать ионы 1+, 2+ и 3+ соответственно; элементы в группах 15, 16 и 17 имеют тенденцию к образованию ионов 3–, 2– и 1– соответственно.
| Группа 1 | Группа 2 | Группа 3 | Группа 13 | Группа 15 | Группа 16 | Группа 17 |
|---|---|---|---|---|---|---|
Ли + литий | Be 2 + бериллий | N 3− нитрид (азид) | O 2− оксид | Ф. — фторид | ||
Na + натрий | мг 2 + магний | Al 3 + алюминий | П 3− фосфид | S 2− сульфид | Класс — хлорид | |
К + калий | Ca 2 + кальций | СК 3 + скандий | Ga 3 + галлий | As 3− арсенид | SE 2− селенид | рублей — бромид |
руб. + рубидий | Sr 2 + стронций | Y 3 + иттрий | В 3 + Индий | Те 2− теллурид | I — йодид | |
CS + цезий | Ba 2 + барий | Ла 3 + лантан |
Пример \ (\ PageIndex {3} \)
Предскажите заряд самого обычного одноатомного иона, образованного каждым элементом.
- алюминий, используемый в квантовых логических часах, самых точных часах в мире
- селен, из которого делают стекло рубинового цвета
- Иттрий, используемый для изготовления высокопроизводительных свечей зажигания
Дано : элемент
Запрошено : ионный заряд
Стратегия :
A Укажите группу в периодической таблице, к которой принадлежит элемент. Основываясь на его расположении в периодической таблице, решите, является ли элемент металлом, который имеет тенденцию терять электроны; неметалл, который имеет тенденцию собирать электроны; или полуметалл, который может делать то и другое.
B После обнаружения ближайшего к элементу благородного газа определите количество электронов, которое элемент должен получить или потерять, чтобы иметь такое же количество электронов, как и ближайший благородный газ.
Решение :
- A Алюминий — металл 13 группы; следовательно, он будет терять электроны. B Ближайший к алюминию благородный газ — неон. Алюминий потеряет три электрона с образованием иона Al 3 + , который имеет то же количество электронов, что и неон.
- A Селен — неметалл группы 16, поэтому он будет иметь тенденцию приобретать электроны. B Ближайший благородный газ — криптон, поэтому мы прогнозируем, что селен получит два электрона, чтобы сформировать ион Se 2-, который имеет то же количество электронов, что и криптон.
- A Иттрий находится в группе 3, и элементы этой группы представляют собой металлы, которые имеют тенденцию терять электроны. B Ближайшим к иттрию благородным газом является криптон, поэтому прогнозируется, что иттрий потеряет три электрона с образованием Y 3 + , который имеет такое же количество электронов, как и криптон.
Упражнение \ (\ PageIndex {3} \)
Предскажите заряд самого обычного одноатомного иона, образованного каждым элементом.
- Кальций, применяемый для профилактики остеопороза
- йод, необходимый для синтеза гормонов щитовидной железы
- цирконий, широко используемый в ядерных реакторах
Ответ :
- Ca 2 +
- I –
- Zr 4 +
Физические свойства ионных и ковалентных соединений
Как правило, ионные и ковалентные соединения имеют разные физические свойства.Ионные соединения образуют твердые кристаллические вещества, плавящиеся при высоких температурах и устойчивые к испарению. Эти свойства проистекают из характерной внутренней структуры ионного твердого тела, схематически проиллюстрированной в части (а) на рисунке \ (\ PageIndex {8} \), который показывает трехмерный массив чередующихся положительных и отрицательных ионов, удерживаемых вместе сильным электростатическим притяжением. . Напротив, как показано в части (b) на рисунке \ (\ PageIndex {8} \), большинство ковалентных соединений состоят из дискретных молекул, удерживаемых вместе сравнительно слабыми межмолекулярными силами (силами между молекулами), даже если атомы внутри каждой молекулы удерживаются вместе прочными внутримолекулярными ковалентными связями (силами внутри молекулы).Ковалентные вещества могут быть газами, жидкостями или твердыми телами при комнатной температуре и давлении, в зависимости от силы межмолекулярных взаимодействий. Ковалентные молекулярные твердые вещества имеют тенденцию образовывать мягкие кристаллы, которые плавятся при низких температурах и легко испаряются. Однако некоторые ковалентные вещества не являются молекулярными, а состоят из бесконечных трехмерных массивов ковалентно связанных атомов и включают некоторые из самых твердых известных материалов, например алмаз . Эта тема будет затронута в другом месте. Ковалентные связи, которые удерживают атомы вместе в молекулах, не затрагиваются, когда ковалентные вещества плавятся или испаряются, поэтому образуется жидкость или пар независимых молекул.Например, при комнатной температуре метан, основной компонент природного газа, представляет собой газ, состоящий из дискретных молекул CH 4 . Сравнение различных физических свойств ионных соединений и ковалентных молекулярных веществ приведено в Таблице \ (\ PageIndex {3} \).
| Ионные соединения | Ковалентные молекулярные вещества |
|---|---|
| твердые вещества | газы, жидкости или мягкие твердые вещества |
| высокая температура плавления | низкая температура плавления |
| энергонезависимая | летучие |
Рисунок \ (\ PageIndex {8} \): Взаимодействие в ионных и ковалентных твердых телах.(а) Положительно и отрицательно заряженные ионы в твердом ионном веществе, таком как хлорид натрия (NaCl), удерживаются вместе за счет сильных электростатических взаимодействий. (b) В этом представлении упаковки молекул метана (Ch5) в твердом метане, прототипе молекулярного твердого тела, молекулы метана удерживаются вместе в твердом теле только относительно слабыми межмолекулярными силами, даже если атомы внутри каждой молекулы метана удерживаются вместе прочными ковалентными связями.
Когда химики синтезируют новое соединение, они могут еще не знать его молекулярную или структурную формулу.В таких случаях они обычно начинают с определения его эмпирической формулы, относительного количества атомов элементов в соединении, приведенного к наименьшим целым числам. Поскольку эмпирическая формула основана на экспериментальных измерениях количества атомов в образце соединения, она показывает только отношения количества присутствующих элементов. Разницу между эмпирической и молекулярной формулами можно проиллюстрировать на примере бутана, ковалентного соединения, используемого в качестве топлива в одноразовых зажигалках.Молекулярная формула бутана: C 4 H 10 . Отношение атомов углерода к атомам водорода в бутане составляет 4:10, которое может быть уменьшено до 2: 5. Таким образом, эмпирическая формула для бутана: C 2 H 5 . Формульная единица — это абсолютная группа атомов или ионов, представленная эмпирической формулой соединения, ионного или ковалентного. Бутан имеет эмпирическую формулу C 2 H 5 , но он содержит две формульные единицы C 2 H 5 , что дает молекулярную формулу C 4 H 10 .
Поскольку ионные соединения не содержат дискретных молекул, для обозначения их состава используются эмпирические формулы. Все соединения, ионные или ковалентные, должны быть электрически нейтральными. Следовательно, положительный и отрицательный заряды в формульной единице должны точно компенсировать друг друга. Если катион и анион имеют одинаковые заряды, например Na + и Cl —, то соединение должно иметь соотношение катионов к анионам 1: 1, а эмпирическая формула должна быть NaCl.Если заряды различаются по величине, то для получения нейтрального соединения необходимо соотношение катион: анион, отличное от 1: 1. В случае Mg 2 + и Cl — , например, необходимы два иона Cl — для уравновешивания двух положительных зарядов на каждом ионе Mg 2 + , что дает эмпирическую формулу MgCl 2 . Точно так же формула для ионного соединения, содержащего ионы Na + и O 2−, — это Na 2 O.
Примечание
Ионные соединения не содержат дискретных молекул, поэтому для обозначения их состава используются эмпирические формулы.
Бинарные ионные соединения
Ионное соединение, которое содержит только два элемента, один присутствует в виде катиона, а другой в виде аниона, называется бинарным ионным соединением. Одним из примеров является MgCl 2 , коагулянт, используемый при приготовлении тофу из соевых бобов. Для бинарных ионных соединений индексы в эмпирической формуле также могут быть получены путем пересечения зарядов: используйте абсолютное значение заряда на одном ионе в качестве индекса для другого иона.Этот метод схематически показан следующим образом:
Перекрестные сборы . Одним из способов получения индексов в эмпирической формуле является пересечение зарядов .
При пересечении сборов иногда необходимо уменьшить индексы до их простейшего отношения, чтобы написать эмпирическую формулу. Рассмотрим, например, соединение, образованное Mg 2 + и O 2-. Использование абсолютных значений зарядов на ионах в качестве индексов дает формулу Mg 2 O 2 :
Это упрощает правильную эмпирическую формулу MgO.Эмпирическая формула содержит один ион Mg 2 + и один ион O 2-.
Пример \ (\ PageIndex {4} \)
Напишите эмпирическую формулу для простейшего бинарного ионного соединения, образованного из каждого иона или пары элементов.
- Ga 3 + и As 3−
- Eu 3 + и O 2-
- кальций и хлор
Дано : ионы или элементы
Запрошенный : эмпирическая формула бинарного ионного соединения
Стратегия :
A Если не указано, определите ионные заряды на основе расположения элементов в периодической таблице.
B Используйте абсолютное значение заряда каждого иона в качестве индекса для другого иона. Уменьшить индексы до наименьших цифр
, чтобы написать эмпирическую формулу. Убедитесь, что эмпирическая формула электрически нейтральна.
Решение
а. B Использование абсолютных значений зарядов на ионах в качестве индексов дает Ga3As3:
Сокращение индексов до наименьших целых чисел дает эмпирическую формулу GaAs, которая электрически нейтральна [+3 + (−3) = 0].С другой стороны, мы могли бы признать, что Ga 3 + и As 3- имеют заряды одинаковой величины, но противоположных знаков. Один ион Ga 3 + уравновешивает заряд одного иона As 3-, и соединение 1: 1 не будет иметь чистого заряда. Поскольку мы пишем индексы, только если число больше 1, эмпирическая формула — GaAs. GaAs — это арсенид галлия, который широко используется в электронной промышленности в транзисторах и других устройствах.
г. B Поскольку Eu 3 + имеет заряд +3, а O 2- имеет заряд −2, соединение 1: 1 будет иметь чистый заряд +1. Следовательно, мы должны найти кратные списаниям отменяемых платежей. Мы перекрестно заряжаем, используя абсолютное значение заряда одного иона в качестве индекса для другого иона:
Нижний индекс для Eu 3 + равен 2 (от O 2−), а нижний индекс для O 2− равен 3 (от Eu 3 + ), что дает Eu 2 O 3 ; нижние индексы не подлежат дальнейшему уменьшению.Эмпирическая формула содержит положительный заряд 2 (+3) = +6 и отрицательный заряд 3 (-2) = -6 для чистого заряда 0. Соединение Eu 2 O 3 является нейтральным. Оксид европия отвечает за красный цвет экранов телевизоров и компьютеров.
г. A Поскольку заряды на ионах не указаны, мы должны сначала определить ожидаемые заряды для наиболее распространенных ионов, полученных из кальция и хлора. Кальций находится в группе 2, поэтому он должен потерять два электрона, чтобы сформировать Ca 2 + .Хлор находится в группе 17, поэтому он должен получить один электрон, чтобы образовать Cl — .
B Два иона Cl — необходимы для уравновешивания заряда на одном ионе Ca 2 + , что приводит к эмпирической формуле CaCl 2 . Мы также могли бы перекрестно заряжать, используя абсолютное значение заряда для Ca 2 + в качестве индекса для Cl и абсолютное значение заряда для Cl — в качестве индекса для Ca:
Нижние индексы в CaCl 2 не подлежат дальнейшему уменьшению.Эмпирическая формула электрически нейтральна [+2 + 2 (−1) = 0]. Это соединение — хлорид кальция, одно из веществ, используемых в качестве «соли» для таяния льда на дорогах и тротуарах зимой.
Упражнение \ (\ PageIndex {4} \)
Напишите эмпирическую формулу для простейшего бинарного ионного соединения, образованного из каждого иона или пары элементов.
- Li + и N 3−
- Al 3 + и O 2-
- литий и кислород
Ответ :
- Li 3 N
- Al 2 O 3
- Li 2 O
Многоатомные ионы
Многоатомные ионы — это группы атомов, которые несут суммарные электрические заряды, хотя атомы в многоатомном ионе удерживаются вместе теми же ковалентными связями, которые удерживают атомы вместе в молекулах.Подобно тому, как существует гораздо больше видов молекул, чем простых элементов, существует гораздо больше видов многоатомных ионов, чем одноатомных ионов. Двумя примерами многоатомных катионов являются ионы аммония (NH 4 + ) и метиламмония (CH 3 NH 3 + ). Многоатомных анионов гораздо больше, чем многоатомных катионов; некоторые общие примеры находятся в Таблице \ (\ PageIndex {4} \).
| Формула | Имя Иона |
|---|---|
| NH 4 + | аммоний |
| CH 3 NH 3 + | метиламмоний |
| ОН — | гидроксид |
| O 2 2− | перекись |
| CN — | цианид |
| SCN — | тиоцианат |
| НЕТ 2 — | нитрит |
| НЕТ 3 — | нитрат |
| CO 3 2− | карбонат |
| HCO 3 — | гидрокарбонат или бикарбонат |
| СО 3 2− | сульфит |
| СО 4 2− | сульфат |
| HSO 4 — | гидросульфат или бисульфат |
| PO 4 3− | фосфат |
| HPO 4 2− | гидрофосфат |
| H 2 PO 4 — | дигидрофосфат |
| ClO — | гипохлорит |
| ClO 2 — | хлорит |
| ClO 3 — | хлорат |
| ClO 4 — | перхлорат |
| MnO 4 — | перманганат |
| CrO4 2 — | хромат |
| Cr 2 O 7 2− | дихромат |
| C 2 O 4 2− | оксалат |
| HCO 2 — | формиат |
| CH 3 CO 2 — | ацетат |
| C 6 H 5 CO 2 — | бензоат |
Метод, используемый для прогнозирования эмпирических формул для ионных соединений, содержащих одноатомные ионы, также может использоваться для соединений, содержащих многоатомные ионы.Общий заряд катионов должен уравновешивать общий заряд анионов в формульной единице. Таким образом, ионы K + и NO 3 — объединяются в соотношении 1: 1 с образованием KNO 3 (нитрата калия или селитры), основного ингредиента черного пороха. Точно так же Ca 2 + и SO 4 2− образуют CaSO 4 (сульфат кальция), который соединяется с различными количествами воды с образованием гипса и гипса. Многоатомные ионы NH 4 + и NO 3 — образуют NH 4 NO 3 (нитрат аммония), широко используемое удобрение и, в чужих руках, взрывчатое вещество.Одним из примеров соединения, в котором ионы имеют заряды разной величины, является фосфат кальция, который состоит из ионов Ca 2 + и PO 4 3−; это основной компонент костей. Соединение электрически нейтрально, потому что ионы объединяются в соотношении три иона Ca 2 + [3 (+2) = +6] на каждые два иона [2 (−3) = −6], что дает эмпирическое значение формула Ca 3 (PO 4 ) 2 ; круглые скобки вокруг PO 4 в эмпирической формуле указывают на то, что это многоатомный ион.Запись формулы фосфата кальция в виде Ca 3 P 2 O 8 дает правильное число каждого атома в формульной единице, но это скрывает тот факт, что соединение содержит легко идентифицируемый PO 4 3− ионы.
Пример \ (\ PageIndex {5} \)
Напишите эмпирическую формулу соединения, образованного каждой ионной парой.
- Na + и HPO 4 2−
- Катион калия и анион цианида
- Катион кальция и анион гипохлорита
Дано : ion
Запрошенный : эмпирическая формула для ионного соединения
Стратегия :
A Если он не указан, определите заряд одноатомного иона по его положению в периодической таблице.Используйте таблицу \ (\ PageIndex {4} \) «Общие многоатомные ионы и их имена», чтобы найти заряд многоатомного иона.
B Используйте абсолютное значение заряда каждого иона в качестве индекса для другого иона. При написании эмпирической формулы сократите индексы до наименьших целых чисел.
Решение :
а. B Поскольку HPO 4 2− имеет заряд -2, а Na + имеет заряд +1, эмпирическая формула требует, чтобы два иона Na + уравновешивали заряд многоатомного иона, давая Na 2 HPO 4 .Индексы сокращаются до наименьших чисел, поэтому эмпирическая формула: Na 2 HPO 4 . Это соединение представляет собой гидрофосфат натрия, который используется для придания текстуры плавленому сыру, пудингам и быстрым завтракам.
г. A Катион калия имеет вид K + , а анион цианида — CN —. B Поскольку величина заряда на каждом ионе одинакова, эмпирическая формула — KCN. Цианид калия очень токсичен, и одно время его использовали как крысиный яд.Однако это использование было прекращено, потому что слишком много людей были случайно отравлены.
г. A Катион кальция — Ca 2 + , а анион гипохлорита — ClO —. B Два иона ClO — необходимы для уравновешивания заряда на одном ионе Ca 2 + , что дает Ca (ClO) 2 . Нижние индексы не могут быть далее уменьшены, поэтому эмпирическая формула Ca (ClO) 2 . Это гипохлорит кальция, «хлор», используемый для очистки воды в плавательных бассейнах.
Упражнение \ (\ PageIndex {5} \)
Напишите эмпирическую формулу соединения, образованного каждой ионной парой.
- Ca 2 + и H 2 PO 4 —
- Катион натрия и анион бикарбоната
- Катион аммония и сульфат-анион
Ответ :
- Ca (H 2 PO 4 ) 2 : дигидрофосфат кальция является одним из ингредиентов разрыхлителя.
- NaHCO 3 : бикарбонат натрия содержится в антацидах и разрыхлителе; в чистом виде продается как пищевая сода.
- (NH 4 ) 2 SO 4 : сульфат аммония является обычным источником азота в удобрениях.
Резюме
- Существует два принципиально разных типа химических связей (ковалентная и ионная), которые приводят к тому, что вещества имеют очень разные свойства.
- Состав соединения представлен эмпирической или молекулярной формулой, каждая из которых состоит по крайней мере из одной формульной единицы.Авторы
Атомы в химических соединениях удерживаются вместе притягивающими электростатическими взаимодействиями, известными как химические связи. Ионные соединения содержат положительно и отрицательно заряженные ионы в соотношении, которое приводит к нулевому общему заряду. Ионы удерживаются вместе в регулярном пространственном расположении за счет электростатических сил. Большинство ковалентных соединений состоят из молекул, групп атомов, в которых одна или несколько пар электронов разделяются по крайней мере двумя атомами, образуя ковалентную связь.Атомы в молекулах удерживаются вместе за счет электростатического притяжения между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, разделяемыми ядрами. Молекулярная формула ковалентного соединения дает типы и количество присутствующих атомов. Соединения, которые содержат преимущественно углерод и водород, называются органическими соединениями, тогда как соединения, которые состоят в основном из элементов, отличных от углерода и водорода, являются неорганическими соединениями. Двухатомные молекулы содержат два атома, а многоатомные молекулы — более двух.Структурная формула указывает на состав, приблизительную структуру и форму молекулы. Одинарные связи, двойные связи и тройные связи представляют собой ковалентные связи, в которых одна, две и три пары электронов, соответственно, разделяются между двумя связанными атомами. Атомы или группы атомов, обладающие чистым электрическим зарядом, называются ионами; они могут иметь либо положительный заряд (катионы), либо отрицательный заряд (анионы). Ионы могут состоять из одного атома (одноатомные ионы) или нескольких (многоатомные ионы). Заряды на одноатомных ионах большинства элементов основной группы можно предсказать, исходя из местоположения элемента в периодической таблице.Ионные соединения обычно образуют твердые кристаллические вещества с высокими температурами плавления. Ковалентные молекулярные соединения, напротив, состоят из дискретных молекул, удерживаемых вместе слабыми межмолекулярными силами, и могут быть газами, жидкостями или твердыми телами при комнатной температуре и давлении.
Эмпирическая формула дает относительное количество атомов элементов в соединении, приведенное к наименьшим целым числам. Формульная единица представляет собой абсолютную группу, представленную эмпирической формулой соединения, ионного или ковалентного.Эмпирические формулы особенно полезны для описания состава ионных соединений, которые не содержат легко идентифицируемых молекул. Некоторые ионные соединения встречаются в виде гидратов, которые содержат определенное соотношение слабосвязанных молекул воды, называемых водами гидратации.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Примеры соединений
Соединения
Соединение — это вещество, состоящее из двух или более химических элементов, атомы которых связаны вместе.Эти атомы химически связаны определенным образом и в определенных пропорциях, и вещества не могут быть легко разделены простыми физическими средствами.
Существует несколько различных типов соединений, включая бинарные, ионные, молекулярные, кислоты, катионы и анионы. Эти типы соединений имеют разные свойства и разный химический состав, но это категории, которые описывают потенциально миллионы различных химических соединений.
Примеры соединений:
1.Вода — формула: H 2 O = водород 2 + кислород
Два атома элемента водорода соединяются с одним атомом кислорода посредством ковалентной связи с образованием воды. Водород имеет слегка положительный заряд, а кислород — отрицательный, и поэтому он
образует полярную молекулу. Воду можно расщепить обратно на водород и кислород посредством электролиза.
2. Перекись водорода — Формула: H 2 O 2 = Водород 2 + кислород 2
Перекись водорода образуется, когда два атома водорода образуют связь с двумя связанными друг с другом атомами кислорода.Хотя у него всего на один атом кислорода больше, чем в молекуле воды (H 2 O), его свойства сильно отличаются.
3. Соль — формула: NaCl = натрий + хлор
В соли один атом натрия связывается с одним атомом хлора с образованием ионного соединения хлорида натрия. Соль довольно легко получить для коммерческого использования путем простого испарения морской воды,
хотя его можно добывать и с земли. Хлорид натрия можно разделить на разные атомы с помощью электролиза.
4. Пищевая сода — формула: NaHCO 3 = натрий + водород + углерод + кислород 3
Бикарбонат натрия (пищевая сода) может быть получен в результате реакции диоксида углерода с водным раствором гидроксида натрия, в результате чего образуется карбонат натрия; затем он объединяется с молекулами диоксида углерода с образованием бикарбоната натрия. В природе он встречается в горячих источниках и других местах на земле, но его производят в промышленных масштабах.
5.Октан — формула: C 8 H 18 = углерод 8 + водород 18
Октан — это углеводород, действительная формула которого: CH 3 (CH 2 ) 6 CH 3 . Это низкомолекулярное соединение, что означает его высокую летучесть и воспламеняемость, что делает его идеально подходящим для производства бензина.
Примеры соединений
Определение соединений в химии
У слова «составной» есть несколько определений.В области химии «соединение» относится к «химическому соединению».
Определение соединения
Соединение — это химическая разновидность, которая образуется при химическом соединении двух или более атомов с ковалентными или ионными связями.
Соединения можно разделить на категории в зависимости от типа химических связей, удерживающих атомы вместе:
- Молекулы связаны ковалентными связями.
- Ионные соединения удерживаются вместе ионными связями.
- Интерметаллические соединения удерживаются вместе металлическими связями.
- Комплексы часто удерживаются вместе координационными ковалентными связями.
Обратите внимание, что некоторые соединения содержат смесь ионных и ковалентных связей. Также обратите внимание, что некоторые ученые не считают чистые элементарные металлы соединениями (металлическими связями).
Примеры соединений
Примеры соединений включают поваренную соль или хлорид натрия (NaCl, ионное соединение), сахарозу (молекулу), газообразный азот (N 2 , ковалентная молекула), образец меди (интерметаллид) и воду (H 2. O, ковалентная молекула).Примеры рассматриваемых химических соединений , а не включают ион водорода H + и элементы благородных газов (например, аргон, неон, гелий), которые с трудом образуют химические связи.
Написание составных формул
По соглашению, когда атомы образуют соединение, его формула перечисляет сначала атом (ы), действующий как катион, а затем атом (ы), действующий как анион. Это означает, что иногда атом может быть первым или последним в формуле. Например, в диоксиде углерода (CO 2 ) углерод (C) действует как катион.В карбиде кремния (SiC) углерод действует как анион.
Соединение против молекулы
Иногда соединение называют молекулой. Обычно эти два термина являются синонимами. Некоторые ученые различают типы связей в молекулах (ковалентные) и соединения (ионные).
Химикаты повсюду — Science Learning Hub
Все, что вы можете вдохнуть, увидеть, проглотить или потрогать, состоит из химикатов. Вся материя, в том числе и мы, состоит из химикатов. Химия — это изучение состава, структуры, свойств и реакций вещества.
Материя
Материя — это все, что вас окружает — твердое, жидкое или газообразное. Материя состоит из крошечных частиц, называемых атомами. Атомы похожи на отдельные блоки LEGO. Это наименьшая единица, на которую можно разбить что-либо, не делая чего-то экстремального (например, поднести паяльную лампу к блоку LEGO или разбить атомы в ядерном реакторе). Эти атомы, как и блоки LEGO, могут быть связаны друг с другом различными способами, образуя множество структур. Материя имеет массу и объем.
Химические вещества
Вещество (все, что состоит из атомов) также можно назвать химическим веществом. Итак, если атомы представляют собой блоки LEGO, химические вещества — это структуры, которые вы можете строить из них. Они могут быть в любой форме — жидкой, твердой или газовой. Химические вещества могут быть чистым веществом или смесью. Например, вода (H 2 O) — это химическое вещество. Это чистое химическое вещество, потому что оно однородно — чистая вода одинакова по своей структуре. Он состоит из одних и тех же молекул (H 2 O), каждая из которых имеет одинаковую комбинацию и структуру атомов — такое же соотношение водорода и кислорода, связанных одинаковым образом.Другими часто встречающимися химическими веществами в чистом виде являются алмаз (карбонгольд, поваренная соль (хлорид натрия) и рафинированный сахар (сахароза).
Мы можем думать, что химическое вещество является чистым, хотя на самом деле это комбинация химических веществ. Например, вода может содержать небольшое количество растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества
Элементы
Элемент — это химическое вещество, состоящее только из одного типа атомов.Он не может быть разрушен или преобразован в другой элемент (хотя он может быть преобразован в другой элемент посредством ядерной реакции). Элементы представлены в периодической таблице элементов.
По состоянию на ноябрь 2016 года известно 118 элементов. Каждый представлен химическим символом. Большинство элементов — это металлы, например золото (Au), серебро (Ag) и железо (Fe), а другие — неметаллы, например углерод (C), азот (N) и кислород (O).
Химические соединения
Химическое соединение — это чистое вещество, состоящее из двух различных элементов, соединенных химически.Примером химического соединения является вода (H 2 O). Он образуется путем химического соединения элементов водорода (H) и кислорода (O).
Смеси
Часто элементы и соединения встречаются в смесях. Смесь — это комбинация двух или более веществ, в которой каждое вещество сохраняет свою идентичность. Как правило, их можно разделить на составляющие вещества. Почва и воздух — обычные примеры смесей.
Присвоение наименований химическим веществам
Каждое химическое вещество имеет одно или несколько систематических названий, обычно называемых в соответствии с правилами, установленными Международным союзом чистой и прикладной химии (IUPAC).Эта федерация представляет химиков из отдельных стран. Важно, чтобы все страны признавали химическое вещество под одним и тем же названием.
Многие соединения также известны под их более распространенными и простыми названиями, многие из которых предшествуют систематическому названию. Например, глюкоза (сахар) теперь систематически называется 6- (гидроксиметил) оксан-2,3,4,5-тетрол.
Промышленные химические вещества
Промышленные химические вещества — это химические вещества, созданные людьми. Их часто называют синтетическими химическими веществами.Природные химические вещества — это химические вещества, которые встречаются в природе (производятся растениями и животными). Некоторые люди думают, что существует фундаментальная разница между химическими веществами промышленного производства и натуральными.


 Annalen der Chemie und Pharmacie 104 (2): 129–150. DOI:10.1002/jlac.18571040202.
Annalen der Chemie und Pharmacie 104 (2): 129–150. DOI:10.1002/jlac.18571040202. 06.2018).
06.2018).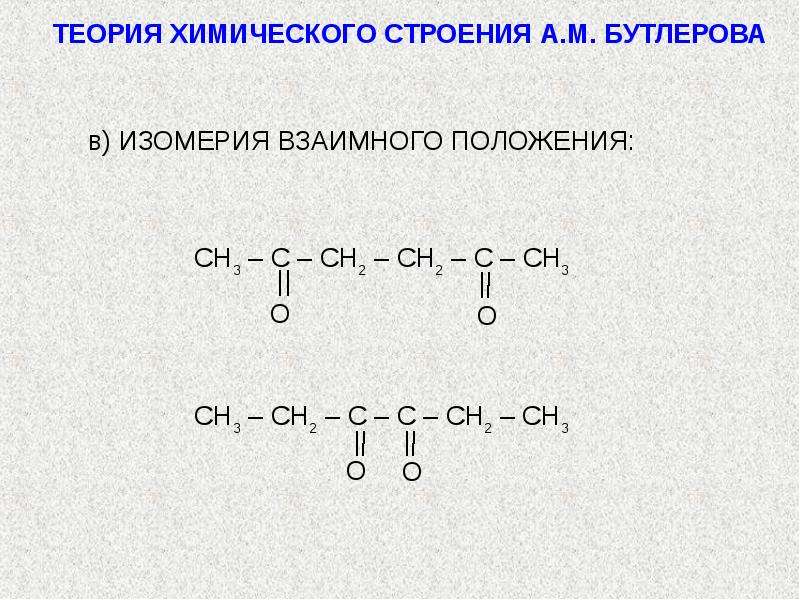
 ; Дэвис, Раймонд Э .; Пек, М. Ларри (2000). Общая химия (6-е изд.). Форт-Уэрт, Техас: Издательство колледжа Сондерс / Издательство колледжа Харкорт.ISBN 978-0-03-072373-5.
; Дэвис, Раймонд Э .; Пек, М. Ларри (2000). Общая химия (6-е изд.). Форт-Уэрт, Техас: Издательство колледжа Сондерс / Издательство колледжа Харкорт.ISBN 978-0-03-072373-5.