Содержание
Задачи на избыток. Средние и кислые соли.
Задачи на избыток реагента. Средние и кислые соли.
Иногда от количеств вещества реагентов может зависеть не только количество продуктов реакции, но и их состав.
Задача 11. К раствору, содержащему 49 г серной кислоты, добавлено 20 г гидроксида натрия. Определите состав и массу полученной соли.
Решение.
n (H2SO4) = 49 г : 98 г/моль = 0,5 моль
n (NaOH) = 20 г : 40 г/моль = 0,5 моль
Так как серная кислота двухосновна, то она может образовать два ряда солей:
2NaOH + H2SO4 → Na2SO4 + 2H2O средняя соль
NaOH + H2SO4 → NaHSO4 + H2O кислая соль
В нашей задаче оказалось равное мольное количество кислоты и щелочи, поэтому расчет следует вести по второму уравнению реакции:
0,5 моль 0,5 моль 0,5 моль
NaOH + H2SO4 → NaHSO4 + H2O
m (NaHSO4) = M • n = 120 г/моль • 0,5 моль = 60 г.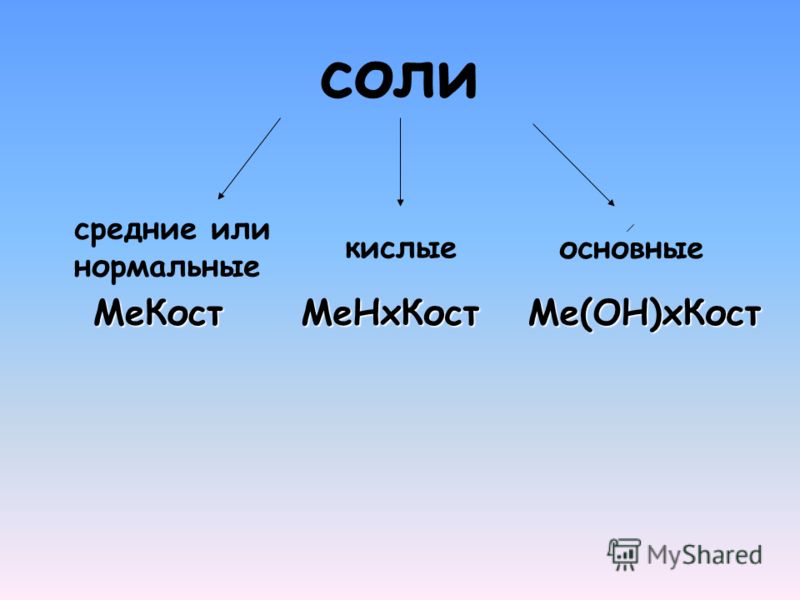
Задача 12. Через раствор, содержащий 60 г гидроксида натрия, пропущен углекислый газ, полученный при действии избытка соляной кислоты на 200 г карбоната кальция. Определите состав и массу полученной соли.
Решение.
Определяем количества вещества веществ, указанных в условии задачи:
n (NaOH) = m : M = 60 г : 40 г/моль = 1,5 моль
n (CaCO3) = m : M = 200 г : 100 г/моль = 2 моль
Записываем уравнение реакции, в которой был получен углекислый газ, и по количеству вещества СаСО3 определяем, сколько моль газа выделилось:
2 моль 2 моль
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Таким образом, для второй реакции у нас имеется 2 моль углекислого газа и 1,5 моль гидроксида натрия. Так как СО2 – ангидрид двухосновной угольной кислоты Н2СО3, то при его взаимодействии с щелочами могут образоваться как средние, так и кислые соли:
Так как СО2 – ангидрид двухосновной угольной кислоты Н2СО3, то при его взаимодействии с щелочами могут образоваться как средние, так и кислые соли:
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
Теперь нужно определиться, по какому из двух уравнений реакций нам следует вести расчет. Для образования средней соли щелочи должно быть вдвое больше, чем газа. У нас же, наоборот, газа больше, чем щелочи. Следовательно, реакция пойдет по первому уравнению, с образованием кислой соли, причем СО2 окажется в избытке (0,5 моль):
1,5 моль 1,5 моль 1,5 моль
NaOH + CO2 → NaHCO3
m (NaHCO3) = M • n = 84 г/моль • 1,5 моль = 126 г.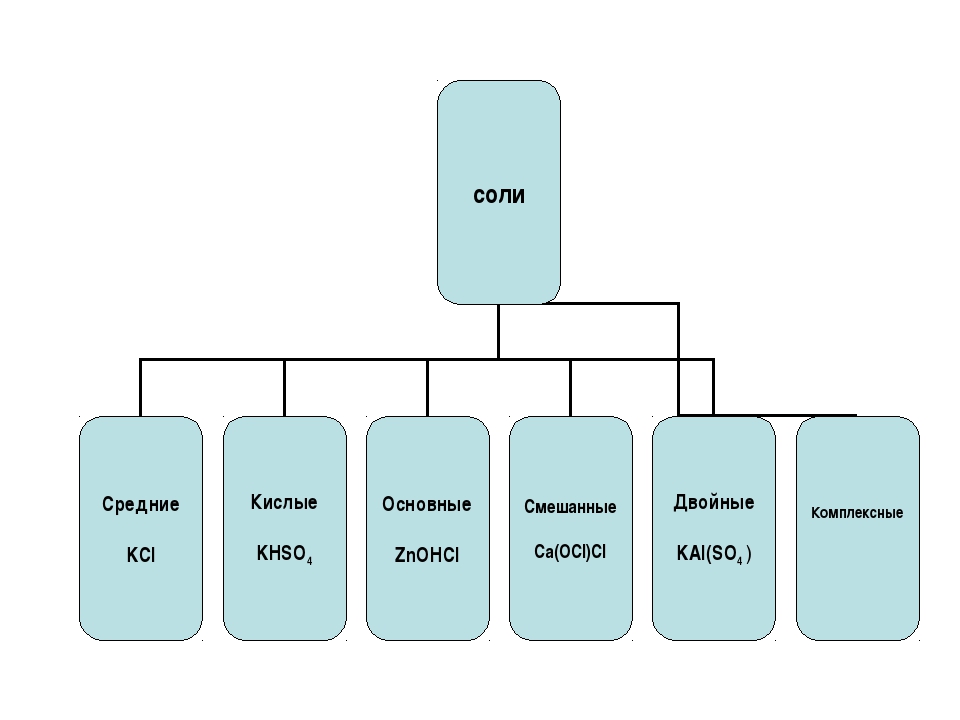
Решим самостоятельно: тренировочные задачи на избыток реагента.
- 14 г оксида кальция обработали раствором, содержащим 36 г азотной кислоты. Какова масса полученной соли? (41 г)
- К раствору, содержащему 40 г сульфата меди (II), добавили 12 г железных опилок. Останется ли в растворе сульфат меди после реакции?
- Хватит ли 15 л кислорода для сжигания 4 г серы?
- В раствор, содержащий 16 г сульфата меди (II), пропустили сероводород объемом 5,6 л. Какова масса выпавшего осадка? (9,6 г).
- К раствору, содержащему 10,4 г хлорида бария, добавили 9,8 г серной кислоты. Определите массу осадка и состав полученного раствора (11,65 г)
- Аммиак массой 3,4 г соединен с хлороводородом массой 8 г. Какова масса продукта реакции?
Еще больше задач самых разных типов — в книге «Учимся решать задачи по химии», ее можно заказать у автора.
Была ли вам полезна эта статья? Поделитесь, пожалуйста:
Еще на эту тему:
Копилка знаний…: Кислые соли
Кислые соли получаются при неполном замещении в
кислоте атомов водорода металлом. Они, как правило, образуются многоосновными
кислотами, например:
Н2SO4
+ NaOH
=
NaHSO4 + Н2O
Са3(PО4)2 + Н3PО4 = Са(Н2PО4)2
Кислые соли — это электролиты, которые в
водных растворах диссоциируют на положительно
заряженные ионы металлов и водорода и отрицательно
заряженные ионы кислотных остатков.
Названия кислых солей, содержащих не полностью замещенный в
кислоте водород, образуются по правилу названия простых солей, но с добавлением
слова «гидро», чтобы обозначить его в соли. В случае необходимости перед «гидро
указывается числовой префикс. За «гидро» без пробела следует название аниона в
За «гидро» без пробела следует название аниона в
именительном падеже, затем — название катиона в родительном падеже:
КHSO4
– гидросульфат калия
КН2PО4 – дигидрофосфат калия
Кислые соли при растворении в воде диссоциируют на ионы
металлов, водорода и кислотных остатков:
→NaHSO4
↔Na+
+ H+
+ SO42-
поэтому они способны к реакциям, в которые вступают средние
соли и кислоты, то есть вступают в реакции с металлами, оксидами, основаниями,
кислотами и солями. Покажем это на примерах:
NaHSO4
+ Fe = Na2SO4 + FeSO4 + Н2↑
2H++ Fe
= Fe2+ + Н2↑
2КHSO4
+ СuО
= К2SO4
+ СuSO4
+ Н2O
СuО
+ 2H+
= Сu2+
+ Н2O
2NaHSO4
+ 2КOH = Na2SO4 + К2SO4 + 2Н2O
H++ OH—
= Н2O
NaHCO3
+ HCI = NaCI +CO2↑ +Н2O
HCO3—
+ H+ = H2CO3— + CO2+Н2O
Следует заметить, что возможность реакций
взаимодействия кислых солей, слабых кислот с металлами и оксидами ограничена
так как слабая диссоциация ионов (НСО— и др) а также малая
растворимость их средних солей препятствуют протеканию реакций.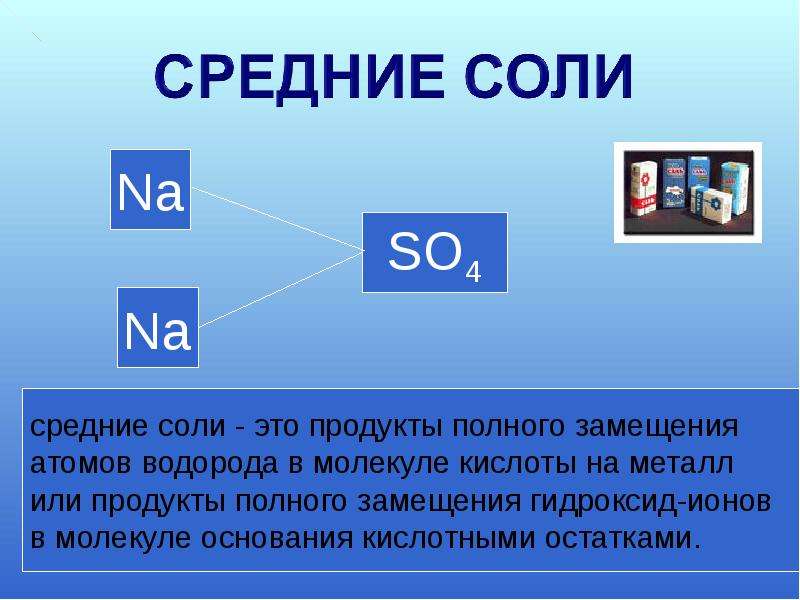
Автор: задачник А.И. Хохлова
Skype – l.hakimova
Ух .ты! Как интересненько!
Щас все кнопочки понажимаю!
Средняя кислая соль — Большая Энциклопедия Нефти и Газа, статья, страница 2
Средняя кислая соль
Cтраница 2
Сероводородной кислоте соответствуют средние и кислые соли, называемые соответственно сульфидами и гидросульфидами. Все гидросульфиды растворимы в воде и известны лишь в растворах.
[16]
Адипиновая кислота образует средние и кислые соли и сложные эфиры.
[17]
Для многоосновных кислот известны средние и кислые соли щелочных металлов.
[18]
По международной номенклатуре название средних и кислых солей производят от названия кислот и металлов, их образовавших. Так: CuSO4 — сульфат меди, К2 О3 — сульфит калия, NaHSO3 — гидросульфит натрия, Na3PO4 — фосфат натрия, NaHPO4 — гидрофосфат натрия, Nah3PO4 — дигидрофосфат натрия.
[19]
Образует два ряда солей: средние и кислые соли.
[20]
Угольная кислота двухосновная и образует средние и кислые соли. Средние соли называются карбонатами или углекислыми солями. Кислые соли называются гидрокарбонатами или кислыми углекислыми солями. Ниже приведена сравнительная характеристика средних и кислых солей.
[21]
Угольная кислота двухосновная и образует средние и кислые соли. Средние соли называются карбонатами, или углекислыми солями.
[22]
Но как двухосновная кислота она образует средние и кислые соли; первые называют карбонатами, а вторые — гидрокарбонатами: Na2CO3 и СаСО3 — карбонаты натрия и кальция; NaHCO3 и Са ( НСО3) 2 — гидрокарбонаты натрия и кальция. Почти все гидрокарбонаты хорошо растворимы в воде; из средних солей растворимы карбонаты щелочных металлов и аммония.
[23]
Составьте уравнения, соотиетсгвующие процессу диссоциации средних и кислых солей.
[24]
Поскольку фосфорная кислота трехосновна, то образует средние и кислые соли, например: Na3P04 — фосфат натрия; Na2HPO4 — гидрофосфат натрия и Nah3PO4 — дкгидрофосфат натрия. Различно замещенные фосфаты отличаются друг от друга растворимостью в воде: все однозамещенные растворимы в воде, вторичные — мало растворимы, а третичные фосфаты большей частью нерастворимы в воде. Соли фосфорной кислоты находят широкое применение а сельском хозяйстве как удобрения, например, суперфосфат.
[25]
Поскольку фосфорная кислота трехосновна, то образует средние и кислые соли, например: Na3PO4 — фосфат натрия; Na2HPO4 — гидрофосфат натрия и Nah3PO4 — дигидрофосфат натрия.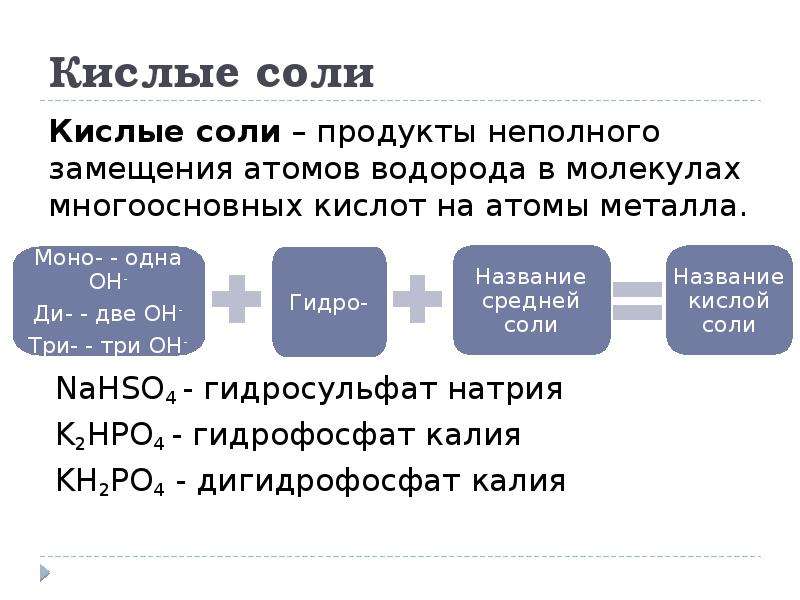 Различно замещенные фосфаты отличаются друг от друга растворимостью в воде: все однозамещенные растворимы в воде, вторичные — мало растворимы, а третичные фосфаты большей частью нерастворимы в воде. Соли фосфорной кислоты находят широкое применение в сельском хозяйстве как удобрения, например, суперфосфат.
Различно замещенные фосфаты отличаются друг от друга растворимостью в воде: все однозамещенные растворимы в воде, вторичные — мало растворимы, а третичные фосфаты большей частью нерастворимы в воде. Соли фосфорной кислоты находят широкое применение в сельском хозяйстве как удобрения, например, суперфосфат.
[26]
Поскольку фосфорная кислота трехосновна, то образует средние и кислые соли, например: Na3PO4 — фосфат натрия; NaaHPC — гидрофосфат натрия и Nah3PO4 — дигидрофосфат натрия. Различно замещенные фосфаты отличаются друг от друга растворимостью в воде: все однозамещенные растворимы в воде, вторичные — мало растворимы, а третичные фосфаты большей частью нерастворимы в воде. Соли фосфорной кислоты находят широкое применение в сельском хозяйстве как удобрения, например, суперфосфат.
[27]
Поскольку фосфорная кислота трехосновна, то образует средние и кислые соли ( фосфаты и гидрофосфаты), например: Na3PO4 — фосфат натрия; Na2HPO4 — гидрофосфат натрия и Nah3PO4 — дигидрофосфат натрия.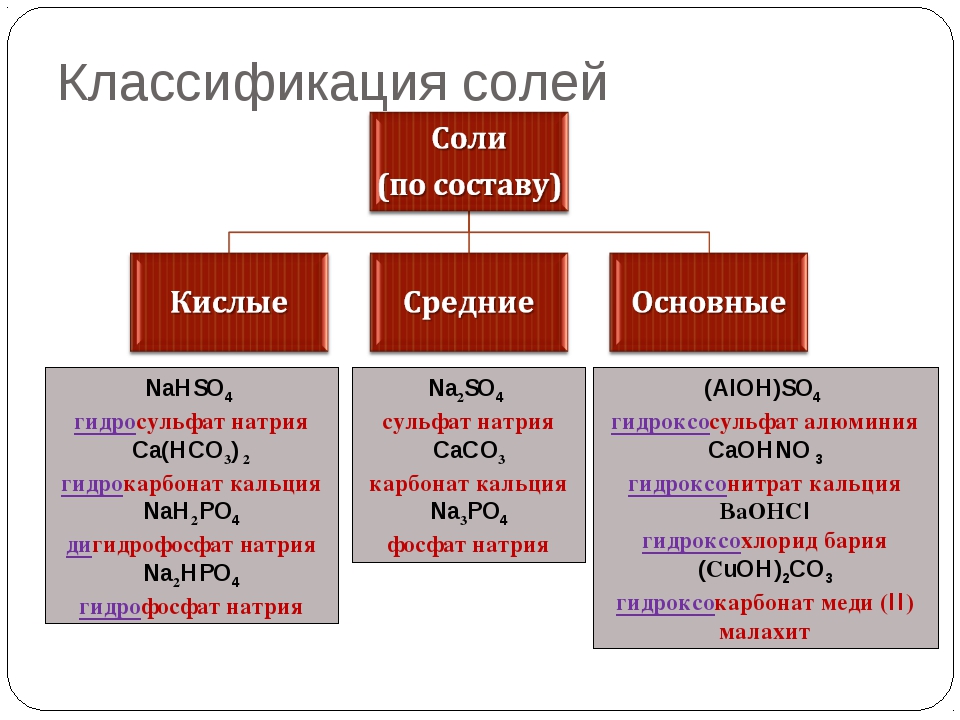 Различно замещенные фосфаты отличаются друг от друга растворимостью в воде: однозамещенные растворимы в воде, двузамещенные — мало растворимы, а трехзамещенные большей частью нерастворимы в воде.
Различно замещенные фосфаты отличаются друг от друга растворимостью в воде: однозамещенные растворимы в воде, двузамещенные — мало растворимы, а трехзамещенные большей частью нерастворимы в воде.
[28]
Волластона, объяснившего с помощью своих эквивалентов состав средних и кислых солей. Волластон не пожелал принять даже самого названия атом, возрожденного Дальтоном.
[29]
Фреми исследовал между розоко-бальтиаковыми солями многие, названные им средними и кислыми солями серной кислоты.
[30]
Страницы:
1
2
3
Средние соли
Средними солями
называются соли, которые являются
продуктом полного замещения атомов
водорода соответствующей кислоты на
атомы металла или ион NH4+.
Например:
H2CO3
(NH4)2CO3;
H3PO4
Na3PO4
Название средней соли
образуется из названия аниона, за которым
следует название катиона. Для солей
бескислородных кислот наименование
соли составляется из латинского названия
неметалла с добавлением суффикса –ид,
например, NaCl – хлорид натрия. Если
неметалл проявляет переменную степень
окисления, то после его названия в
скобках римскими цифрами указывается
степень окисления металла: FeS – сульфид
железа (II), Fe2S3
– сульфид железа (III).
Для солей кислородсодержащих
кислот к латинскому корню названия
элемента добавляется окончание –ат
для высших степеней окисления, -ит
для более низких.
Например,
K2SiO3
– силикат калия, KNO2
– нитрит калия,
KNO3
– нитрат калия, K3PO4
– фосфат калия,
Fe2(SO4)3
– сульфат железа (III),
Na2SO3
– сульфит натрия.
Для солей некоторых
кислот используется приставка –гипо
для более низких степеней окисления и
–пер
для высоких степеней окисления. Например,
KClO
– гипохлорит калия, KClO2
– хлорит калия,
KClO3
– хлорат калия, KClO4
– перхлорат калия.
Способы получения
средних солей:
— взаимодействием
металлов с неметаллами, кислотами и
солями:
2Na
+ Cl2
= 2NaCl
Zn + 2HCl = ZnCl2
+ H2
Fe
+ CuSO4
= FeSO4
+ Cu
— взаимодействием
оксидов:
основных с кислотами
BaO + 2HNO3
= Ba(NO3)2
+ H2O
кислотных со щелочами
2NaOH + SiO2
= Na2SiO3
+ H2O
основных оксидов с
кислотными Na2O
+ CO2
= Na2CO3
— взаимодействием
кислот с основаниями и с амфотерными
гидроксидами:
KOH
+ HCl = KCl + H2O
Cr(OH)3
+ 3HNO3
= Cr(NO3)3
+ 3H2O
—
взаимодействием солей с кислотами, со
щелочами и солями:
Na2CO3
+ 2HCl = 2NaCl + CO2
+ H2O
FeCl3
+ 3KOH = 3KCl + Fe(OH)3
Na2SO4
+ BaCl2
= BaSO4
+ 2NaCl
Химические свойства
средних солей:
— взаимодействие с
металлами
Zn
+ Hg(NO3)2
= Zn(NO3)2
+ Hg
— взаимодействие с
кислотами
AgNO3
+ HCl
= AgCl
+ HNO3
— взаимодействие со
щелочами
CuSO4
+ 2NaOH
= Cu(OH)2
+ Na2SO4
— взаимодействие с
солями
CaCl2
+ Na2CO3
= CaCO3
+ 2NaCl
— разложение солей
NH4Cl
= NH3
+ HCl
CaCO3
= CaO
+ CO2
(NH4)2Cr2O7
= N2
+ Cr2O3
+ 4H2O
Кислые соли
Кислые соли – это
продукты неполного замещения атомов
водорода в молекулах многоосновных
кислот на атомы металла.
Например: H2CO3
NaHCO3
H3PO4
NaH2PO4
Na2HPO4
При наименовании кислой
соли к названию соответствующей средней
соли добавляется приставка гидро-,
которая указывает на наличие атомов
водорода в кислотном остатке.
Например, NaHS –
гидросульфид натрия, Na2HPO4
– гидрофосфат натрия, NaH2PO4
– дигидрофосфат натрия.
Кислые соли могут быть
получены:
— действием избытка
многоосновных кислот на основные оксиды,
щелочи и средние соли:
K2O
+ 2H2S
= 2KHS + H2O
NaOH + H2SO4
= NaHSO4
+ H2O
K2SO4
+ H2SO4
= 2KHSO4
— действием избытка
кислотных оксидов на щелочи
NaOH
+ CO2
= NaHCO3
Химические свойства
кислых солей:
— взаимодействие с
избытком щелочи
Ca(HCO3)2
+ Ca(OH)2
= 2CaCO3
+ 2H2O
— взаимодействие с
кислотами
Ca(HCO3)2
+ 2HCl
= CaCl2
+ 2H2O
+ 2CO2
— разложение
Ca(HCO3)2
= CaCO3
+ CO2
+ H2O
средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
Видеоурок 1: Классификация неорганических солей и их номенклатура
Видеоурок 2: Способы получения неорганических солей. Химические свойства солей
Химические свойства солей
Лекция: Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
Характеристика солей
Соли – это такие химические соединения, состоящие из катионов металлов (или аммония) и кислотных остатков.
Соли так же следует рассматривать в виде продукта взаимодействия кислоты и основания. В итоге данного взаимодействия, могут образовываться:
нормальные (средние),
кислые,
основные соли.
Нормальные соли образуются при достаточном для полного взаимодействия количестве кислоты и основания. К примеру:
Названия нормальных солей состоят из двух частей. В начале называется анион (кислотный остаток), затем катион. Например: хлорид натрия — NaCl, сульфат железа(III) — Fe2(SО4)3, карбонат калия — K2CO3, фосфат калия — K3PO4 и др.
Кислые соли образуются при избытке кислоты и недостаточном количестве щелочи, потому как при этом катионов металла становится недостаточно для замещения всех катионов водорода, имеющихся в молекуле кислоты. К примеру:
В составе кислотных остатков данного вида солей вы всегда увидите водород. Кислые соли всегда возможны для многоосновных кислот, а для одноосновных нет.
В названиях кислых солей ставится приставка гидро- к аниону. Например: гидросульфат железа(III)- Fe(HSO4)3, гидрокарбонат калия — KHCO3, гидрофосфат калия — K2HPO4 и др.
Основные соли образуются при избытке основания и недостаточном количестве кислоты, потому как в данном случае анионов кислотных остатков недостаточно для полного замещения гидроксогрупп, имеющихся в основании. К примеру:
Таким образом основные соли в составе катионов содержат гидроксогруппы. Основные соли возможны для многокислотных оснований, а для однокислотных нет. Некоторые основные соли способны самостоятельно разлагаться, при этом выделяя воду, образуя оксосоли, обладающие свойствами основных солей. К примеру:
Некоторые основные соли способны самостоятельно разлагаться, при этом выделяя воду, образуя оксосоли, обладающие свойствами основных солей. К примеру:
Название основных солей строится следующим образом: к аниону добавляется приставка гидроксо-. Например: гидроксосульфат железа(III) — FeOHSO4, гидроксосульфат алюминия — AlOHSO4, дигидроксохлорид железа (III) — Fe(OH)2Cl и др.
Многие соли, находясь в твердом агрегатном состоянии, являются кристаллогидратами: CuSO4.5h3O; Na2CO3.10h3O и т.д.
Химические свойства солей
Соли – это достаточно твердые кристаллические вещества, имеющие ионную связь между катионами и анионами. Свойства солей обусловлены их взаимодействием с металлами, кислотами, основаниями и солями.
Типичные реакции нормальных солей
С металлами реагируют хорошо. При этом, более активные металлы вытесняют менее активные из растворов их солей. К примеру:
С кислотами, щелочами и другими солями реакции проходят до конца, при условии образования осадка, газа или малодиссоциируемых соединений.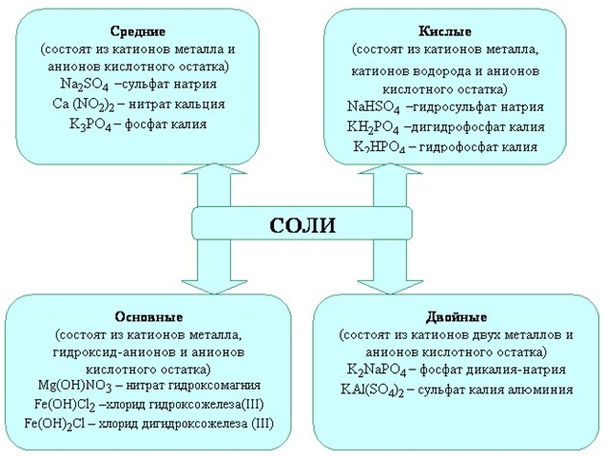 Например, в реакциях солей с кислотами образуются такие вещества, как сероводород H2S – газ; сульфат бария BaSO4 – осадок; уксусная кислота CH3COOH – слабый электролит, малодиссоциируемое соединение. Вот уравнения данных реакций:
Например, в реакциях солей с кислотами образуются такие вещества, как сероводород H2S – газ; сульфат бария BaSO4 – осадок; уксусная кислота CH3COOH – слабый электролит, малодиссоциируемое соединение. Вот уравнения данных реакций:
K2S + H2SO4 → K2SO4 + H2S;
BaCl2 + H2SO4 → BaSO4 + 2HCl;
CH3COONa + HCl → NaCl + CH3COOH.
В реакциях солей со щелочами образуются такие вещества, как гидроксид никеля (II) Ni(OH)2 – осадок; аммиак NH3 – газ; вода H2О – слабый электролит, малодиссоциируемое соединение:
Соли реагируют между собой, если образуется осадок:
Или в случае образования более устойчивого соединения:
В этой реакции из кирпично-красного хромата серебра образуется черный сульфид серебра, ввиду того, что он является более нерастворимым осадком, чем хромат.
Многие нормальные соли разлагаются при нагревании с образованием двух оксидов – кислотного и основного:
Нитраты разлагаются другим, отличным от остальных нормальных солей образом. При нагревании нитраты щелочных и щелочноземельных металлов выделяют кислород и превращаются в нитриты:
Нитраты почти всех других металлов разлагаются до оксидов:
Нитраты некоторых тяжелых металлов (серебра, ртути и др) разлагаются при нагревании до металлов:
Особое положение занимает нитрат аммония, который до температуры плавления (170оС) частично разлагается по уравнению:
При температурах 170 — 230 оС, по уравнению:
При температурах выше 230 оС — со взрывом, по уравнению:
Хлорид аммония NH4Cl разлагается с образованием аммиака и хлороводорода:
Типичные реакции кислых солей
Они вступают во все те реакции, в которые вступают кислоты. Со щелочами реагируют следующим образом, если в составе кислой соли и щелочи имеется один и тот же металл, то в результате образуется нормальная соль. К примеру:
К примеру:
Если же щелочь содержит другой металл, то образуются двойные соли. Пример образования карбоната лития — натрия:
Типичные реакции основных солей
Данные соли вступают в те же реакции, что и основания. С кислотами реагируют следующим образом, если в составе основной соли и кислоты имеется один и тот же кислотный остаток, то в результате образуется нормальная соль. К примеру:
Если же кислота содержит другой кислотный остаток, то образуются двойные соли. Пример образования хлорида меди — брома:
Комплексные соли
Комплексное соединение — соединение, в узлах кристаллической решетки которого содержатся комплексные ионы.
Рассмотрим комплексные соединения алюминия — тетрагидроксоалюминаты и цинка — тетрагидроксоцинкаты. В квадратных скобках формул данных веществ указываются комплексные ионы.
Химические свойства тетрагидроксоалюмината натрия Na[Al(OH)4] и тетрагидроксоцинката натрия Na2[Zn(OH)4]:
1. Как и все комплексные соединения выше названные вещества диссоциируются:
Как и все комплексные соединения выше названные вещества диссоциируются:
- Na[Al(OH)4] → Na+ + [Al(OH)4]—;
- Na2[Zn(OH)4] → 2Na+ + [Zn(OH)4]—.
Имейте ввиду, что дальнейшая диссоциация комплексных ионов невозможна.
2. В реакциях с избытком сильных кислот образуют две соли. Рассмотрим реакцию тетрагидроксоалюмината натрия с разбавленным раствором хлороводорода:
- Na[Al(OH)4] + 4HCl → AlCl3 + NaCl + H2O.
Мы видим образование двух солей: хлорида алюминия, хлорида натрия и воды. Подобная реакция произойдет и в случае с тетрагидроксоцинкатом натрия.
3. Если же сильной кислоты будет недостаточно, допустим вместо 4HCl мы взяли 2HCl, то соль образует наиболее активный металл, в данном случае натрий активнее, значит образуется хлорид натрия, а образовавшиеся гидроксиды алюминия и цинка выпадут в осадок. Этот случай рассмотрим на уравнении реакции с тетрагидроксоцинкатом натрия:
Этот случай рассмотрим на уравнении реакции с тетрагидроксоцинкатом натрия:
1.7. Соли — ЗФТШ, МФТИ
сложные вещества, состоящие из атомов металлов (катионов) и анионов кислотного остатка. Соли по составу похожи на кислоты, только вместо ионов водорода содержат ионы металлов. Поэтому соли можно назвать продуктами замещения атомов водорода в кислоте на атом металла.
Соли принято делить на три группы: средние, кислые и основные.
продукты полного замещения атомов водорода в кислоте замещены металлом
(`»Na»_2″SO»_4`, `»KNO»_3`, `»BaSO»_4` и др.)
$$ 3\mathrm{NaOH} + {\mathrm{H}}_{3}{\mathrm{PO}}_{4} \to {\mathrm{Na}}_{3}{\mathrm{PO}}_{4} + 3{\mathrm{H}}_{2}\mathrm{O}$$;
$$ \mathrm{Al}(\mathrm{OH}{)}_{3} + 3\mathrm{HCl} \to {\mathrm{AlCl}}_{3} + 3{\mathrm{H}}_{2}\mathrm{O}$$.
Кислые и основные соли
Кислые соли представляют собой продукт неполного замещения кислот и оснований.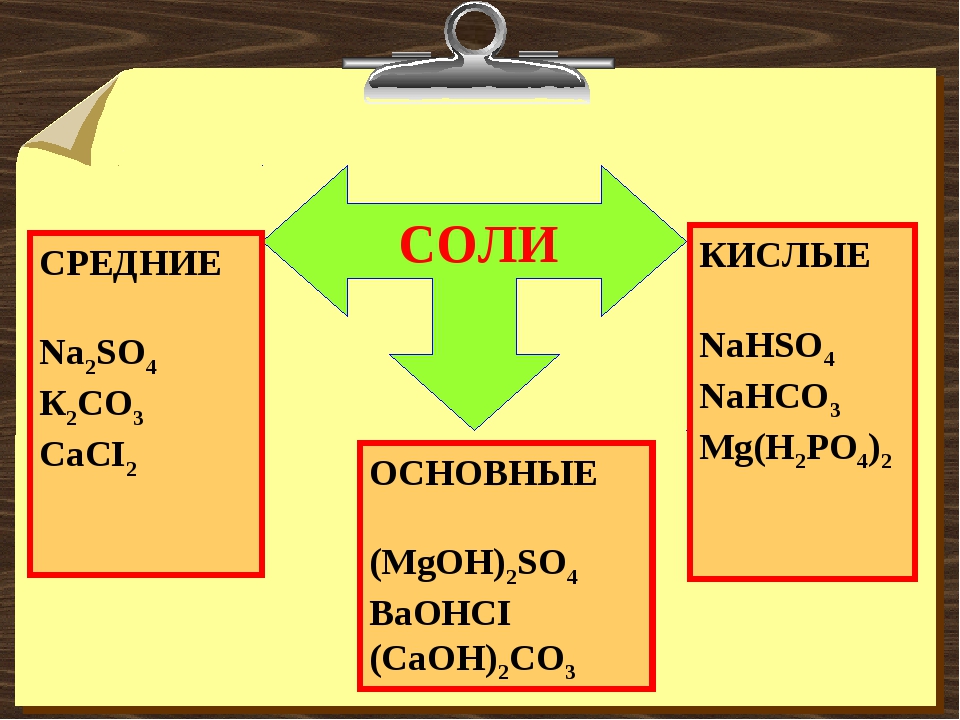 -` – приставкой гидрокси, например: `»NaHS»` – гидросульфид натрия, `»NaHSO»_4` – гидросульфат натрия, `»Mg(OH)Cl»` – гидроксихлорид магния, `»Al(OH)»_2″Cl»` – дигидроксихлорид алюминия.
-` – приставкой гидрокси, например: `»NaHS»` – гидросульфид натрия, `»NaHSO»_4` – гидросульфат натрия, `»Mg(OH)Cl»` – гидроксихлорид магния, `»Al(OH)»_2″Cl»` – дигидроксихлорид алюминия.
представляют собой продукты неполного замещения атомов водорода в кислоте на атом металла, например:
`2″NaOH» + «H»_3″PO»_4 -> «Na»_2″HPO»_4 + 2″H»_2″O»`;
гидрофосфат натрия
`»NaOH» + «H»_3″PO»_4 -> «NaH»_2″PO»_4 + «H»_2″O»`.
дигидрофосфат натрия
представляют собой продукты неполного замещения гидроксильных групп оснований кислотными остатками:
`»Al(OH)»_3 + «HCl» -> «Al(OH)»_2″Cl» + «H»_2″O»`;
дигидроксихлорид алюминия
`»Al(OH)»_3 + 2″HCl» -> «Al(OH)Cl»_2 + 2″H»_2″O»`;
гидроксихлорид алюминия
Существуют также некоторые другие типы солей, например, двойные соли, в которых содержатся два разных катиона и один анион:
`»CaCO»_3*»MgCO»_3` (доломит), `»KCl»*»NaCl»` (сильвинит), `»KAl(SO»_4)_2` — алюмокалиевые квасцы, или смешанные соли, в которых содержится один катион и два разных аниона: `»CaOCl»_2` или `»Ca(OCl)Cl»`.
Соли представляют собой ионные соединения, и их названия строятся по названиям катионов и анионов. Для солей бескислородных кислот к названию неметалла добавляется суффикс —ид, например, хлорид натрия `»NaCl»`.
При наименовании солей кислородсодержащих кислот к латинскому корню названия элемента добавляется окончание —ат для высшей степеней окисления, —ит для более низких (для некоторых кислот используется приставка гипо— для низких степеней окисления неметалла; для солей хлорной и марганцовой кислот используется приставка пер-):
|
`»CaCO»_3` — карбонат натрия
|
`»КClO»` — гипохлорит калия
|
|
`»FeSO»_3` — сульфит железа (II)
|
`»KClO»_2` — хлорит калия
|
|
`»KMnO»_4` — перманганат калия
|
`»KClO»_3` — хлорат калия
|
|
`»KNO»_2` — нитрит калия
|
`»KClO»_4` — перхлорат калия
|
Способы получения средних солей
Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса.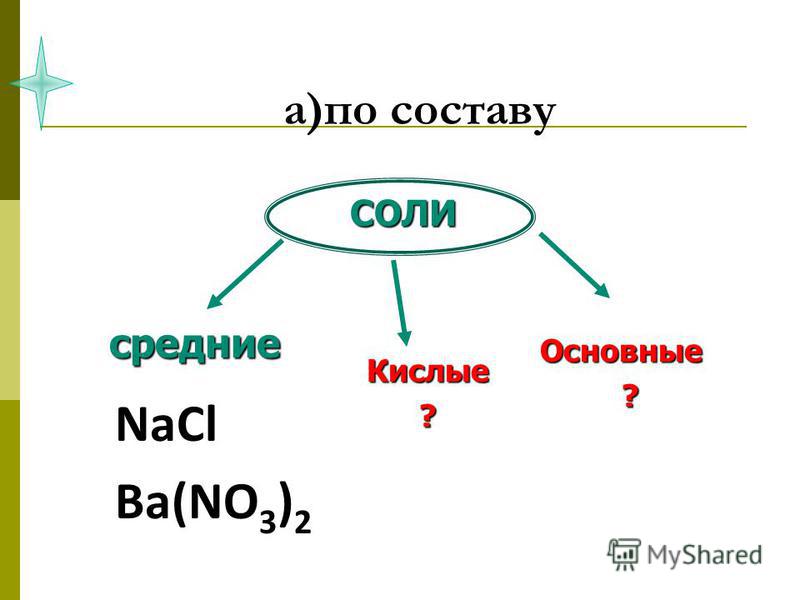 Большинство способов получения солей было разобрано выше.
Большинство способов получения солей было разобрано выше.
Способы получения кислых и основных солей
Кислые соли могут быть получены либо неполной нейтрализацией кислот, либо действием избытка кислот на средние соли, щелочи, оксиды или соли:
`»NaOH» + «H»_2″SO»_4 -> «NaHSO»_4 + «H»_2″O»`;
`»Na»_2″SO»_4 + «H»_2″SO»_4 -> 2″NaHSO»_4`;
`»NaCl» + «H»_2″SO»_4 -> «NaHSO»_4 + «HCl»`;
`»CaCO»_3 + «CO»_2 + «H»_2″O» -> «Ca(HCO»_3)_2`.
Основные соли часто получаются при осторожном добавлении небольших количеств щелочей к растворам средних солей металлов, имеющих малорастворимые основания, или при действии солей слабых кислот на средние соли:
`»AlCl»_3 + 2″NaOH» -> «Al(OH)»_2″Cl» + 2″NaCl»`;
В общем виде способы получения кислых или основных солей из средних солей представим в виде следующей схемы:
Химические свойства солей
Многие соли устойчивы при нагревании.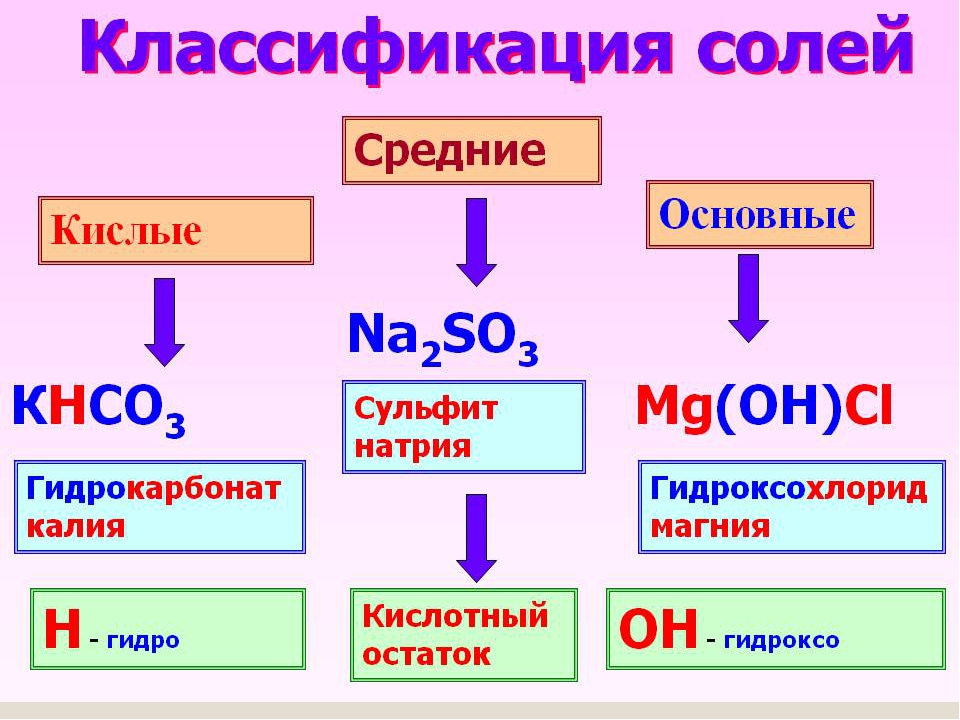 Однако соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются (также см. получение оксидов).
Однако соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются (также см. получение оксидов).
$$ {\mathrm{NH}}_{4}\mathrm{Cl} \stackrel{\mathrm{t}°\mathrm{C}}{\to } {\mathrm{NH}}_{3}\uparrow + \mathrm{HCl}$$;
$$ 2{\mathrm{FeSO}}_{4} \stackrel{\mathrm{t}°\mathrm{C}}{\to } {\mathrm{Fe}}_{2}{\mathrm{O}}_{3} + {\mathrm{SO}}_{2}\uparrow + {\mathrm{SO}}_{3}\uparrow $$;
$$ 4{\mathrm{FeSO}}_{4} \stackrel{\mathrm{t}°\mathrm{C}}{\to } 2{\mathrm{Fe}}_{2}{\mathrm{O}}_{3} + 4{\mathrm{SO}}_{2}\uparrow + {\mathrm{O}}_{2}\uparrow $$;
$$ ({\mathrm{NH}}_{4}{)}_{2}{\mathrm{Cr}}_{2}{\mathrm{O}}_{7} \stackrel{\mathrm{t}°\mathrm{C}}{\to } {\mathrm{Cr}}_{2}{\mathrm{O}}_{3} + {\mathrm{N}}_{2}\uparrow + 4{\mathrm{H}}_{2}\mathrm{O}$$;
$$ 2{\mathrm{KClO}}_{3} \stackrel{150-300°\mathrm{C}, {\mathrm{MnO}}_{2}}{\to } 2\mathrm{KCl} + 3{\mathrm{O}}_{2}\uparrow $$;
$$ 4{\mathrm{KClO}}_{3} \stackrel{400°\mathrm{C}}{\to } 3{\mathrm{KClO}}_{4} + \mathrm{KCl}$$.
Взаимодействие растворов или расплавов солей менее активных металлов с более активными металлами:
`»Cu» + 2″AgNO»_3 -> 2″Ag»darr + «Cu(NO»_3)_2`.
Взаимодействие соли с кислотой, в результате которого образуется нерастворимое или летучее вещество:
`»AgNO»_3 + «HBr» → «AgBr»↓ + «HNO»_3`;
`»FeS» + 2″HCl» → «H»_2″S»↑ + «FeCl»_2`.
Взаимодействие раствора соли со щелочью, в результате которого образуется нерастворимое вещество:
`»CuCl»_2 + «KOH» → «Cu(OH)»_2 ↓+ 2″KCl»`;
`»Na»_2″CO»_3 + «Ca(OH)»_2 → «CaCO»_3↓ + 2″NaOH»`.
Взаимодействие растворов солей друг с другом, в результате которого образуется нерастворимое вещество:
`»Na»_2″CO»_3 + «Ba(NO»_3)_2 → «BaCO»_3 ↓+ 2″NaNO»_3`.
Участие в ОВР:
`2″FeCl»_2 + «Cl»_2 → 2″FeCl»_3`;
`2″NaNO»_2 + «O»_2 → 2″NaNO»_3`;
`»Na»_2″SO»_3 + «H»_2″O» + «Cl»_2 → «Na»_2″SO»_4 + 2″HCl»`.
Гидролиз некоторых солей:
$$ {\mathrm{MgCl}}_{2} + {\mathrm{H}}_{2}\mathrm{O} \rightleftarrows \mathrm{MgOHCl} + \mathrm{HCl}$$;
$$ {\mathrm{Na}}_{2}{\mathrm{CO}}_{3} + {\mathrm{H}}_{2}\mathrm{O} \rightleftarrows {\mathrm{NaHCO}}_{3} + \mathrm{NaOH}$$.
При нагревании многие кислые соли разлагаются:
$$ 2{\mathrm{NaHCO}}_{3} \stackrel{\mathrm{t}°\mathrm{C}}{\to } {\mathrm{Na}}_{2}{\mathrm{CO}}_{3} + {\mathrm{CO}}_{2}\uparrow + {\mathrm{H}}_{2}\mathrm{O}$$;
$$ \mathrm{Ca}({\mathrm{HCO}}_{3}{)}_{2} \stackrel{\mathrm{t}°\mathrm{C}}{\to } {\mathrm{CaCO}}_{3}\downarrow + {\mathrm{CO}}_{2}\uparrow + {\mathrm{H}}_{2}\mathrm{O}$$.
называется связь между веществами разных классов соединений, основанная на их взаимных превращениях и отражающая единство их происхождения.
Генетическая связь может быть отражена в генетических рядах.
Генетический ряд состоит из веществ, которые образованы одним химическим элементом, принадлежат к разным классам соединений и связаны взаимными превращениями.
В приведённой ниже таблице обобщены рассмотренные выше химические свойства важнейших классов неорганических соединений.
| Реагент | Основной оксид | Амфотерный оксид | Кислотный оксид | Щелочь | Амфотерный гидроксид | Кислота | Соль | `»H»_2″O»` |
| Основной оксид | `-` | соль | соль | `-` | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | `-` | щелочь |
| Амфотерный оксид | соль | `-` | соль | соль `+` `»H»_2″O»` | `-` | соль `+` `»H»_2″O»` | `-` | `-` |
| Кислотный оксид | соль | соль | `-` | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | `-` | `-` | кислота |
| Щелочь | `-` | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | `-` | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | соль `+` основание |
дис-
социация
|
| Амфотерный гидроксид | соль `+` `»H»_2″O»` | `-` | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | `-` | соль `+` `»H»_2″O»` | `-` | |
| Кислота | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | `-` | соль `+` `»H»_2″O»` | соль `+` `»H»_2″O»` | `-` | соль `+` кислота |
дис-
социация
|
| Соль | `-` | `-` | `-` | соль `+` основание | `-` | соль `+` кислота | соль `+` соль | гидролиз |
Уста чудес: Кислая соль
Отличный ингредиент недели
Кислая соль, также известная как лимонная кислота, — это натуральный ингредиент, содержащийся во всех цитрусовых. Вы можете купить его на полках для специй или в Интернете. Он выглядит как маленькие белые кристаллы и имеет множество применений в кулинарии, консервировании, добавлении ароматизаторов и чистке. Лимонная кислота — это встречающаяся в природе слабая кислота, которая безопасна для употребления в пищу и использования человеком.
Кислая соль, смешанная с водой в виде сиропа, может использоваться в процессе консервирования или добавляться непосредственно в банку или банку; методы различаются в зависимости от того, что вы сохраняете.Лимонную кислоту добавляют в различные продукты, чтобы предотвратить различные виды пищевых отравлений, включая ботулизм. При добавлении к фруктам или овощам с низким уровнем кислотности лимонная кислота также минимизирует обесцвечивание, чтобы избежать коричневатого оттенка. Это особенно полезно в качестве натурального пищевого консерванта.
Лимонная кислота используется для придания кислого вкуса или просто для уравновешивания кисло-сладкого вкуса. Некоторые люди используют его при приготовлении традиционных голубцов для придания кисло-сладкого вкуса или в капустных супах.
Другое применение кислой соли:
- Есть также много экологически безопасных чистящих средств и применений, для которых лимонная кислота идеально подходит, в том числе: средства для чистки ковров; чистящие средства для стекол; и мыло для удаления накипи.
- Используется в химическом процессе при проявке оттиска.
- Удаляет пятна с кастрюль и сковородок — вскипятите воду с добавлением лимонной кислоты.
- Кислая соль лучше всего подходит для рецептов, которые также включают сахар, но цель состоит в том, чтобы создать приятный баланс между сладким и кислым, например, в холодном свекольном борще или лимонном чизкейке.
- Кислая соль очень вкусна, когда ее «солят» на попкорне. Вы пристраститесь к новому способу есть попкорн.
- Я также использую кислую соль в своем холодном чае, в заправках для салатов, с сахаром на фруктах и во многих других применениях на кухне. У меня никогда не бывает лимонов, когда они мне нужны, поэтому я заменяю их кислой солью.
- Я также использую его для подкисления воды, чтобы предотвратить окисление и обесцвечивание артишоков во время приготовления.
- Его также можно использовать для чистки кофеварки, электрического чайника, душевых лейок и в любом другом месте, где скапливаются отложения жесткой воды.Используйте одну унцию порошка лимонной кислоты на литр воды — это похоже на волшебство!
Борщ от Mimi Sheraton
Состав
3 больших или 4 средних свежих свеклы
сок 1 1/2 лимона, примерно
соль
щепотка кислой соли
5 стаканов воды
2 очень больших целых яйца
щепотка сахара, если нужно
белый перец по вкусу
гарниры: сметана и (по желанию) отварной картофель
Процедура
Вымойте и очистите свеклу, нарежьте мелкими кубиками или натрите на крупной терке. Поместите в кастрюлю сок 1/2 лимона, по щепотке соли и кислой соли и 5 чашек воды.Доведите до кипения, убавьте огонь, накройте крышкой и тушите, пока свекла не станет мягкой, около 40 минут. Добавьте сок еще 1/2 лимона. Снять с огня. Взбейте яйца вилкой, пока они не станут жидкими и водянистыми. Медленно налейте немного горячего борща в яйца, постоянно взбивая. Когда будет добавлено около половины супа, вылейте яичную смесь обратно в кастрюлю с оставшимся супом; снова влить медленно и постоянно взбивать. Когда вся яичная смесь смешается с супом, перелейте суп туда-сюда между кастрюлей и миской или кувшином примерно 10-15 раз, пока смесь не станет однородной, воздушной и кремообразной.В середине добавьте еще лимонного сока, чтобы вызвать плаксивый эффект; при необходимости добавьте щепотку сахара, а при необходимости — соль и белый перец. Продолжайте заливать до однородного состояния. Тщательно охладите. Лучше всего незадолго до подачи добавить сметану, чтобы борщ держался дольше. Сметану можно просто подавать к столу ложкой. Или вы можете добавить сметану (примерно 1 столовая ложка с горкой на стакан борща) в суп в банке. Плотно закройте и энергично встряхните, чтобы смешать.В этом ледяном супе замечательно подойдет рассыпчатый, сухой, горячий отварной картофель.
Лимонная кислота — лимонная соль
Лимонная кислота естественным образом содержится в некоторых фруктах и ягодах и обычно добавляется во многие продукты и напитки в качестве консерванта или ароматизатора. У него терпкий вкус, его также называют лимонной или кислой солью. Многие из наших клиентов используют нашу лимонную кислоту для мытья посудомоечных машин и посуды или для изготовления газированных бомб для ванн (весело!).
Что такое лимонная кислота?
Лимонная кислота является полностью натуральной, вырабатывается клетками во время цикла Кребса.Кислота получила свое название от семейства цитрусовых, в которое входят лимоны, лаймы, апельсины, мандарины и грейпфруты. Цитрусовые, особенно более кислые, такие как лимоны и лаймы, обязаны своим острым вкусом лимонной кислоте.
Как использовать лимонную кислоту в продуктах питания
Наши клиенты использовали нашу лимонную кислоту в качестве ингредиента практически во всем: сырах, мороженом, алкогольных напитках, хлебе и многом другом. Из-за характерного терпкого вкуса лимонную кислоту часто добавляют в безалкогольные напитки и кислые конфеты — белый порошкообразный налет на кислых конфетах часто представляет собой лимонную кислоту).
Используйте лимонную кислоту вместо лимонного сока: Хотя ее вкус немного менее сложен, чем вкус лимона, лимонной кислотой можно заменить буквально везде, где используется лимонный сок. Лимонную кислоту проще всего использовать вместо лимонного сока в домашнем лимонаде! Растворите одну чайную ложку лимонной кислоты и сахара и отрегулируйте по вкусу в стакане воды.
Лимонная кислота предотвращает потемнение свежих фруктов: Используйте лимонную кислоту для нарезанных свежих фруктов и при приготовлении домашних консервов вместо лимонного сока.Кислота действует так же, как лимоны, предотвращая потемнение свежих фруктов и регулирует уровень pH в консервированных продуктах, предотвращая рост бактерий. Вы даже можете добавлять лимонную кислоту в маринады, домашние джемы и многое другое!
Используйте лимонную кислоту вместо соли: Если вы следите за потреблением натрия, лимонную кислоту можно использовать вместо соли в кислом хлебе, таком как закваска и ржаной хлеб. Замените равное количество лимонной кислоты на соль того же вкуса, но без натрия.
Добавьте кислинки сладостям: Когда вы готовите домашние конфеты, завершите их слоем лимонной кислоты для классической кислинки во рту. Или добавьте его в безалкогольные напитки, чтобы получить лимонно-лаймовую газировку.
Используйте лимонную кислоту в качестве добавки к домашней пище: Когда вы готовите домашнее мороженое или сыр, лимонная кислота помогает вам достичь успешных результатов. Он действует как эмульгатор в домашнем мороженом, задерживая жировые шарики.Лимонная кислота, добавленная в сыр, помогает молоку свернуться и затвердеть.
Использование лимонной кислоты в непищевых целях
Лимонная кислота также используется в непищевых целях. Многие из наших клиентов используют нашу лимонную кислоту для мытья посудомоечных машин и посуды или для изготовления газированных бомб для ванн (весело!).
Одно действительно забавное применение лимонной кислоты — это бомбы для ванн . Когда вы опускаете бомбу для ванны в воду, она извергается и шипит, что делает ванну приятной. Многие люди комбинируют лимонную кислоту и пищевую соду, чтобы сделать самодельные бомбы для ванн, добавляя масла и отдушки для приятного аромата.
Лимонная кислота обладает умеренно кислотными свойствами, что делает ее отличным чистящим средством. При добавлении к средствам для мытья посуды лимонная кислота может смягчать воду, а удаляет отложения жесткой воды с посуды, посудомоечных машин, кофеварок, чайников и труб (это называется очисткой от накипи).
Некоторые люди используют лимонную кислоту в шампунях, средствах для ухода за кожей и фотографии. Его используют в шампунях, чтобы снизить уровень pH, чтобы волосы стали более гладкими и блестящими. При уходе за кожей он может улучшить здоровье клеток кожи, стимулируя выработку коллагена и действуя как антиоксидант.При проявлении пленки лимонная кислота используется, чтобы быстро остановить проявление фотографий.
Польза лимонной кислоты для здоровья
Исследования показали, что лимонная кислота помогает костям легче усваивать кальций . Его способность легко связываться с минералами помогает усвоению и усвоению минералов. Лимонная кислота также может помочь предотвратить превращение маленьких камней в почках в более крупные проблемные камни. Лимонная кислота покрывает камни и предотвращает прилипание материалов к ним и их увеличение.
Вы могли бы подумать о том, чтобы держать под рукой емкость с лимонной кислотой, чтобы использовать ее в самых разных целях!
Приготовление пищи с лимонной кислотой: советы и хитрости
Вы, наверное, видели лимонную кислоту, указанную на этикетке с ингредиентами на банке с газировкой или на упаковке закусок, и это звучит как вещество, принадлежащее химической лаборатории, а не кухне. Да, порошок, полученный из цитрусовых, используется в качестве консерванта и эмульгатора, но мы клянёмся, что приготовление еды в домашних условиях с лимонной кислотой — хорошая идея.
Во-первых, вы можете использовать его при консервировании фруктовых консервов (точно так же, как используется лимонный сок, чтобы снизить pH до безопасного уровня для хранения) или для очистки автоматической кофеварки с капельным бачком. Хотя лимонная кислота имеет множество полезных функций помимо домашней кухни, она также является секретным источником восхищения — в конце концов, это просто чистая кислота. Кислота является одним из основных элементов сбалансированного вкуса (наряду со сладким, соленым, горьким и умами), поэтому она необходима в каждом блюде.О, и лимонная кислота также может улучшить внешний вид вашей еды . Вот как можно использовать лимонную кислоту на кухне:
Сохраняйте свежесть продуктов питания
Многие нарезанные фрукты, такие как яблоки или авокадо, имеют свойство окисляться и становиться коричневыми после того, как посидели какое-то время. Вероятно, вы слышали о выдавливании лимона или лайма на фрукты, чтобы предотвратить окисление, но лимонная кислота — это уловка следующего уровня, которую любят кулинарные стилисты. Рода, директор по кулинарии Epi, говорит: «Если я хочу, чтобы такие продукты, как яблоки и авокадо, выглядели действительно свежими для камеры, я делаю смесь лимонной кислоты и воды и наношу ее на срезанные стороны фруктов, чтобы они не подрумянились. .»
Даже если вы не устраиваете полноценную фотосессию со своими продуктами, лимонная кислота может пригодиться, когда вы, скажем, готовите гуакамоле для толпы, и не хотите, чтобы он подрумянился, пока вы ждете. для гостей, чтобы они окопались — или намочите гуак в соке лайма. Или, если ваши дети немного разборчивы (или вы немного невротичны), посыпьте их яблочные дольки щепоткой порошка, прежде чем упаковывать их для перекуса.
Сделайте из него сыр
Всего 1/2 чайной ложки лимонной кислоты (растворенной в 2 столовых ложках воды) можно заменить 2 столовые ложки лимонного сока или уксуса при приготовлении свежих сыров, таких как рикотта или панир (чертовски вкусный сыр, который содержится в тонны индийских блюд).По этой причине во многих индийских продуктовых магазинах вы найдете лимонную кислоту, также известную как «кислая соль». Лимонная кислота имеет более постоянный pH, чем лимонный сок, поэтому при приготовлении сыра она может гарантировать идеальный кислотный баланс, не добавляя лимонного или уксусного вкуса.
Добавьте пикантности к богатым блюдам
Мэтью Зурас, старший редактор MUNCHIES, также большой поклонник готовки с лимонной кислотой: «Я использую ее, когда хочу придать блюду немного остроты, но не дополнительной жидкости, например, ампинг. добавляю кислоту в густой лимонный творог или сложное масло, или когда я делаю сухие мази и смеси специй.«Лимонную кислоту также можно использовать практически в любом блюде для добавления кислоты без добавления жидкости (из уксуса или лимонного сока) или каких-либо особенно сильных вкусовых добавок, кроме, ну, ну, кислотности.
В этой теме домашние повара рассказывают, как использовать лимонную кислоту. кислоты, или «кислой соли», в их кулинарии — матери многих поваров использовали щепотку ее в супах, таких как борщ (в этом рецепте используется вместо красного винного уксуса) и томатный суп, чтобы сбалансировать вкус. также использовала его в голубцах и смешивала с солью для обрамления маргариты с добавлением морщин.Вы даже можете добавить половину чайной ложки лимонной кислоты в рецепты хлеба на закваске, чтобы усилить остроту.
Продано на варку с лимонной кислотой? Попробуйте его вместо уксуса в этих рецептах с добавлением кислых добавок.
Хрустящий сэндвич с курицей с пахтой и майонезом с травами
Этот хрустящий сэндвич получает двойной удар тепла благодаря пикантному рассолу соуса Табаско и покрытию с добавлением кайенских приправ. Хрустящая пахта и сливочный майонез с травами обеспечивают освежающий вкус и являются прекрасным противовесом специям.
Получить этот рецепт
Что такое кислая соль и откуда она взята?
Неправильное название кислой соли. Это не имеет ничего общего с поваренной солью или хлоридом натрия. На самом деле это вовсе не соль; это кислота. Это два разных класса химикатов.
Каждая кислота представляет собой уникальное химическое вещество, обладающее свойствами, которые отличают ее от всех других кислот. Но у него могут быть десятки производных, называемых солями; каждая кислота является родителем целого ряда солей.
Так называемая кислая соль — это не одна из этих солей-потомков, а, скорее, сама по себе исходная кислота: лимонная кислота.Он имеет чрезвычайно кислый вкус и добавляется для придания терпкости сотням готовых блюд, от безалкогольных напитков до джемов и замороженных фруктов.
Помимо терпкости, лимонная и другие кислоты замедляют потемнение фруктов за счет ферментов и окисления. Его получают из цитрусовых или ферментированной патоки и используют в блюдах Ближнего Востока и Восточной Европы, обычно в борще. Вы можете найти ее под названием «кислая соль» на кошерных рынках или в отделе этнических продуктов в крупных супермаркетах или как лимонная соль на рынках Ближнего Востока.
Лимонная кислота не единственная по своей кислотности. Все кислоты кислые. На самом деле только кислоты
кислый из-за их уникального свойства производить так называемые ионы водорода, которые заставляют наши вкусовые рецепторы «киснуть» для нашего мозга. Самые сильные кислоты на вашей кухне — это уксус и лимонный сок. Но кислая соль, представляющая собой 100-процентную лимонную кислоту в кристаллической форме, намного кислее, чем уксус, который представляет собой всего лишь 5-процентный раствор уксусной кислоты в воде, или лимонный сок, который содержит только около 7 процентов лимонной кислоты.
Лимонная кислота уникальна тем, что придает кислый вкус практически без какого-либо другого вкуса, тогда как резкие ароматы лимонного сока и уксуса должны быть учтены в общем балансе любого блюда.
Американские повара могут извлечь выгоду, поэкспериментируя с кислой солью в блюдах, которые требуют легкой терпкости без каких-либо сопровождающих их привкусов лимона или уксуса.
Высокое содержание соли, обнаруженное клетками кислого и горького вкуса
Исследователи обнаружили, что высокие уровни соли вызывают у мышей как кислые, так и горькие вкусовые клетки.Это открытие может помочь объяснить, почему мы считаем неаппетитным высокий уровень соли.
За последние 15 лет лаборатории доктора Николаса Рыбы из Национального института стоматологических и черепно-лицевых исследований Национального института здоровья (NIDCR) и доктора Чарльза Цукера из Медицинского центра Колумбийского университета идентифицировали клетки языка, которые определяют сладкое, кислое, горькое, умами (острый) и малосолевой вкус. Сладкий вкус и вкус умами обычно считаются аппетитными, а кислый и горький — неприятными.
Солевой вкус уникален, потому что большинство животных потребляют его до определенного уровня, но после этого он становится непривлекательным.Натрий в пищевой соли (хлорид натрия) — это незаменимый ион, используемый каждой клеткой тела. Однако избыток соли может нанести вред. Клетки вкусовых рецепторов, экспрессирующие эпителиальный натриевый канал (ENaC), обнаруживают низкие уровни солей натрия, но клетки, стоящие за отвращением к более высоким уровням соли, были неизвестны.
В своем новом исследовании ученые решили определить, насколько высокий уровень соли ощущается. Под руководством доктора Юки Ока в лаборатории Зукера они сначала искали ингибиторы реакции с высоким содержанием соли у мышей.Они сообщили в Интернете на сайте Nature 13 февраля 2013 года, что одно соединение частично блокировало реакцию на высокие уровни соли, не влияя на реакцию на низкие уровни. Соединение также подавляло реакцию на горькие раздражители. Дополнительное исследование отдельных вкусовых рецепторных клеток подтвердило, что высокие концентрации соли активировали ощущающие горечь вкусовые клетки.
Дальнейшие эксперименты показали, что у мышей, генетически модифицированных без горького вкуса, были снижены вкусовые реакции на высокий уровень соли.Однако они все же отказались от концентрированных солевых растворов. Поскольку кислый вкус также непривлекателен для мышей, исследователи проверили, могут ли чувствительные к кислому вкусу клетки также способствовать обнаружению высокого содержания соли. Ученые обнаружили, что когда клетки с кислым вкусом были деактивированы, способность мышей ощущать высокий вкус соли также частично снижалась, но мыши снова избегали сильных соленых стимулов.
Когда были заблокированы и горький, и кислый вкус, мыши перестали проявлять отвращение к соли. Они охотно потребляли хлорид натрия даже в таких высоких концентрациях, как в морской воде.
Эти данные предполагают, что, хотя специализированные солевые рецепторные клетки, возможно, эволюционировали, чтобы сделать соль привлекательной, активация кислых и горьких на вкус клеток высокими концентрациями соли помогает предотвратить потребление соли, которая может серьезно повлиять на здоровье.
«На протяжении многих лет наши исследования показали, что каждое качество вкуса — сладкий, горький, кислый, умами и с низким содержанием соли — обеспечивается разными клетками», — говорит Рыба. «Мы подумали, что для высокого содержания соли должны быть разные вкусовые рецепторы.Но совершенно неожиданно доктор Юки Ока обнаружил, что высокое содержание соли обеспечивается клетками, которые мы уже знали ».
Будущие исследования потребуются для подтверждения роли этих чувствительных к соли клеток у людей. Это исследование может в конечном итоге привести к стратегиям, которые ограничат наше стремление к высокосолевой диете и помогут нам избежать слишком большого количества натрия.
— Миранда Хэнсон, доктор философии.
Артикул: Nature. 2013 13 февраля. Doi: 10.1038 / nature11905. [Epub перед печатью]. PMID: 23407495.
Что такое кислые соли? State Bird Provisions изобретает новую приправу
Здесь, в Bon Appétit , мы любим соль.Нам нравится это на наших стейках. Мы любим его в наших десертах. Нам даже нравится делать наши собственные ароматизированные соли, которыми можно посыпать все, от отбивных до хумуса. Большинство из нас хранят на столах разные виды солей на обед. Но несколько месяцев назад, когда я обедал в ресторане State Bird Provisions в Сан-Франциско, я увидел кое-что новенькое: квашеной капусты с добавлением соли , которая была сложена вместе с пикантными оладьями из квашеной капусты. Это был острый, необычный порошок, который прилипал к пирогу размером с серебряный доллар, но при этом не был слишком соленым.Мой разум был взорван.
Йогурт, авокадо и хрустящая лебеда с солью из маринованных лаймов и корнем кинзы
Итак, я позвонил повару State Bird, Стюарт Бриоза , чтобы поговорить о соли. Он объяснил, как он экспериментировал со своим дегидратором, создавая белую соль и яркий, соленый, кислый порошок из листьев шисо, а затем внезапно понял, что может использовать эти соленые порошки еще дальше.
«Давайте взорвем это!» он сказал. Он заверил меня, что начнет экспериментировать и разработает множество различных обезвоженных «солей» для всего, от окунания до опрыскивания.
Пару недель спустя я вернулся в State Bird, в разгар подготовки к обслуживанию, когда Бриоза вытащил восемь контейнеров, наполненных разноцветными порошками. Их этикетки были нацарапаны такими вещами, как «соленый лайм, 2/20» и «порошок шисо-умэ 4, повар!» Они заставят упасть в обморок любого ботаника по ферментации: рассол Мейер с лимоном, шиитаке-умэбоши, консервированный лимон. Каждый обезвоженный ингредиент привносит свои концентрированные уникальные ароматы вместе с содержанием соли.
«Я называю это« кислой солью », — объявил Бриоза.Его процесс прост: Он берет маринованный или ферментированный ингредиент, чертовски его обезвоживает, а затем измельчает в мелкий порошок . Если у вас есть дегидратор и хороший блендер, вы можете легко приготовить эти соли дома. Как любое полезное изобретение, о нем мог подумать кто угодно, но Бриоза первым об этом подумал (мы думаем).
Пришло время поэкспериментировать с солями. Бриоза взял рассол лайма, ферментированный корень кинзы, шиитаке-умэбоши и консервированную лимонную соль и принес их на освободившееся место на кухне.Каждый из них поразил меня так же, как и соль квашеной капусты: рассол из лайма представлял собой буйный желтый порошок с электрической кислотностью, пряностями и острым вкусом, напоминавшим его прежний вкус. Консервированная лимонная соль заставила меня морщиться во рту, но в ней был солоновато-сладкий элемент, который смягчал ее укус. Шиитаке-умэбоши был очень ароматным, с запахом кофе и какао. Особенно удивила соль корня кинзы.
«Это то, что на самом деле нельзя было бы использовать иначе, — сказал Бриоза. — Это аромат, который я никогда раньше не пробовал в такой форме.Это как свежая кинза в 10-й степени ». Соленая, травяная и немного напуганная, эта соль с корнем кинзы была бы деньгами на гуакамоле, карри или даже яичницу-болтунью. Хотел бы я взять немного домой.
Спаржа с Мейер айоли с лимоном и консервированной лимонной солью
Для первого блюда он взял зазубренную деревянную доску, положил немного йогурта и нарезал кубиками авокадо, затем посыпал все это хрустящей жареной киноа. корень кинзы — по обе стороны его архитектурного авокадо. Это было здорово: запах, жир, хруст, кислота и соль. И вы можете выбрать свое собственное приключение, выбрав соль, в которую все это окунуть.
Остальные блюда были такими же простыми, с менее чем пятью ингредиентами: спаржа, обернутая айоли с лимоном Мейера, затем посыпанная терпким, но похожим на конфеты консервированная лимонная соль; толстый ломтик поджаренного пшеничного хлеба (от Josey Baker на The Mill), посыпанный землистой солью шиитаке-умэбоши, украшенный листьями фенхеля (более интенсивными и лакричными, чем обычный фенхель) и покрытый соленой соломой. и копченый яичный желток.После того, как каждое блюдо было готово, Бриоза отнес тарелки своей жене, совладельцу State Bird Николь Красински . Мы трое пробовали каждое блюдо, закатывая глаза. Они оба согласились: скоро соли появятся в их постоянно меняющемся меню.
Не можете добраться до Сан-Франциско? Не волнуйтесь — вы, вероятно, очень скоро начнете видеть эти ярко окрашенные порошки с насыщенным вкусом и в других блюдах ресторана. Я звоню.
СОЛОМА ДЫНЬ КИСЛОСОЛЬ НИКОТИН НАИЛУЧШЕЙ ЭЛЕКТРОННОЙ ЖИДКОСТЬЮ
Не позволяйте размеру вводить вас в заблуждение — иногда лучшие вещи приходят в небольших упаковках! Серия Salt Nic Strawmelon Sour — это идеальное переосмысление ваших любимых лакомств, продуманное сочетание сладости клубники и арбуза с ненавязчивой терпкой и кислой ноткой, упакованных в одну вкусную маленькую ароматизированную упаковку жидкости для электронных сигарет.
Характеристики
- Вкус — кислая клубника и арбуз
- Размер бутылки -30 мл
- Уровень никотина — 30 мг, 50 мг
- VG / PG — 70/30
- Состав — пропиленгликоль, растительный глицерин, натуральные и искусственные ароматизаторы, никотин.
КАЛИФОРНИЯ ПРЕДЛОЖЕНИЕ 65 ПРЕДУПРЕЖДЕНИЯ: НИКОТИН ЯВЛЯЕТСЯ ХИМИЧЕСКИМ ХИМИКОМ, ИЗВЕСТНЫМ В ГОСУДАРСТВЕ КАЛИФОРНИИ, ВЫЗЫВАЮЩИМ ДЕФЕКТЫ РОЖДЕНИЯ ИЛИ ДРУГОЙ РЕПРОДУКТИВНЫЙ ВРЕД.Учить больше
City of Vape продает товары, предназначенные только для взрослых. City of Vape никоим образом и не означает продвигать или продавать товары несовершеннолетним (лицам, не достигшим совершеннолетия).
Электронные сигареты — это продукт для продвинутых пользователей, и любой, кто использует какие-либо электронные системы доставки никотина, должен проявлять особую осторожность в любое время и при любых обстоятельствах. City of Vape не несет ответственности за любой ущерб, травмы или дефекты, вызванные неправильным использованием батарей, устройств и других проданных товаров.Мы рекомендуем внимательно ознакомиться с описанием продукта и его использованием перед покупкой.
Никотин является химическим веществом, вызывающим привыкание, и продукты, продаваемые на этом сайте, содержат никотин, химическое вещество, которое, как известно в штате Калифорния, вызывает врожденные дефекты, рак или другие нарушения репродуктивной функции. Электронные жидкости или соки, продаваемые на этом сайте, содержат пропиленгликоль, растительный глицерин, ароматизаторы и никотин. При пероральном приеме эти продукты могут быть ядовитыми. Храните эти продукты в недоступном для детей и домашних животных месте.
КАЛИФОРНИЯ ПРЕДЛОЖЕНИЕ 65 ПРЕДУПРЕЖДЕНИЯ: НИКОТИН ЯВЛЯЕТСЯ ХИМИЧЕСКИМ ПРИЗНАНИЕМ, ИЗВЕСТНЫМ В ГОСУДАРСТВЕ КАЛИФОРНИИ, ВЫЗЫВАЮЩИМ ДЕФЕКТЫ РОЖДЕНИЯ ИЛИ ДРУГОЙ РЕПРОДУКТИВНЫЙ ВРЕД.
Если у вас есть вопросы об аккумуляторах, посетите раздел «Литий-ионные аккумуляторы» на нашей странице заявления об отказе от ответственности ЗДЕСЬ.
Из-за строгих санитарных норм открытые картриджи, распылители или жидкость для электронных сигарет не могут быть возвращены, если они не повреждены. По всем остальным вопросам обращайтесь к нам за помощью в определении того, находится ли деталь на гарантии.
Продукты должны быть в новом, неиспользованном состоянии, чтобы иметь право на обмен или возврат. Это исключает право на возврат средств за использованные электронные жидкости, форсунки / змеевики, наконечники для капель, резервуары и восстанавливаемые форсунки.
