Содержание
Примеры составления реакций ионного обмена
1. Если врезультате реакции выделяется малодиссоциирующее (мд) вещество – вода.
а) Молекулярное уравнение
реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O
Сокращённое ионное уравнение
реакции:
H+ + OH– =
H2O
б) Молекулярное уравнение
реакции основного оксида с кислотой:
CaO
(оксид) + 2HNO3 (р) = Ca(NO3)2 (р) + H2O (мд)
Полное ионное уравнение реакции:
CaO + 2H+ + 2NO3— = Ca2+ + 2NO3— + H2O
Сокращённое ионное уравнение
реакции:
CaO + 2H+ = Ca2+ +
H2O
в) Молекулярное уравнение
реакции нерастворимого основания с кислотой:
Mg(OH)2 (н) + H2SO4 (р) = MgSO4(р) + 2H2O
(мд)
Полное ионное уравнение реакции:
Mg(OH)2 + 2H+ + SO42- = Mg2+ + SO42- + 2H2O
Сокращённое
ионное уравнение реакции:
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
2. Если врезультате реакции выделяется нерастворимое в воде вещество.
Если врезультате реакции выделяется нерастворимое в воде вещество.
а) Молекулярное уравнение
реакции растворимой соли со щелочью:
CuCl2 (р) +
2KOH (р) = 2KCl(р) + Cu(OH)2↓
Полное ионное уравнение реакции:
Cu2+ +
2Cl– + 2K+ + 2OH– = 2K+ +
2Cl– + Cu(OH)2↓
Сокращённое ионное уравнение
реакции:
Cu2+ + 2OH– =
Cu(OH)2↓
б) Молекулярное уравнение
реакции двух растворимых солей:
Al2(SO4)3 (р) + 3BaCl2 (р) = 3BaSO4↓ +
2AlCl3(р)
Полное ионное уравнение реакции:
2Al3+ + 3SO42- + 3Ba2+ + 6Cl— = 3BaSO4↓ + 2Al3+ + 6Cl—
Сокращённое ионное уравнение реакции:
SO42- + Ba2+ = BaSO4↓
3. Если врезультате реакции выделяется газообразное вещество.
Если врезультате реакции выделяется газообразное вещество.
а) Молекулярное уравнение
реакции растворимой соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + H2S↑
Полное ионное уравнение реакции:
2K+ +
S2– + 2H+ + 2Cl– = 2K+ +
2Cl– + H2S↑.
Сокращённое ионное уравнение
реакции:
S2– + 2H+ =
H2S↑
б) Молекулярное уравнение
реакции растворимой соли (карбоната) с кислотой:
Na2CO3 +
2HNO3 = 2NaNO3 + H2O + CO2↑
Полное ионное уравнение реакции:
2Na+ + CO32- + 2H+ + 2NO3— = 2Na+ + CO2↑ + H2O + 2NO3—
Сокращённое ионное уравнение
реакции:
CO32- + 2H+ = CO2↑ + H2O
О протекании данной реакции до
конца свидетельствуют два признака: выделение воды и газа – оксида
углерода(IV).
Ионно-молекулярные уравнения в химии
Ионно-молекулярные уравнения
В обменных реакциях, протекающих в растворах электролитов, наряду с недиссоциированными молекулами слабых электролитов, осадками и газами участвуют, находящиеся в растворе ионы. Поэтому механизм протекания реакций в растворе наиболее полно выражается при замене молекулярных уравнений ионно-молекулярными. В таких уравнениях слабые электролиты, малорастворимые соединения и газы записываются в молекулярной форме, а сильные электролиты в виде ионов.
Например:
1.
— молекулярное уравнение
Ею можно изобразить в ионной форме (иногда такую форму записи называют ионномолекулярной. Еси формулы растворимых сильных электролитов записать в виде тех ионов, на которые они диссоциируют в растворе, а формулы слабых электролитов в виде молекул, то уравнение реакции можно представить в виде:
— полное ионно-молекулярное уравнение
Исключая из данного уравнения одинаковые ионы в правой и левой частях, получим запись уравнения в сокращенной ионно-молекулярной форме:
— сокращенное ионно-молекулярное уравнение
Такое уравнение показывает, что реакция между сульфатом кобальта (II) и гидроксидом натрия сводится к взаимодействию между ионами кобальта (II) и гидроксид ионами с образованием гидроксида кобальта (II). С точки зрения теории электролитической диссоциации ионы
С точки зрения теории электролитической диссоциации ионы
принимают участия в реакции. По такому же принципу составим уравнения других реакций обмена в водных растворах электролитов (примеры 2 -6).
2.
— молекулярное уравнение
— полное ионно-молекулярное уравнение
— сокращенное ионно-молекулярное уравнение
3.
— молекулярное уравнение
полное ионно-молекулярное уравнение
— сокращенное ионно-молекулярное уравнение
4.
— молекулярное уравнение
— полное ионно-молекулярное уравнение
— сокращенное ионно-молекулярное уравнение
5.
— молекулярное уравнение
— полное ионно-молекулярное уравнение
— сокращенное ионно-молекулярное уравнение
Рассмотренные примеры показывают, что обменные реакции в растворах электролитов протекают в направлении связывания ионов, приводящего к образованию осадков, газов или слабых электролитов.
С другой стороны на основании сокращенного ионно-молекулярного уравнения можно составить уравнение реакции в полном молекулярном виде. Например:
Например:
— сокращенное ионно-молекулярное уравнение
Согласно теории электролитической диссоциации катионы металлов образуются при диссоциации солей, которые являются сильными электролитами. В данном случае необходимо выбрать хорошо растворимую соль. Так как все соли азотной кислоты являются растворимым, то можно использовать
. В качестве второго реагента используем раствор щелочи . так как основания металлов 1 и II главных подгрупп таблицы Менделеева являются сильными электролитами. Тогда
Рассмотрим пример взаимодействия в растворе хлорида калия и сульфата натрия:
Запишем уравнение реакции в ионной форме:
В левой и правой частях уравнения записаны одни и те же ионы. В соответствии с теорией электролитической диссоциации такие реакции не протекают. Действительно, при сливании растворов
видимых изменений не происходит. Однако, если упарить раствор досуха, то в остатке обнаружатся все четыре соли: . Такую реакцию обмена следует отнести к обратимым.
Эта теория взята со страницы помощи по химии:
Онлайн помощь по химии
Возможно эти страницы вам помогут:
Как решать (составлять) молекулярные уравнения
В ходе изучения химии часто возникают вопросы, связанные с составлением молекулярных уравнений реакций. Какие вещества реагируют друг с другом и как узнать, идет ли реакция? Нужно ли расставлять коэффициенты в уравнении реакции?
Молекулярные уравнения – это запись, которая позволяет понимать какие молекулы, и в каком количестве вступали в реакцию и в какие новые молекулы они превратились в ходе химической реакции.
4Mg + 5H2SO4 (конц.) = 4MgSO4 + H2S ↑ + 4H2O
Перед нами химическая реакция, где Mg + H2SO4 (конц.) – исходные (израсходованные) вещества, то есть вещества, вступившие в химическую реакцию, а MgSO4 + H2S ↑ + H2O – это вещества, которые образовались в ходе химической реакции. Они называются продуктами реакции. Часто составления химических реакций достаточно знать к каким классам относятся исходные вещества, что бы понимать будет ли между ними реакция, если вещество проявляет кислотные свойства, то оно будет реагировать с веществом с основными свойствами. Амфотерные соединения проявляют химическую двойственность, что позволяет им реагировать как с веществами с кислотными свойствами, так и с основными. Кроме общих химических свойств для различных классов веществ (металлы, неметаллы, оксиды кислотные, амфотерные и основные, кислоты, основания, амфотерные гидроксиды) существуют и специфические свойства,характерные для определенных веществ.
Они называются продуктами реакции. Часто составления химических реакций достаточно знать к каким классам относятся исходные вещества, что бы понимать будет ли между ними реакция, если вещество проявляет кислотные свойства, то оно будет реагировать с веществом с основными свойствами. Амфотерные соединения проявляют химическую двойственность, что позволяет им реагировать как с веществами с кислотными свойствами, так и с основными. Кроме общих химических свойств для различных классов веществ (металлы, неметаллы, оксиды кислотные, амфотерные и основные, кислоты, основания, амфотерные гидроксиды) существуют и специфические свойства,характерные для определенных веществ.
Разберем общие правила, которые позволят составлять молекулярные уравнения.
1. Реакции замещения идут лишь, когда более активный металл замещает, то есть встает на место менее активного металла в сложном веществе. Для определения активности следует использовать «электрохимический ряд напряжения металлов», в котором металл, находящийся левее активнее, то есть сильнее металла, стоящего правее, а значит, кто левее сможет вытеснять из сложных веществ, например солей, те металлы, которые правее.
2Al + 3Zn = Al2O3 + 3Zn
Электрохимический ряд напряжения металлов в порядке ослабления активности металлов, ослаблении восстановительных свойств
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
2. Реакции ионного обмена идут до конца, когда в ходе химической реакции образуется в продуктах реакции газ, осадок или вода. Важно отметить, что может быть одновременное образование воды и осадка, или двух осадков. Выделение газа, образование осадка это видимые признаки химической реакции. В таблице растворимости можно посмотреть является ли основание, соль или кислота нерастворимым соединением.
Na2SO4 + BaCl2 = BaSO4 ↓ + 2NaCl
3. Важным правилом при составлении молекулярных уравнений является расстановка стехиометрических коэффициентов. Количество атомов одного и того же элемента в левой части от знака равно должно быть равным количеству атомов в правой части уравнения.
Ca(OH)2 + 2CO2= Ca(HCO3)2
В данном случае, количество атомов кальция в левой и правой части = 1, количество углерода равно 2, водород тоже уравнен, в исходных веществах и в продуктах реакции по 2 водорода, а кислорода по 6 атомов.
4. В ходе некоторых реакций образуются неустойчивые вещества, которые сразу же разлагаются, а значит нужно написать в продуктах реакции сразу выделяющийся газ и воду.
H2CO3 = CO2 ↑ +H2O
H2SO3 = SO2 ↑ +H2O
NH4OH = NH3 ↑ + H2O
Пример:
H2SO4 + K2CO3 = K2SO4 + H2CO3 – неверная запись молекулярного уравнения
H2SO4 + K2CO3 = K2SO4 + CO2 ↑ + H2O – верное уравнение.
5. Если в ходе химической реакции образуется газ, то стоит поставить знак «↑», что символизирует, что образующийся газ улетел. Если образуется осадок, то «↓», что будет означать, что в ходе реакции образовалось нерастворимое в воде соединение.
Реакции ионного обмена и условия их протекания
Цели урока: продолжить формирование навыков составления полных и сокращенных ионных уравнений.
Ход урока
1. Организационный момент.
2. Решение практических заданий
Задание № 1.
Определите, может ли осуществляться взаимодействие между растворами следующих веществ, записать реакциив молекулярном, полном, кратком ионном виде:
гидроксид калия и хлорид аммония.
Решение
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
KOH + Nh5Cl = KCl + Nh5OH
Так как Nh5OH неустойчивое вещество и разлагается на воду и газ Nh4 уравнение РИО примет окончательный вид:
KOH (p) + Nh5Cl (p) = KCl (p) + Nh4 ↑+ h3O
-Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K+ + OH- + Nh5+ + Cl- = K+ + Cl- + Nh4 ↑+ h3O
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
OH- + Nh5+ = Nh4 ↑+ h3O
— Делаем вывод:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (Nh4↑) и малодиссоциирующее вещество вода (h3O).
Задание № 2
Дана схема:
2H+ + CO32- = h3O + CO2↑
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
Решение
— Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H+ и CO32-.
Например, кислота — h4PO4 (p) и соль -K2CO3 (p).
— Составляем молекулярное уравнение РИО:
2h4PO4 (p) +3 K2CO3 (p) → 2K3PO4 (p) + 3h3CO3 (p)
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду h3O, уравнение примет окончательный вид:
2h4PO4 (p) +3 K2CO3 (p) → 2K3PO4 (p) + 3CO2 ↑ + 3h3O
— Составляем полное ионное уравнение РИО:
6H+ +2PO43- + 6K+ + 3CO32- → 6K++ 2PO43-+ 3CO2 ↑ + 3h3O
— Составляем краткое ионное уравнение РИО:
6H+ + 3CO32- = 3CO2 ↑ + 3h3O
Сокращаем коэффициенты на три и получаем:
2H+ + CO32- = CO2 ↑ + h3O
— Делаем вывод:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание № 3
Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2h4PO4 (р) → 2Na3PO4 (р) + 3h3O (мд),
где нэ — неэлектролит, на ионы не диссоциирует, мд — малодиссоциирующее вещество, на ионы не раскладываем, вода — признак необратимости реакции.
2. Составляем полное ионное уравнение:
3Na2O + 6H+ + 2PO43- → 6Na+ + 2PO43- + 3h3O
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H+ → 6Na+ + 3h3O
Сокращаем коэффициенты на три и получаем:
Na2O + 2H+ → 2Na+ + h3O
Данная реакция необратима, т. е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
3. Задания для самостоятельной работы
Задание № 1
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.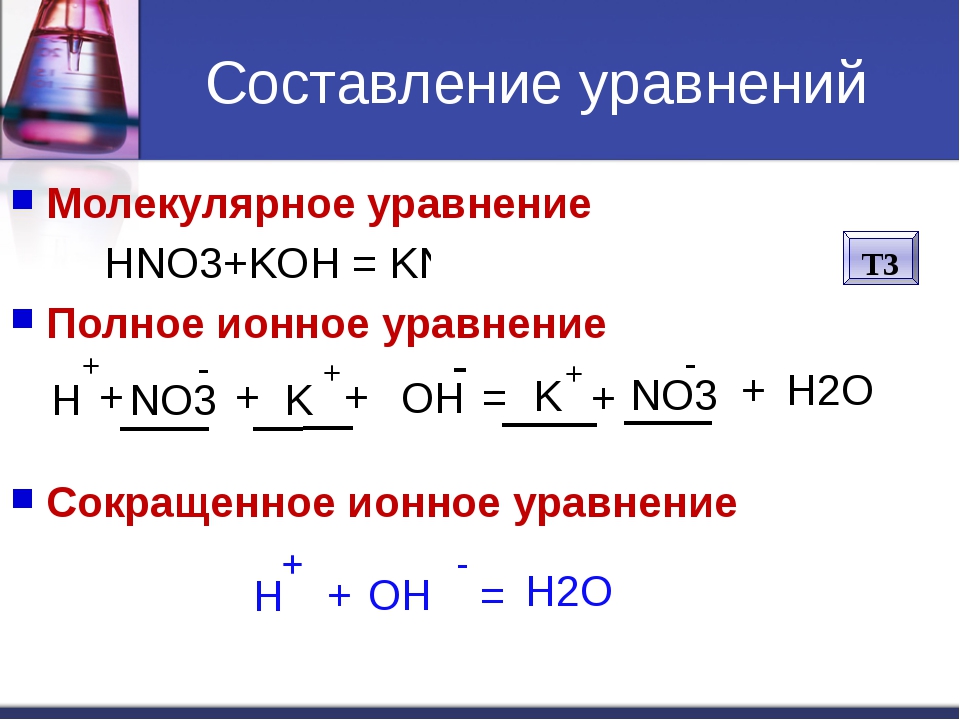
Задание № 2
Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
ZnF2 + Ca(OH)2 →
K2S + h4PO4 →
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание № 3
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание № 4
Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
Hg(NO3)2 + Na2S →
K2SO3 + HCl →
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
4. Домашнее задание
П. 4, упр. 3-5, задача 2 на стр. 22.
Реакции ионного обмена и условия их протекания.
Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
HNO3 + KOH = KNO3 + H2O (1)
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.е. в виде ионов:
H+ + NO3− + K+ + OH‑ = K+ + NO3− + H2O (2)
Как можно заметить из уравнения (2), что до реакции, что после в растворе находятся ионы NO3− и K+ . Другими словами, по сути, нитрат-ионы и ионы калия никак не участвовали в реакции. Реакция произошла только благодаря объединению частиц H+ и OH− в молекулы воды. Таким образом, произведя алгебраически сокращение одинаковых ионов в уравнении (2):
Другими словами, по сути, нитрат-ионы и ионы калия никак не участвовали в реакции. Реакция произошла только благодаря объединению частиц H+ и OH− в молекулы воды. Таким образом, произведя алгебраически сокращение одинаковых ионов в уравнении (2):
H+ + NO3− + K+ + OH‑ = K+ + NO3− + H2O
мы получим:
H+ + OH‑ = H2O (3)
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание. Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
2HCl+ Ba(OH)2 = BaCl2 + 2H2O
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H+ + 2Cl− + Ba2+ + 2OH− = Ba2+ + 2Cl− + 2H2O
Сократим одинаковые ионы слева и справа и получим:
2H+ + 2OH− = 2H2O
Разделив и левую и правую часть на 2, получим:
H+ + OH− = H2O,
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
1) Воды H2O
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
практически все органические)).
3) Слабых оcнований (NH4OH и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
2Fe(OH)3+ 3H2SO4 = Fe2(SO4)3 + 6H2O
Гидроксиду железа (III) соответствует в таблице растворимости обозначение «Н», что говорит нам о его нерастворимости, т.е. в ионном уравнении его надо записывать целиком, т.е. как Fe(OH)3 . Серная кислота растворима и относится к сильным электролитам, то есть существует в растворе преимущественно в продиссоциированном состоянии. Сульфат железа (III), как и практически все другие соли, относится к сильным электролитам, и, поскольку он растворим в воде, в ионном уравнении его нужно писать в виде ионов. Учитывая все вышесказанное, получаем полное ионное уравнение следующего вида:
Учитывая все вышесказанное, получаем полное ионное уравнение следующего вида:
2Fe(OH)3 + 6H+ + 3SO42- = 2Fe3+ + 3SO42- + 6H2O
Сократив сульфат-ионы слева и справа, получаем:
2Fe(OH)3 + 6H+ = 2Fe3+ + 6H2O
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na+ + CO32- + Ca2+ + 2Cl− = CaCO3↓+ 2Na+ + 2Cl−
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
CO32- + Ca2+ = CaCO3↓
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
CuS + Fe(NO3)2 ≠ FeS + Cu(NO3)2
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
А вот, например,
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
Cu(OH)2 + Na2S – не протекает,
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
2NaOH + Cu(NO3)2 = Cu(OH)2 ↓+ 2NaNO3
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
Другими словами:
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
K2S + 2HBr = 2KBr + H2S↑
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, NH4OH и H2SO3:
H2CO3 = H2O + CO2 ↑
NH4OH = H2O + NH3 ↑
H2SO3 = H2O + SO2 ↑
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 ↑
NH4NO3 + KOH = KNO3 + H2O + NH3 ↑
Na2SO3 + 2HCl = 2NaCl + H2O + SO2 ↑
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
1) Для реакции:
K2S + 2HBr = 2KBr + H2S↑
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K+ + S2- + 2H+ + 2Br— = 2K+ + 2Br— + H2S↑
Сократив одинаковые ионы получаем:
S2- + 2H+ = H2S↑
2) Для уравнения:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 ↑
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
2Na+ + CO32- + 2H + + SO42- = 2Na+ + SO42 + H2O + CO2 ↑
CO32- + 2H + = H2O + CO2↑
3) для уравнения:
NH4NO3 + KOH = KNO3 + H2O + NH3↑
Молекулы воды и аммиака запишутся целиком, а NH4NO3, KNO3 и KOH запишутся в ионном виде , т. к. все нитраты являются хорошо растворимыми солями, а KOH является гидроксидом щелочного металла, т.е. сильным основанием:
к. все нитраты являются хорошо растворимыми солями, а KOH является гидроксидом щелочного металла, т.е. сильным основанием:
NH4+ + NO3−+ K+ + OH− = K+ + NO3− + H2O + NH3↑
NH4+ + OH− = H2O + NH3↑
Для уравнения:
Na2SO3 + 2HCl = 2NaCl + H2O + SO2 ↑
Полное и сокращенное уравнение будут иметь вид:
2Na+ + SO32- + 2H+ + 2Cl− = 2Na+ + 2Cl− + H2O + SO2 ↑
SO32- + 2H+ = H2O + SO2 ↑
5.6 Реакции обмена в водных растворах электролитов
5.6. Реакции обмена в водных растворах
электролитов. Ионные реакции и уравнения
В обменных реакциях, протекающих в
растворах электролитов, наряду с недиссоциированными молекулами слабых
электролитов, твердыми веществами и газами участвуют также находящиеся в
растворе ионы. Поэтому сущность протекающих процессов наиболее полно выражается
Поэтому сущность протекающих процессов наиболее полно выражается
при записи их в форме ионно-молекулярных уравнений. Например, уравнения реакций
нейтрализации сильных кислот щелочами
HClO4 + NaOH →NaClO4 + H2O,
2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O,
выражаются одним и тем же ионно-молекулярным уравнением
H+ + OH– → H2O,
из которого следует, что сущность этих процессов сводится к образованию из
ионов водорода и гидроксид-ионов малодиссоциированного электролита – воды.
Аналогично уравнения реакций
BaCl2 +H2SO4 → BaSO4 + 2HCl,
Ba(NO3)2 + Na2SO4 → BaSO4 + 2NaNO3
выражают один и тот же процесс образования из ионов Ва2+ и SO42— осадка малорастворимого электролита – сульфата бария
Ва2+ + SO42– → BaSO4↓.
На основании рассмотренных примеров можно
сделать следующий вывод: реакции в растворах электролитов всегда идут
в сторону образования наименее диссоциированных или наименее растворимых
веществ. Из этого, в частности, следует, что сильные кислоты вытесняют слабые из
растворов их солей
CH3COONa +
HCl → CH3COOH + NaCl.
Суть этой реакции более точно отражается ионно-молекулярным уравнением, где
формулы слабых электролитов записаны в виде молекул, а сильных – в виде ионов
CH3COO– + Na+ + H+ + Cl–
→ CH3COOH + Na+ + Cl– ,
или в сокращенном виде
CH3COO– + H+ → CH3COOH.
Аналогично протекают реакции между щелочами и солями слабых оснований.
Например,
FeSO4 + 2 NaOH → Na2SO4 + Fe(OH)2↓
Fe2+ + SO42– + 2 Na+ + 2 OH– → SO42– + 2 Na+ + Fe(OH)2↓
Fe2+ + 2 OH– → Fe(OH)2↓.
Таким образом, реакции в растворах электролитов идут до конца если в результате
взаимодействия веществ происходит образование осадка, выделение газа и
образование слабого электролита. При написании ионно—молекулярных
уравнений реакций, слабые электролиты, малорастворимые
соединения и газы записываются в молекулярной форме, а
находящиеся в растворе сильные электролиты – в виде составляющих
их ионов.
Все рассмотренные
уравнения реакций являются необратимыми т.к. равновесие в них смещено вправо
вследствие малой растворимости BaSO4 и Fe(OH)2,
образовании уксусной кислоты CH3COOH и воды H2O.
Однако в обменные реакции
могут вступать растворы сильных и слабых электролитов, что может приводить к
образованию слабых электролитов. Такие реакции являются обратимыми. Например:
FeS + 2HCl FeCl2 + H2S.
Запишем его в ионно-молекулярной форме, оставив в виде молекул
нерастворимый сульфид железа (FeS) и слабодиссоциируемый
газообразный сероводород (H2S). Сильные электролиты (HCl и FeCl2) запишем в виде ионов.
Сильные электролиты (HCl и FeCl2) запишем в виде ионов.
FeS + 2 H+ + 2Cl— Fe2+ +2Cl— + H2S.
Исключив одинаковые ионы (не участвующие в реакции) в левой и правой частях
уравнения, получаем сокращенное ионно-молекулярное уравнение:
FeS + 2 H+ Fe2+ + H2S.
Взаимодействие кислой соли и щелочи приводит к образованию средней соли и воды. Например:
KHCO3 + KOH K2CO3 + H2O.
Запишем полное ионно-молекулярное уравнение
K+ + HCO3– + K+ + OH– 2K+ + CO32– + H2O.
Исключив одинаковые ионы (не участвующие в реакции) в левой и правой частях
уравнения, получаем сокращенное ионно-молекулярное уравнение:
HCO3– + OH– CO32– + H2O.
При взаимодействии основной
соли и кислоты образуется средняя соль и вода.
Например:
NiOHNO3 + HNO3 Ni(NO3)2 + H2O.
Запишем полное и сокращенное ионно-молекулярное уравнения
NiOH+ + NO3–
+ H+ + NO3– Ni2+ + 2 NO3– + H2O
NiOH+ + H+ Ni2+ + H2O.
Амфотерные гидроксиды [Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3 и
др.] растворяются в растворах щелочей с образованием комплексных
солей. Например:
Zn(OH)2 + 2KOHK2[Zn(OH)4].
Запишем полное и сокращенное ионно-молекулярное уравнения
Zn(OH)2 + 2K+ + 2OH–2K + + [Zn(OH)4]2–
Zn(OH)2 + 2OH– [Zn(OH)4]2–.
В сокращенном ионно-молекулярном уравнении сумма электрических зарядов
левой части уравнения всегда равна сумме электрических зарядов правой части
уравнения.
Правила написания уравнений реакций в ионном
виде
1. Записывают формулы веществ, вступивших в
реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ.
Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ
(солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р»
(хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и
обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и
неметаллов, вода, газообразные вещества, нерастворимые в воде соединения,
обозначенные в таблице растворимости буквой «Н». Формулы этих веществ
записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают
Получают
сокращенное ионное уравнение.
| На ионы диссоциируют | |
| Реагенты (исходные вещества) | Продукты реакции |
| Растворимые (P) в воде (см. ТР): (Включая Ca(OH)2 – M) | Растворимые (P) в воде (см. ТР): Исключения – неустойчивые вещества не диссоциируют, а H2S↑ |
Р — растворимое вещество;
М — малорастворимое вещество;
ТР — таблица растворимости.
Алгоритм составления
реакций ионного обмена (РИО)
в молекулярном, полном и
кратком ионном виде
| 1). Записываем уравнение РИО в молекулярном виде: | Взаимодействие серной кислоты и хлорида бария: H2SO4 + |
2). Используя ТР указываем растворимость веществ Используя ТР указываем растворимость веществводе: — Если продукт является М или Н – — Если продукт является газом, справа от химической | Р Р Н Р H2SO4 + Молекулярный вид |
| 3). Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице — ПАМЯТКЕ | 2H+ + SO42- + Ba2+ + 2Cl— = BaSO4 ↓+ 2H+ + 2Cl— Полный ионный вид |
| 4). Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции. Помните! РИО необратима и практически осуществима, если в
| SO42- + Ba2+ + = BaSO4 ↓ Краткий ионный вид Вывод – данная реакция необратима, т. |
1.
Составим уравнение реакции между гидроксидом
железа (III) и азотной кислотой.
Fe(OH)3 +
3HNO3 = Fe(NO3)3 + 3H2O
Запишем данное
уравнение в ионной форме:
(Гидроксид
железа (III) является нерастворимым снованием, поэтому не подвергается электролитической диссоциации. Вода – малодиссоциируемое вещество, на
ионы в растворе практически недиссоциировано.)
Fe(OH)3 + 3H+ + 3NO3— = Fe3+ + 3NO3— + 3H2O
Зачеркнем
одинаковое количество нитрат-анионов слева и справа, запишем сокращенное
ионное уравнение:
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Данная реакция
протекает до конца, т.к. образуется малодиссоциируемое вещество
– вода.
_____________________________________________________________
2.
Составим уравнение реакции между карбонатом
натрия и нитратом магния.
Na2CO3 + Mg(NO3)2 = 2NaNO3 + MgCO3↓
Запишем
данное уравнение в ионной форме:
(Карбонат
магния является нерастворимым в воде веществом, следовательно, на
ионы не распадается.)
2Na+ +
CO32-+ Mg2+ +
2NO3— = 2Na+ + 2NO3— + MgCO3↓
Зачеркнем
одинаковое количество нитрат-анионов и катионов натрия слева и
справа, запишем сокращенное ионное уравнение:
Данная реакция
протекает до конца, т.к. образуется осадок – карбонат магния.
_____________________________________________________________
3.
Составим уравнение реакции между карбонатом
натрия и азотной кислотой.
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 ↑+ H2O
(Углекислый
газ и вода – продукты разложения образующейся слабой угольной кислоты.)
2Na+ +
CO32- + 2H+ + 2NO3— = 2Na+ + 2NO3—+ CO2↑
+ H2O
CO32- + 2H+ = CO2↑ + H2O
Данная реакция
протекает до конца, т.к. в результате нее выделяется газ и образуется
вода.
_____________________________________________________________
а) Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O
Cокращенное ионное уравнение реакции:
H+ + OH– = H2O
б) Молекулярное уравнение реакции основного оксида с кислотой:
CaO (оксид) + 2HNO3 (р) =
Ca(NO3)2 (р) + H2O
(мд)
Полное ионное уравнение реакции:
CaO + 2H+ + 2NO3— = Ca2+ + 2NO3— + H2O
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca2+ + H2O.
в) Молекулярное уравнение реакции
нерастворимого основания с кислотой:
3Mg(OH)2 (н) + 2H3PO4 (р) = Mg3(PO4)2↓ + 6H2O (мд)
Полное ионное уравнение реакции:
3Mg(OH)2 + 6H+ + 2PO43- = Mg3(PO4)2↓ + 6H2O
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Определите, может ли осуществляться взаимодействие между растворами
следующих веществ, записать реакции в молекулярном, полном, кратком ионном
виде:
гидроксид калия и хлорид аммония.
2. Дана схема:
2H+ + CO32- = H2O + CO2↑
Подберите вещества, взаимодействие между которыми в водных растворах
выражается следующими сокращёнными уравнениями. Составьте соответствующие
Составьте соответствующие
молекулярное и полное ионное уравнения.
3. Запишите реакцию обмена между
оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном
виде.
4. Составьте уравнение реакции ионного
обмена карбоната натрия с
серной кислотой в
молекулярном, полном и кратком ионном виде.
5. Закончите уравнения реакций в
молекулярном, полном и кратком ионном виде:
ZnF2 + Ca(OH)2 ->
K2S + H3PO4 ->
При выполнении задания используйте таблицу
растворимости веществ в воде. Помните об исключениях!
6. Составьте уравнение реакции ионного
обмена хлорида бария с сульфатом
магния в молекулярном, полном
и кратком ионном виде.
7. Закончите уравнения реакций в
молекулярном, полном и кратком ионном виде:
Hg(NO3)2 + Na2S ->
K2SO3 + HCl ->
При выполнении задания используйте таблицу
растворимости веществ в воде. Помните об исключениях!
Помните об исключениях!
8.
Напишите
полные и сокращенные ионные уравнения следующих реакций:
9. Составьте молекулярные и ионные уравнения реакций
между растворами веществ:
Какие
реакции обратимы? Какие необратимы?
10. Напишите полные
и сокращенные ионные уравнения реакций между попарно сливаемыми растворами
солей:
В
каких случаях образуется осадок?
1. | |
г)Fe(NO3)2 и Al(OH)3 | |
2. | |
а)NaOH и Mg(NO3)2 | |
3. | |
4. | |
в) H2SO4 и Ba(OH)2 | |
5. | |
в) Ва2+ и | |
6. | |
г) Ba2+ и CO32- | |
7. | |
8. | |
9. | |
10. | |
Растворы электролитов.
 Ионно–молекулярные уравнения
Ионно–молекулярные уравнения
Электролиты
При растворении в воде некоторые вещества имеют способность проводить электрический ток.
Те соединения, водные растворы которых способны проводить электрический ток называются электролитами.
Электролиты проводят ток за счет так называемой ионной проводимости, которой обладают многие соединения с ионным строением (соли, кислоты, основания).
Вещества, имеющие сильнополярные связи, но в растворе при этом подвергаются неполной ионизации (например, хлорид ртути II) являются слабыми электролитами.
Многие органические соединения (углеводы, спирты), растворенные воде, не распадаются на ионы, а сохраняют свое молекулярное строение. Такие вещества электрический ток не проводят и называются неэлектролитами.
Приведем некоторые закономерности, руководствуясь которыми можно определить относятся вещества к сильным или слабым электролитам:
- Кислоты.
 К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами.
К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами. - Основания. Наиболее распространенные сильные основания – гидроксиды щелочных и щелочноземельных металлов (исключая Be) относятся к сильным электролитам. Слабый электролит – NH3.
- Соли. Большинство распространенных солей – ионных соединений — сильные электролиты. Исключения составляют, в основном, соли тяжелых металлов.
Теория электролитической диссоциации
Электролиты, как сильные, так и слабые и даже очень сильно разбавленные не подчиняются закону Рауля и принципу Вант-Гоффа.
Имея способность к электропроводности, значения давления пара растворителя и температуры плавления растворов электролитов будут более низкими, а температуры кипения более высокими по сравнению с аналогичными значениями чистого растворителя. В 1887 г С. Аррениус, изучая эти отклонения, пришел к созданию теории электролитической диссоциации.
В 1887 г С. Аррениус, изучая эти отклонения, пришел к созданию теории электролитической диссоциации.
Электролитическая диссоциация предполагает, что молекулы электролита в растворе распадаются на положительно и отрицательно заряженные ионы, которые названы соответственно катионами и анионами.
Сущность теории электролитической диссоциации
- В растворах электролиты распадаются на ионы, т.е. диссоциируют. Чем более разбавлен раствор электролита, тем больше его степень диссоциации.
- Диссоциация — явление обратимое и равновесное.
- Молекулы растворителя бесконечно слабо взаимодействуют (т.е. растворы близки к идеальным).
Степень диссоциации электролита зависит от:
- природы самого электролита
- природы растворителя
- концентрации электролита
- температуры.
Степень диссоциации
Степень диссоциации α, показывает какое число молекул n распалось на ионы, по сравнению с общим числом растворенных молекул N:
α = n/N
- Степень диссоциации равна 0 α = 0 означает, что диссоциация отсутствует.

- При полной диссоциации электролита степень диссоциации равна 1 α = 1.
С точки зрения степени диссоциации, по силе электролиты делятся на:
- сильные (α > 0,7),
- средней силы ( 0,3 > α > 0,7),
- слабые (α < 0,3 ).
Константа диссоциации
Более точно процесс диссоциации электролита характеризует константа диссоциации, не зависящая от концентрации раствора. Если представить процесс диссоциации электролита в общем виде:
Aa Bb ↔ aA— + bB+
K = [A—]a·[B+]b/[Aa Bb]
Для слабых электролитов концентрация каждого иона равна произведению степени диссоциации α на общую концентрацию электролита С.
Таким образом, выражение для константы диссоциации можно преобразовать:
K = α2C/(1-α)
Для разбавленных растворов (1-α) =1, тогда
K = α2C
Отсюда нетрудно найти степень диссоциации
α = (K/C)1/2
Ионно–молекулярные уравнения
Как составить полное и сокращенное ионные уравнения
Рассмотрим несколько примеров реакций, для которых составим молекулярное, полное и сокращенное ионное уравнения.
1) Пример нейтрализации сильной кислоты сильным основанием
1. Процесс представлен в виде молекулярного уравнения.
HCl + NaOH = NaCl + HOH
2. Представим процесс в виде полного ионного уравнения. Т.е. запишем в ионном виде все соединения — электролиты, которые в растворе полностью ионизированы.
H+ + Cl— +Na+ + OH— = Na+ + Cl— + HOH
3. После «сокращения» одинаковых ионов в левой и правой частях уравнения получаем сокращенное ионное уравнение:
После «сокращения» одинаковых ионов в левой и правой частях уравнения получаем сокращенное ионное уравнение:
H+ + OH— = HOH
Мы видим, что процесс нейтрализации сводится к соединению H+ и OH— и образованию воды.
При составлении ионных уравнений следует помнить, что в ионном виде записываются только сильные электролиты. Слабые электролиты, твердые вещества и газы записываются в их молекулярном виде.
2) Пример реакции осаждения
Смешаем водные растворы AgNO3 и HI:
| Молекулярное уравнение | AgNO3 + HI →AgI↓ + HNO3 |
| Полное ионное уравнение | Ag+ + NO3— + H+ + I— →AgI↓ + H+ + NO3— |
| Сокращенное ионное уравнение | Ag+ + I— →AgI↓ |
Процесс осаждения сводится к взаимодействию только Ag+ и I— и образованию нерастворимого в воде AgI.
Чтобы узнать способно ли интересующее нас вещество растворяться в воде, необходимо воспользоваться таблицей растворимости кислот, солей и оснований в воде. В приведенной таблице также указан цвет образуемого осадка, сила кислот и оснований и способность анионов к гидролизу.
Пример образования летучего соединения
Рассмотрим третий тип реакций, в результате которой образуется летучее соединение. Это реакции взаимодействия карбонатов, сульфитов или сульфидов с кислотами. Например,
| Молекулярное уравнение | Na2SO3 + 2HI → 2NaI + SO2↑ + H2O |
| Полное ионное уравнение | 2Na+ + SO32- + 2H+ + 2I— → 2Na+ + 2I— + SO2↑ + H2O |
| Сокращенное ионное уравнение | SO32- + 2H+ → SO2↑ + H2O |
Отсутствие взаимодействия между растворами веществ
При смешении некоторых растворов ионных соединений, взаимодействия между ними может и не происходить, например
| Молекулярное уравнение | CaCl2 + 2NaI = 2NaCl +CaI2 |
| Полное ионное уравнение | Ca2+ + Cl— + 2Na+ + I— = 2Na+ + Cl— + Ca2++ 2I— |
| Сокращенное ионное уравнение | отсутствует |
Условия протекания реакции (химического превращения)
Итак, подводя итог, отметим, что химические превращения наблюдаются в случаях, если соблюдается одно из следующих условий:
- Образование неэлектролита.
 В качестве неэлектролита может выступать вода.
В качестве неэлектролита может выступать вода. - Образование осадка.
- Выделение газа.
- Образование слабого электролита, например уксусной кислоты.
- Перенос одного или нескольких электронов. Это реализуется в окислительно – восстановительных реакциях.
- Образование или разрыв одной или нескольких ковалентных связей.
Больше примеров приведено в разделе Задачи к разделу растворы электролитов
Также для тренировки, рекомендуем пройти тест Задания 14. Электролиты и неэлектролиты. Катионы и анионы
Молекулярные и ионные уравнения | Химия для неосновных специалистов
Цели обучения
- Определите молекулярные и ионные уравнения.
- Приведите примеры молекулярных и ионных уравнений.
«Немного дождя…»
Один из неприятных побочных продуктов нашего индустриального общества — кислотные дожди. Двуокись серы при сжигании угля и оксиды азота из выхлопных газов автомобилей образуют кислоты. Когда эти кислоты вступают в реакцию с известняком (карбонатом кальция), происходят реакции, которые растворяют известняк и выделяют воду и углекислый газ.Со временем конструкциям наносится серьезный ущерб.
Когда эти кислоты вступают в реакцию с известняком (карбонатом кальция), происходят реакции, которые растворяют известняк и выделяют воду и углекислый газ.Со временем конструкциям наносится серьезный ущерб.
Молекулярные и ионные уравнения
Когда ионные соединения растворяются в воде, полярные молекулы воды разрушают твердую кристаллическую решетку, в результате чего гидратированные ионы равномерно распределяются в воде. Этот процесс называется диссоциацией и является причиной того, что все ионные соединения являются сильными электролитами. Когда два разных ионных соединения, растворенных в воде, смешиваются, между определенными парами гидратированных ионов может происходить химическая реакция.
Рассмотрим реакцию двойного замещения, которая происходит при смешивании раствора хлорида натрия с раствором нитрата серебра.
Движущей силой этой реакции является образование осадка хлорида серебра.
Рис. 1. Белый осадок хлорида серебра мгновенно образуется при добавлении раствора нитрата серебра к раствору хлорида натрия.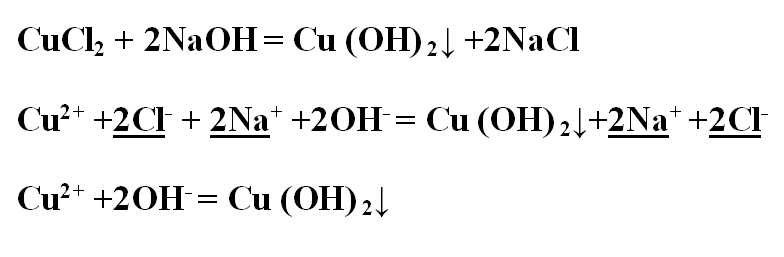 Изображение из Викимедиа.
Изображение из Викимедиа.
Это называется молекулярным уравнением. Молекулярное уравнение — это уравнение, в котором формулы соединений записаны так, как будто все вещества существуют в виде молекул.Однако есть лучший способ показать, что происходит в этой реакции. Все водные соединения должны быть записаны как ионы, потому что они присутствуют в воде как разделенные ионы из-за их диссоциации.
Это уравнение называется ионным уравнением , уравнением, в котором растворенные ионные соединения показаны как свободные ионы.
Некоторые другие реакции двойного замещения не приводят к образованию осадка в качестве одного из продуктов. Образование газа и / или молекулярного соединения, такого как вода, также может стимулировать реакцию.Например, рассмотрим реакцию раствора карбоната натрия с раствором соляной кислоты (HCl). Продуктами реакции являются водный раствор хлорида натрия, диоксид углерода и вода. Сбалансированное молекулярное уравнение:
Ионное уравнение:
Реакция однократного замещения — это реакция, в которой элемент заменяет другой элемент в соединении. Элемент находится в твердом, жидком или газообразном состоянии и не является ионом. В приведенном ниже примере показана реакция твердого металлического магния с водным раствором нитрата серебра с образованием водного раствора нитрата магния и металлического серебра.
Элемент находится в твердом, жидком или газообразном состоянии и не является ионом. В приведенном ниже примере показана реакция твердого металлического магния с водным раствором нитрата серебра с образованием водного раствора нитрата магния и металлического серебра.
Сбалансированное молекулярное уравнение:
Ионное уравнение:
Этот тип реакции однократного замещения называется замещением металла. Другими распространенными категориями реакций однократного замещения являются замещение водорода и замещение галогена.
Сводка
- Показаны примеры молекулярных и ионных уравнений.
Практика
Прочтите материал по ссылке ниже и решите практические уравнения:
www.Chemteam.info/Equations/DoubleReplacement.html
Обзор
- Что обозначают строчные буквы после соединений?
- Почему важно отображать состояние каждого соединения?
- Что говорят нам ионные уравнения?
Глоссарий
- ионное уравнение: Уравнение, в котором растворенные ионные соединения показаны как свободные ионы.

- молекулярное уравнение: Уравнение, в котором формулы соединений записаны так, как будто все вещества существуют в виде молекул.
Молекулярные, ионные и полные ионные уравнения
Цель обучения
- Определите, записано ли химическое уравнение в молекулярной, ионной или полной ионной форме.
Ключевые моменты
- Химические реакции, протекающие через ионные формы, можно описать разными способами.
- Молекулярные уравнения показывают реагирующие вещества в виде их молекулярной формулы с добавленными нижними индексами, чтобы указать их твердую, жидкую, газообразную или водную природу.
- Ионные уравнения показывают реагирующие частицы как их ионные компоненты. Для описания состояния вещества индексы не нужны, потому что все ионы находятся в водном растворе. Чистое ионное уравнение — это уравнение, в котором ионы-наблюдатели удалены.
- Ионы Spectator присутствуют в растворе, но не участвуют в реальной реакции осаждения.

Условия
- соль — ионное соединение, состоящее из катионов и анионов. Составляющие ионы удерживаются вместе ионными, а не ковалентными связями
- электролит: вещество, которое при растворении в растворе позволяет раствору проводить электричество.
- спектатор ионан-ион, который присутствует в растворе, но не участвует в реакции осаждения
.
Молекулярное уравнение
Существуют различные способы записи реакций осаждения.В молекулярном уравнении электролиты записываются как соли, за которыми следует ( aq ), чтобы указать, что электролиты полностью диссоциированы на составляющие их ионы; обозначение ( водн. ) указывает на то, что ионы находятся в водном растворе . Например, реакцию водного раствора хлорида кальция с водным раствором нитрата серебра можно записать следующим образом:
[латекс] CaCl_ {2} (водный) + 2 AgNO_ {3} (водный) \ rightleftharpoons Ca (NO_ {3}) _ {2} (водный) + 2 AgCl (s) [/ латекс]
В правой части уравнения осадитель (AgCl) записан в его полной формуле и обозначен как твердое вещество, поскольку это осадок, который образуется в результате реакции. {-} [/ latex] и ионы остаются в растворе и не участвуют в реакции. Их называют ионами-наблюдателями, потому что они не принимают непосредственного участия в реакции; скорее, они существуют с одинаковой степенью окисления как на стороне реагента, так и на стороне продукта химического уравнения. Они нужны только для баланса заряда исходных реагентов.
{-} [/ latex] и ионы остаются в растворе и не участвуют в реакции. Их называют ионами-наблюдателями, потому что они не принимают непосредственного участия в реакции; скорее, они существуют с одинаковой степенью окисления как на стороне реагента, так и на стороне продукта химического уравнения. Они нужны только для баланса заряда исходных реагентов.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
16.18: Net Ionic Equations — Chemistry LibreTexts
На спортивных мероприятиях по всему миру мы можем наблюдать, как небольшое количество спортсменов яростно соревнуются на поле. Они устают, пачкаются и иногда получают травму, пытаясь выиграть игру. Вокруг них смотрят и аплодируют тысячи зрителей. Была бы игра без зрителей? Да, определенно будет. Они воодушевляют команду и вызывают энтузиазм. Зрители на самом деле не играют в игру, но они, безусловно, являются частью процесса. -} \ left (aq \ right) \ rightarrow \ ce {AgCl} \ left (s \ right) \]
-} \ left (aq \ right) \ rightarrow \ ce {AgCl} \ left (s \ right) \]
Чистое ионное уравнение — это химическое уравнение, которое показывает только те элементы, соединения и ионы, которые непосредственно участвуют в химической реакции. Обратите внимание, что при написании чистого ионного уравнения положительно заряженный катион серебра был записан сначала на стороне реагента, а затем отрицательно заряженный хлорид-анион. Это несколько обычное дело, потому что именно в таком порядке ионы должны быть записаны в продукте хлорида серебра.Однако заказывать реагенты таким образом не обязательно.
Чистые ионные уравнения должны быть сбалансированы как массой, так и зарядом. Балансировка по массе означает обеспечение равного количества каждого элемента. Балансировка по заряду означает обеспечение того, чтобы общий заряд был одинаковым для обеих сторон уравнения. В приведенном выше уравнении общий заряд равен нулю или нейтрален по обе стороны уравнения. Как правило, если вы правильно уравновесите молекулярное уравнение, итоговое ионное уравнение будет уравновешено как массой, так и зарядом.
Пример \ (\ PageIndex {1} \)
При смешивании водных растворов хлорида меди (II) и фосфата калия образуется осадок фосфата меди (II). Напишите сбалансированное чистое ионное уравнение этой реакции.
Решение
Шаг 1. Спланируйте проблему.
Сначала напишите и сбалансируйте молекулярное уравнение, убедившись, что все формулы верны. Затем напишите ионное уравнение, указав все водные вещества в виде ионов.{3-}} \ left (aq \ right) \ rightarrow \ ce {Cu_3 (PO_4) _2} \ left (s \ right) \]
Шаг 3. Подумайте о своем результате.
Для реакции осаждения чистое ионное уравнение всегда показывает два иона, которые объединяются, чтобы сформировать осадок. Уравнение сбалансировано массой и зарядом.
Complete Molecular, Complete Ionic и Net Ionic
ChemTeam: Уравнения: Complete Molecular, Complete Ionic и Net Ionic
Уравнения: полные молекулярные, полные ионные и чистые ионные
Как писать ионные уравнения — обширное обсуждение этой темы. В нем много полезной информации, изложенной в другой последовательности, чем я делаю ниже. Если вы пойдете туда, убедитесь, что вы игнорируете стиль конца 1990-х годов и сосредотачиваетесь на информации.
В нем много полезной информации, изложенной в другой последовательности, чем я делаю ниже. Если вы пойдете туда, убедитесь, что вы игнорируете стиль конца 1990-х годов и сосредотачиваетесь на информации.
I. Полные молекулярные уравнения
Эти уравнения также могут называться «уравнениями полных формул», «уравнениями полных формул» или просто «уравнениями формул». Стандартного названия нет. За годы работы в химии я видел два одноразовых названия того, что я называю полным молекулярным уравнением.Это (а) «эмпирическое уравнение» и (б) «неионное уравнение».
Вы должны знать их все (даже единичные), потому что вы никогда не знаете, что может использовать конкретный учитель / учебник. Или, возможно, будущий партнер по лаборатории, который научился этому одним способом, а вы — другим.
Уравнение этого типа показывает полную формулу для каждого задействованного вещества (или полное название каждого вещества) без ссылки на то, является ли вещество ионным или молекулярным. Часто задачи такого типа начинаются с словесного уравнения.Вот два примера:
Часто задачи такого типа начинаются с словесного уравнения.Вот два примера:
Раствор хлорида бария реагирует с раствором сульфата натрия с образованием твердого сульфата бария и водного раствора хлорида натрия.
Реакция взаимодействия водных растворов соляной кислоты и гидроксида натрия с образованием хлорида натрия и воды
Формулировки в задачах, подобных приведенной выше, могут несколько отличаться. Слово «водный» может использоваться так же, как «осадок». Иногда в качестве реагентов используется водный раствор, но предполагается, что для продуктов. Иногда водный раствор никогда не используется, и автор вопроса просто предполагает, что вы знаете, что все происходит в водном растворе.Не существует стандартного способа составить химическое уравнение, используя названия веществ. (Однако при использовании формул используемые примеры, как правило, выполняются в похожем стиле во всем мире.)
Я начал с имен для полных молекулярных уравнений, потому что ваш первый ответ в данной задаче часто состоит в том, чтобы перевести имена в полное уравнение молекулярного уравнения. Это означает, что вы должны уметь (1) написать правильные химические формулы из имен и (2) сбалансировать химические уравнения.
Это означает, что вы должны уметь (1) написать правильные химические формулы из имен и (2) сбалансировать химические уравнения.
Вот слова уравнения выше, повторенные с использованием формул:
BaCl 2 (водн.) + Na 2 SO 4 (водн.) —> BaSO 4 (s) + 2NaCl (водн.)
HCl (водн.) + NaOH (водн.) —> NaCl (водн.) + H 2 O (ℓ)
Только полные формулы (никогда слова или ионы) входят в полное молекулярное уравнение. Ионы (никогда не слова) будут использоваться для полного ионного уравнения и чистого ионного уравнения, которое будет следовать чуть ниже. Вы можете использовать слова для ионного уравнения (полное или чистое), но обычно этого не делают.
Я решил использовать «ℓ» для обозначения жидкого состояния, в отличие от более распространенного «l». Имейте в виду, что «ℓ» и «aq» означают разные вещи.
II. Полные ионные уравнения
Слово «общее» также может использоваться, например, как «полное ионное уравнение» или даже просто «полное уравнение». Для этого типа уравнения нет стандартного термина.
Для этого типа уравнения нет стандартного термина.
Чтобы преобразовать полное молекулярное уравнение в полное ионное уравнение, вам необходимо знать разницу между ионным соединением и молекулярным соединением.Основы следующие:
Ионные соединения находятся между металлами и неметаллами или между металлами и многоатомными ионами. Примерами являются хлорид натрия (NaCl), нитрат магния [Mg (NO 3 ) 2 ] и сульфат аммония [(NH 4 ) 2 SO 4 ]. Когда ионное вещество растворяется в водном растворе, оно ВСЕГДА ионизируется, и ионы всегда имеют заряд. Не забывайте никогда не расщеплять многоатомный ион.
Иногда студент задается вопросом, является ли соединение между двумя полиатомами, скажем, NH 4 NO 3 , ионным веществом.Да, это. Он имеет ионную связь между двумя полиатомами и, таким образом, квалифицируется как ионное вещество. Он ионизируется в NH 4 + и NO 3 ¯.
В молекулярных соединениях присутствуют только неметаллы. Примеры включают триоксид серы (SO 3 ), диоксид углерода (CO 2 ), воду (H 2 O) и глюкозу (C 6 H 12 O 6 ). Молекулярные вещества никогда не ионизируются в растворе, они существуют как полные молекулы и НИКОГДА не имеют заряда.Кстати, молекулярные соединения еще называют ковалентными соединениями. Все связи в молекулах, подобных приведенным выше примерам, ковалентны. В ковалентном соединении не существует ни одной ионной связи.
Следующее, что вам нужно знать:
нерастворимые ионные вещества всегда записываются в виде полной формулы, а не в виде ионов
Это требует небольшого пояснения. Прежде всего, небольшое количество нерастворимого вещества растворяется и ионизируется. Однако, если это не ясно из контекста, вы всегда игнорируете крошечное количество, которое растворяется (и ионизируется). По умолчанию вы выбираете нерастворимое ионное соединение в виде полной формулы, а не в виде ионов. Вы можете подумать, что это немного странно, но имейте в виду, что почти все нерастворимое вещество никогда не растворяется, поэтому у него никогда не будет возможности ионизироваться. Считается, что ионное вещество распадается на отдельные ионы только тогда, когда оно находится в водном растворе.
По умолчанию вы выбираете нерастворимое ионное соединение в виде полной формулы, а не в виде ионов. Вы можете подумать, что это немного странно, но имейте в виду, что почти все нерастворимое вещество никогда не растворяется, поэтому у него никогда не будет возможности ионизироваться. Считается, что ионное вещество распадается на отдельные ионы только тогда, когда оно находится в водном растворе.
Я только что сослался на контекст. Чтобы проиллюстрировать это, рассмотрим следующее:
Мг (ОН) 2 (водн.)
Гидроксид магния нерастворим, но государственный символ указывает на то, что он растворяется.Что вы делаете, так это игнорируете концепцию нерастворимости и рассматриваете только крошечное количество гидроксида магния, которое действительно растворяется. Поскольку он ионный, он ионизируется на 100%, и это можно записать в ионном уравнении:
Mg 2+ (водн.) + 2OH¯ (водн.)
Чтобы знать, какие вещества растворимы, а какие нерастворимы, вы должны знать свою диаграмму растворимости. Многие из них доступны в Интернете.
Многие из них доступны в Интернете.
Последний пункт, о котором я упомяну, это:
слабые кислоты и основания всегда записаны молекулярным способом, никогда не ионным
Вот пример:
HF (водн.) + NaOH (водн.) —> NaF (водн.) + H 2 O ()
Вышеупомянутое записано как полное молекулярное уравнение.Теперь полное ионное уравнение:
HF (водн.) + Na + (водн.) + OH¯ (водн.) —> Na + (водн.) + F¯ (водн.) + H 2 O ()
Обратите внимание, что HF, слабая кислота, не показана ионизированной, как NaOH и NaF. Теперь для чистого ионного:
HF (водн.) + OH¯ (водн.) —> F¯ (водн.) + H 2 O (ℓ)
Сравните это с чистым ионным уравнением, которое получится в результате реакции HCl (сильной кислоты) и NaOH, как показано ниже.
Есть списки сильных кислот и сильных оснований. Вот один. многие другие доступны в Интернете.
Вот один. многие другие доступны в Интернете.
Кислоты и основания, не указанные в списке, считаются слабыми. Все слабые вещества записываются как полные неионизированные молекулы.
И, конечно, всегда есть исключения. Mg (OH) 2 нерастворим, поэтому с ним используются символы состояния. Однако, если используется (водный), как я обсуждал выше, мы считаем, что он ионизируется на 100%, потому что это ионное вещество. Любое количество ионного вещества в растворе ионизируется на 100%.Поскольку Mg (OH) 2 нерастворим, он обычно не появляется в списке сильных оснований.
Выше, в разделе I, были два полных молекулярных уравнения. Чуть ниже я записал полные ионные уравнения:
Ba 2+ (водн.) + 2Cl¯ (водн.) + 2Na + (водн.) + SO 4 2 ¯ (водн.) —> BaSO 4 (s) + 2Na + (водн.) + 2Cl¯ (водн.)
H + (водн.) + Cl¯ (водн.) + Na + (водн.
) + OH¯ (водн.) —> Na + (водн.) + Cl¯ (водн.) + H 2 О (ℓ)
Обратите внимание, что сульфат бария — нерастворимое вещество, а вода — молекулярное вещество.
Иногда слово «полный» удаляется, и текст (или учитель) предполагает, что вы знаете, что «ионное уравнение» — это НЕ то же самое, что «чистое ионное уравнение». Лучше всего предположить, что «полное ионное уравнение» — это то, что подразумевается под «ионным уравнением». Другими словами, слово «сеть» всегда включается, когда подразумевается определение «чистого ионного уравнения».
Вот пример ошибки, которую иногда допускают студенты:
Ba 2+ (водн.) + Cl¯ (водн.) + Na + (водн.) + SO 4 2 ¯ (водн.) —> BaSO 4 (s) + Na + (водн.) + Cl¯ (водн.)
Ошибка состоит в том, что при написании полного ионного уравнения из молекулярного уравнения не отображаются правильные коэффициенты. Например, когда BaCl 2 ионизируется, он образует в растворе один ион бария и два иона хлорида, а не по одному каждому.
Например, когда BaCl 2 ионизируется, он образует в растворе один ион бария и два иона хлорида, а не по одному каждому.
Вот еще пример:
Исходное молекулярное уравнение было:
Sr (NO 3 ) 2 (вод.) + K 2 CO 3 (вод.) —> SrCO 3 (s) + 2KNO 3 (вод.)
Полное ионное уравнение, которое написал студент, было:
Sr 2+ (вод.) + NO 3 ¯ (вод.) + K + (вод.) + CO 3 2 ¯ (вод.) —> SrCO 3 (с) + K + (водн.) + NO 3 ¯ (водн.)
В ответе учащегося не хватает 2 перед каждым нитратом, а также перед каждым ионом калия.
III. Зритель Ион
Ион-зритель — важная идея. Вот определение:
ионы-зрители присутствуют на стороне реагента и на стороне продукта в точно такой же форме
В обоих приведенных выше примерах уравнений ион натрия и ион хлорида являются ионами-наблюдателями.
Вот почему так важно идентифицировать ионы-наблюдатели:
, чтобы перейти от полного ионного уравнения к чистому ионному уравнению, все ионы-наблюдатели исключаются из уравнения
Проблема, с которой сталкиваются студенты, заключается в том, что способность идентифицировать ионы-зрители связана со знанием (1) того, как писать правильные формулы, (2) того, как ионные вещества ионизируются в растворе и (3) какие вещества растворимы, а какие нерастворимы.
Это может быть проблемой, потому что нужно знать много разных битов информации, прежде чем можно будет ответить на типы вопросов, которые являются предметом этого руководства. Кроме того, некоторые вещи, которые вам нужно знать, начинают преподавать после изучения этой области. Милый!
IV. Чистые ионные уравнения
Используя два моих примера уравнений, когда мы вычеркиваем ионы-наблюдатели, мы получаем следующие чистые ионные уравнения:
Ba 2+ (водн.
) + SO 4 2 ¯ (водн.) —> BaSO 4 (т)
H + (водн.) + OH¯ (водн.) —> H 2 O (900)
Помните, в чистом ионном уравнении все ионы-наблюдатели полностью удалены.По сути, они не считаются частью реакции.
В. Нет реакции
Ситуация «отсутствия реакции» возникает, когда все продукты растворимы и ионизируются в растворе, как и реагенты.
Взгляните на эту молекулярную реакцию:
CaCl 2 + Mg (NO 3 ) 2 —> Ca (NO 3 ) 2 + MgCl 2
Реагенты растворимы и ионизируются в растворе, что дает это в левой части полного ионного уравнения:
Ca 2+ (водн.) + 2Cl¯ (водн.) + Mg 2+ (водн.) + 2NO 3 ¯ (водн.) —>
Продукты растворимы и ионизируются в растворе, что дает это в правой части полного ионного уравнения:
—> Ca 2+ (водн.
) + 2NO 3 ¯ (водн.) + Mg 2+ (водн.) + 2Cl¯ (водн.)
Сложите их вместе:
Ca 2+ (водн.) + 2Cl¯ (водн.) + Mg 2+ (водн.) + 2NO 3 ¯ (водн.) —> Ca 2+ (водн.) + 2NO 3 ¯ (водн.) + Mg 2+ (водн.) + 2Cl¯ (водн.)
Все на левой стороне точно так же, как все на правой стороне.Следуя правилу, которое гласит, что нужно исключить все ионы-наблюдатели, мы получаем это для чистого ионного уравнения:
—>
Другими словами, нет никакого чистого ионного уравнения. Это называется «нет реакции» и часто обозначается так: NR.
Предупреждение: учителя любят предоставлять всю информацию о том, как составить чистые ионные уравнения, и никогда не упоминают о существовании NR. Тогда, как и следовало ожидать, на тесте «нет реакции».
Вот вопрос NR, заданный студентом:
Как написать чистое ионное уравнение для бромида бария и соляной кислоты?
BaBr 2 (водн.
) + 2HCl (водн.) —> BaCl 2 (водн.) + 2HBr (водн.)
Студент говорит: «Я не уверен, правильно ли я выполнил полное ионное уравнение, потому что все они сокращаются.»
Ba 2+ (водный) + 2Br¯ (водный) + 2H + (водный) + 2Cl¯ (водный) —> Ba 2+ (водный) + 2Cl¯ (водный) + 2H + (водн.) + 2Br¯ (водн.)
Полное ионное уравнение верно. Студент был сбит с толку идеей, что все отменяется, поведение, которое является отличительной чертой NR.
Другой способ задать вопрос NR:
Какие продукты образуются, когда Al 2 (SO 4 ) 3 и NH 4 Cl реагируют в водном растворе?
Ответ — NR, потому что продукты (1) растворимы и (2) на 100% ионизируются.Оба эти момента относятся к реагентам. Таким образом, все четыре иона (алюминий, сульфат, аммоний, хлорид) остаются в растворе и остаются неизменными. Если бы мы написали сбалансированное полное ионное уравнение, мы бы увидели следующее:
Если бы мы написали сбалансированное полное ионное уравнение, мы бы увидели следующее:
2Al 3+ (водный) + 3SO 4 2 ¯ (водный) + 6NH 4 + (водный) + 6Cl¯ (водный) —> 2Al 3+ (водный ) + 6Cl¯ (водн.) + 6NH 4 + (водн.) + 3SO 4 2 ¯ (водн.)
Так как с обеих сторон все абсолютно одинаково, то это НР.
Другой пример NR:
ZnCl 2 (водн.) + 2NaBr (водн.) —> ZnBr 2 (водн.) + 2NaCl (водн.)
Все четыре соединения очень растворимы, и все четыре являются ионными, ионизирующими на 100% в растворе. Нет никакого чистого ионного уравнения, потому что нет реакции (все четыре иона абсолютно одинаковы с каждой стороны, все они вычеркнуты как ионы-наблюдатели). Часто NR используется для обозначения отсутствия реакции.
Вы найдете дополнительные примеры NR в 13, 23, 28 и 44 в моих наборах задач. В №44 есть несколько примеров. А еще интересный дом №46. И еще один на 47-м.
В №44 есть несколько примеров. А еще интересный дом №46. И еще один на 47-м.
Я собрал все свои примеры NR в один файл. Это здесь.
Другой пример NR:
Водные растворы нитрата марганца (II) и бромида железа (II) объединяют. Что такое чистое ионное уравнение?
Это пример, когда ученику дают представление о существовании чистого ионного уравнения, поэтому они лихорадочно ищут его. В этом примере «продукты» растворимы и ионизируются на 100%, как и «реагенты».»Это NR, ребята!
И еще один НР:
Каковы общие ионные и чистые ионные уравнения для ацетата меди (II) и хлорида кальция?
Cu 2+ (водный) + 2Ch4COO¯ (водный) + Ca 2+ (водный) + 2Cl¯ (водный) —> Cu 2+ (водный) + 2Cl¯ (водный) + Ca 2+ (водн.) + 2Ch4COO¯ (водн.)
Это общий ионный. Нет чистого ионного.
И еще один НР:
Напишите сбалансированное чистое ионное уравнение для HCl (водн.
), Реагирующего с H 2 SO 4 (водн.)
Проблема в том, что эти два соединения (оба кислоты) не вступают в реакцию.Однако обратите внимание на формулировку вопроса, подразумевающую, что два соединения действительно реагируют. Автор вопросов вам врет !!!
Еще один пример (не NR), затем несколько заключительных комментариев:
Напишите полные молекулярные, полные ионные и чистые ионные уравнения для этой реакции:
растворы хлорида натрия и нитрата серебра реагируют с образованием осадка хлорида серебра и водного раствора нитрата натрия
Ответ:
полная молекула: NaCl (водн.) + AgNO 3 (водн.) —> AgCl (s) + NaNO 3 (водн.)
Вы знаете, что AgCl нерастворим, по графику растворимости.
полный ионный: Na + (водн.) + Cl ¯ (водн.) + Ag + (водн.) + NO 3 ¯ (водн.) —> AgCl (s) + Na + (водн.
) + NO 3 ¯ (водн.)
В этом примере ион натрия и ион нитрата являются ионами-наблюдателями. Они встречаются по обе стороны стрелки в абсолютно одинаковой форме.
чистый ионный: Ag + (водн.) + Cl¯ (водн.) —> AgCl (s)
Старый школьный метод обозначения осадка заключается в использовании стрелки, направленной вниз:
чистый ионный: Ag + (водн.) + Cl¯ (водн.) —> AgCl ↓
Стрелка, направленная вверх, указывает на образование газа.Например, газообразный водород будет иметь вид H 2 ↑, а не H 2 (г).
VI. Последние комментарии
Есть три основных (и одна второстепенная) области, в которых используются чистые ионные уравнения. Основное применение — это восстановительное окисление (сокращенное название — окислительно-восстановительный потенциал). У меня есть целый раздел о окислительно-восстановительном потенциале (и он, вероятно, будет рассмотрен позже в вашем курсе). Некоторые из уравнений, которые я буду использовать ниже, являются уравнениями окислительно-восстановительного потенциала, но они не будут идентифицированы как таковые.Уравнения, которые я использую, будут довольно простыми, их можно будет сбалансировать визуально, и для них не потребуются методы, описанные в разделе окислительно-восстановительного потенциала.
Некоторые из уравнений, которые я буду использовать ниже, являются уравнениями окислительно-восстановительного потенциала, но они не будут идентифицированы как таковые.Уравнения, которые я использую, будут довольно простыми, их можно будет сбалансировать визуально, и для них не потребуются методы, описанные в разделе окислительно-восстановительного потенциала.
Двумя другими основными типами, которые вы увидите в приведенных ниже задачах, являются:
(1) реакции двойного замещения (также называемые двойным замещением, также называемые метатезисом). Да, вы должны знать все три имени.
(2) кислотно-щелочная нейтрализация.
Для реакций двойного замещения вам понадобится диаграмма растворимости.Нейтрализация кислотных оснований приведет к образованию воды из иона водорода и иона гидроксида.
Наконец, хотя есть ряд отдельных реакций замещения, которые можно записать в чистой ионной форме, я называю это второстепенной областью. Основная причина того, что однократная замена является незначительной, заключается в том, что она гораздо реже используется в качестве источника для сетевых проблем ионного типа. В подавляющем большинстве случаев речь идет о реакциях двойного замещения и нейтрализации.
В подавляющем большинстве случаев речь идет о реакциях двойного замещения и нейтрализации.
Вот два (несбалансированных) одиночных примера замены:
Al (тв.) + HBr (водн.) —> AlBr 3 (водн.) + H 2 ↑
Br 2 () + NaI (водн.) —> I 2 (s) + NaBr (водн.)
Я сделаю их первыми двумя проблемами в задачах с номерами от 1 до 10 (см. Ссылку №1-10 ниже).
Вот два (несбалансированных) примера двойной замены:
Pb (NO 3 ) 2 (водн.) + Na 2 S (водн.) —>
фосфат аммония + хлорид кальция —>
Ответы на эти два находятся в # 21 и # 22 (см. Ссылку # 11-25 ниже). Попробуйте их самостоятельно, прежде чем посмотреть ответы и посмотреть, насколько хорошо вы справляетесь.
Вот еще один пример: напишите молекулярное уравнение, полное ионное уравнение и чистое ионное уравнение для:
Раствор нитрата свинца (II) смешивают с раствором иодида калия с образованием осадка иодида свинца (II) и водного раствора нитрата калия. Ответ:
Ответ:
молекулярное уравнение —> Pb (NO 3 ) 2 (водн.) + 2KI (водн.) —> PbI 2 (s) + 2KNO 3 (водн.)
полное ионное уравнение —> Pb 2+ (водный) + 2NO 3 ¯ (водный) + 2K + (водный) + 2I¯ (водный) —> PbI 2 (s) + 2K + (водн.) + 2NO 3 ¯ (водн.)
чистое ионное уравнение —> Pb 2+ (водн.) + 2I¯ (водн.) —> PbI 2 (s)
Последний, последний комментарий: другой тип проблемы, которую вы иногда видите в тесте, не обсуждая ее в классе, — это двойное осаждение, при котором оба продукта (а не только один) реакции двойного замещения будут выпадать в осадок.Вот пример двойного осаждения:
Sr (OH) 2 (водн.) + CuSO 4 (водн.) —> SrSO 4 (т.) + Cu (OH) 2 (т.)
Я оставлю чистое ионное уравнение незаписанным. Я отмечу, однако, что нет никаких ионов-зрителей, которые нужно удалить. Здесь есть еще несколько примеров реакций двойного осаждения в задаче №10.
Итак, в конце марта 2020 года я наткнулся на необычный пример, который я никогда раньше не видел, и поэтому этот комментарий был сделан после последнего, последнего комментария.Реакция имеет твердое вещество как на стороне реагента, так и на стороне продукта. Однако это не останавливает процесс.
Запишите сбалансированные: (a) молекулярные, (b) полностью ионные и (c) чистые ионные для следующей реакции:
FePO 4 (с) + KC 2 H 3 O 2 (водный) —> Fe (C 2 H 3 O 2 ) 3 (с) + K 3 PO 4 (водн.)
Решение:
1) Сбалансированная молекулярная:
FePO 4 (с) + 3KC 2 H 3 O 2 (водный) —> Fe (C 2 H 3 O 2 ) 3 (с) + K 3 PO 4 (водн.)
2) Полный ионный:
FePO 4 (т) + 3K + (вод.) + C 2 H 3 O 2 ¯ (водн.) —> Fe (C 2 H 3 O 2 ) 3 (s) + 3K + (вод.) + PO 4 3 ¯ (вод.)
3) Чистый ионный:
FePO 4 (с) + C 2 H 3 O 2 ¯ (водный) —> Fe (C 2 H 3 O 2 ) 3 (с ) + PO 4 3 ¯ (водн.)
Ацетат железа (III) — интересное соединение с общим названием «основной ацетат железа».’
Ионные уравнения
Ионные уравнения
Ионные уравнения и чистые ионные уравнения обычно пишутся только для реакций, протекающих в растворе, и представляют собой попытку показать, как реагируют присутствующие ионы. В то время как ионные уравнения показывают все вещества, присутствующие в растворе, чистое ионное уравнение показывает только те, которые изменяются в ходе реакции.
Чтобы написать ионные уравнения, выполните следующие действия. Каждый этап будет продемонстрирован на примере реакции металлического магния с соляной кислотой.
| 1. | Напишите молекулярное уравнение и уравновесите его. Mg + 2 HCl MgCl 2 + H 2 |
| 2. | Определите состояние каждого вещества (газ, жидкость, твердое, водное). Используйте правила растворимости, чтобы определить, какие из ионных соединений растворимы в воде. Растворимые ионные соединения обозначаются знаком (водн.), Нерастворимые — символом (и). Большинство элементов и ковалентных соединений (ковалентные соединения образуются, когда два или более неметаллических элемента связаны друг с другом) нерастворимы в воде и должны быть обозначены (s), (l) или (g).Mg (тв.) + 2 HCl (водн.) MgCl 2 (водн.) + H 2 (г) |
| 3. | Напишите ионное уравнение, разбив все растворимые ионные соединения (отмеченные знаком (aq)) на их соответствующие ионы. Каждый ион должен быть показан с его зарядом и знаком (водн.), Чтобы показать, что он присутствует в растворе. Используйте коэффициенты, чтобы показать количество каждого присутствующего иона. Перепишите элементы и ковалентные соединения, как они появились на предыдущем шаге. Mg (s) + 2 H + (водн.) + 2 Cl — (водн.) Mg +2 (водн.) + 2 Cl — (водн.) + H 2 (г) |
| 4. | Напишите чистое ионное уравнение, удалив ионы-наблюдатели. Ионы-наблюдатели — это те ионы, которые абсолютно одинаковы по обе стороны ионного уравнения. Mg (тв) + 2 H + (водн.) Mg +2 (водн.) + H 2 (г) |
Попробуйте написать ионные и чистые ионные уравнения для реакции двойного вытеснения нитрата серебра с сульфатом натрия. Когда вы закончите, проверьте свои ответы.
Определение чистого ионного уравнения (химия)
Есть разные способы написать уравнения химических реакций.Некоторые из наиболее распространенных — это несбалансированные уравнения, которые указывают на участвующие виды; сбалансированные химические уравнения, которые указывают количество и тип разновидностей; молекулярные уравнения, которые выражают соединения как молекулы, а не как составляющие ионы; и чистые ионные уравнения, которые имеют дело только с частицами, участвующими в реакции. По сути, вам нужно знать, как написать первые два типа реакций, чтобы получить чистое ионное уравнение.
Определение чистого ионного уравнения
Чистое ионное уравнение — это химическое уравнение реакции, в котором перечислены только те частицы, которые участвуют в реакции.Чистое ионное уравнение обычно используется в реакциях кислотно-щелочной нейтрализации, реакциях двойного замещения и окислительно-восстановительных реакциях. Другими словами, чистое ионное уравнение применимо к реакциям с сильными электролитами в воде.
Пример чистого ионного уравнения
Итоговое ионное уравнение для реакции, которая возникает в результате смешивания 1 M HCl и 1 M NaOH, выглядит следующим образом:
H + (водн.) + OH — (водн.) → H 2 O (l)
Cl — Ионы и Na + не вступают в реакцию и не входят в итоговое ионное уравнение.
Как написать чистое ионное уравнение
Чтобы написать чистое ионное уравнение, нужно выполнить три шага:
- Выровняйте химическое уравнение.
- Напишите уравнение, используя все ионы в растворе. Другими словами, разложите все сильные электролиты на ионы, которые они образуют в водном растворе. Обязательно укажите формулу и заряд каждого иона, используйте коэффициенты (числа перед видом), чтобы указать количество каждого иона, и напишите (aq) после каждого иона, чтобы указать, что он находится в водном растворе.
- В чистом ионном уравнении все частицы с (s), (l) и (g) останутся неизменными. Любые (водные), которые остаются по обе стороны уравнения (реагенты и продукты), могут быть исключены. Их называют «ионами-наблюдателями», и они не участвуют в реакции.
Советы по написанию чистого ионного уравнения
Ключом к знанию того, какие виды диссоциируют на ионы, а какие образуют твердые вещества (осадки), является способность распознавать молекулярные и ионные соединения, знать сильные кислоты и основания и предсказывать растворимость соединений.Молекулярные соединения, такие как сахароза или сахар, не диссоциируют в воде. Ионные соединения, такие как хлорид натрия, диссоциируют в соответствии с правилами растворимости. Сильные кислоты и основания полностью диссоциируют на ионы, тогда как слабые кислоты и основания диссоциируют лишь частично.
Для ионных соединений полезно ознакомиться с правилами растворимости. Соблюдайте правила по порядку:
- Все соли щелочных металлов растворимы. (например, соли Li, Na, K и т. д. — обратитесь к таблице Менделеева, если вы не уверены)
- Все соли NH 4 + растворимы.
- Все NO 3 —, C 2 H 3 O 2 —, ClO 3 — и соли ClO 4 — растворимы.
- Все соли Ag + , Pb 2+ и Hg 2 2+ нерастворимы.
- Все соли Cl — , Br — и I — растворимы.
- Все CO 3 2-, O 2- , S 2- , OH —, PO 4 3- , CrO 4 2- , Cr 2 Соли O 7 2- и SO 3 2- нерастворимы (за исключением).
- Все соли SO 4 2- растворимы (за исключением).
Например, следуя этим правилам, вы знаете, что сульфат натрия растворим, а сульфат железа — нет.
Шесть сильных кислот, которые полностью диссоциируют: HCl, HBr, HI, HNO 3 , H 2 SO 4 , HClO 4 . Оксиды и гидроксиды щелочных (группа 1А) и щелочно-земельных (группа 2А) металлов являются сильными основаниями, которые полностью диссоциируют.
Пример задачи Net Ionic Equation
Например, рассмотрим реакцию между хлоридом натрия и нитратом серебра в воде.Напишем чистое ионное уравнение.
Во-первых, вам нужно знать формулы этих соединений. Рекомендуется запоминать обычные ионы, но если вы их не знаете, это реакция, написанная (aq) после вида, чтобы указать, что они находятся в воде:
NaCl (водн.) + AgNO 3 (водн.) → NaNO 3 (водн.) + AgCl (s)
Как узнать, образуются нитрат серебра и хлорид серебра, а хлорид серебра — твердое вещество? Используйте правила растворимости, чтобы определить диссоциацию обоих реагентов в воде.Чтобы реакция произошла, они должны обмениваться ионами. Опять же, используя правила растворимости, вы знаете, что нитрат натрия растворим (остается водным), потому что все соли щелочных металлов растворимы. Хлоридные соли нерастворимы, поэтому вы знаете, что AgCl выпадает в осадок.
Зная это, вы можете переписать уравнение, чтобы показать все ионы (полное ионное уравнение ):
Na + ( водн. ) + Cl — ( водн. ) + Ag + ( водн. ) + NO 3 — ( водн. ) → Na + ( водн. ) + NO 3 — ( водн. ) + AgCl ( с )
Ионы натрия и нитрата присутствуют с обеих сторон реакции и не изменяются в результате реакции, поэтому вы можете отменить их с обеих сторон реакции.Это оставляет вам чистое ионное уравнение:
Cl — (водн.) + Ag + (водн.) → AgCl (т.)
| Причина написания химического уравнения состоит в том, чтобы выразить то, что, по нашему мнению, является на самом деле происходит в химической реакции. Одно из наиболее полезных применений концепции основных видов. записывает чистых ионных уравнений . Это уравнения которые сосредоточены на основных веществах и ионах, участвующих в реакции — основных частицах — игнорируя те зритель ионов, которые действительно не участвуют. Например, рассмотрим реакцию, описываемую следующим полным молекулярным уравнением: HCl (водн.) + NaOH (водн.) NaCl (водн.) + H 2 O HCl, NaOH и NaCl — сильные электролиты. Таким образом, они диссоциируют H + (водн.) + Cl — (водн.) + Na + (водн.) + OH — (водн.) Na + (водн.) + Cl — (водн.) + H 2 O Обратите внимание, что Na + и Cl — на самом деле никогда не вступают в реакцию. Они есть H + (водн.) + OH — (водн.) H 2 O где мы пренебрегли Na + и Cl — , потому что они H 3 O + (водн.) + OH — (водн.) 2 H 2 O Написание чистых ионных уравненийНаписать чистые ионные уравнения проще, чем вы думаете. Прежде всего, мы ДОЛЖНЫ начать с уравнения, которое включает физическое состояние:
Три правила написания чистых ионных уравнений действительно довольно просты.
Ясно, что правило 2 — непростое. Вы должны знать свои сильные электролиты:
Это вопрос запоминания семи сильных кислот и проверки наличия Другой примерВот еще один пример: HF (водн.) + AgNO 3 (водн.) AgF (s) + HNO 3 (водн.) Разделив водные сильные электролиты, мы имеем: HF (водн.) + Ag + (водн.) + NO 3 — (водн.) AgF (s) + H + (водн.) + NO 3 — (водн.) Учтите, что HF — слабая кислота, поэтому оставим ее вместе.Поскольку AgF — твердое тело, мы HF (водн.) + Ag + (водн.) AgF (s) + H + (водн.) Опять же, если вы хотите подчеркнуть, что H + гидратирован, вы можете написать: HF (водн.) + Ag + (водн.) + H 2 O AgF (s) + H 3 O + (водн.) Что делать, если у меня нет продуктов? В некоторых ситуациях вы знаете только реагенты.Например, кому-то может понадобиться знать чистое ионное уравнение для «реакции между NaHSO 4 и NH 3 ». Что тогда?
|

 е. идёт до
е. идёт до


