Содержание
Официальный сайт СШ№ 6 с.Батпак Осакаровского района
1.1. Состав вещества выражен формулой SO3. Определите:
a) Название вещества
b) Качественный состав
c) Количественный состав
d) Валентность химических элементов
e) Молярную массу
f) Массовые доли элементов, образующих вещество
g) Массу вещества количеством 1,5 моль.
2. Запишите уравнения химических реакций, соответствующих схеме:
________________________________.
Назовите полученные вещества, укажите условия протекания и тип химических реакций.
3. При сгорании кальция массой 16г. количество выделившейся теплоты составило 254 кДж.
Составьте термохимическое уравнение реакции.
4. Необходимо приготовить 250 г. 10% раствора хлорида натрия
(NaCl).
Рассчитайте массы соли и воды, необходимые для приготовления данного раствора.
5* 10 г металла натрия, который загрязнен оксидом (массовая доля оксида — 8%) поместили в воду.
Полученный водород сожгли в кислороде. Какая масса воды образовалась при этом.
1. Состав вещества выражен формулой CO2. Определите:
a) Название вещества
b) Качественный состав
c) Количественный состав
d) Валентность химических элементов
e) Молярную массу
f) Массовые доли элементов, образующих вещество
g) Массу вещества количеством 4,5 моль.
2. Запишите уравнения химических реакций, соответствующих схеме:
________________________________.
Назовите полученные вещества, укажите условия протекания и тип химических реакций.
3. На разложение оксида ртути (II) массой 8,68г. затрачена теплота количеством 3,64 кДж.
Составьте термохимическое уравнение реакции.
4. Необходимо приготовить 125 г. 30% раствора хлорида калия (KCl).
Рассчитайте массы соли и воды, необходимые для приготовления данного раствора.
5* 20 г металла кальция, который загрязнен оксидом (массовая доля оксида — 5%) поместили в воду.
Полученный водород сожгли в кислороде. Какая масса воды образовалась при этом.
1. Состав вещества выражен формулой H2O. Определите:
a) Название вещества
b) Качественный состав
c) Количественный состав
d) Валентность химических элементов
e) Молярную массу
f) Массовые доли элементов, образующих вещество
g) Массу вещества количеством 2 моль.
2. Запишите уравнения химических реакций, соответствующих схеме:
________________________________.
Назовите полученные вещества, укажите условия протекания и тип химических реакций.
3. Термохимическое уравнение реакции горения углерода имеет вид: C + O2 = CO2 + 394кДж,
рассчитайте массу углерода, вступившего в реакцию, если выделилось 1970 кДж теплоты.
4. Необходимо приготовить 50 г. 1% раствора хлорида натрия
(NaCl).
Рассчитайте массы соли и воды, необходимые для приготовления данного раствора.
5* При восстановлении водородом оксида двухвалентного металла получен металл массой 16 г.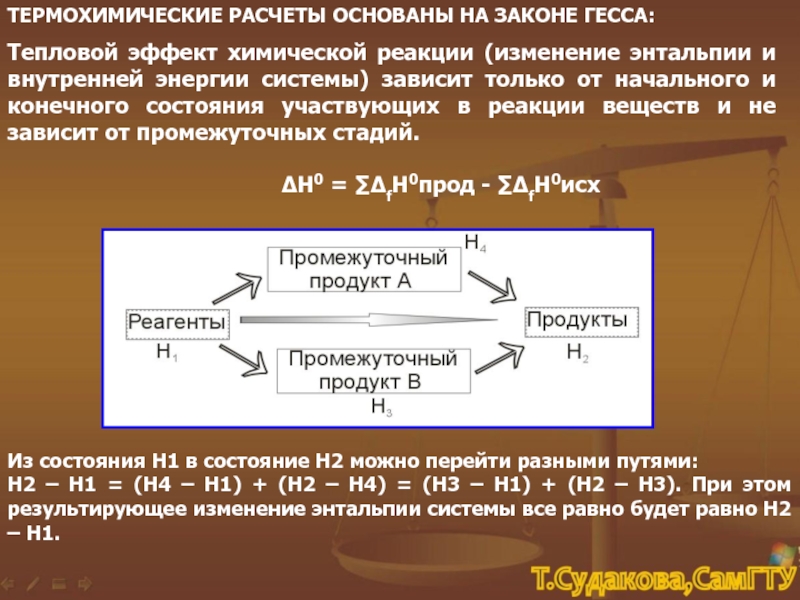
Определите, какой это металл.
1. Состав вещества выражен формулой P2O5. Определите:
a) Название вещества
b) Качественный состав
c) Количественный состав
d) Валентность химических элементов
e) Молярную массу
f) Массовые доли элементов, образующих вещество
g) Массу вещества количеством 0,5 моль.
2. Запишите уравнения химических реакций, соответствующих схеме:
________________________________.
Назовите полученные вещества, укажите условия протекания и тип химических реакций.
3.Для реакции алюминия с серой термохимическое уравнение реакции имеет вид:
2Al + 3S = Al2S3 + 509 кДж.
Какое количество теплоты выделится в реакции, для которой взято 128 г серы?
4. Необходимо приготовить 500 г. 5% раствора хлорида натрия(NaCl).
Рассчитайте массы соли и воды, необходимые для приготовления данного раствора.
5* Из перманганата калия массой 7,9 г. был получен кислород, который прореагировал с магнием.
был получен кислород, который прореагировал с магнием.
Какая масса оксида магния будет при этом получена?
Примечание: задание 5* необязательно для выполнения всеми учащимися.
План урока «Термохимические уравнения» — химия, уроки
Учитель проведет небольщой опрос по предыдущей теме и просит объяснить понятие экзотермический. Экзотермические реакции выделяют энергию в окружающую среду. На примере природного газа.
После этого учитель задаст вопрос все реакции экзотермические? Есть ли у них другие формы?
После этого учащиеся объясняют понятие эндотермический. Эндотермические реакции впитывают энергию из окружающей среды. На примере нескольких демонстрации и видеоформата ;
Взаимодействие карбоната натрия с разбавленной уксусной кислотой, реакция между лимонной кислотой и гидрокарбонатом натрия.
Далее учитель обьясняет что реакции идущие с изменением теплоты называются термохимическими.
Обсудите, как объясняет теория частиц изменение энергии в физических явлениях: когда объект нагревают, движение частиц становится более энергичным, так как они приобретают энергию. При охлаждении движение частиц уменьшается, поскольку они теряют энергию.
(П) Работа в паре по схеме
Обсудите, как объясняет теория частиц изменение энергии в процессе химических реакций: перегруппировка атомов/ионов, разрыв связей и образование новых связей и новых видов частиц.
Термохимические уравнения
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
(CuOH)2 CO3 = 2CuO + H 2 O + CO 2 — 47 кДж
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
Решим задачи:
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O2 = 2MqO + 1204 кДж
Решение:
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n = m / M
n(MqO) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
По уравнению 2 моля MqO — 1204 кДж
По условию 3 моля MqO — Q1
Отсюда
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ответ: При образовании 120г оксида магния выделится 1803 кДж энергии
Задача 2. В результате реакции, термохимическое уравнение которой
В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
Решение:
1) Установим пропорциональные отношения между количеством вещества ацетилена и количеством теплоты.
По уравнению 2 моль C2H2_———- 2610 кДж
По условию х моль ———- 652,5 кДж
Решаем пропорцию
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2) Определяем массу ацетилена по формуле m= n * M
m = 0,5 моль * 26 г/моль = 13 г.
Ответ: масса сгоревшего ацетилена 13 г.
Задача 3. В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Решение:
1. Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2 = CO2 +2H2O + Q
2. Определим количество 48 г метана
n = m / M
n(CH4) = 48г/ 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию 3моля CH4 — 2406 кДж
По уравнению 1 моль CH4 — Q
Решаем пропорцию
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж
НАПОМИНАНИЕ в ХОДЕ УРОКА о личной миссии, успешности, образования.
Пример, все ли ты сделал для успешности на уроке?
Когда в жизни этот материал тебе может пригодиться?
Закрепление
Решение задач по термохимическим уравнениям 8 класс
Задача 1. Используя термохимическое уравнение реакции
3Fe(тв) + 2O2(г) = Fe3O4(г)+ 118 кДж вычислите, сколько теплоты выделится при взаимодействии 11,2 г железа с кислородом.
Задача2. Используя термохимическое уравнение реакции
2HgO(тв) = 2Hg(ж) + О2(г)-180кДж вычислите , сколько граммов ртути образуется, если при этом выделилось 54 кДж энергии.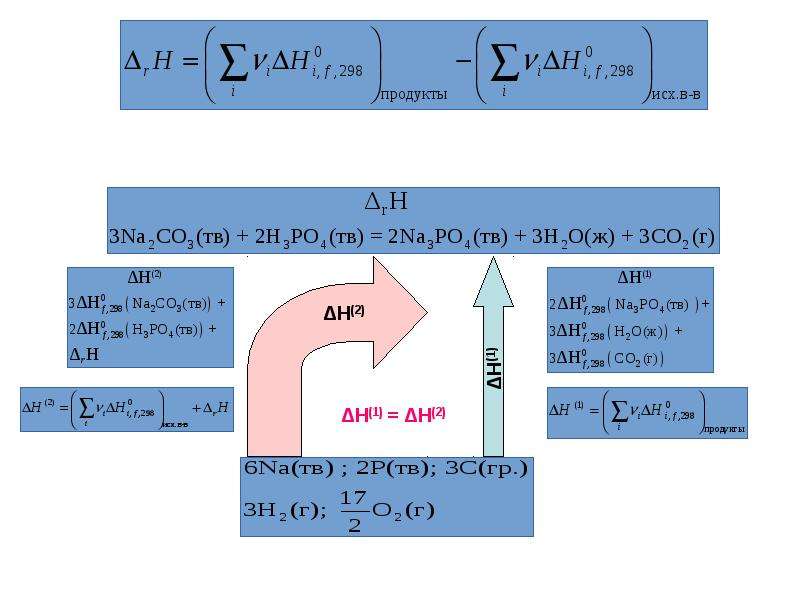
Задача 3. Составьте термохимическое уравнение реакции горения водорода в кислороде, если при горении 2,24 л водорода выделилось 28.6 кДж энергии
Задача 4. Вычислите массу разложившегося мела (СаСО3), если известно, что на его разложение затрачено 314 кДж. Термохимическое уравнение реакции :
СаСО3 = СаО + СО2 -157 кДж
Задача 5. Составьте термохимическое уравнение реакции горения кальция в кислороде, если при горении 2 г кальция выделилось 127 кДж энергии
Задача 6.При сгорании 56 л водорода выделилось 605 кДж теплоты. Вычислите тепловой эффект реакции горения водорода и составьте термохимическое уравнение реакции
Составьте термохимическое уравнение реакции горения этилена, если известно, что тепловой эффект этой реакции 1410,97 кДж/моль.
 Вычислите объем сгоревшего этилена (н. у.), если при этом выделилось 7054,8 кДж теплоты
Вычислите объем сгоревшего этилена (н. у.), если при этом выделилось 7054,8 кДж теплоты
W=m\m р-ра
m=n*M
m р-ра =V*ρ
w=n*M\V*ρ=(c*M)\ρ=(1*98)\1100=0,08909 (8,91%)
W(N) = 14/ 53,5 = 26,17\% (Nh5Cl)
w(N) = 14 *2 / 32 = 43,75\% (N2h5)
w(N) = 14 / 35 = 40\% (Nh5OH)
w(N) = 14 / 85 = 16,47\% (NaNO3)
w(N) = 14 / 164 = 8,54\% (Ca(NO3)2)
больше всего азота в соединении N2h5
Na2S + 2HCl = 2NaCl + h3S
N=6800
M((C6h20O5)n)-?
M(C6h20O5)=6*12+10*1+5*16=72+10+80=162
M((C6h20O5)₆₈₀₀=6800*162=1101600 г/моль
Ответ: 1101600 г/моль
18. Глюкозу характеризуют:
Глюкозу характеризуют:
В) способность к различным видам процесса брожения
Д) взаимодействие с гидроксидом меди (II) с образованием раствора
инего цвета
Е) образование сорбита при взаимодействии с водородом
Ответ:
В, Д, Е
19. В водном растворе с выпадением осадка протекает реакция
А) хлорид алюминия + гидроксид калия
Д) карбонат калия + гидроксид кальция
Е) сульфат натрия + хлорид бария
Ответ:
А, Д, Е
20. Укажите формулы солей, в водном растворе которых рН > 7
Б) Na2SO3
Д) Na3РO4
Ж) NaСН3СОО
Ответ:
Б, Д, Ж
8 класс. Химия. Расчеты по термохимическим уравнениям — Расчеты по термохимическим уравнениям
Комментарии преподавателя
Тепловой эффект и термохимическое уравнение реакции
Практически все реакции протекают с выделением или поглощением теплоты. Количество теплоты, которое выделяется или поглощается в ходе реакции, называется тепловым эффектом химической реакции.
Количество теплоты, которое выделяется или поглощается в ходе реакции, называется тепловым эффектом химической реакции.
Если тепловой эффект записан в уравнении химической реакции, то такое уравнение называют термохимическим.
В термохимических уравнениях, в отличие от обычных химических, обязательно указывают агрегатное состояние вещества (твердое, жидкое, газообразное).
Например, термохимическое уравнение реакции между оксидом кальция и водой выглядит так:
СаО(т) + Н2О(ж) = Са(ОН)2(т) + 64 кДж
Количество теплоты Q, выделившееся или поглощенное при протекании химической реакции, пропорционально количеству вещества реагента или продукта. Поэтому, пользуясь термохимическими уравнениями, можно производить различные расчеты.
Рассмотрим примеры решения задач.
Задача 1:Определите количество теплоты, затраченное на разложение 3,6 г воды в соответствии с ТХУ реакции разложения воды:
Решить эту задачу можно с помощью пропорции:
при разложении 36 г воды поглотилось 484 кДж
при разложении 3,6 г воды выделилось x кДж
Таким образом, можно составить уравнение реакции. Полное решение задачи приведено на Рис.1.
Полное решение задачи приведено на Рис.1.
Рис. 1. Оформление решения задачи 1
Задача может быть сформулирована таким образом, что вам нужно будет составить термохимическое уравнение реакции. Рассмотрим пример такой задачи.
Задача 2: При взаимодействии 7 г железа с серой выделилось 12,15 кДж теплоты. На основании этих данных составьте термохимическое уравнение реакции.
Обращаю ваше внимание на то, что ответом в данной задаче служит само термохимическое уравнение реакции.
Рис. 2. Оформление решения задачи 2
источник конспекта — http://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/raschety-po-termohimicheskim-uravneniyam
источник видео — http://www.youtube.com/watch?v=tXRl8yIP6BM
источник видео — http://www.youtube.com/watch?v=XFDv8WwNuM0
источник видео — http://www.youtube.com/watch?v=KKVOxcF6YLw
Файлы
Нет дополнительных материалов для этого занятия.
3. Энергетика химических Задачи контрольной работы
Примеры решения задач к разделу Пример 1 При взаимодействии кристаллов Решение.
Пример 2.
Решение.
|
Задачи (9 класс) Расчеты по термохимическим уравнениям
Задачи (9 класс) Расчеты по термохимическим уравнениям — страница №1/1
Задачи (9 класс)
Расчеты по термохимическим уравнениям (экзотермические, эндотермические реакции, тепловой эффект)
1. Составьте термохимическое уравнение реакции горения магния, если известно, что при
сгорании магния массой 12 г выделилось количество теплоты 307,2 кДж.
(2 Mg(к) + O2(г) = 2 MgO(к) + 1228,8 кДж.)
2. Вычислите по термохимическому уравнению 4 P(к) + 5O2(г) =2 P2O5(к) + 3010 кДж
количество теплоты, выделяемой при сгорании 31 г фосфора. (752,5 кДж.)
(752,5 кДж.)
3. По термохимическому уравнению CaCO3(к) = CaO(к)+ СO2(г) — 157 кДж
Вычислите массу разложившегося известняка, если известно, что на его разложение
затрачено 1570 кДж (1000 г)
4. При сгорании кальция массой 8 г, выделилось количество теплоты 127 кДж.
Составьте термохимическое уравнение реакции.
-
По термохимическому уравнению 2KNO3(к) = 2KNO2(к)+ O2(г) — 255 кДж
вычислите количество теплоты, которая поглотится при получении кислорода (н.у.) объемом 6,72 л. (76,5 кДж)
6. По термохимическому уравнению 2NaOH + H2SO4 = Na2SO4 + 2H2O +290 кДж
вычислите массу гидроксида натрия, вступившего в реакцию, если известно, что при
его нейтрализации выделилось количество теплоты 725 кДж. (200 г.)
(200 г.)
-
На разложение оксида ртути (II) массой 8,68 г затрачено количество теплоты 3,64кДж.
Составьте термохимическое уравнение реакции.
Задачи на тепловой эффект химической реакции 11 класс
1.При взаимодействии углерода массой 6г с водородом выделилось 37,42 кДж теплоты. Напишите термохимическое уравнение образования метана.
2. Тепловой эффект горения метана 890,31 кДж. Составьте термохимическое уравнение горения метана. 1) Рассчитайте, какое количество теплоты выделится, если сжечь метана: а) количеством вещества 0,8 моль; б) объёмом 250 мл ; в) массой 200 г.? 2) Сколько необходимо взять метана по объёму и по массе, чтобы при этом выделилось 148,385 кДж теплоты?
3.Рассчитайте по термохимическому уравнению
С3H8+5O2=3CO2+4H2O+2220,03 кДж
Какое количество теплоты выделится, если кислорода расходуется:
a) массой 16г; б) объёмом 67,2л; в) количеством вещества 2б5 моль.
Сколько оксида углерода(IV) по объёму и по массе получится, если при горении пропена выделится 277,5 кДж теплоты?
4.Составьте термохимическое уравнение реакций горения этилена, если известно, что тепловой эффект реакции 1410,97 кДж. 1)Сколько теплоты выделится, если сгорает этилена; а) количеством вещества 5 моль; б) массой 140 г в) объёмом 112л.?
2) Сколько кислорода (по объёму и по массе) необходимо сжечь, чтобы выделилось
352,74 кДж теплоты?
Тепловой эффект химической реакции. Термохимические уравнения.
Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты.
По признаку выделения или поглощения теплоты различают экзотермические и эндотермические реакции.
Экзотермические реакции – такие реакции, в ходе которых тепло выделяется (+Q).
Эндотермические реакции – реакции, при протекании которых тепло поглощается (-Q).
Тепловым эффектом реакции (Q) называют количество теплоты, которое выделяется или поглощается при взаимодействии определенного количества исходных реагентов.
Термохимическим уравнением называют уравнение, в котором указан тепловой эффект химической реакции. Так, например, термохимическими являются уравнения:
Также следует отметить, что термохимические уравнения в обязательном порядке должны включать информацию об агрегатных состояниях реагентов и продуктов, поскольку от этого зависит значение теплового эффекта.
Расчеты теплового эффекта реакции
Пример типовой задачи на нахождение теплового эффекта реакции:
При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с уравнением
C6H12O6(тв.) + 6O2(г) = 6CO2(г) + 6H2O(г) + Q
выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Решение:
Рассчитаем количество вещества глюкозы:
n(C6H12O6) = m(C6H12O6) / M(C6H12O6) = 45 г / 180 г/моль = 0,25 моль
Т. е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
0,25 моль глюкозы — 700 кДж
1 моль глюкозы — Q
Из этой пропорции следует соответствующее ей уравнение:
0,25 / 1 = 700 / Q
Решая которое, находим, что:
Q = 2800 кДж
Таким образом, тепловой эффект реакции составляет 2800 кДж.
Расчёты по термохимическим уравнениям
Намного чаще в заданиях ЕГЭ по термохимии значение теплового эффекта уже известно, т.к. в условии дается полное термохимическое уравнение.
Рассчитать в таком случае требуется либо количество теплоты, выделяющееся/поглощающееся при известном количестве реагента или продукта, либо же, наоборот, по известному значению теплоты требуется определить массу, объем или количество вещества какого-либо фигуранта реакции.
Пример 1
В соответствии с термохимическим уравнением реакции
3Fe3O4(тв.) + 8Al(тв.) = 9Fe(тв.) + 4Al2O3(тв.) + 3330 кДж
образовалось 68 г оксида алюминия. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Решение
Рассчитаем количество вещества оксида алюминия:
n(Al2O3) = m(Al2O3) / M(Al2O3) = 68 г / 102 г/моль = 0,667 моль
В соответствии с термохимическим уравнением реакции при образовании 4 моль оксида алюминия выделяется 3330 кДж. В нашем же случае образуется 0,6667 моль оксида алюминия. Обозначив количество теплоты, выделившейся при этом, через x кДж составим пропорцию:
4 моль Al2O3 — 3330 кДж
0,667 моль Al2O3 — x кДж
Данной пропорции соответствует уравнение:
4 / 0,667 = 3330 / x
Решая которое, находим, что x = 555 кДж
Т. е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
Пример 2
В результате реакции, термохимическое уравнение которой
4FeS2(тв.) + 11O2(г) = 8SO2(г) + 2Fe2O3(тв.) + 3310 кДж
выделилось 1655 кДж теплоты. Определите объем (л) выделившегося диоксида серы (н.у.). (Запишите число с точностью до целых.)
Решение
В соответствии с термохимическим уравнением реакции при образовании 8 моль SO2 выделяется 3310 кДж теплоты. В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
8 моль SO2 — 3310 кДж
x моль SO2 — 1655 кДж
Из которой следует уравнение:
8 / х = 3310 / 1655
Решая которое, находим, что:
x = 4 моль
Таким образом, количество вещества SO2, образовавшееся при этом, составляет 4 моль.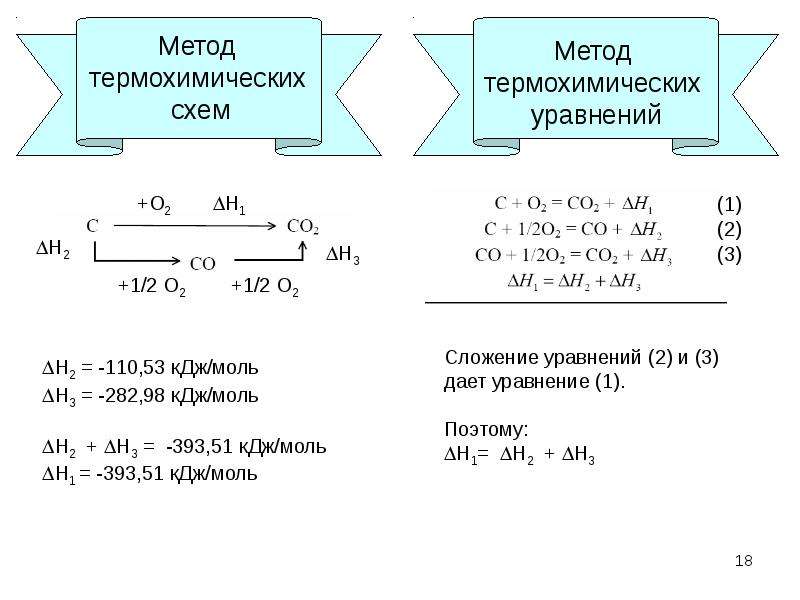 Следовательно, его объем равен:
Следовательно, его объем равен:
V(SO2) = Vm ∙ n(SO2) = 22,4 л/моль ∙ 4 моль = 89,6 л ≈ 90 л (округляем до целых, т.к. это требуется в условии.)
Больше разобранных задач на тепловой эффект химической реакции можно найти здесь.
Термохимическое уравнение | Химия для неосновных
- Определите термохимическое уравнение.
- Определите теплоту реакции.
Как лучше отапливать дом?
Отопление дома становится все дороже. Используем ли мы газ, нефть, электричество, дрова? Частично решение зависит от того, какое топливо обеспечит наибольшее выделение энергии при сгорании. Исследования термохимии могут быть очень полезны для получения надежной информации для принятия этих важных решений.
Термохимическое уравнение
При сгорании газообразного метана выделяется тепло, что делает реакцию экзотермической. В частности, при сгорании 1 моля метана выделяется 890,4 килоджоулей тепловой энергии. Эта информация может быть отображена как часть сбалансированного уравнения.
Эта информация может быть отображена как часть сбалансированного уравнения.
Уравнение говорит нам, что 1 моль метана соединяется с 2 молями кислорода с образованием 1 моля диоксида углерода и 2 моль воды. В процессе выделяется 890,4 кДж, и поэтому записывается как продукт реакции.Термохимическое уравнение — это химическое уравнение, которое включает изменение энтальпии реакции. Процесс в приведенном выше термохимическом уравнении может быть показан визуально на Рис. ниже.
Рисунок 17.7
(A) Поскольку реагенты превращаются в продукты в экзотермической реакции, энтальпия выделяется в окружающую среду. Изменение энтальпии реакции отрицательное. (B) Поскольку реагенты превращаются в продукты в эндотермической реакции, энтальпия поглощается из окружающей среды.Изменение энтальпии реакции положительное.
В примере сгорания метана изменение энтальпии отрицательное, потому что система выделяет тепло. Следовательно, общая энтальпия системы уменьшается. теплота реакции — это изменение энтальпии химической реакции. В приведенном выше случае теплота реакции составляет -890,4 кДж. Термохимическую реакцию также можно записать так:
Следовательно, общая энтальпия системы уменьшается. теплота реакции — это изменение энтальпии химической реакции. В приведенном выше случае теплота реакции составляет -890,4 кДж. Термохимическую реакцию также можно записать так:
Теплота реакции обычно измеряется в килоджоулей.Важно включить физические состояния реагентов и продуктов в термохимическое уравнение, поскольку значение зависит от этих состояний.
Эндотермические реакции поглощают энергию из окружающей среды по мере протекания реакции. Когда 1 моль карбоната кальция разлагается на 1 моль оксида кальция и 1 моль диоксида углерода, поглощается 177,8 кДж тепла. Процесс показан визуально на рис. выше (B). Термохимическая реакция показана ниже.
Поскольку система поглощает тепло, модель 177.8 кДж записано как реагент. Теплота реакции положительна для эндотермической реакции.
Способ написания реакции влияет на значение изменения энтальпии реакции. Многие реакции обратимы, что означает, что продукт (ы) реакции способен объединять и преобразовывать реагент (ы). Если реакция написана в обратном направлении, знак меняется. Например, мы можем написать уравнение реакции оксида кальция с диоксидом углерода с образованием карбоната кальция.
Если реакция написана в обратном направлении, знак меняется. Например, мы можем написать уравнение реакции оксида кальция с диоксидом углерода с образованием карбоната кальция.
Реакция экзотермическая, поэтому знак изменения энтальпии отрицательный.
Сводка
- Описаны компоненты термохимического уравнения.
Практика
Читайте материал по ссылке ниже и решайте задачи на экранах
http://www.wisc-online.com/Objects/ViewObject.aspx?ID=GCH8805
Обзор
Вопросы
- Что включает в себя термохимическое уравнение?
- Почему эта информация важна?
- Что происходит со знаком изменения энтальпии, когда реакция меняется на противоположную?
- теплота реакции: Изменение энтальпии химической реакции.
- термохимическое уравнение: Химическое уравнение, которое включает изменение энтальпии реакции.
3.
 8: Термохимические уравнения — Chemistry LibreTexts
8: Термохимические уравнения — Chemistry LibreTexts
Изменения энергии, сопровождающие химические реакции, почти всегда выражаются термохимическими уравнениями , такими как
\ [\ text {C} H_ {4} (g) + 2 \ text {O} _ {2} (g) \ rightarrow \ text {C} \ text {O} _ {2} (g) + 2 \ text {H} _ {2} \ text {O} (l) \ text {(25 ° C, давление 1 атм)} \\ \ Delta H_ {m} = –890 \ text {кДж} \ label {1 } \]
, который отображается на атомарном уровне ниже.Чтобы понять, как выглядит эта реакция на макроскопическом уровне, посмотрите на пламя справа.
Здесь Δ H m (дельта H , индекс m) сообщает нам, выделяется или поглощается тепловая энергия, когда реакция происходит, как написано, а также позволяет нам найти фактическое количество задействованной энергии. Условно, если Δ H м равно положительному значению , тепло будет поглощено реакцией; я.е., это эндотермический . Чаще Δ H м равно отрицательному значению , как в уравнении. \ (\ ref {1} \), что указывает на то, что тепловая энергия выделяется , а не поглощается реакцией, и что реакция экзотермическая . Это соглашение относительно того, является ли Δ H m положительным или отрицательным, рассматривает изменение тепла с точки зрения вещества, фактически участвующего в реакции, а не его окружения. В реакции в формуле. \ (\ ref {1} \) атомы C, H и O вместе потеряли энергию, и именно эта потеря обозначается отрицательным значением Δ H m .
\ (\ ref {1} \), что указывает на то, что тепловая энергия выделяется , а не поглощается реакцией, и что реакция экзотермическая . Это соглашение относительно того, является ли Δ H m положительным или отрицательным, рассматривает изменение тепла с точки зрения вещества, фактически участвующего в реакции, а не его окружения. В реакции в формуле. \ (\ ref {1} \) атомы C, H и O вместе потеряли энергию, и именно эта потеря обозначается отрицательным значением Δ H m .
Важно отметить, что Δ H m — это энергия реакции, как написано. В случае уравнения \ (\ ref {1} \) это представляет образование 1 моля диоксида углерода и 2 моль воды. Количество тепла, выделяемого или поглощаемого реакцией, пропорционально количеству каждого вещества, потребляемого или производимого реакцией. Таким образом, уравнение. \ (\ ref {1} \) говорит нам, что 890,4 кДж тепловой энергии выделяется на каждый моль из CH 4 , которые потребляются. В качестве альтернативы он говорит нам, что выделяется 890,4 кДж, на каждые 2 моля произведенного H, 2 O. С этой точки зрения Δ H m — это коэффициент преобразования, позволяющий рассчитать тепло, поглощаемое или выделяемое при потреблении или производстве заданного количества вещества. Если q — количество поглощенного или выделенного тепла, а n — количество вовлеченного вещества, то
В качестве альтернативы он говорит нам, что выделяется 890,4 кДж, на каждые 2 моля произведенного H, 2 O. С этой точки зрения Δ H m — это коэффициент преобразования, позволяющий рассчитать тепло, поглощаемое или выделяемое при потреблении или производстве заданного количества вещества. Если q — количество поглощенного или выделенного тепла, а n — количество вовлеченного вещества, то
\ [\ large \ Delta H _ {\ text {m}} = \ frac {q} {n} \]
Пример \ (\ PageIndex {1} \): Тепловая энергия
Сколько тепловой энергии получается при сжигании 1 кг газообразного этана, C 2 H 6 , в кислороде в соответствии с уравнением:
\ [2 \ text {C} _ {2} \ text {H} _ {6} (g) + 7 \ text {O} _ {2} (g) \ rightarrow 4 \ text {C} \ text { O} _ {2} (g) + 6 \ text {H} _ {2} \ text {O} (l) \\ \ Delta H_ {m} = –3120 \ text {kJ} \ label {3} \ ]
Решение: Масса C 2 H 6 легко конвертируется в количество C 2 H 6 , из которого тепловая энергия q легко вычисляется с помощью уравнения. 3 \ text {g} \ ce {C2H6} \ times \ frac {\ text {1 mol} \ ce {C2H6}} {\ text {30.07 g} \ ce {C2H6}} \ times \ frac {-3120 \ text {кДж}} {\ text {2 моль} \ ce {C2H6}} \\ & = — \ text {51 879 кДж} = — \ text {51,88 МДж} \ end {align} \)
3 \ text {g} \ ce {C2H6} \ times \ frac {\ text {1 mol} \ ce {C2H6}} {\ text {30.07 g} \ ce {C2H6}} \ times \ frac {-3120 \ text {кДж}} {\ text {2 моль} \ ce {C2H6}} \\ & = — \ text {51 879 кДж} = — \ text {51,88 МДж} \ end {align} \)
По соглашению, отрицательное значение q соответствует выделению тепловой энергии веществом, участвующим в реакции.
Величина Δ H m упоминается как изменение энтальпии на для реакции . В этом контексте символ Δ (дельта) означает изменение «, в то время как H является символом изменяемой величины, а именно энтальпии.Мы рассмотрим энтальпию более подробно в гл. 15. На данный момент мы можем думать об этом как о свойстве материи, которое увеличивается, когда материя поглощает энергию, и уменьшается, когда материя выделяет энергию.
Важно понимать, что значение Δ H м , данное в термохимических уравнениях, таких как \ (\ ref {1} \) или \ (\ ref {3} \), зависит от физического состояния обоих реагентов. и продукты. Таким образом, если вода была получена в виде газа, а не жидкости в реакции в формуле.\ (\ ref {1} \) значение Δ H м будет отличаться от -890,4 кДж. Также необходимо указать как температуру, так и давление, поскольку значение Δ H м очень слабо зависит от этих переменных. Если они не указаны, они обычно относятся к 25 ° C и нормальному атмосферному давлению.
и продукты. Таким образом, если вода была получена в виде газа, а не жидкости в реакции в формуле.\ (\ ref {1} \) значение Δ H м будет отличаться от -890,4 кДж. Также необходимо указать как температуру, так и давление, поскольку значение Δ H м очень слабо зависит от этих переменных. Если они не указаны, они обычно относятся к 25 ° C и нормальному атмосферному давлению.
Еще две характеристики термохимических уравнений вытекают из закона сохранения энергии. Во-первых, запись уравнения в обратном направлении меняет знак изменения энтальпии. Например,
\ [\ text {H} _ {2} \ text {O} (l) \ rightarrow \ text {H} _ {2} \ text {O} (g) \\ \ Delta \ text {H} _ {m } = 44 \ text {кДж} \]
На изображении выше пламя вводит энергию в воду, давая ей энергию, необходимую для перехода в газовую фазу. Поскольку пламя обеспечивает энергию для фазового перехода, это эндотермическая реакция (энергия поглощается).
говорит нам, что когда моль жидкой воды испаряется, поглощается 44 кДж тепла. Это соответствует тому факту, что при испарении пота ваша кожа поглощает тепло, и вы остываетесь.С другой стороны, при конденсации 1 моля водяного пара выделяется точно такое же количество тепла.
Это соответствует тому факту, что при испарении пота ваша кожа поглощает тепло, и вы остываетесь.С другой стороны, при конденсации 1 моля водяного пара выделяется точно такое же количество тепла.
\ [\ text {H} _ {2} \ text {O} (g) \ rightarrow \ text {H} _ {2} \ text {O} (l) \\ \ Delta \ text {H} _ {m } = –44 \ text {кДж} \]
Это нелогично, но обычное летнее явление, показанное выше, на самом деле экзотермическое. Поскольку реакция не является сильно экзотермической (например, горение CH 4 ), нам трудно связать ее с выделением энергии. Термодинамика позволяет нам лучше понять на микроуровне изменения энергии, подобные этому.
Чтобы понять, почему это должно быть правдой, предположим, что Δ H м [Ур. (4a)] = 44 кДж, тогда как Δ H m [Ур. (4b)] = –50,0 кДж. Если мы возьмем 1 моль жидкой воды и позволим ему испариться, то будет поглощено 44 кДж. Тогда мы могли бы конденсировать водяной пар, и было бы выделено 50,0 кДж. У нас снова может быть 1 моль жидкой воды при 25 ° C, но у нас также будет 6 кДж тепла, которое было создано из ниоткуда! Это нарушило бы закон сохранения энергии.Единственный способ избежать проблемы состоит в том, чтобы Δ H m обратной реакции было равно по величине, но противоположно по знаку, чем Δ H m прямой реакции. То есть
У нас снова может быть 1 моль жидкой воды при 25 ° C, но у нас также будет 6 кДж тепла, которое было создано из ниоткуда! Это нарушило бы закон сохранения энергии.Единственный способ избежать проблемы состоит в том, чтобы Δ H m обратной реакции было равно по величине, но противоположно по знаку, чем Δ H m прямой реакции. То есть
\ [\ Delta \ text {H} _ {m} \ text {forward} = — \ Delta \ text {H} _ {m} \ text {reverse} \]
правил термохимических уравнений
Термохимические уравнения подчиняются некоторым легко запоминающимся правилам, которые делают их полезными для приложений, которые будут использоваться позже в этом модуле.
1. Если в определенном процессе происходит изменение энтальпии DH, обратный процесс имеет изменение энтальпии -DH.
H 2 O (т) H 2 O (л) DH = 6,00 кДж
Например, чтобы превратить один моль льда в жидкую воду, требуется ввести 6,00 кДж энтальпии. Таким образом, жидкая вода имеет на 6,00 кДж больше энтальпии, чем лед. Если должен произойти обратный процесс — замораживание воды до льда, вода должна потерять эту энтальпию.Таким образом, при замораживании одного моля жидкой воды до льда изменение энтальпии составляет -6,00 кДж.
Таким образом, жидкая вода имеет на 6,00 кДж больше энтальпии, чем лед. Если должен произойти обратный процесс — замораживание воды до льда, вода должна потерять эту энтальпию.Таким образом, при замораживании одного моля жидкой воды до льда изменение энтальпии составляет -6,00 кДж.
Между прочим, как вы можете видеть, энтальпия и другие термодинамические изменения во многом зависят от фаз реагентов и продуктов в термохимическом уравнении. Поэтому при написании термохимических уравнений необходимо всегда тщательно указывать фазы.
Примечание: процесс с положительным DH называется эндотермическим . Процесс с отрицательным DH называется экзотермическим .Таким образом, обратный эндотермический процесс является экзотермическим, а обратный экзотермический процесс является эндотермическим.
2. Умножение термохимического уравнения на константу также умножает термодинамическую величину на эту константу.
Если для плавления одного моля льда требуется 6,00 кДж энтальпии, то потребуется 2 * 6,00 или 12,0 кДж, чтобы растопить два моля льда, и 0,5 * 6,00 или 3,00 кДж, чтобы растопить 0,5 моль льда.
3. Термодинамическая величина для реакции применяется как , так как уравнение записывается как .Таким образом, его можно использовать как стехиометрическое соотношение с любым из реагентов или продуктов реакции. Например, в реакции:
H 2 (г) + Cl 2 (г) 2 HCl (г) DHº = -183 кДж
Вы можете использовать -183 кДж / моль H 2 , -183 кДж / моль Cl 2 или -183 кДж / 2 моль HCl в качестве стехиометрических соотношений в задаче фактор-метка.
Каково изменение энтальпии, когда 3,5 г H 2 (г) реагирует с Cl 2 (г) с образованием HCl (г)?
Термохимическое уравнение — Концепция — Видео по химии от Brightstorm
Термохимические уравнения — это сбалансированные химические уравнения, которые включают физические состояния всех реагентов и продуктов, а также изменение энергии.Если энергия является реагентом, реакция эндотермическая, но если энергия является продуктом, реакция экзотермическая.
Хорошо, иногда, когда вы имеете дело со сбалансированными термохимическими уравнениями, вам нужно включить количество энергии, которое либо поглощается, либо выделяется в этой реакции. Итак, мы собираемся называть этих ребят термохимическими уравнениями, и это сбалансированные химические уравнения, которые включают физические состояния всех реагентов и продуктов, которые они всегда должны иметь, и изменение энергии.Мы будем называть эту дельту H или изменение энтальпии. Итак, у меня есть несколько различных типов реакций, и я также включил в них изменения их энтальпии или энергии. Итак, у нас есть первая реакция, которая является простой реакцией комбинации или реакцией синтеза. И обратите внимание, что дельта H составляет 1625 килоджоулей, что означает, что он выделяет столько энергии в атмосферу. Итак, когда эти два парня объединяются и образуют ржавчину, мы выделяем 1625 килоджоулей тепла, хорошо, отлично.
У нас тоже есть реакция, или это на самом деле реакция растворимости. У нас есть вещество нитрат аммония, которое растворяется в некотором количестве воды и распадается на ионы, и на самом деле для этого потребуется некоторая энергия. 27 килоджоулей энергии. энергия, чтобы вызвать эту реакцию, это эндотермическая реакция, хорошо. Затем у нас также были все реакции горения, мы на самом деле будем обозначать это как дельта H гребешок, чтобы сказать, что это реакция горения.Итак, у нас сгорает глюкоза, и мы говорим, что она выделяет 2808 килоджоулей тепла, это много энергии, когда происходит реакция. И мы собираемся просто, эта маленькая расческа просто говорит мне, что это дельта H реакции горения.
Здесь у нас есть фазовые изменения, фазовые изменения также могут происходить через энергетические изменения, которые требуют энергии или высвобождают какую-то энергию. Это вода, переходящая из жидкости в газ, просто переход фазы, и переход фазы испарения от жидкости к испарению газа.Итак, мы собираемся обозначить это как дельта H vap, говорящее вам, что это энтальпия испарения, и для этого требуется 40,7 килоджоулей тепла, а затем мы также можем говорить о реакциях образования, означающих, что соединение или вещество, образующиеся из его элементов . Итак, у вас есть газообразный водород, соединяющийся с серой с образованием сероводорода, и мы собираемся сказать, что дельта H в этой форме говорит мне, что это реакция образования, и для эндотермической реакции требуется 33 килоджоуля тепла. Итак, мы можем получить, просто взглянув на это основное уравнение термохимического уравнения, мы можем получить много информации из него, и это в основном все различные химические уравнения [IB], с которыми вы столкнетесь.
термохимических уравнений | Протокол
6.7: Термохимические уравнения
Для химической реакции (системы), проводимой при постоянном давлении — с единственной работой, совершаемой за счет расширения или сжатия — энтальпия реакции (также называемая теплотой реакции, Δ H rxn ) равна теплообмен с окружающей средой ( q p ).
Изменение энтальпии — это обширное свойство, и оно зависит от количества реагентов, участвующих в реакции (или числа молей реагентов). Изменение энтальпии зависит от реакции, и важное значение имеют физические состояния реагента и продуктов. Экзотермическая реакция характеризуется значением -Δ H rxn , в то время как эндотермическая реакция имеет значение + Δ H rxn .
Поскольку количество тепла, выделяемого или поглощаемого в результате реакции, соответствует количеству каждого вещества, потребляемого или производимого в результате реакции, удобно использовать термохимическое уравнение для представления изменений как вещества, так и энергии.В термохимическом уравнении изменение энтальпии реакции показано как Δ H rxn , и обычно оно предоставляется в соответствии с уравнением реакции. Величина Δ H rxn указывает количество тепла, связанное с реакцией, показанной в химическом уравнении. Знак Δ H rxn указывает, является ли реакция экзотермической или эндотермической, как написано. В следующем уравнении 1 моль газообразного водорода и 1/2 моля газообразного кислорода (при определенной температуре и давлении) реагируют с образованием 1 моля жидкой воды (при той же температуре и давлении).
Это уравнение показывает, что 286 кДж тепла выделяется в окружающую среду. Другими словами, 286 кДж тепла выделяется (реакция экзотермична) на каждый моль потребляемого водорода или на каждый моль производимой воды. Следовательно, энтальпия реакции — это коэффициент преобразования, который можно использовать для расчета количества тепла, которое выделяется или поглощается во время реакций с участием определенных количеств реагентов и продуктов.
Если коэффициенты химического уравнения умножаются на некоторый коэффициент (т.е.е., если количество вещества изменяется), изменение энтальпии должно быть умножено на тот же коэффициент.
(увеличение в 2 раза)
(уменьшение в 2 раза)
Чтобы проиллюстрировать, что изменение энтальпии реакции зависит от физического состояния реагентов и продуктов, рассмотрим образование газообразной воды (или водяного пара). Когда 1 моль газообразного водорода и ½ моля газообразного кислорода реагируют с образованием 1 моля газообразной воды, выделяется только 242 кДж тепла, в отличие от 286 кДж тепла, которое выделяется при образовании жидкой воды.
Рекомендуемая литература
- Канагаратна, Себастьян Г. «Наглядное пособие для расчета энтальпии». Журнал химического образования 77, вып. 9 (2000): 1178.
- Кейфер, Дэвид. «Энтальпия и второй закон термодинамики». Журнал химического образования 96, вып. 7 (2019): 1407-1411.
- Халил, Мутасим И. «Расчет энтальпии реакции матричным методом». Журнал химического образования 77, вып.2 (2000): 185.
термохимических уравнений — научный класс [2021]
Вычисления физических изменений
Чтобы вычислить, сколько энергии было передано в реакции, нам нужно знать начальную и конечную энергию. Мы смотрим на общую энергию всех реагентов и общую энергию всех продуктов и определяем разницу (продукты минус реагенты).
Даже физические изменения могут иметь изменение энергии. Примером может служить переход воды из жидкости в газ.Полная энергия жидкой воды составляет -285 кДж / моль, а полная энергия газообразной воды составляет -242 кДж / моль. Если мы разорвем все связи в жидкой воде, высвободится 285 кДж / моль, но если мы разорвем все связи в газообразной воде, высвободится только 242 кДж / моль. Это означает, что когда вода превращается из жидкости в газ, в окружающую среду выделяется энергия 43 кДж / моль (-285 — (-242) = -43). Это имеет смысл, потому что связи в газообразной воде не так плотно упорядочены, поэтому они не удерживают в себе столько энергии, сколько в жидкой воде.Правильно сбалансированное термохимическое уравнение включает дельта -43 кДж / моль:
Когда мы возвращаемся в уравнение назад, знак энергии меняется. Чтобы перейти от газообразной воды к жидкой, нам нужно затратить 43 кДж / моль энергии. Нам нужно добавить тепла или энергии.
Когда мы смотрим на изменение энергии, мы смотрим на разницу от начала до конца. Часто где-то посередине все еще необходимо добавить энергию, называемую энергией активации, но как только экзотермическая реакция завершена, она находится в более низком энергетическом состоянии.
Вычисления экзотермических реакций
Давайте посмотрим на другой пример, на этот раз реорганизуемые связи.
Если нам дана информация, что теплота образования для каждого из соединений будет следующей:
- Фосфат натрия: -1936 кДж / моль
- Хлорид магния: -642 кДж / моль
- Хлорид натрия: -411 кДж / моль
- Фосфат магния: -466 кДж / моль
Суммирование полной энергии каждого из реагентов дает:
(2 * -1936) + (3 * -642) = -5798.
Всего в реагентах содержится -5798 кДж / моль энергии.
Общая энергия в продуктах:
(6 * -411) + (- 466) = -2,932.
В продуктах содержится -2932 кДж / моль энергии.
Поскольку -5798 — (-2932) = -2866, произошло выделение 2866 кДж / моль энергии, вероятно, в виде тепла.
Знак минус означает, что энергия была выделена. Обратите внимание, что мы умножили каждое соединение на стехиометрический коэффициент, который представляет собой количество молей каждого соединения в сбалансированном химическом уравнении.Это связано с тем, что теплота сгорания дается на моль, поэтому, если в реакции участвуют два моля фосфата натрия, нам нужно умножить теплоту сгорания на два.
Расчеты эндотермических реакций
Для протекания эндотермической реакции необходимо вложить в реакцию энергию. Напомним, что экзотермические реакции все еще могут потребовать ввода энергии активации, но в конце концов высвободят всю эту энергию плюс больше.При эндотермических реакциях энергия должна быть вложена, и в конечном итоге она не будет выделяться.
Фотосинтез — очень важная эндотермическая реакция. Во время фотосинтеза дополнительная энергия поступает от света, а не от тепла.
Энтальпия образования:
- Двуокись углерода: -394 кДж / моль
- Вода: -286 кДж / моль
- Глюкоза: -1275 кДж / моль
- Кислород: 0 кДж / моль
Реагенты: (6 * -394) + (6 * -286) = -4,080
Продукты: -1275 + (6 * 0) = -1275
Изменение: -1275 — (-4080) = 2805
Было изменение на положительную величину 2805 кДж / моль.Это означает, что растениям нужно было добавить 2805 кДж / моль энергии, чтобы они могли производить глюкозу. Для производства глюкозы растениям требуется много энергии. В уравненное уравнение входит энергия света:
Резюме урока
Термохимические уравнения включают перенос энергии, так что мы можем видеть, является ли реакция экзотермической или эндотермической . Количество энергии в соединении можно определить, сжигая его в калориметре и наблюдая, сколько тепла оно выделяет.Эти энтальпии были определены ранее, и их можно найти на диаграмме энтальпии образования или горения .
Чтобы вычислить, является ли реакция эндотермической или экзотермической, сначала добавьте общую энтальпию образования реагентов и общую энергию образования продуктов. Затем вычтите общую энергию реагента из общей энергии продукта. Если в результате была выделена отрицательная энергия, это экзотермический эффект. Если результат положительный, значит, он использует энергию и является эндотермическим.
Расчеты стехиометрии с использованием энтальпии
7.4 Расчеты стехиометрии с использованием энтальпии
Цель обучения
- Выполните расчеты стехиометрии, используя изменения энергии из термохимических уравнений.
В главе 5 «Стехиометрия и моль» мы связали количества одного вещества с другим в химическом уравнении, выполнив вычисления с использованием сбалансированного химического уравнения; сбалансированное химическое уравнение обеспечило эквивалентности, которые мы использовали для построения коэффициентов пересчета.Например, в сбалансированном химическом уравнении
2H 2 (г) + O 2 (г) → 2H 2 O (ℓ)
мы признали эквиваленты
2 моль H 2 ⇔ 1 моль O 2 ⇔ 2 моль H 2 O
, где ⇔ — математический символ, обозначающий «эквивалентно.» Однако в нашем термохимическом уравнении есть другая величина — изменение энергии:
2H 2 (г) + O 2 (г) → 2H 2 O (ℓ) Δ H = −570 кДж
Это новое количество позволяет нам добавить еще один эквивалент к нашему списку:
2 моль H 2 ⇔ 1 моль O 2 ⇔ 2 моль H 2 O ⇔ −570 кДж
То есть, теперь мы можем добавить количество энергии к эквивалентностям — изменение энтальпии сбалансированной химической реакции.Эту эквивалентность также можно использовать для построения коэффициентов пересчета, чтобы мы могли соотнести изменение энтальпии с количествами прореагировавших или произведенных веществ.
Обратите внимание, что эти эквиваленты решают проблему. Когда указано количество энергии для сбалансированной химической реакции, к какому количеству реагентов или продуктов оно относится? Ответ заключается в том, что количество молей вещества определяется его коэффициентом в сбалансированной химической реакции. Таким образом, 2 моль H 2 относятся к -570 кДж, а 1 моль O 2 относятся к -570 кДж.Вот почему единицей измерения изменения энергии является кДж, а не кДж / моль.
Например, рассмотрим термохимическое уравнение
H 2 (г) + Cl 2 (г) → 2HCl (г) Δ H = -184,6 кДж
Эквивалентность этого термохимического уравнения:
1 моль H 2 ⇔ 1 моль Cl 2 ⇔ 2 моль HCl ⇔ −184,6 кДж
Предположим, мы спросили, сколько энергии выделяется при реакции 8,22 моль H 2 . Мы бы построили коэффициент преобразования между числом молей H 2 и выделяемой энергией, −184.6 кДж:
8,22 моль h3 × −184,6 кДж1 моль h3 = −1,520 кДж
Знак минус означает, что выделяется столько энергии.
Пример 8
Учитывая термохимическое уравнение
N 2 (г) + 3H 2 (г) → 2NH 3 (г) Δ H = -91,8 кДж
сколько энергии выделяется при реакции 222,4 г N 2 ?
Решение
Сбалансированное термохимическое уравнение связывает изменение энергии с молями, а не с граммами, поэтому мы сначала переводим количество N 2 в моль, а затем используем термохимическое уравнение для определения изменения энергии:
222.4 г N2 × 1 моль N228,00 г N2 × −91,8 кДж1 моль N2 = −729 кДж
Проверьте себя
Учитывая термохимическое уравнение
N 2 (г) + 3H 2 (г) → 2NH 3 (г) Δ H = -91,8 кДж
сколько тепла выделяется, когда вступает в реакцию 1,00 г H 2 ?
Ответ
−15,1 кДж
Как и любая стехиометрическая величина, мы можем начать с энергии и определить количество, а не наоборот.
Пример 9
Учитывая термохимическое уравнение
N 2 (г) + O 2 (г) → 2NO (г) Δ H = 180,6 кДж
Если подано 558 кДж энергии, какую массу NO можно получить?
Решение
На этот раз мы начнем с количества энергии:
558 кДж × 2 моль NO 180,6 кДж × 30,0 г NO1 моль NO = 185 г NO
Проверьте себя
Сколько грамм N 2 прореагирует, если 100.Поставляется 0 кДж энергии?
N 2 (г) + O 2 (г) → 2NO (г) Δ H = 180,6 кДж
Ответ
15,5 г
Химия везде: сварка с химическими реакциями
Одна очень энергичная реакция называется термитной реакцией . Его классические реагенты — металлический алюминий и оксид железа (III); реакция дает металлическое железо и оксид алюминия:
2Al (s) + Fe 2 O 3 (s) → Al 2 O 3 (s) + 2Fe (s) Δ H = −850.2 кДж
При правильном проведении реакция выделяет столько энергии, что железо выделяется в виде жидкости . (Обычно железо плавится при температуре 1536 ° C.) При осторожном обращении жидкий чугун может заполнять промежутки между двумя или более металлическими частями и после быстрого охлаждения может сваривать металлические части вместе.
Термитные реакции используются для этой цели и сегодня. В гражданских целях они используются для переваривания сломанных осей локомотивов, которые нелегко снять для ремонта.Они используются для сварки железнодорожных путей. Реакции термитов также можно использовать для отделения тонких кусков металла, если по какой-либо причине горелка не работает.
В небольшом глиняном горшочке находится термитная смесь. На фотографии он реагирует при высокой температуре и в конечном итоге образует расплавленный металл, который присоединится к железнодорожным путям под ним.
Реакции термитов также используются в военных целях. Смеси термитов часто используются с дополнительными компонентами в качестве зажигательных устройств — устройств, запускающих огонь.Реакции термитов также полезны для обезвреживания вражеского оружия: артиллерийское орудие не работает так хорошо, когда в его стволе есть дыра из-за термитной реакции!
Ключевые вынос
- Изменение энергии химической реакции можно использовать в расчетах стехиометрии.
Упражнения
Напишите эквивалентности, которые подразумевает это сбалансированное термохимическое уравнение.
PCl 3 (г) + Cl 2 (г) → PCl 5 (г) Δ H = -87,9 кДж
Напишите эквивалентности, которые подразумевает это сбалансированное термохимическое уравнение.
2SO 3 (г) → 2SO 2 (г) + O 2 (г) Δ H = 197,9 кДж
Сколько килоджоулей выделяется, когда 17.8 моль CH 4 (г) реагируют?
CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O (ℓ) Δ H = −890,1 кДж
Сколько килоджоулей поглощается при реакции 0,772 моль N 2 (г)?
N 2 (г) + 2NO (г) → 2N 2 O (г) Δ H = 73,8 кДж
Сколько килоджоулей поглощается, когда 23.09 моль C 6 H 6 (ℓ)?
6C (т) + 3H 2 (г) → C 6 H 6 (ℓ) Δ H = 49,0 кДж
Сколько килоджоулей выделяется при реакции 8,32 моля Mg?
2Mg (тв) + O 2 (г) → 2MgO (тв) Δ H = -1 213 кДж
Глюкоза является основным топливом, метаболизируемым в клетках животных:
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O Δ H = −2,799 кДж
Сколько энергии выделяется при 100.0 г C 6 H 12 O 6 реагировать?
Учитывая термохимическое уравнение
2Al (s) + Fe 2 O 3 (s) → Al 2 O 3 (s) + 2Fe (s) Δ H = −850,2 кДж
сколько энергии выделяется при производстве 288 г Fe?
Учитывая термохимическое уравнение
2CO 2 (г) → 2CO (г) + O 2 (г) Δ H = 566 кДж
сколько энергии поглощается при 85.2 г CO 2 реагируют?
Учитывая термохимическое уравнение
2Na + (водн.) + SO 4 2- (водн.) → Na 2 SO 4 (с) Δ H = 819,8 кДж
сколько энергии поглощается при реакции 55,9 г Na + (водн.)?
NaHCO 3 разлагается при нагревании:
2NaHCO 3 (с) → Na 2 CO 3 (с) + CO 2 (г) + H 2 O (ℓ) Δ H = 91.5 кДж
Какая масса NaHCO 3 разлагается на 256 кДж?
HgO разлагается при нагревании:
2HgO (s) → 2Hg (ℓ) + O 2 (г) Δ H = 181,6 кДж
Какую массу O 2 можно получить при 100,0 кДж?
Для термохимического уравнения
Fe 2 O 3 (с) + 3SO 3 (г) → Fe 2 (SO 4 ) 3 (с) Δ H = −570.2 кДж
какая масса SO 3 необходима для выработки 1 566 кДж?
Для термохимического уравнения
H 2 (г) + Br 2 (ℓ) → 2HBr (г) Δ H = −72,6 кДж
какая масса HBr образуется при выделении 553 кДж энергии?
ответы
1 моль PCl 3 ⇔ 1 моль Cl 2 ⇔ 1 моль PCl 5 ⇔ −87.9 кДж
.

 Сколько теплоты
Сколько теплоты Тепловой эффект
Тепловой эффект Реакция сопровождается выделением 111,4 кДж теплоты.
Реакция сопровождается выделением 111,4 кДж теплоты. Учитывая сказанное, составляем термохимическое уравнение данной
Учитывая сказанное, составляем термохимическое уравнение данной
 Для этого умножим уравнение (2) на два и вычтем найденное
Для этого умножим уравнение (2) на два и вычтем найденное