Содержание
Характерные химические свойства солей / Справочник :: Бингоскул
Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка)
Соли – это сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металлов.
Общим способом получения солей является взаимодействие оснований с кислотами:
NaOH + HCl = NaCl + H2O (так же эту реакцию называют реакцией нейтрализации, т.к. соли не имеют среды – она нейтральна)
Общая формула солей: Mex(Ac)y, где
- Me – металл,
- x и y – индексы,
- Ac – кислотный остаток.
Классификация солей
(III) Приставка «ди» используется, если в молекуле основной соли с одним атомом Me связаны с гидроксильными группами.
- Средние (нормальные) соли – это продукты полного замещения атомов водорода на металл.

Название средней соли = название Ac + название Me + валентность Me
- NaCl – хлорид натрия
- Fe(NO3)2 — нитрат железа (II)
- Кислые соли – это продукты неполного замещения атомов водорода на Me.
Название кислой соли = «Гидро» или «Дигидро» + название Ac + название Me + валентность Me
- NaHCO3 – гидрокарбонат натрия
- KH2PO4 – дигидрофосфат калия
- Основные соли – это соли, которые кроме ионов Me и Ac содержат гидроксогруппы.
Название основной соли = «Гидроксо-» или «Дигидроксо-» + название Ac + название Me + валентность Me
- CaOHCl – гидроксохлорид кальция
- Ca(OH)2SO4 – гидроксосульфат кальция
- Fe(OH)2NO3 – дигидроксонитрат железа
- Комплексные соли – соли, содержащие комплексный ион.

- [Ag(NH3)2]Сl – хлорид диаммин серебра (I)
- [Cu(NH3)4]SO4 – сульфат тетрааммин меди (II)
- K4[Fe(CN)6] – гексацианоферрат (II) калия
Химические свойства солей
I. Средние соли
- Растворимые соли в водных растворах диссоциируют на ионы – катионы Me и анионы Ac.
К примеру, хлорид калия в водном растворе распадается на катионы калия и анионы хлора.
KCl ↔ K— + Cl—
- Соли могут взаимодействовать с металлами, при этом каждый Me, стоящий левее в ряду напряжений Me, способен вытеснять Me, стоящие правее, из их солей.
Щелочные и щелочноземельные металлы с солями реагировать не будут, так как вступают в реакцию с водой.
Например, при взаимодействии сульфата меди с железом, происходит замещение меди железом, так как железо более активный металл, чем медь и находится в электрохимическом ряду напряжений левее водорода.

CuSO4 + Fe → FeSO4 + Cu↓
При взаимодействии сульфида железа с цинком происходит тот же процесс, но в данной реакции более активным металлом является цинк. Цинк вытесняет железо из соединения, в результате происходит образование чистого железа.
FeS + Zn → ZnS + Fe↓
- Реакция растворов солей с растворами щелочей возможна в том случае, когда образующиеся основание или соль выпадают в осадок.
Взаимодействие хлорида железа (III) с раствором гидроксида калия является качественной реакцией на ионы Fe3+. Продуктом реакции будет гидроксид железа (III), который представляет собой бурый осадок с амфотерными свойствами.
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
- При взаимодействии соли с кислотой, для того чтобы осуществилась реакция, необходимо образование более слабой кислоты или нерастворимой соли.
В представленной ниже реакции осуществляется взаимодействие между хлоридом бария и серной кислотой. Продуктами реакции являются нерастворимая соль и сильная кислота.
 Данная реакция является качественной на сульфаты, так как образуется сульфат бария – осадок белого цвета.
Данная реакция является качественной на сульфаты, так как образуется сульфат бария – осадок белого цвета. BaCl2 + h3SO4 → BaSO4↓ + 2HCl
- Для солей характерно взаимодействие между собой. В этом случае одним из продуктов реакции должна быть нерастворимая соль.
Взаимодействие нитрата серебра с хлоридом калия сопровождается выпадением осадка белого цвета – хлорида серебра. Эта реакция является качественной на хлорид-ионы.
AgNO3 + KCl → AgCl↓ + KNO3
- При нагревании разлагаются соли слабых кислот, соли аммония, а также образованные сильными окислителями или восстановителями.
- Все карбонаты при термическом разложении распадаются на основный оксид и углекислый газ.
- При разложении нитратов следует учитывать следующие условия:
- Если металл находится в ряду напряжений левее магния, то в результате реакции образуется нитрит и кислород. Реакция протекает по следующей схеме:
- Если металл расположен в электрохимическом ряду напряжений между магнием и медью, при этом будет происходить образование оксида металла, диоксида азота и кислорода.

- Если металл находится в ряду напряжений металлов правее меди, при этом наблюдается образование металла, оксида азота (IV) и кислорода.
- Разложение солей аммония также может протекать по-разному. Во многом это зависит от того, каким кислотным остатком она образована.
- Если в состав соли аммония входит кислотный остаток летучей кислоты, то в результате будет образовываться аммиак и летучая кислота.
- Если соль аммония образована нелетучей кислотой, то продуктами реакции будет аммиак и кислая соль.
- Если кислотный остаток соли проявляет окислительные свойства, то в результате разложения образуется молекулярный азот или оксид азота (I).
II. Кислые соли
- Растворимые соли в водных растворах диссоциируют на ионы – катионы Me и сложный анион Ac. Диссоциация протекает в две стадии. Первая стадия всегда необратима, по второй стадии протекает обратимая диссоциация.

KHSO4 → K— + HSO4—
HSO4— ↔ H+ + SO42— - Кислые соли могут взаимодействовать с металлами, стоящими левее водорода. Не стоит в таких реакциях использовать щелочные металлы, так как они прежде всего реагируют с водой. Реакция щелочных металлов с водой протекает бурно с выделением большого количества энергии, при таких условиях может произойти взрыв.
В результате данной реакции образуется средняя соль и водород. Гидросульфат калия при взаимодействии с магнием образует в качестве продуктов реакции молекулярный водород, сульфаты магния и калия.
2KHSO4 + Mg → H2↑ + MgSO4 + K2SO4
- При взаимодействии кислой соли с раствором щелочи образуется средняя соль и вода. Гидрокарбонат натрия способен вступать в реакцию с раствором щелочи, продуктами реакции будут сульфит натрия и вода.
NaHCO3 + NaOH → Na2SO3 + H2O
- При взаимодействии соли с кислотой, для того чтобы осуществилась реакция, необходимо образование более слабой или летучей кислоты.
 Этот процесс можно рассмотреть на примере реакции гидросульфида калия с серной кислотой. Продуктами реакции является летучая кислота – сероводородная, а также сульфат калия.
Этот процесс можно рассмотреть на примере реакции гидросульфида калия с серной кислотой. Продуктами реакции является летучая кислота – сероводородная, а также сульфат калия.2KHS + H2SO4 → K2SO4 + 2H2S
- Для кислых солей характерно взаимодействие со средними солями. Однако, при такой реакции должны образоваться вода, газ или осадок. В противном случае взаимодействие происходить не будет. Очень хорошо это просматривается на примере взаимодействия гидросульфата калия и хлорида бария. Продуктами реакции будут сульфат бария – осадок белого цвета, сульфат калия и хлороводородная кислота.
2KHSO4 + BaSO4↓ + K2SO4 + 2HCl
- При нагревании некоторые соли разлагаются. Ярким примером может служить разложение гидрокарбонатов. В результате реакции образуется вода, углекислый газ и карбонат натрия.
Реакции разложения гидрокарбонатов кальция и магния являются причиной образования накипи в водонагревательных приборах.

III. Основные соли
- Способны в водных растворах разлагаться на сложные катионы и анионы Ac. Диссоциация проходит в несколько ступеней, причем по первой ступени разложение проходит необратимо. Все последующие ступени протекают обратимо.
Al(OH)2CH3COO → Al(OH)2+ + CH3COO—
Al(OH)2+ ↔ AlOH2+ + OH—
Al(OH)2+ ↔ Al3+ + OH— - Основные соли могут взаимодействовать с растворами щелочей с образованием нерастворимого основания и кислой соли. Гидроксонитрат железа (III) и раствор едкого калия при взаимодействии друг с другом образуют нитрат калия и гидрокисд железа (II) – осадок белого цвета.
Fe(OH)NO3 + KOH → Fe(OH)2↓ + KNO3
- При взаимодействии основной соли с кислотой, образуется средняя соль и вода. Взаимодействие гидроксохлорида меди (II) и соляной кислоты протекает с образованием хлорида меди (II) и воды.

CuOHCl + HCl → CuCl2 + H2O
- Характерно термическое разложение основных солей. При разложении дигидроксокарбоната меди (II) образуется оксид меди (II), углекислый газ и вода.
IV. Комплексные соли
- Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, то есть как сильные электролиты (первичная диссоциация).
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4—
Комплексные ионы, в свою очередь, диссоциируют как слабые электролиты, многоступенчато и обратимо. Это — вторичная диссоциация комплексных ионов.
[Fe(CN)6]3— ⟷ [Fe(CN)5]2— + CN—
[Fe(CN)5]2— ⟷ [Fe(CN)4]— + CN—
[Fe(CN)4]— ⟷ [Fe(CN)3] + CN—
[Fe(CN)3] ⟷ [Fe(CN)2]+ + CN—
[Fe(CN)2]+ ⟷ [Fe(CN)2]2+ + CN—
[Fe(CN)]2+ ⟷ Fe3+ + CN—Данную многоступенчатую диссоциацию можно выразить суммарно в виде следующего уравнения:
[Fe(CN)6]3— ⟷ Fe3+ + 6CN—
- Комплексные соли способны вступать в реакции обмена со средними солями.
 В результате такой реакции образуется две другие соли – комплексная и средняя.
В результате такой реакции образуется две другие соли – комплексная и средняя.FeCl3 + K4[Fe(CN)6] = Fe4[Fe(CN)6]↓ + 3KCl
Данная реакция является качественной реакции на ионы Fe3+. Нерастворимое соединение, образовавшееся в результате реакции, обладает ультрамариновым цветом и получило название «берлинской лазури» или гексацианоферрат(II) железа(III)-калия.
- При нагревании комплексных солей происходит их разложение.
Тетрагидроксоалюминат натрия распадается на алюминат натрия и воду.
Na[Al(OH)4] → NaAlO2 + 2H2O
- При взаимодействии комплексной соли со средней, происходит разрушение комплексов за счёт образования малорастворимых соединений.
2[Cu(NH3)2]Cl + K2S → CuS↓ + 2KCl + 4NH3↑
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Взаимосвязь различных классов неорганических веществ
Кислые и средние соли | Дистанционные уроки
09-Дек-2014 | комментария 4 | Лолита Окольнова
Задания на соли встречаются в ЕГЭ не только в части А, но и в части С.
Давайте разберем основные примеры задач на
1. Определите, какое вещество, и в каком количестве образуется, если прореагировали (н.у.):
а) 0,2 моль Н2S и 0,2 моль КОН;
б) 2,24 л SO2 и 4 г NaOH;
в) 4,48 л СО2 и 7,4 г Са(ОН)2;
г) 4,48 л аммиака и 19,6 г серной кислоты;
д) 0,3 моль гидроксида натрия и 0,3 моль фосфорной кислоты;
е) 4,48 л аммиака и 100 г 9,8 %-ного раствора фосфорной кислоты;
ж) 14,2 г Р2О5 и 0,4 моль КОН;
з) 5,6 г оксида кальция и 0,2 моль серной кислоты.
Итак, как образуются кислые и средние соли?
Обычно это взаимодействие основного оксида или основания с кислотой или кислотным оксидом.
Какая соль образуется — зависит от соотношения реагентов
LiOH + h3SO3 = LiHSO3 + h3O (образовалась кислая соль)
(1 моль щелочи : 1 моль кислоты)
2LiOH + h3SO4 = Li2SO4 + 2h3O (образовалась средняя соль)
(2 моль щелочи : 1 моль кислоты)
Вывод:
- если в избытке основание, то образуется средняя соль;
- при эквимолярном соотношении — кислая соль
Обратите внимание — сравнивать нужно именно количества веществ — моли!
В нашем задании:
а) соотношение сероводорода и гидроксида калия 1:1, значит, получится кислая соль KHS;
б) 0,1 моль SO2 и 0,1 моль NaOH (формулы: n=m\Mr и т=V\V м).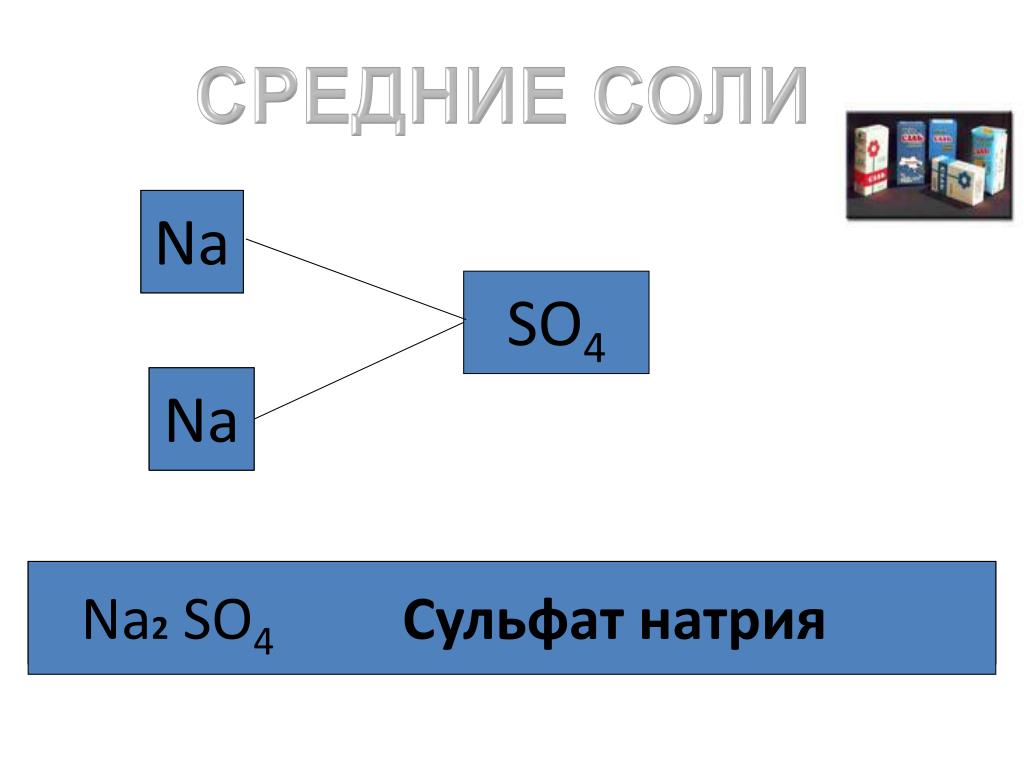 Соль — NaHSO3
Соль — NaHSO3
в) 0,2 моль CO2 и 0,1 моль Ca(OH)2:
CO2 + Ca(OH)2 = CaCO3 + h3O
Т.к. реагируют двухвалентный кальций и кислотный остаток имеет заряд -2, то образуется карбонат кальция — средняя соль
г) 0,2 моль Nh4 и 0.2 моль h3SO4. Соотношение 1:1, значит, получится соль — Nh5HSO4 — гидросульфат аммония;
д) NaOH и h4PO4. Соотношение 1:1. Получится Nah3PO4 — дигидрофосфат натрия — кислая соль;
e) 0.2 моль Nh4 и 0.1 моль (см. формулу массовой доли ω). Аммиак в избытке, значит, получится средняя соль — (Nh5)2SO4
ж) 0.1 моль P2O5 и 0,4 моль КОН
3KOH + h4PO4 = K3PO4 + 3h3O
Гидроксид калия дан в значительном избытке, значит, получится фософат калия — средняя соль
з) 0.1 моль CaO и 0.2 моль h3SO4
CaO + 2h3SO4 = Ca(НSO4)2 + h3O
2.
Определить количества растворенных веществ в растворе, полученном пропусканием через 200 г 4 %-ного раствора гидроксида натрия при н.у.:
а) 1,12 л углекислого газа;
б) 2,24 л сернистого газа;
в) 3,36 л сероводорода;
г) 4,48 л углекислого газа;
д) 20 г SO3.
n(NaOH)=m(раствора)*ω \Mr = 200 г*0.04 \40 г\моль = 0.2 моль
Выпишем все уравнения:
CO2 + 2NaOH = Na2CO3 + h3O
0,05 0.2 —> 0,05 моль
SO2 + 2NaOH = Na2SO3 + h3O
0.1 0.2 —> 0.1 моль
h3S + NaOH = NHS + h3O
0,15 0.2 моль —> 0,15 моль
CO2 + NaOH = NaHCO3
0.2 0.2 —> 0.2 моль
SO3 + NaOH = NaHSO4
0.25 0.2 —> 0.2 моль
Количества вещества продукта реакции находим традиционно по недостатку.
Еще на эту тему:
Обсуждение: «Кислые и средние соли»
(Правила комментирования)
2.
 3.1 Средние (или нормальные) соли
3.1 Средние (или нормальные) соли
Средние (или
нормальные) соли
− это продукты полного замещения атомов
водорода в молекулах кислот на ионы
металла, или продукты полного замещения
гидроксидных групп в молекулах оснований
(или амфотерного гидроксида) на кислотные
остатки. Средние соли состоят из ионов
металла и кислотного остатка, например:
KBr,
ZnSO4,
BaCl2,
Cu(NO3)2
и
др.
п
К2
олное замещение атомов водорода
H2SO4
SO4
кислота
ионами металла
средняя соль
полное замещение
гидроксильных групп
(NO3)3
Fe(OH)3
Fe
амфотерный гидроксид
кислотными остатками
средняя соль
Номенклатура (название) средних солей
Название средних
солей складывается из названия аниона
кислоты в именительном падеже и катиона
металла в родительном падеже, например:
Al2(SO4)3
– сульфат алюминия, KI
– иодид калия, CaCO3
– карбонат кальция и т. д. Если металл
д. Если металл
имеет переменную степень окисления, то
она указывается после названия металла
римской цифрой в скобках, например:
FeCl2
– хлорид железа (II), FeCl3
– хлорид железа (III).
Нужно помнить,
что в молекуле средней соли сумма
степеней окисления атомов металла,
равна сумме зарядов анионов кислоты.
Способы получения средних солей
Рассмотрим основные
способы получения средних солей.
1. Взаимодействие
оснований и амфотерных гидроксидов с
кислотами:
NaOH
+ HCl
→ NaCl
+ H2O,
Ba(OH)2
+ H2SO4
→ BaSO4
+ 2H2O,
Zn(OH)2
+ 2HNO3
→ Zn(NO3)2
+ 2H2O.
2. Взаимодействие
оснований с кислотными оксидами:
Ca(OH)2
+ CO2
→ CaCO3
+ H2O,
2NH4OH
+ SO3
→ (NH4)2SO4
+ H2O.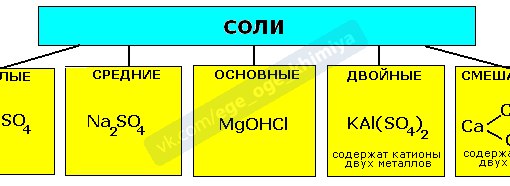
3. Взаимодействие
основных и амфотерных оксидов с кислотами:
BaO + H2SO4
→ BaSO4
+ H2O,
CuO +
2HNO3
→ Cu(NO3)2
+ H2O.
4. Взаимодействие
основных и амфотерных оксидов с кислотными
и амфотерными оксидами:
CaO
+ CO2
→ CaCO3,
ZnO
+ SO3
→ ZnSO4,
K2O
+ Al2O3
→ 2KAlO2.
5. Взаимодействие
растворимых оснований (щелочей) с солями:
2KOH+
FeSO4
→ K2SO4
+ Fe(OH)2.
6. Взаимодействие
солей с кислотами (смотрите ряд активности
кислот, помните
о ряде активности кислот):
AgNO3
+ HCl → AgCl↓ + HNO3,
BaCl2
+ H2SO4
→ BaSO4↓
+ 2HCl.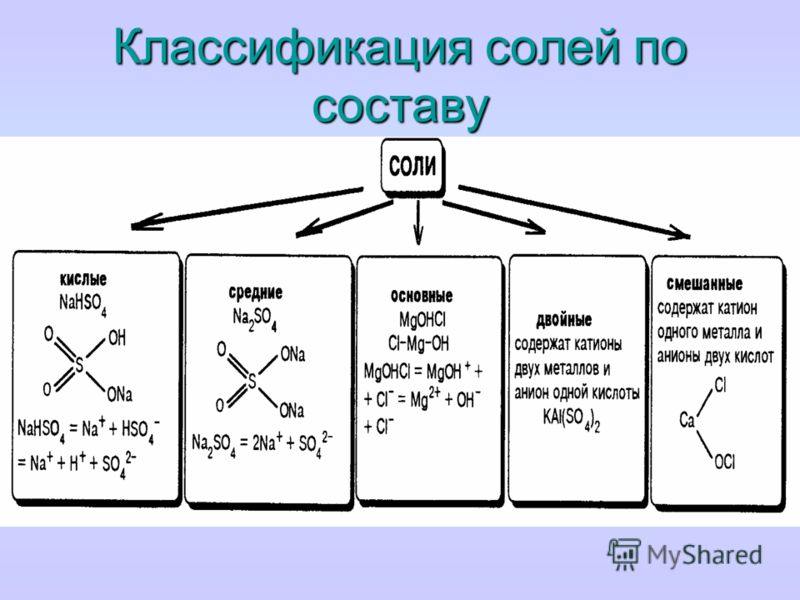
7. Взаимодействие
двух различных растворимых солей между
собой (если образуется труднорастворимая
соль):
AgNO3
+ NaCl → AgCl↓ + NaNO3,
Na2CO3
+ BaCl2
→ BaCO3↓
+ 2NaCl,
BaCl2
+ K2SO4
→ BaSO4↓
+ 2KCl.
8. Взаимодействие
металлов с кислотами. Водород выделяется
при взаимодействии активных металлов
с разбавленными растворами кислот,
кроме азотной кислоты HNO3
и концентрированной серной кислоты
H2SO4:
Mg
+ H2SO3
→ MgSO3
+ H2↑,
(разб)
Zn
+ 2HCl
→ ZnCl2
+ H2↑.
9. Взаимодействие
активных металлов с солями менее активных
металлов (смотри ряд напряжений
(активности) металлов):
Cu + HgCl2
→ CuCl2
+
Hg,
Zn +
Cu(NO3)2
→ Zn(NO3)2
+ Cu,
Fe + CuCl2
→ FeCl2
+ Cu.
10. Взаимодействие
металлов с неметаллами:
2Fe
+ 3Cl2
2FeCl3,
Fe + S
FeS,
2Na + Cl2
→ 2NaCl.
Кроме этих общих
способов получения солей возможны и
некоторые частные способы:
1. Сплавление солей
с некоторыми кислотными оксидами,
например:
K2CO3
+ SiO2
K2SiO3
+ CO2↑.
2. Взаимодействие
растворимых оснований (щелочей) с
галогенами, и некоторыми другими простыми
неметаллическими веществами, например:
Cl2
+ 2KOH
KCl + KClO + H2O;
3Cl2
+ 6KOH
5KCl + KClO3
+ 3H2O;
Br2
+ 2NaOH → NaBr + NaBrO + H2O.
3. Взаимодействие
активных галогенов с солями менее
активных галогенов галогенсодержащих
кислот. Окислительная активность
Окислительная активность
галогенов уменьшается в ряду: F2,
Cl2,
Br2,
J2:
2KBr
+ Cl2
→ 2KCl
+ Br2,
2NaJ
+ Br2
→ 2NaBr
+ J2.
Урок №8. Диссоциация кислот, оснований и солей
Диссоциация кислот,
оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают
определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов
образуются только катионы водорода (H +).
Например,
HCl -> H + + Cl —
HNO 3 -> H + + NO 3 —
Многоосновные кислоты диссоциируют ступенчато :
Н3РО4 ↔ Н+ + Н2РО—4
(первая ступень) – дигидроортофосфат ион
Н2РО—4 ↔ Н+
+ НРO2-4 (вторая ступень) – гидроортофосфат ион
НРО2-4 ↔ Н+ + PОЗ-4
(третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным
образом по первой ступени, в меньшей степени по второй и лишь в незначительной
степени — по третьей.
Диссоциация оснований
Основаниями называются электролиты, при диссоциации которых в качестве анионов
образуются только гидроксид-ионы (OH —).
Диссоциация щелочей | Диссоциация амфотерных оснований (амфолитов) |
Вспомните! Щёлочи – это Это LiOH, | Амфолиты — это электролиты, которые при диссоциации |
Примеры уравнений диссоциации щелочей KOH -> K + NH 4OH ↔ NH +4 + OH — Многокислотные Ba(ОН)2 -> Bа(ОН)+ + OH— (первая ступень) Ba(OH)+ | Примеры уравнений диссоциации амфолитов Н2O ↔ Н+ + ОН— Диссоциацию 2ОН— |
Диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы
металлов а также катион аммония (NH+4) и анионы кислотных
остатков.
Например, диссоциация средних солей :
(NH4)2SO4 -> 2NH+4+
SO2-4;
Na3PO 4 -> 3 Na + + PO
3- 4
Кислые же и основные соли диссоциируют ступенчато:
Например,
Диссоциация кислых солей | Диссоциация основных солей |
У кислых солей вначале отщепляются ионы металлов, а KHSO4 -> K + + HSO —4 ↔ | У основных солей вначале отщепляются кислотные Mg( OH )Cl -> Mg( OH )++ Mg ( OH )+↔ Mg2+ + OH— |
Тренажёр
№1 — Уравнения диссоциации электролитов
Тренажёр
№2 — Катионы и анионы
Тренажёр
№3 «Электролитическая диссоциация оснований»
Тренажёр
№4 «Электролитическая диссоциация кислот»
Тренажёр
№5 «Электролитическая диссоциация солей»
Памятка
– Определение солей
Памятка
– Определение кислот
Памятка
– Определение оснований
Памятка
– Схема диссоциации кислот
Памятка
– «Диссоциация многоосновных кислот (серная кислота)»
Интерактивная
таблица — «Анионы некоторых кислот»
ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ
№1.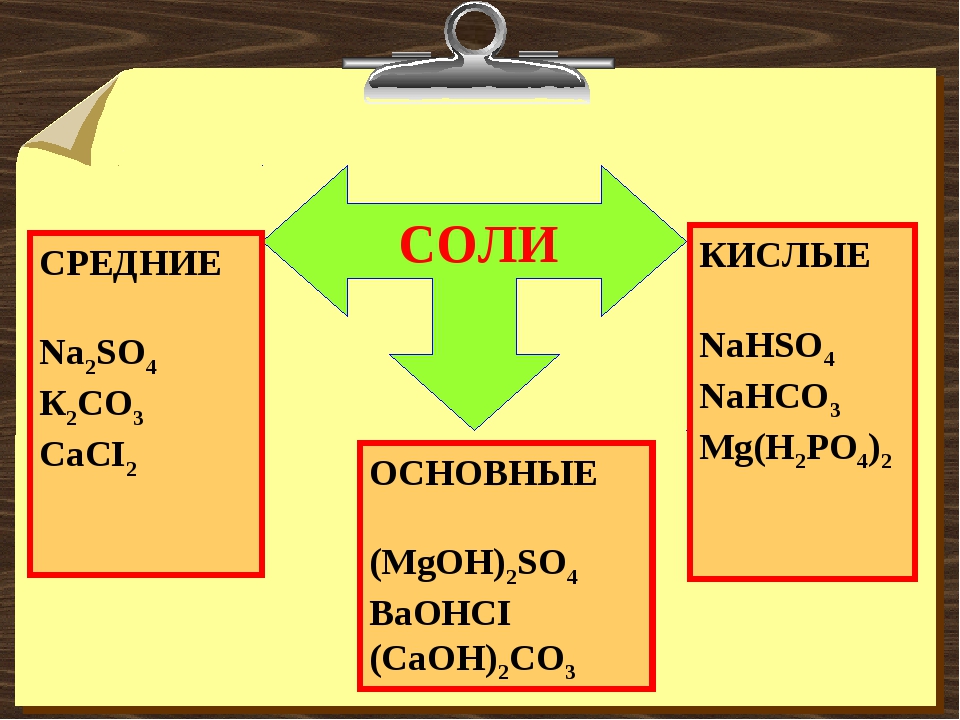 Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
HF, Mg(OH)2, CaCl2, Zn(NO3)2,Ba(OH)2, K2SO4, H2SiO3, FeI3, NiCl2, H3PO4
№2.
Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
Ca(OH)2
Na2CO3
Na3PO4
HNO3
KOH
Ba(OH)2
H2SO3
Ca(NO3)2
Ca3(PO4)2
H2S
NaOH
HBr
Виды соли, используемые при приготовлении пищи
Соль можно классифицировать, например, по способу производства и/или добычи, степени измельчения и очистки, содержанию натрия и примесей.
Хотя некоторые соли могут содержать больше разных минералов, чем обычная поваренная соль, их все же никак нельзя считать источниками соответствующих минералов (за искл. йодированной соли). При умеренном потреблении, независимо от вида соли, сопутствующие натрию минералы поступают в крайне малых количествах.
йодированной соли). При умеренном потреблении, независимо от вида соли, сопутствующие натрию минералы поступают в крайне малых количествах.
Никакая соль не может стать полноценным источником минеральных веществ. Это означает, что не нужно есть соль с целью получения минеральных веществ.
МОРСКАЯ СОЛЬ
Морскую соль получают путем выпаривания морской воды в специальных ваннах или прудах под действием солнца. Чистота морской соли зависит от состава и чистоты морской воды, из которой она производится. Кристаллы этой соли крупные, неровные. Помимо хлорида натрия, морская соль может содержать некоторое количество йода, кальция, магния и калия.
СОЛЬ ГРУБОГО ПОМОЛА, ИЛИ КАМЕННАЯ СОЛЬ
Грубую, или каменную соль по преимуществу добывают из подземных залежей. Каменная соль имеет грязно-серый цвет. В залежах каждого конкретного месторождения содержатся различные примеси, поэтому стабильной и/или равномерной чистоты каменной соли добиться почти невозможно.
ПОВАРЕННАЯ, ИЛИ СТОЛОВАЯ СОЛЬ
В случае поваренной соли основная часть воды удаляется из соляного раствора кипячением или выпариванием, после чего при помощи мощных центрифуг отделяется оставшаяся вода, чтобы в конце процесса влажность соли составляла около 3%. После дополнительной сушки получается равномерно чистая, мелкозернистая качественная поваренная соль.
ЙОДИРОВАННАЯ СОЛЬ
Йодированная соль обычно представляет собой столовую или минеральную соль с добавлением йода. Добавление йода не меняет вкуса соли. Йодированная соль – хороший способ получить недостающее количество необходимого организму йода.
ПАН-СОЛЬ
Пан-соль получают путем уменьшения содержания натрия в обычной столовой соли и добавлением 25–40% хлорида калия и 10% сульфата магния. Кроме того, в пан-соли есть аминокислота лизин, которая устраняет металлический привкус йода. В двух чайных ложках пан-соли содержится столько же натрия, сколько в одной чайной ложке поваренной соли.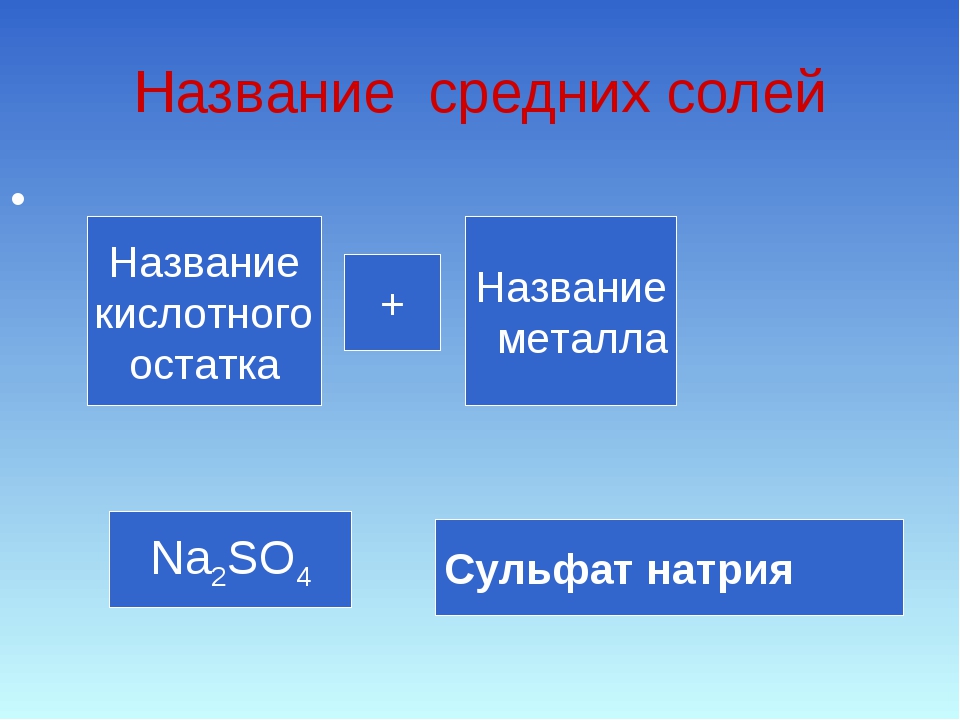 В действительности при употреблении пан-соли потребление натрия нередко не сокращается, поскольку ее добавляют в пищу в больших количествах, чтобы добиться привычного вкуса пищи.
В действительности при употреблении пан-соли потребление натрия нередко не сокращается, поскольку ее добавляют в пищу в больших количествах, чтобы добиться привычного вкуса пищи.
Источниками значимого количества минеральных веществ являются зерновые (особенно цельнозерновые продукты), картофель, фрукты и овощи, а также ягоды, молоко и молочные продукты, рыба, птица, яйца, мясо, добавляемые пищевые жиры, орехи, семена, плоды масличных культур, но не соль. Только йодированную соль можно считать полноценным источником йода.
Помимо обычной соли, в продаже можно найти разноцветные соли с разными названиями (например, Rose, Himaalaja, Hawai, Pärsia), состав и цвет которых зависят от места производства. Несмотря на то, что в их составе зачастую приведен целый список минералов, ни одна из этих солей не содержит ни один из минералов в таком количестве, чтобы оно покрыло значимую часть суточной потребности.
Кроме того, выпускается соль с различными вкусовыми нюансами. Это, например, ароматизированная, чесночная, копченая соль. Соль добавляется и во многие смеси пряностей (например, в перцовую смесь). Так что в случае смесей пряностей нужно обязательно читать маркировку, чтобы узнать, сколько соли они содержат.
Это, например, ароматизированная, чесночная, копченая соль. Соль добавляется и во многие смеси пряностей (например, в перцовую смесь). Так что в случае смесей пряностей нужно обязательно читать маркировку, чтобы узнать, сколько соли они содержат.
В производстве мяса часто используется соль с добавлением нитрита. Нитритная соль – соль высокой степени очистки, специально предназначенная для мясной промышленности. Эта соль придает мясу розовато-красный цвет и сдерживает развитие нежелательных микроорганизмов, продлевая тем самым срок годности продукта.
Соли средние — Справочник химика 21
Сероводородная кислота может реагировать с основаниями, основными окислами или солями, образуя два ряда солей средние — сульфиды, кислые — бисуль фиды (или гидросульфиды). Большинство сульфидов (за исключением сульфидов щелочных и щелочноземельных металлов, а также сульфида аммония) плохо растворимо в воде. Сульфиды, как соли очень слабой кислоты подвергаются гидролизу. Например, сульфид натрия очень сильно гидролизуется, давая щелочной раствор (см. 6, гл. VH). [c.294]
Например, сульфид натрия очень сильно гидролизуется, давая щелочной раствор (см. 6, гл. VH). [c.294]
Какие соли (средние, кислые или основные) могут быть получены при взаимодействии 1) гидроокиси железа с уксусной кислотой, 2) гидроокиси алюминия с серной кислотой, 3) едкого натра с ортофосфорной кислотой Напишите названия и структурные формулы всех полученных солей. [c.140]
Как двухосновная кислота, угольная кислота образует два ряда солей — средние и кислые средние соли называются карбона т а м и, кислые — гидрокарбонатами. [c.439]
Средняя соль кислая соль средний эфир кислый эфир [c.160]
Карбонаты — соли угольной кислоты. Известны два ряда солей средние (карбонаты) и кислые (гидрокарбонаты). Без разложения плавятся только карбонаты щелочных металлов. Остальные карбонаты при нагревании разлагаются [c.135]
Помимо обычных мыл — щелочных солей средних и высших жирных кислот — к коллоидным ПАВ относится большое число веществ (синтетических и природных), близких к ним по строению молекул и проявляющих сходные физикохимические и технологические свойства. [c.9]
[c.9]
Как кислота двухосновная, серная кислота образует два ряда солей средние и кислые. Средние соли серной кислоты называются сульфатами, а кислые — гидросульфатами. [c.464]
Угольная кислота двухосновна, ее сила характеризуется следующими константами электролитической диссоциации /fi = 4,5-10 /С2 = 4,7-10 . Она образует два ряда солей средние (карбонаты) и кислые (гидрокарбонаты). Из средних солей растворимы только карбонаты щелочных металлов и аммония. Все гидрокарбонаты растворимы в воде. [c.197]
Ортофосфорная кислота не принадлежит к числу сильных кислот. Ее константы кислотности равны Л к1 = 8 10 , К 2 = 6 10″ , А кз = 10 . Будучи трехосновной, она образует три ряда солей средние и кислые с одним или с двумя атомами водорода в кислотном остатке. Средние соли фосфорной кислоты называют ортофосфатами или просто фосфатами, кислые — гидрофосфатами [c.445]
Химические свойства. Се]) 1ая кислота является кислотой сильной. Кроме того, это кислота двухосновная, следовательно, образует соли средние (сульфаты) и кислые (бисульфаты). [c.194]
Кроме того, это кислота двухосновная, следовательно, образует соли средние (сульфаты) и кислые (бисульфаты). [c.194]
Соли. Группы солей-средние, кислые, основные, двойные, еме-нкшныс. Номенклатура солей и их химические свойства. [c.91]
Очень интересным свойством эмульгаторов является их способность образовывать определенный тип эмульсии. Оказалось, что незначительные изменения в составе некоторых эмульгаторов могут вызвать обращение эмульсии, которую они стабилизируют. Например, щелочные соли средних жирных кислот дают эмульсии типа М/В, а соли этих же кислот с двухвалентными металлами (например, с магнием) — эмульсию В/М. Если в эмульсии М/В, стабилизированной мылом с одновалентным катионом, постепенно увеличивать концентрацию двухвалентных ионов, то можно вызвать обращение этой эмульсин в эмульсию В/М, причем в некоторой промежуточной области концентраций оба типа эмульсий оказываются неустойчивыми. [c.245]
Соли — соединения, которые при электролитической диссоциации образуют ионы металла и анионы кислотного остатка. Различают средние, кислые, оснбвные и двойные соли. Средние соли — продукты полного замещения атомов водорода в кислоте на металл. Кислые соли — продукты неполного замещения. Основные соли — продукты неполного замещения гидроксильных групп гидроксидов на кислотный остаток. Двойные соли содержат катионы двух разнородных металлов. На схеме 1 показана[ взаимосвязь между основными классами кислородсодержащих неорганических соединений и приведены формулы отдельных представителей этих классов [c.26]
Различают средние, кислые, оснбвные и двойные соли. Средние соли — продукты полного замещения атомов водорода в кислоте на металл. Кислые соли — продукты неполного замещения. Основные соли — продукты неполного замещения гидроксильных групп гидроксидов на кислотный остаток. Двойные соли содержат катионы двух разнородных металлов. На схеме 1 показана[ взаимосвязь между основными классами кислородсодержащих неорганических соединений и приведены формулы отдельных представителей этих классов [c.26]
Среди перечисленных солей указать соли средние (нормальные), кислые (гидросоли) и основные (гидроксосоли) [c.41]
Абсолютно бессмысленны графические формулы солей (средних, основных и кислых), так как соли имеют кристаллическую структуру, в которой молекул нет. [c.81]
Общеизвестно, что эмульгаторы поверхностно-активны. Но для того чтобы эмульгатор проявлял поверхностную активность к данной межфазной границе, т. е. адсорбировался на ней, его сродство к обеим фазам должно иметь один и тот же порядок. Если это условие не выполнено, то эмульгатор перейдет в ту фазу, к которой он обладает большим сродством. Типичный пример хорошо сбалансированных в этом отношении поверхностно-активных ве-шеств — некоторые мыла, молекулы которых состоят из углеводородного хвоста с сильным сродством к М и ионизированной головы со значительным сродством к В. При очень коротком хвосте (низкомолекулярные мыла) преобладает сродство к В, и молекула эмульгатора всасывается в фазу В такой эмульгатор считается слабо сбалансированным . При очень длинном хвоста> преобладает сродство к М — эмульгатор опять плохо сбалансирован . Следует ожидать, что при определенном среднем соотношении размеров головы и хвоста их свойства будут оптимально сбалансированы , что даст наибольший стабилизирующий эффект. Действительно, наилучшими эмульгаторами оказываются соли средних жирных кислот, такие, как олеат и стеарат. [c.245]
Если это условие не выполнено, то эмульгатор перейдет в ту фазу, к которой он обладает большим сродством. Типичный пример хорошо сбалансированных в этом отношении поверхностно-активных ве-шеств — некоторые мыла, молекулы которых состоят из углеводородного хвоста с сильным сродством к М и ионизированной головы со значительным сродством к В. При очень коротком хвосте (низкомолекулярные мыла) преобладает сродство к В, и молекула эмульгатора всасывается в фазу В такой эмульгатор считается слабо сбалансированным . При очень длинном хвоста> преобладает сродство к М — эмульгатор опять плохо сбалансирован . Следует ожидать, что при определенном среднем соотношении размеров головы и хвоста их свойства будут оптимально сбалансированы , что даст наибольший стабилизирующий эффект. Действительно, наилучшими эмульгаторами оказываются соли средних жирных кислот, такие, как олеат и стеарат. [c.245]
С. к. образует два типа солей средние — сульфиты и кислые — гидросульфиты.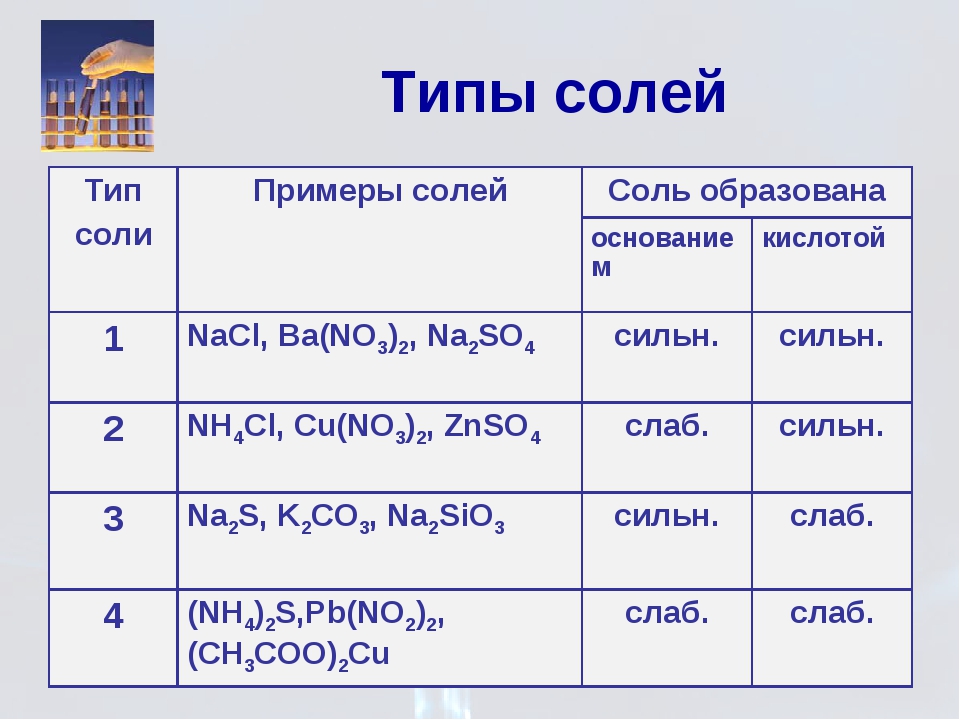 С к. и ее соли являются восстановителями, но при взаимодействии с сильными восстановителями С. к. играет роль окислителя [c.225]
С к. и ее соли являются восстановителями, но при взаимодействии с сильными восстановителями С. к. играет роль окислителя [c.225]
Средние соли. Средняя соль в сущности есть электролит — сильный или слабый, растворимый или нерастворимый (практически), который при электролитической диссоциации образует положительные ионы металла и отрицательные ионы кислотного остатка. Принято также среднюю соль опреде.,1ять как продукт полной нейтрализации кислоты щелочью. Это последнее определение сложилось исторически и базировалось на реакции получения солей нейтрализацией кислот основаниями. Но в настоящее время известно очень много других способов получения солей и не так редки случаи, когда соответствующие кислоты неизвестны (неустойчивы). [c.180]
Будучи двухосновной (К 2Л0 , /(г = 6,3 10 ), сернистая кислота обра ует два ряда солей. Средние ее соли называются сульфитами, кислые — гидросульфитами. [c.386]
Интересными свойствами обладают различные металлические соли щавелевой кислоты. В соответствии с двухосновностью кислоты известны два ряда солей средние и кислые. Средние [c.339]
В соответствии с двухосновностью кислоты известны два ряда солей средние и кислые. Средние [c.339]
Для получения солей (средних, кислых, основных) используются следующие способы [c.162]
Угольная кислота образует два типа солей средние — карбонаты и кислые — гидрокарбонаты (старое название бикарбонаты). [c.91]
Амфотерные гидроксиды 74, ПО Соли средние и кислые 65, 72, 73, 77. их свойства и названия 72, 77. [c.187]
Будучи двухосновной, угольная кислота образует два ряда солей — средние (карбонаты) и кислые (гидрокарбонаты), которые могут быть получены действием СО на щелочи (см. выше) или обменными реакциями [c.76]
В соответствии со своей электролитической характеристикой h3SO4 дает два ряда солей средние— сульфаты Me SO 11 кислые — гидратов гидросульфаты MeHSOj. [c.578]
Константа диссоциации h3SO3 по первой ступени равна / i = l,6-10″ , по второй — /(2=6,3-Ю . Являясь двухосновной кислотой, сернистая кислота дает два ряда солей средние — сернистокиелые, сульфиты, и кислые — бисульфиты, гидросульфиты. [c.295]
Являясь двухосновной кислотой, сернистая кислота дает два ряда солей средние — сернистокиелые, сульфиты, и кислые — бисульфиты, гидросульфиты. [c.295]
Будучи двухосновной, сернистая кислота дает два ряда солей средние (сульфиты) и кислые (бисульфиты). Подобно самим ионам sor и HSO3, те и другие, как правило, бесцветны. Почти все бисульфиты устойчивы только в растворах, а из сульфитов хорошо растворимы главным образом соли натрия и калия. [c.314]
Сероводород образует два типа солей средние — сульфиды, например NajS, и кислые — гидросульфиды, например NaHS. Эти соли могут быть получены взаимодействием гидроксидов с сероводородом [c.184]
Буду чи трехосновной, образует три ряда солей средние — фосфаты и кистые [c.82]
Сернистая кислота как двухосновная образует два типа солей средние — сульфиты, например НазЗОз, и кислые — гидросульфиты, например КаН80з. [c.186]
Как двухосновная, серная кислота образует два ряда солей — средние (сульфаты) и кислые (1Идросулъфаты). Большинство их хорошо растворяется в воде. К практически нерастворимым относятся сульфаты бария, стронция и свинца. [c.87]
Большинство их хорошо растворяется в воде. К практически нерастворимым относятся сульфаты бария, стронция и свинца. [c.87]
Серная кислота образует два типа солей средние — сульфаты, например N32804, и кислые — гидросульфаты, например N311804. [c.191]
Сернистая кислота как двухосновная образует два типа сОлей средние — сульфиты, например Na2S03, и кислые — гидросульфиты, например NaHSOj. [c.207]
Будучи двухосновной кислотой, Н2СО3 дает два ряда солей средние (с анионом СОз ) и кислые (с анионом НСОГ). Первые называются углекислыми (иначе, карбонатами), вторые — кислыми углекислыми бикарбонатами). Подобно самим анионам угольной кислоты, большинство ее солей бесцветно. [c.494]
Угольная кислота образует два ряда солей средние—кароо-наты и кислые — гндрокарбонаты. От проявляют общие Boii TBa солен. [c.134]
Классификация неорганических веществ — Химия для Степы
Сложные вещества обычно делят на классы: оксиды, кислоты, основания, амфотерные гидроксиды и соли. Данная классификация несовершенна, т. к. в ней нет места для аммиака, соединений металлов с фосфором, азотом, углеродом и т. д.
Данная классификация несовершенна, т. к. в ней нет места для аммиака, соединений металлов с фосфором, азотом, углеродом и т. д.
Оксиды могут быть солеобразующими и несолеобразующими. Солеобразующим оксидам соответствуют гидроксиды и соли с элементом в той же степени окисления, что и в оксиде. Несолеобразующие оксиды не имеют соответствующих гидроксидов и солей. Таких оксидов немного: N2O, NO, SiO, CO.
Солеобразующие оксиды в зависимости от кислотно-основного характера делятся на кислотные, амфотерные и основные.
Основные оксиды образованы металлами с небольшими степенями окисления +1, +2. Амфотерные оксиды образованы переходными металлами со степенями окисления +3, +4, а также Be, Zn, Sn, Pb. Кислотные оксиды образованы неметаллами, а также металлами со степенью окисления больше, чем +4. Рис. 3.
______________________________________________
Гидроксиды
______________________________________________
Основания
ОСНОВАНИЯ
– это сложные вещества, состоящие из ионов металла и гидроксид-ионов.
Основания – это сложные вещества, состоящие из катионов металла и одного или нескольких гидроксид-анионов. В основу классификации оснований могут быть положены разные признаки. Например, их отношение к воде. По данному признаку основания делят на растворимые в воде (щелочи) и нерастворимые в воде.
______________________________________________
Амфотерные гидроксиды
это сложные вещества, которые имеют свойства и кислот, и оснований, и потому их формулы можно записывать в разных формах:
Zn(OH)2 = h3ZnO2
форма основания форма кислоты
______________________________________________
Кислоты
КИСЛОТЫ
– это сложные вещества, состоящие из ионов водорода и
кислотных остатков.
Кислоты – это сложные вещества, состоящие из атомов водорода, способных замещаться на металлы, и кислотных остатков. Кислоты можно разделить на группы по содержанию кислорода: кислородосодержащие (например, HNO3, h3SO4, h4PO4) и бескислородные (HI, h3S).
______________________________________________
Соли
СОЛИ
– это сложные вещества, состоящие из ионов металла и
кислотных остатков.
Средние соли состоят из катионов металла (или аммония) и анионов кислотных остатков. Кислые соли, кроме катионов металла, содержат катионы водорода и анион кислотного остатка. Основные соли в своем составе содержат гидроксид-анионы.
Если соль образована двумя видами катионов металлов и одним анионом, то ее называют двойной. Например, сульфат алюминия-калия KAl(SO4)2.
Соли с двумя разными анионами и одним катионом называют смешанными. Например, Са(OCl)Cl – хлорид-гипохлорит кальция.
В комплексных солях содержится сложный ион, который принято заключать в квадратные скобки.
______________________________________________
По материалам сайтов
http://interneturok.ru/ru/school/chemistry/11-klass/undefined/klassifikatsiya-i-nomenklatura-neorganicheskih-veschestv
солей, из которых производятся базовые растворы
Цель обучения
- Отличить основные соли от неосновных солей
Ключевые моменты
- В кислотно-основной химии соли — это ионные соединения, образующиеся в результате реакции нейтрализации кислоты и основания.

- Основные соли содержат сопряженное основание слабой кислоты, поэтому, когда они растворяются в воде, они реагируют с водой с образованием раствора с pH более 7.0.
Срок
- основная соль продукт нейтрализации сильного основания и слабой кислоты; его анион является сопряженным основанием слабой кислоты
В кислотно-основной химии соль определяется как ионное соединение, которое образуется в результате реакции нейтрализации между кислотой и основанием. Таким образом, соли состоят из катионов (положительно заряженных ионов) и анионов (отрицательных ионов), и в их несольватированных твердых формах они электрически нейтральны (без чистого заряда).Ионы, составляющие соль, могут быть неорганическими; примеры включают хлорид (Cl — ), органический ацетат (CH 3 COO — ) и одноатомный фторид (F — ), а также многоатомные ионы, такие как сульфат (SO 4 2− ).
Реакция основной соли в воде
Существует несколько разновидностей солей, и в этом разделе мы рассмотрим основные соли. Что делает основную соль основной? Это связано с тем, что анион в соли является сопряженным основанием слабой кислоты.- (водн.) [/ латекс]
Поскольку он способен депротонировать воду и давать щелочной раствор, бикарбонат натрия является основной солью.
Другие примеры основных солей включают:
- Карбонат кальция (CaCO 3 )
- Ацетат натрия (NaOOCCH 3 )
- Цианид калия (KCN)
- Сульфид натрия (Na 2 S)
Обратите внимание, что для всех этих примеров анион является сопряженным основанием слабой кислоты (угольная кислота, бисульфат (вторая стадия диссоциации серной кислоты), уксусная кислота, синильная кислота, сероводород).
Конъюгированные основания слабой и сильной кислот
Имейте в виду, что соль будет основной, только если она содержит сопряженное основание слабой кислоты . Например, хлорид натрия содержит хлорид (Cl — ), который является сопряженным основанием HCl. Но поскольку HCl является сильной кислотой, ион Cl – не является основным в растворе и не способен депротонировать воду.
Например, хлорид натрия содержит хлорид (Cl — ), который является сопряженным основанием HCl. Но поскольку HCl является сильной кислотой, ион Cl – не является основным в растворе и не способен депротонировать воду.
Бикарбонат натрия Поскольку бикарбонат-ион является сопряженным основанием с угольной кислотой, слабая кислота, бикарбонат натрия, образует щелочной раствор в воде.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Гидролиз солей: уравнения | Химия для неосновных специалистов
Цели обучения
- Определите гидролиз соли.
- Напишите уравнения солей, образующих основные растворы.
- Напишите уравнения солей, образующих кислые растворы.
- Напишите уравнения солей, образующих нейтральные растворы.
Выпечка печенья лучше
Выпечка кажется легкой со всеми доступными смесями в коробках («просто добавьте воды и перемешайте»).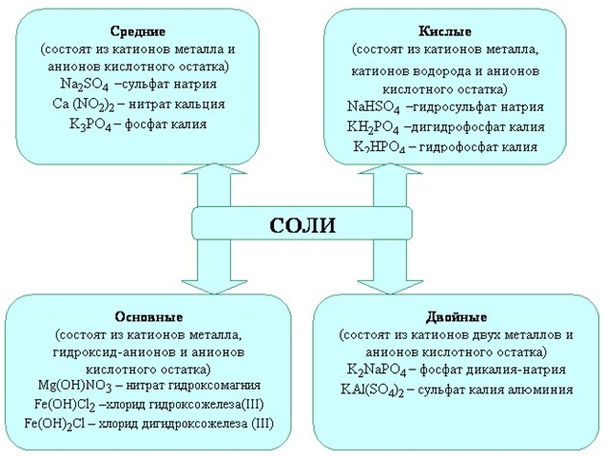 Однако выпечка включает в себя много химии — независимо от того, работаете ли вы с коробкой или с ингредиентами, которые вы отмеряете.
Однако выпечка включает в себя много химии — независимо от того, работаете ли вы с коробкой или с ингредиентами, которые вы отмеряете.
Одним из важных компонентов любого печенья является бикарбонат натрия (более известный как разрыхлитель). Если у вас рецепт без дрожжей, любая взбитость готового печенья обычно возникает из-за углекислого газа, образующегося из разрыхлителя.Одна популярная марка упакованной смеси использует комбинацию бикарбоната натрия и сульфата натрия и алюминия для производства CO 2 . Реакция видна ниже:
Если все пойдет хорошо, печенье поднимется, блины будут воздушными, и все будут довольны.
Гидролиз солей: уравнения
Соль — это ионное соединение, которое образуется, когда кислота и основание нейтрализуют друг друга. Хотя может показаться, что солевые растворы всегда будут нейтральными, они часто могут быть кислыми или щелочными.
Рассмотрим соль, образующуюся при нейтрализации слабокислой фтористоводородной кислоты сильным основным гидроксидом натрия. Молекулярные и чистые ионные уравнения показаны ниже.
Молекулярные и чистые ионные уравнения показаны ниже.
Поскольку фторид натрия растворим, ион натрия является ионом-наблюдателем в реакции нейтрализации. Фторид-ион способен в небольшой степени реагировать с водой, принимая протон.
Ион фтора действует как слабое основание Бренстеда-Лоури. Ион гидроксида, который образуется в результате вышеуказанной реакции, делает раствор слегка щелочным. Гидролиз соли — это реакция, в которой один из ионов соли реагирует с водой, образуя кислотный или щелочной раствор.
Соли, образующие основные растворы
Когда твердый фторид натрия растворяется в воде, он полностью диссоциирует на ионы натрия и ионы фтора. Ионы натрия не обладают способностью к гидролизу, но фторид-ионы гидролизуются с образованием небольшого количества фтористоводородной кислоты и гидроксид-иона.
Соли, полученные в результате нейтрализации слабой кислоты (HF) сильным основанием (NaOH), всегда будут давать солевые растворы, которые являются основными.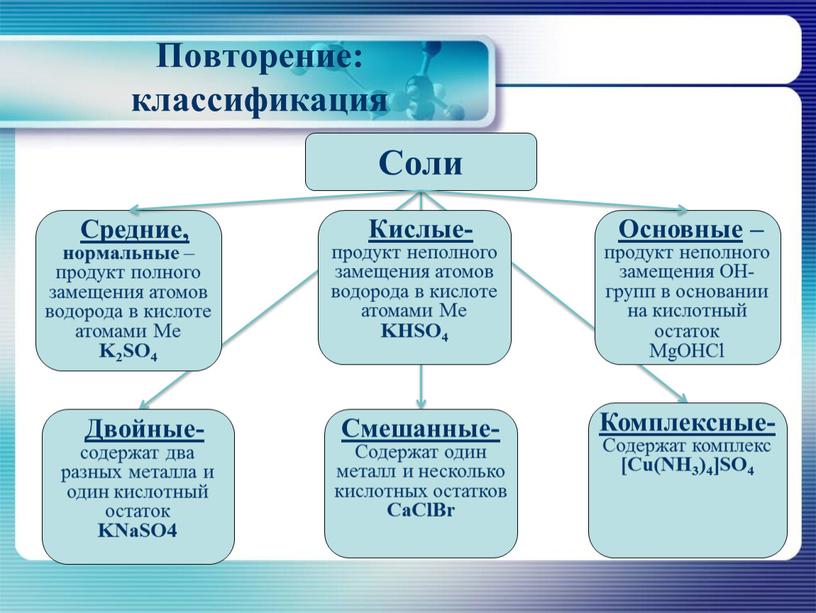
Соли, образующие кислотные растворы
Хлорид аммония (NH 4 Cl) представляет собой соль, которая образуется, когда сильная кислота HCl нейтрализуется слабым основанием NH 3 . Хлорид аммония растворим в воде. Образовавшийся хлорид-ион не может гидролизоваться, потому что он является сопряженным основанием сильной кислоты HCl. Другими словами, ион Cl — не может принимать протон из воды с образованием HCl и OH — , как это сделал ион фтора в предыдущем разделе.Однако ион аммония способен незначительно реагировать с водой, отдавая протон и, таким образом, действуя как кислота.
Соли, образующие нейтральные растворы
Соль, полученная в результате реакции сильной кислоты с сильным основанием, образует раствор с pH 7. Примером является хлорид натрия, образующийся в результате нейтрализации HCl с помощью NaOH. Раствор NaCl в воде не обладает ни кислотными, ни основными свойствами, поскольку ни один ион не способен гидролизоваться. Другие соли, образующие нейтральные растворы, включают нитрат калия (KNO 3 ) и бромид лития (LiBr).В приведенной ниже таблице показано, как определить кислотность или основность солевого раствора.
Другие соли, образующие нейтральные растворы, включают нитрат калия (KNO 3 ) и бромид лития (LiBr).В приведенной ниже таблице показано, как определить кислотность или основность солевого раствора.
| Соль, образованная из: | Солевой раствор |
| Сильная кислота + сильное основание | нейтральный |
| Сильная кислота + Слабое основание | Кислый |
| Слабая кислота + сильное основание | Базовый |
Соли, образующиеся в результате реакции слабой кислоты и слабого основания, труднее анализировать из-за конкурирующих реакций гидролиза между катионом и анионом.Эти соли не будут рассматриваться в этой концепции.
Сводка
- Определен гидролиз солей.
- Описаны реакции гидролиза солей с образованием кислых, основных или нейтральных растворов.

Практика
Решите задачи 1, 2, 3 и 5 в ChemWiki.
Обзор
- Каким образом F — дает базовое решение?
- Как ион аммония производит кислый раствор?
- Почему растворенный NaCl дает нейтральный раствор?
Глоссарий
- гидролиз соли: Реакция, в которой один из ионов соли реагирует с водой, образуя кислотный или щелочной раствор.
Почему вашему организму нужна соль и 6 незаменимых солей на кухне | от Holar из Тайваня
Соль или хлорид натрия — это « белое кристаллическое вещество, которое придает морской воде характерный вкус и используется для приправы или консервирования пищи ».
Химически описанный как NaCl, хлорид натрия или соль необходим для поддержания жизни на планете. В кулинарии соль — один из важнейших ингредиентов для придания вкуса и приправы пищи.
Люди также используют соль в промышленных целях; На данный момент перечислено более 12 000 применений поваренной соли. Среди его применений — способность понижать температуру плавления льда? Добавляя соль в снег, снег тает при более низких температурах, и дороги можно быстро очистить ото льда и обезопасить.
Среди его применений — способность понижать температуру плавления льда? Добавляя соль в снег, снег тает при более низких температурах, и дороги можно быстро очистить ото льда и обезопасить.
Как мы упоминали выше, каждое живое существо, подвергающееся воздействию соли, обезвоживается, становится неактивным или умирает, в зависимости от того, сколько соли задействовано. В таком случае соль, если злоупотреблять ею, становится токсичной для людей — и тогда она может убить вас.
Соль является основным регулятором жидкостей в организме. Другими словами, он регулирует, сколько жидкости удерживается и сколько жидкости (воды) выделяется организмом.
Когда мы потребляем слишком много соли, организм поглощает лишнюю воду, и это может вызвать серьезное повышение артериального давления и огромную нагрузку на сердце.
Статистика показывает, что высокое потребление соли коррелирует с очень высокой частотой инсультов, заболеваний почек и колоссальным увеличением на 30% сердечных заболеваний.
Помня о том, что высокое кровяное давление известно как «тихий убийца» — многие люди не проявляют никаких симптомов, прежде чем оно убьет их, — в то время как пассивное потребление натрия (соли) трудно измерить в мире, где мы перегружены обработанными продуктами, насыщенными в соли потребление соли стало проблематичным.
В США средний мужчина потребляет 4,240 мг натрия в день, а средняя женщина — 2,980 мг в день. Сравните это с рекомендуемыми 2300 мг натрия в день, которые считаются здоровыми, и масштаб проблемы станет совершенно ясным.
Соль имеет гипертоническую природу, что означает, что она определяет, сколько воды будет поступать в определенные клетки в организме животных или из них. Как правило, любое живое существо, подвергшееся воздействию соли, обезвоживается и либо умирает, либо становится неактивным.
Внутри вашего тела соль, растворенная в жидкостях, образует растворы электролитов, которые регулируют гидратацию организма, уровень кислоты в крови и функцию мышц — например, когда мы истощаемся от соли, мышечные судороги и общая усталость немедленно поражают нас.
Нарушение баланса электролитов, вызванное недостатком соли, приведет к проблемам с сердцем, неврологической неэффективности, проблемам с доставкой кислорода, дисбалансу жидкости и нарушению кислотного баланса, что в тяжелых случаях может привести к сонливости, ступору, коме и даже смерти.
Поваренная соль, буквально, соль, которую чаще всего добавляют в солонки на столах. Поваренная соль, как правило, поступает из залежей галогенидов, связанных с известняком, доломитом, а сланцы — глубоко под землей. Вы должны добывать соль, чтобы поднять ее на поверхность.Поваренная соль подвергается тщательной обработке для удаления минералов и добавок и обеспечения ее глубокого белого цвета — только самая чистая форма галогенидов бывает белой; большая часть добываемых галогенидов окрашена в пурпурный цвет и требует белого отбеливания.
Чтобы предотвратить комкование поваренной соли и сохранить ее текучесть, люди добавляют трикальцийфосфат и силикат магния. После этого также добавляется йод для улучшения эффективности работы щитовидной железы.
Морская соль
Морская соль содержит больше минералов и крупнее поваренной соли.Что касается вкуса, то она предлагает более сложный и уникальный вкус, чем поваренная соль.
Fleur de sel — это соль, которая образуется на поверхности свитера при испарении. По мере испарения воды большая часть морской соли упадет на дно, где образуется обычная морская соль. Флер-де-сел — это кристаллы соли, которые всплывают на поверхность воды и «собираются» вручную.
Сегодня этот процесс «сбора урожая» по-прежнему очень популярен во Франции, Испании и Португалии.
Эти кристаллы с очень низким содержанием натрия, нежны на вкус и очень тяжелы для банковского баланса; Fleur de sel — это бриллианты соляной пирамиды.
Кельтская морская соль, собранная на севере Франции в глиняных прудах, построенных недалеко от берега, остается после испарения морской воды. Его «заготавливают» деревянными орудиями и вообще не обрабатывают химически. Он высушен на солнце и содержит те же элементы, что и морская вода, что придает ему серый оттенок. Он отлично подходит для рыбы и мяса, как в кулинарии, так и в качестве приправы.
Традиционными гавайскими солями были красные соли, называемые Haleakala Ruby и Molokai Red, которые представляют собой смесь морской соли с красной гавайской вулканической глиной. Белые соли, такие как опал Папохаку, представляют собой необработанные морские соли, испаряющиеся солнечным светом, а черные соли, такие как Оникс Килауэа, получают путем объединения морской соли и древесного угля. Придает блюдам неповторимый цвет и аромат.
Каменная соль
Каменная соль, родом из соленых озер, добывается там, где древние озера высохли тысячи лет назад. Теперь покрытые осадком, эти соли кристаллизуются и содержат примеси, перенесенные из отложений с течением времени.
Гималайские соли бывают разных цветов, от белого до розового, даже свекольно-красного цвета. Розовая гималайская соль состоит из горных кристаллов соли, которую люди находили в районах, близких к Гималаям, часто в Пакистане. Он происходит из древнего морского дна пермской и меловой эпох и, следовательно, очень богат магнием, калием и кальцием. Он великолепен в качестве пищевого ароматизатора, а его красочный оттенок создает великолепную эстетику.
Первоначально евреи использовали кошерную соль для еврейских религиозных целей.Он использовался для удаления крови с поверхности мяса.
Грубая и ароматная соль, не содержащая каких-либо добавок, она похожа на поваренную соль по происхождению, но не по вкусу и чистоте. Для кошерной соли можно использовать и сухой рассол, она известна как кухонная соль: ее предпочитают для приготовления пищи, а не как поваренную соль. Он придает великолепный вкус, который в наши дни стал очень модным для добавления хрустящей корочки в салаты, стейки и даже сладости.
Поскольку пища не всегда была свежей, когда она нам была нужна, соление — хороший способ сохранить ее, и это сделало возможным выживание человечества на протяжении тысячелетий.С кулинарной точки зрения соль — это важнейший ароматизатор. Еда без соли обычно несъедобна и неинтересна. Часто разница между обученным поваром и любителем заключается в их знании соли.
Когда использовать кошерную соль? Когда использовать гималайскую или гавайскую соль? С добавлением всех нюансов солености ваша способность создавать настоящую высокую кухню будет становиться все больше и больше. Овладение солью сделает вас мастером в приготовлении пищи!
Ссылка: https: //www.holar.com.tw/blog/why-your-body-needs-salt-6-essential-salts-in-the-kitchen/
Мы являемся экспертом в области производства кухонь и столовых продуктов из Тайваня и специализируемся на производстве высококачественных продуктов. качественная мельница для соли и перца, кофемолка, канистра, банка для оливкового масла, столешница и многое другое.
— Более 50 лет производства кухонных и столовых товаров.
— Long сотрудничает и владеет фабриками , чтобы контролировать высочайшее качество.
— Предложите более 600 продуктов , чтобы вы могли конкурировать на любых рынках.
— Продукция изготовлена из тщательно отобранных материалов для поддержания совершенства.
— 100% сделано в Тайване. для обеспечения высокой конкурентоспособности во всем мире.
— Сертификат третьей стороны для доставки вам надежной качественной продукции.
Какую соль использовать? | Марк Биттман
Давайте поговорим о соли: какие виды соли у вас могут быть в кладовой, что вы предпочитаете, мелкая она или крупная. Вы рано и часто солируете или находитесь в лагере сезонной еды на финише? Или где-то посередине?
Во-первых, несколько основ.Все соли создаются естественным путем — в камнях и водоемах, — но не все они одинаковы. Поваренная соль добывается, измельчается, очищается и «обогащается» йодом и другими ингредиентами. Но у консистенции есть и обратная сторона: вкус поваренной соли резкий, с преобладающим минеральным вкусом йода.
На другом конце спектра находится множество специальных солей, добываемых как из океанов, так и из глины, с нюансами вкуса и цвета, которые, как вы, возможно, думаете, стоят потраченных денег, или нет.
Между ними находится горстка обычных солей — либо грубо измельченных из отложений в горных породах, либо полученных путем испарения океанской воды.В любом случае, в результате получается соль без добавок. Это те, которые я использую как на кухне, так и на столе.
Соль получила свое название и основной вкус от хлорида натрия, основного соединения, присутствующего во всех типах в той или иной степени. Тонкие ароматы морских солей, которые можно описать как соленые, металлические или землистые, происходят от следов минералов. Чем больше микроэлементов, тем меньше хлорида натрия, поэтому многие морские соли имеют менее соленый вкус, чем поваренная соль и кошерные соли. Я в основном использую кошерную или морскую соль.
Солить пищу — это личное дело каждого, поэтому я редко указываю количество. Но я не буду полностью оставлять вас в неведении: инструкции подсказывают, когда приправлять солью — обычно более одного раза во время процесса и почти всегда в конце — и я всегда рекомендую попробовать.
В своих рецептах я указываю точные размеры для редких блюд, где точное количество соли действительно имеет значение, и, конечно же, в рецептах выпечки, где я почти всегда использую кошерную соль; морская соль менее однородна и может иметь сильный минеральный вкус.
Кошерная соль
Обычно она поставляется в больших коробках, либо в хлопьях, либо в крупнозернистых. Мне больше всего нравятся хлопья, но оба хороши. Он белый, как поваренная соль, но вкус чистый, слегка минеральный, без затяжного послевкусия. (Только будьте осторожны при измерении объема — есть большая разница между чайной ложкой Diamond Crystal и чайной ложкой кошерной соли Morton.)
Использование: Это моя универсальная соль для выпечки, соления воды для приготовления пищи и последней -минутная заправка.
Обычная морская соль
Производится путем нагрева соленой воды в трубах и ваннах или испарением на открытом воздухе; самые сложные обычно начинаются с самых сложных соленых вод. Тем не менее, знатоки утверждают, что нагревание воды разрушает аромат.
Попробуйте несколько разных и посмотрите, что вы думаете; ваше небо может быть более чувствительным, чем мое, потому что я не могу найти между ними такой большой разницы.
Использование: Поскольку они, как правило, дороже, чем другие виды соли, я обычно оставляю их для приготовления и финальной заправки, а не добавляю их в воду для макарон и тому подобное.И я никогда не использую его в рецептах сладкой выпечки.
Fleur de sel
Эта ценная морская соль с побережья Франции (Бретань) мелкая, серовато-белая и слегка влажная.
Использование: После приготовления в качестве последней приправы. Он настолько хорош, что его можно использовать для «заправки» свежей зелени салата, либо отдельно, либо с небольшим количеством лимона.
Морская соль Maldon
Эта соль, изготовленная в Англии по специальной технологии, раскатывается в плоскую и слоистую форму. В отличие от любой другой соли, результат тает на языке и в горячей пище, оставляя после себя приятный вкус, который медленно нарастает.Его бывает сложно найти (хотя его легко доставить по почте), но когда вы это делаете, это обычно относительно недорого.
Использование: Абсолютно лучший вариант для жареных продуктов, жареного картофеля и яичницы.
Поваренная соль
Это обычная соль для шейкеров и бумажных пакетов по всей Америке. Йод был добавлен несколько десятилетий назад и остается в смеси сегодня, часто вместе с другими ингредиентами, препятствующими слеживанию. Мелкие зерна растворяются быстрее, чем большинство крупных солей, что может быть преимуществом.
Использует: Где угодно, но он довольно соленый, поэтому используйте меньше.
Каменная соль
Эта менее чистая соль обычно используется при жарке и изготовлении мороженого для отвода тепла или холода. Небольшой кусочек, вероятно, не убьет вас, но вы определенно не хотите его есть.
Соль для энтузиастов
Если вы хотите увлечься, есть радуга цветов и вкусов, которые можно попробовать: ищите слоновую кость Ravidà с Сицилии, ярко-красную соль Alae с Гавайев, черные соли из Индии и кельтскую соль серого моря. из Франции.Некоторых бывает сложно найти, но каждый известен — иногда даже оправданно — тем, что передает различные ароматы своей земли и моря.
Да, вы можете купить морскую соль и кошерную соль в продуктовых магазинах, а иногда даже в Maldon и fleur de sel. Вот несколько альтернативных вариантов.
Этот отряд в Западной Вирджинии от братьев и сестер Нэнси Брунс и Льюиса Пэйна собирает соль из океана Япетус (до Атлантики), запертую под Аппалачскими горами через подземный водоносный слой с рассолом.Затем соль обрабатывается естественным путем, в чем-то похожем на домики-кольца. Компания производит три размера — для отделки, измельчения и приготовления, а также ароматизированные соли, такие как яблоня, пандус из призрачного перца. По цене от 5,50 долларов за 1 унцию солей для отделки до 24 долларов за 1 фунт.
Предполагается, что эта соль (продажа), собранная на северо-западе Сицилии, богата йодом, фтором, магнием и калием, а содержание хлорида натрия ниже, чем в поваренной соли. Крупная или мелкая соль стоит 3,50 доллара за 1 или 2 кг.2-фунтовая сумка.
Соли Средиземноморья, Гавайев, Гималаев и др. Мелкие или грубые, приправленные и копченые — здесь есть все варианты, от чуть более 6 долларов за Diamond Crystal до 23,49 долларов за банку трюфельной соли объемом 3 унции.
Приправка собственной соли
Приправить собственную соль травами и специями достаточно просто. Например, попробуйте положить веточку свежего розмарина, лаванды, орегано или тимьяна в небольшой шейкер с солью на несколько дней, а затем вынуть.Или поджарьте ложку кориандра, кардамона, семян тмина или даже сушеного чили и добавьте соль целиком или молотую. Используйте эти соли во время готовки или в последнюю минуту.
Хранение соли
Даже самые влажные морские соли очень долговечны и стабильны. Но поскольку соли могут иметь коррозионный эффект, вы должны хранить их в стеклянных, керамических, посудных или деревянных контейнерах — определенно не в металлических. Пластик можно использовать на короткое время.
— From How to Cook Everything
Неорганическая соль — обзор
Токсичность для животных
Металлический Sn и его неорганические соли обычно считаются низкими пероральными токсичными веществами из-за их плохой абсорбции с пищей, и отчеты об их токсичности ограничивается экспериментами с лабораторными животными и ограниченными наблюдениями на людях.
Следует подчеркнуть, что металлический олово или его неорганические соли обычно требуют больших доз в течение продолжительных периодов времени, чтобы вызвать токсичность, в отличие от органических олов, которые более токсичны, чем неорганические соединения. Поскольку соединения олова являются жирорастворимыми и стабильными в биологических жидкостях при pH ткани, может происходить обширное проникновение в мозг и застой в центральной нервной системе. Металлический Sn токсичен только при пероральном приеме в больших дозах, в то время как нестабильный газообразный гидрид олова при вдыхании является нейротоксичным, но, хотя он подобен газу арсина, его эффекты менее серьезны, поскольку он не вызывает гемолиза.Нерастворимые соединения Sn относительно безвредны, тогда как катионные соединения Sn, растворимые в воде или разбавленных кислотах, являются раздражителями желудка и могут быть очень токсичными из-за высокой абсорбции из желудочно-кишечного тракта, но кислотность растворов солей Sn и их раздражающие свойства усложняют интерпретацию Sn токсичность. Поскольку соли двухвалентного Sn легче всасываются из желудочно-кишечного тракта, они более токсичны, чем соли Sn 4 + . Кроме того, они могут образовывать более стабильные комплексы с соединениями SH — , чем Sn 4 + , что объясняет большую токсичность соединений Sn 2 + .У крыс наблюдаются заметные различия в пероральной токсичности различных соединений Sn; нерастворимые соединения двухвалентного олова, такие как оксид, сульфид и олеат, и оксид олова относительно безвредны на уровнях до 1% от рациона, но катионные соединения сульфата, хлорида и тартрата Sn 2 + токсичны на уровнях питания выше 0,3%.
Хроническое отравление оловом у крыс вызывает умеренную дегенерацию яичек, тяжелую атрофию поджелудочной железы, острую бронхопневмонию, энтерит, неврологическое и почечное повреждение, но существуют заметные различия в токсичности оксида олова и двухвалентного олова у крыс в отношении задержки роста.Пожизненное потребление 5 ppm Sn 2 + с питьевой водой мышами и крысами вызывает жировую дегенерацию печени и увеличение частоты сосудистых изменений в их почечных канальцах. Аденокарцинома молочной железы, саркома матки и аденокарцинома около челюсти наблюдались у крыс, которых кормили диетой, содержащей 2% хлоростанната, в течение более 1 года. Гепатоцеллюлярная аденома или карцинома возникла у мышей, а гистолитические лимфомы у самок мышей (примерно 16%), получавших 2 г — 1 хлорида олова в течение 105 недель, не наблюдали побочных эффектов и не различались заболеваемость опухолями в группе мышей, получавших в течение нескольких поколений хлоростаннат натрия в дозе 1 или 5 г Sn на кг — 1 с питьевой водой или олеат двухвалентного олова в дозе 5 г — 1 кг с пищей.Исследования in vitro показали, что экспозиция хлорида олова приводит к потере способности клеток и повреждению ДНК дозозависимым образом, что было связано с опосредованным оловом образованием активных форм кислорода, предполагая, что олово может препятствовать образованию гема за счет конкурентного антагонизма с железо, цинк и медь. Более того, генотоксический эффект хлорида олова был продемонстрирован на тестовом штамме Escherichia coli .
ОТС более токсичны, чем ИТК. Сообщалось об острой токсичности (LD 50 ) для экспериментальных млекопитающих, водных беспозвоночных и позвоночных.За исключением трех акарицидов (ACT, TCHT, FBTO), мыши обычно оказываются наиболее чувствительными видами по сравнению с другими млекопитающими, а пероральный прием менее опасен, поскольку безрецептурные препараты плохо всасываются в желудочно-кишечном тракте. Вкратце, открытия механизмов токсичности ОТЦ из окружающей среды у млекопитающих можно резюмировать следующим образом: (1) ингибирование АТФ-синтазы; (2) нарушение стероидного гомеостаза TBT и TPT, которые усиливают активность ароматазы (CYP19) так же эффективно, как гонадотропин человека, и ингибируют стероидную 5α-редуктазу человека, а также β-гидроксистероид дегидрогеназы человека и крысы; (3) агонистическая активность в отношении NR; (4) ожирение и иммунотоксичность через агонистическую активность PPARγ; (5) нейротоксичность; и (6) снижение уровня белка GluR2 за счет длительного воздействия эндогенных уровней TBT, в результате чего нейроны становятся более уязвимыми к токсичности глутамата.
Среди водных беспозвоночных наиболее чувствительными к TBT являются бентосные, питающиеся фильтром виды, такие как двустворчатые моллюски, мшанки и оболочники. Морские костистые более чувствительны к ТБО, чем пресноводные.
ГЛАВА 7 — СОЛЕНСКИЕ ПОЧВЫ
ГЛАВА 7 — СОЛЕНЫЕ ПОЧВЫ
7.1 Засоление
7.2 Засоление
7.3 Зерновые культуры и засоленные почвы
7.4 Содичность
7.5 Улучшение
засоленных и натриевых почв
7.6 Предупреждение засоления
Почва может быть богата солями, потому что материнская порода, из которой она образовалась, содержит соли. Морская вода — еще один источник солей в низинах вдоль побережья. Очень распространенным источником солей в орошаемых почвах является сама поливная вода. Большинство оросительных вод содержат соли.
После полива вода, добавленная в почву, используется растениями или испаряется непосредственно из влажной почвы. Однако соль остается в почве.Если не удалить, он накапливается в почве; этот процесс называется засолением (см. рис. 102). Иногда очень соленые почвы можно узнать по белому слою сухой соли на поверхности почвы.
Рис. 102. Засоление, вызванное соленой оросительной водой
Соленые подземные воды также могут способствовать засолению. Когда уровень грунтовых вод повышается (например, после полива при отсутствии надлежащего дренажа), соленые грунтовые воды могут достигать верхних слоев почвы и, таким образом, поставлять соли в корневую зону (см.рис.103).
Рис. 103. Засоление, вызванное высоким уровнем
Почвы, содержащие вредное количество соли, часто называют солеными или засоленными. Считается, что почва или вода с высоким содержанием соли имеют высокую засоленность.
7.2.1 Засоление воды
7.2.2 Засоление почвы
7.2.1 Соленость воды
Соленость воды — это количество соли, содержащейся в воде.Она также называется «концентрацией соли» и может выражаться в граммах соли на литр воды (граммы / литр или г / л) (см. Рис. 104) или в миллиграммах на литр (что то же самое, что и части на литр). млн, ppm). Однако соленость воды и почвы легко измерить с помощью электрического прибора. Затем он выражается в показателях электропроводности: миллимхос / см или микромос / см. Концентрация соли в 1 грамм на литр составляет около 1,5 миллимхос / см. Таким образом, концентрация 3 грамма на литр будет примерно такой же, как 4.5 миллимхос / см.
Рис. 104. Концентрация соли 10 г / л
7.2.2 Засоление почвы
Концентрация соли в воде, извлеченной из насыщенной почвы (называемая экстрактом насыщения), определяет соленость этой почвы. Если эта вода содержит менее 3 граммов соли на литр, считается, что почва не засолена (см. Таблицу ниже). Если концентрация соли насыщающего экстракта превышает 12 г / л, считается, что почва сильно засолена.
Концентрация соли в почвенной воде (насыщающий экстракт) | Соленость | |
г / л | в миллимхос / см | |
0–3 | 0 — 4.5 | без соли |
3–6 | 4,5 — 9 | слабосоленый |
6–12 | 9–18 | средний солевой |
более 12 | более 18 | сильно засоленный |
Большинство сельскохозяйственных культур плохо растут на почвах, содержащих соли.
Одна из причин заключается в том, что соль снижает скорость и количество воды, которую корни растений могут забирать из почвы (см. Рис. 105). Кроме того, некоторые соли токсичны для растений, когда присутствуют в высоких концентрациях.
Рис. 105. Высокая концентрация соли в почве вредна для растений, так как поглощение воды снижается.
Некоторые растения более устойчивы к высокой концентрации соли, чем другие. Некоторые примеры приведены в следующей таблице:
Высокая толерантность | Умеренно толерантный | Чувствительный |
Финиковая пальма | Пшеница | Клевер красный |
Ячмень | Помидор | Горох |
Свекла сахарная | Овес | Фасоль |
Хлопок | Люцерна | Сахарный тростник |
Спаржа | Рис | Груша |
Шпинат | Кукуруза | Яблоко |
Лен | Оранжевый | |
Картофель | Чернослив | |
Морковь | Слива | |
Лук | Миндаль | |
Огурец | Абрикос | |
Гранат | Персик | |
Рис | ||
Оливковое | ||
Виноград |
Высокотолерантные культуры выдерживают концентрацию солей насыщающего экстракта до 10 г / л.Умеренно толерантные культуры выдерживают концентрацию солей до 5 г / л. Предел чувствительной группы составляет около 2,5 г / л.
Соленые почвы обычно содержат несколько видов соли. Одна из них — натриевая соль. Там, где концентрация солей натрия высока по сравнению с другими типами солей, может образоваться натриевая почва. Для натриевых почв характерно плохое почвенное строение: у них низкая инфильтрация, они плохо аэрируются и трудно культивируются. Таким образом, натриевые почвы негативно влияют на рост растений.
7.5.1 Улучшение
засоленные почвы
7.5.2 Улучшение натриевых
почвы
Многие районы в мире являются естественно засоленными или натриевыми или стали засоленными из-за неправильной практики орошения. Урожай на многих из них плохой. Однако их производительность можно повысить с помощью ряда мер.
7.5.1 Улучшение засоленных почв
Улучшение засоленной почвы подразумевает снижение концентрации соли в почве до уровня, который не является вредным для сельскохозяйственных культур.
Для этого на поле поливают больше, чем требуется для роста сельскохозяйственных культур. Эта дополнительная вода проникает в почву и просачивается через корневую зону. Во время просачивания он забирает часть солей из почвы и переносит их в более глубокие слои почвы. Фактически, вода вымывает соли из корневой зоны. Этот процесс промывки называется выщелачиванием (см. Рис. 106).
Рис. 106. Выщелачивание солей
Дополнительная вода, необходимая для выщелачивания, должна быть удалена из корневой зоны с помощью системы подземного дренажа (Глава 6).Если не удалить, это может вызвать подъем уровня грунтовых вод, что вернет соли в корневую зону. Таким образом, улучшение засоленных почв включает, в основном, промывку и подповерхностный дренаж.
7.5.2 Улучшение натриевых почв
Улучшение натриевых почв подразумевает уменьшение количества натрия в почве. Это делается в два этапа. Во-первых, химические вещества (например, гипс), богатые кальцием, смешиваются с почвой; кальций заменяет натрий.Затем замещенный натрий вымывается из корневой зоны поливной водой.
7.6.1 Вода для орошения
качество
7.6.2 Орошение
управление и дренаж
Почвы станут солеными, если соли будут накапливаться. Правильное управление орошением и адекватный дренаж являются важными мерами не только для улучшения засоленных почв, они также необходимы для предотвращения засоления.
7.6.1 Качество поливной воды
Пригодность воды для полива зависит от количества и типа соли, содержащейся в поливной воде. Чем выше концентрация солей в оросительной воде, тем выше риск засоления. Следующая таблица дает представление о риске засоления:
Концентрация солей в поливной воде, г / л | Риск засоления почвы | Ограничение использования |
меньше 0.5 г / л | без риска | без ограничений по использованию |
0,5 — 2 г / л | от слабого до среднего риска | следует использовать с соответствующей практикой управления водными ресурсами |
более 2 г / л | высокий риск | обычно не рекомендуется использовать, если не проконсультироваться со специалистами. |
Тип соли в поливной воде будет влиять на риск развития натриевых вод: чем выше концентрация натрия в поливной воде (особенно по сравнению с другими почвами), тем выше риск.
7.6.2 Управление орошением и дренаж
Системы орошения никогда не бывают полностью эффективными. Некоторое количество воды всегда теряется в каналах и на фермерских полях. Часть этого просачивается в почву. Хотя это поможет вымыть соль из корневой зоны, это также будет способствовать повышению уровня грунтовых вод; высокий уровень грунтовых вод опасен, потому что может привести к возврату солей в корневую зону. Поэтому необходимо строго контролировать как потери воды, так и уровень грунтовых вод. Это требует тщательного управления ирригационной системой и хорошей системы подземного дренажа.
Среда для культивирования тканей: типы и 5 этапов отбора — Технология растительных клеток
Вы знаете, используете ли вы подходящую среду для своей культуры?
Правильный выбор среды — решающий шаг для культивирования растительных клеток in vitro. Многие из нас не знают, какой тип питательной среды существует, каково их применение и какая среда будет наиболее подходящей для культивирования.
Важно понимать, какую среду вы используете и как выбрать подходящую среду для ваших культур. Вы должны понимать потребности вашего растения, а затем соответственно готовить пищу, необходимую для его роста.
В предыдущей статье «
Основные компоненты питательной среды », были обсуждены все основные компоненты и диапазон их концентраций, необходимый для подходящего роста растений.
Эта статья познакомит вас с различными типами сред для тканевых культур и представит вам «широкий спектр экспериментов», которые помогут вам выбрать среду, подходящую для вашей культуры.
Типы носителей
На сегодняшний день известен ряд культуральных сред, таких как среда MS, среда B5, среда LS, среда Уайта и т. Д. В этом разделе приводится краткая информация о пяти широко используемых культуральных средах в лабораториях по всему миру.
Мурашиге и Скуг (МС), средний
Эта среда была изобретена двумя учеными по имени Тошио Мурашиге и Фолке К. Скугом в 1962 году, когда эти двое ученых работали над открытием регуляторов роста растений.Это наиболее часто используемая среда в лаборатории тканевых культур.
Иногда вы можете наблюдать некоторые числа за MS, которые указывают на концентрацию сахарозы в среде. Например, MS0 указывает на отсутствие сахарозы, а MS10 указывает на присутствие 10 г / л сахарозы в среде. Композиция представляет собой смесь питательных веществ, таких как неорганические соли, витамины и аминокислоты.
Цель: Эта среда используется для индукции органогенеза, культивирования каллусов, микроразмножения и суспендирования клеток.
Linsmaier and Skoog (LS) средний
Эта среда была разработана Линсмайером и Скугом в 1965 году. Она впервые была использована для оптимизации органических добавок в культуру табака. Среда имеет тот же компонент, что и Murashige и Skoog, с добавлением витаминов Linsmaier и Skoog.
Он обнаружил, что повышенная концентрация гипохлорита тиамина (0,4 мг / л вместо 0,1 мг / л) компенсировала отсутствие витаминов, за исключением инозита.Инозитол является ферментным кофактором в гликолизе и цикле TCA, а также участвует в первичном и вторичном метаболизме растений.
Назначение: Используется для органогенеза, культивирования каллусов, суспензии клеток и микроразмножения.
Гамборг (В5) средний
Эта среда была разработана О. Л. Гамборгом в 1968 году. Он использовал среду для культивирования каллуса и суспензии клеток Glycine max, принадлежащего к семейству Fabaceae.Эта среда представляет собой смесь питательных веществ, таких как неорганические соли, витамины и углеводы.
Среда имеет более высокую концентрацию нитратов и калия и более низкую концентрацию аммиака. Нитрат калия полезен для индукции образования каллюса корня сои, а сульфат аммония играет важную роль в росте клеток.
Назначение: Применяется с целью культивирования протопластов.
Nitsch and Nitsch (NN) средний
Среда была разработана Дж.P. Nitsch в 1969 г. за создание in vitro культуры пыльников Nicotiana из семейства Solanaceae. Он содержит высокую концентрацию тиамина, биотина и фолиевой кислоты, которые поддерживают каллус пыльника.
Цель: Для создания культуры пыльников in vitro.
Средний Уайт
Среда была разработана П. Р. Уайтом в 1963 г. для создания корневой культуры томатов. Это была самая ранняя среда для культивирования тканей растений, разработанная для корневых культур.Он имеет более низкую концентрацию соли и более высокую концентрацию MgSO4. Концентрация нитратов на 19% меньше, чем в среде MS.
Назначение: Среда Уайта может использоваться для выращивания побегов и каллусов. Подходит для выращивания видов Musa и Daucus.
Выбор носителя
Это очень важный шаг в культуре тканей, но нет ни одного шага для создания подходящей среды для создания культуры.Однако вы можете начать работу с тремя средами, имеющими разные концентрации соли, такие как высокая концентрация соли, средняя концентрация соли и низкая концентрация соли, чтобы получить желаемый ответ от культуры.
Комбинация различных соотношений ауксина и цитокинина может использоваться для пролиферации побегов или образования придаточных побегов. Кроме того, для создания культуры можно протестировать диапазон концентраций сахарозы (2-6%). Таким образом, существуют различные возможности сделать желаемую среду подходящей для вашей культуры, просто манипулируя концентрацией питательной соли и регуляторов роста растений.
Де Фосард и др. Описали широкий спектр экспериментов по созданию подходящей среды для вашей культуры, особенно если система не тестировалась.
- Разделите среду на четыре широкие категории: (а) минералы, (б) ауксины, (в) цитокинины и (г) органические питательные вещества (сахароза, аминокислоты, инозит и т. Д.)
- Для каждой группы компонента выберите три концентрации: высокую, среднюю и низкую.
- Попробуйте различные комбинации четырех групп компонентов в трех различных концентрациях.Это приведет к эксперименту с 81 обработкой.
- Обозначьте лучшую из 81 процедуры четырехбуквенным кодом. Например, обработка средними солями, низким содержанием ауксина, средним цитокинином и высоким содержанием органических питательных веществ будет представлена как MLMH.
- После достижения этой стадии можно тестировать различные концентрации ауксина и цитокинина для определения подходящей концентрации регуляторов роста.
Ссылки
- Среды для культивирования тканей.(1996). Исследования в области растениеводства, 39–62. DOI: 10.1016 / s0928-3420 (96) 80005-x.
- Nandkishore Jha. Среда для культивирования тканей растений: типы, составляющие, подготовка и отбор. https://www.biologydiscussion.com/plants/plant-tissue-culture/plant-tissue-culture-media-types-constituents-preparation-and-selection/10656
- Абобкар И.М. Саад и Ахмед М. Эльшахед (17 октября 2012 г.). Среда для культивирования тканей растений, Последние достижения в культуре растений in vitro, Аннарита Лева и Лаура М.Р. Ринальди, IntechOpen, DOI: 10.5772 / 50569
Хотите поделиться историей по PCT?
Мы будем рады услышать ваши отзывы и предложения!
На нашем веб-сайте также будут представлены истории отдельных продуктов PCT. Не забывайте, что некоторые вкусности могут попасть в ваш дом вместе с ним.
Поделитесь со мной своими предложениями и историей на anjali @ plantcelltechnology.ком
Избранные статьи
Размножение тканевой культуры банана
Банан — это тропический фрукт, который люди употребляют в сыром и вареном виде.Считается, что он возник в Юго-Восточной Азии, в таких странах, как Индия, Филиппины, Малайзия и т.д.
Подробнее
Как PPM ™ может спасти ваш эксперимент по культуре тканей
Смесь консервантов для растений (PPM ™) — это надежный состав, используемый в качестве биоцида широкого спектра действия в экспериментах с культурами тканей растений.Путем борьбы с бактериями, грибками и другими загрязнениями…
Подробнее
PPM против антибиотиков — сравнение
Независимо от того, являетесь ли вы производителем семян для фруктов или гуру клонирования растений, вы знаете, насколько важно защищать свои растения от загрязняющих веществ.От микробных инфекций, передающихся по воздуху, от микробных инфекций, передающихся по воздуху…
Подробнее
Загрязнение тканевой культуры и 7 простых шагов по предотвращению
Опять заражение! Культивирование тканей — долгий и трудоемкий процесс, и его неприятно, когда грибки или бактерии атакуют наши прекрасные культуры.Для выращивания клеток в лабораториях требуется много…
Подробнее
.


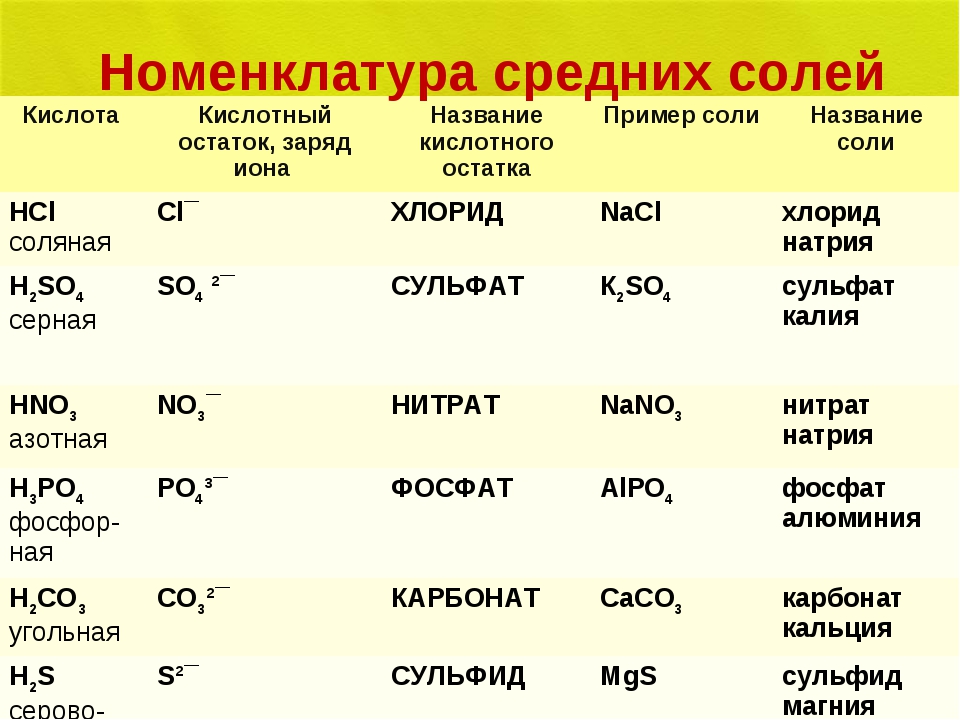

 Данная реакция является качественной на сульфаты, так как образуется сульфат бария – осадок белого цвета.
Данная реакция является качественной на сульфаты, так как образуется сульфат бария – осадок белого цвета. 

 Этот процесс можно рассмотреть на примере реакции гидросульфида калия с серной кислотой. Продуктами реакции является летучая кислота – сероводородная, а также сульфат калия.
Этот процесс можно рассмотреть на примере реакции гидросульфида калия с серной кислотой. Продуктами реакции является летучая кислота – сероводородная, а также сульфат калия.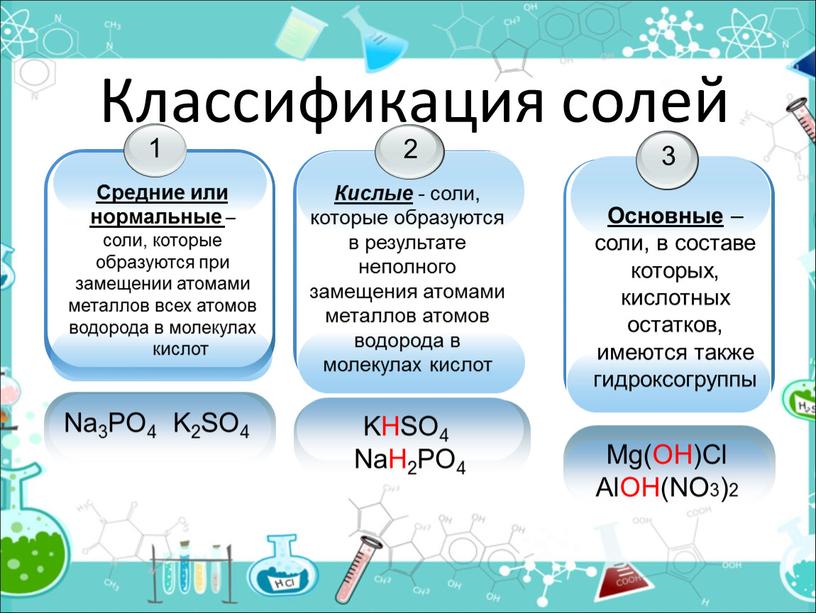

 В результате такой реакции образуется две другие соли – комплексная и средняя.
В результате такой реакции образуется две другие соли – комплексная и средняя. Определить количества растворенных веществ в растворе, полученном пропусканием через 200 г 4 %-ного раствора гидроксида натрия при н.у.:
Определить количества растворенных веществ в растворе, полученном пропусканием через 200 г 4 %-ного раствора гидроксида натрия при н.у.:
