Содержание
Марганец высшие валентности — Справочник химика 21
Валентность марганца изменяется в широких пределах (от одного до семи). Особенно устойчивы крайние валентные состояния (II и VII). В состояниях высших валентностей марганец проявляет основные свойства, в промежуточных — амфотерные, в высоких — кислотные. [c.212]
В соединениях двух- и трехвалентных марганец существует в виде ионов Мп + иМп +, в соединениях же более высокой валентности он связан с кислородом ковалентно. [c.393]
В свободном состоянии марганец и рений — тяжелые металлы, имеющие высокие температуры плавления и кипения. Они отличаются большим разнообразием валентностей. Марганец проявляет валентность от 2 до 7, у рения сверх того известны соединения (например иодид), где его валентность 1- -. Соединения рения высших валентностей более прочны в сравнении с такими же соединениями марганца в частности, они проявляют более слабые окислительные свойства. Соединения рения низших валентностей в отличие от соединений двухвалентного марганца получаются с большим трудом, весьма неустойчивы и вследствие этого до сих пор неДоста- [c.330]
Соединения рения низших валентностей в отличие от соединений двухвалентного марганца получаются с большим трудом, весьма неустойчивы и вследствие этого до сих пор неДоста- [c.330]
Металлические структуры обладают некоторыми очень характерными свойствами. Каждый атом в кристаллической структуре металла имеет высокое координационное число (часто двенадцать и иногда восемь), и структура характеризуется высокой электро- и теплопроводностями. Атомы в металле располагаются близко один к другому это означает, что наблюдается значительное перекрывание орбиталей внешних электронов и что валентные электроны фактически связаны не с отдельным ядром, а делокализованы- по всем атомам металла. Таким образом, металл можно рассматривать как ансамбль положительных ионов, которые, вообще говоря, представляют собой сферы одинакового радиуса (марганец и уран являются исключениями), как можно более плотно упакованные в пространстве. Существует два способа плотной упаковки одинаковых сфер один из них приводит к гексагональной, а другой — к кубической симметрии, но в каждом случае координационное число равно двенадцати.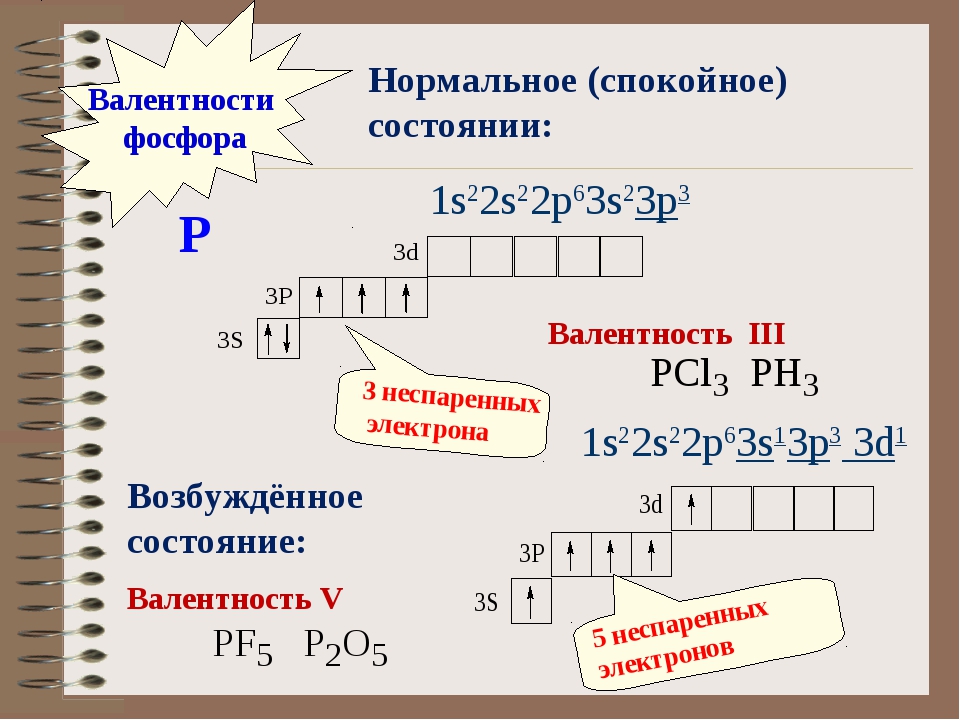 Объемноцентрированная кубическая структура щелочных металлов менее плотно упакована для нее координационное число равно восьми и каждый ион имеет восемь ближайших соседей в услах окружающего его куба. [c.136]
Объемноцентрированная кубическая структура щелочных металлов менее плотно упакована для нее координационное число равно восьми и каждый ион имеет восемь ближайших соседей в услах окружающего его куба. [c.136]
Количественное определение кислорода в воде. Аналитическое определение кислорода в котловой воде не может быть рассмотрено здесь в деталях, однако отдельные замечания могут быть полезными. Большинство методов можно разделить на две группы. К первой относятся те методы, которые используют принцип, разработанный Винклером в этом классическом методе к воде сначала добавляется соль марганца, а затем щелочь для осаждения гидроокиси марганца, которая затем взаимодействует с находящимся в воде в свободном состоянии кислородом, образуя гидроокисные соединения, в которых марганец обладает более высокой валентностью при добавлении иодистого калия эти гидроокиси освобождают эквивалентное количество [c.411]
Интересно отметить, что хром в металлическом состоянии имеет металлическую валентность 6, соответствующую степени окисления + 6, характерной для хроматов и бихроматов, а не более низкой степени окисления -ЬЗ, характерной для солей хрома металлы марганец,, железо, кобальт и никель тоже имеют металлическую валентность 6, хотя почти все эти элементы образуют соединения со степенями окисления + 2 и -ЬЗ. Ценные физические свойства переходных металлов обусловлены высокой металлической валентностью этих элементов. [c.494]
Ценные физические свойства переходных металлов обусловлены высокой металлической валентностью этих элементов. [c.494]
Таким образом, экспериментальные факты свидетельствуют о том, что основную ответственность за подавление детонации в двигателе внутреннего сгорания следует возлагать на металлические продукты распада антидетонаторов, обладающие высокой химической активностью. При этом особой активностью отличаются металлы, имеющие переменную валентность по кислороду, — свинец, железо, марганец, хром. [c.155]
Отличительным свойством марганцевых катализаторов является способность их основного активного компонента — марганца легко окисляться и восстанавливаться. Поскольку для обеспечения высокой каталитической активности необходимо, чтобы марганец находился в определенном валентном состоянии, такая особенность нередко связана со значительными трудностями. Кроме того, марганцевые катализаторы отравляются водяными парами, так как вследствие капиллярной конденсации воды на активной поверхности МпОз образуется водяная пленка. [c.319]
[c.319]
Высокая окислительная способность растворов активного хлора в присутствии марганца также отмечается в работе [68]. Прн сравнении действия смеси гидроксидов металлов Мп—Fe, Мп—Сг и Fe—Сг оказалось, что наибольшей активностью обладает смесь гидроксидов Мп—Сг. Марганец по сравнению с другими металлами обладает способностью менять свою валентность на 4 и 5 единиц (от Мп2+ до Мп +), оставаясь устойчивым в водном растворе. Энергетические затраты при последующем окислении иона марганца мало зависят от степени его окисления [99], т. е. ион марганца мол-сет одновременно взаимодействовать с несколькими молекулами активного хлора. Этим можно объяснить высокую активность марганца. По аналогии с марганцем можно предположить, что ионы хрома должны быть более активными, чем ионы Со +, Си +, Fe +, Ni + и др. По-видимому, этим объясняется высокая активность смеси гидроксидов марганца и хрома [109]. Вероятно также, что ионы металлов переменной валентности, встречающиеся в некоторых категориях сточных вод, катализируют процесс электрохимического окисления органических загрязнений. [c.203]
[c.203]
Очевидно, что в основе регулирующей функции солей К и Мп лежат разные причины. Так как марганец в ходе процесса окисления претерпевает цикл валентных превращений, то естественно предположить, что природа его регулирующей активности связана с высоким окислительным потенциалом Мп [c.363]
В качестве металлов переменной валентности могут использоваться медь, кобальт, палладий, марганец, хром, железо. При достаточно высокой температуре полимеризации могут протекать вторичные реакции восстановления металла гидроперекисью [c.141]
Марганец. Химический элемент VH группы периодической системы Менделеева, порядковый номер 25, атомная масса 54,938. Состоит из одного устойчивого изотопа Мп. Искусственно получены радиоактивные изотопы, из которых наиболее известны и Мп. В природе в свободном виде не встречается. Входит в состав многих минералов, среди которых.наиболее распространены пиролюзит, псило-мелан, манганит и др.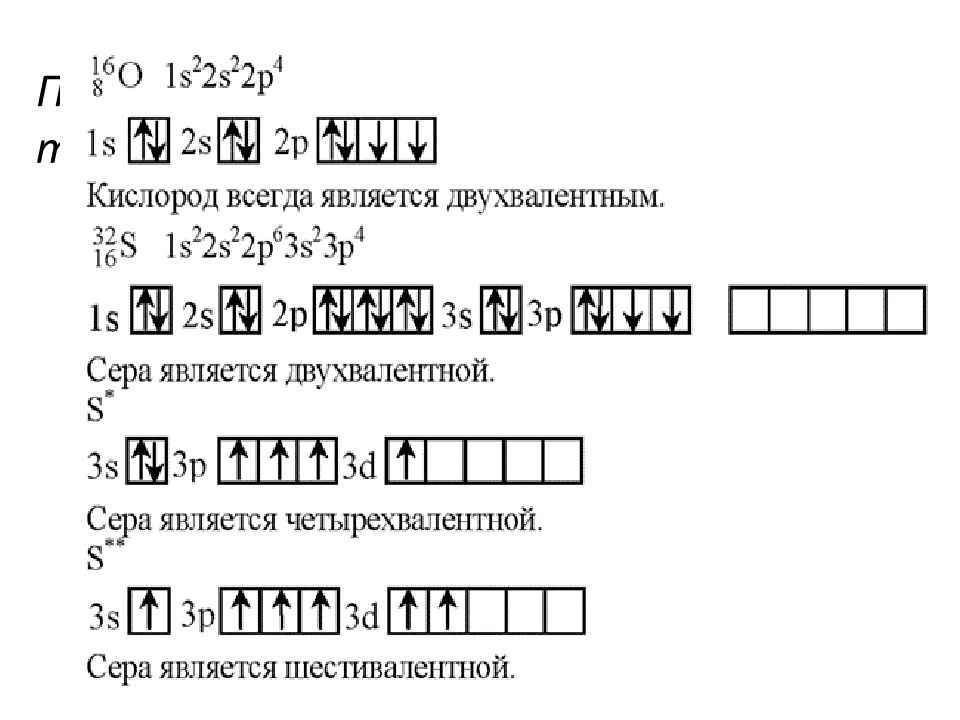 В настоящее время известно около 150 собственно марганцевых минералов. Кроме того, марганец (чаще всего в форме 2-валентного иона) входит в виде примесей в состав сотен других соединений — сульфидов, окислов, карбонатов,- силикатов, боратов, сульфатов и особенно фосфатов. Существует группа очень богатых марганцем живых организмов, (некоторые водные растения, грибы, лишайники и др.), довольно широко распространенных в природе. Содержание марганца в них может достигать 1% живой массы. Однако существуют еще более богатые марганцем организмы. Так, например, некоторые бактерии могут содержать до 6…7% марганца. Эти организмы играют важную роль в образовании марганцевых отложений. Соединения 2-валентного марганца хорошо растворимы в воде, а более высоких валентностей почти не растворимы и поэтому малоподвижны в биосфере. [c.50]
В настоящее время известно около 150 собственно марганцевых минералов. Кроме того, марганец (чаще всего в форме 2-валентного иона) входит в виде примесей в состав сотен других соединений — сульфидов, окислов, карбонатов,- силикатов, боратов, сульфатов и особенно фосфатов. Существует группа очень богатых марганцем живых организмов, (некоторые водные растения, грибы, лишайники и др.), довольно широко распространенных в природе. Содержание марганца в них может достигать 1% живой массы. Однако существуют еще более богатые марганцем организмы. Так, например, некоторые бактерии могут содержать до 6…7% марганца. Эти организмы играют важную роль в образовании марганцевых отложений. Соединения 2-валентного марганца хорошо растворимы в воде, а более высоких валентностей почти не растворимы и поэтому малоподвижны в биосфере. [c.50]
Более сильными окислителями сама двуокись марганца может быть окислена в соединения с более высокой валентностью марганца. При сплавлении двуокиси маргаца с бертолетовой солью (или другим сильным окислителем) и щелочью образуется соль марганцовистой кислоты Н2МПО4, в которой марганец шестивалентен [c. 295]
295]
Исследование А. Т. Ваграмяна и Д. Н. Усачева и показало, что в случае злектроосаждения хрома процесс осложняется наличием пленки на поверхности электрода. Согласно развитому в работе представлению [39], восстановление ионов хрома происходит не из ионов раствора, а непосредственно из продуктов пленки, образующейся в процессе электролиза на поверхности катода. В состав этой пленки входят хромат-ионы и продукты их неполного восстановления, кроме того,— некоторое количество чужеродных анионов, без которых выделения металла не происходит. Д. Н. Усачевым и А. Т. Ваграмяном было предположено, что металлы, которые входят в пленку в виде сложных анионов и являются ее составной частью, могут разряжаться наряду с ионами хрома. Исследование показало, что действительно при введении в раствор хромовой кислоты марганца в виде КМПО4 на катоде осаждается сплав марганец —хром, содержащий при определенных условиях электролиза (температура, плотность тока, концентрация) 15% Мп и 85% Сг. При изменении условий электролиза состав сплава меняется. Следует отметить, что при введении в хромовый электролит марганца не в виде аниона, а в виде катиона М.п + на катоде осаждается лишь хром, а марганец в осадке не обнаруживается. Это совершенно необычное, аномальное явление для электрохимии, когда в одинаковых условиях электролиза ион более высокой валентности восстанавливается до металла, а более низкой — не восстанавливается. [c.194]
При изменении условий электролиза состав сплава меняется. Следует отметить, что при введении в хромовый электролит марганца не в виде аниона, а в виде катиона М.п + на катоде осаждается лишь хром, а марганец в осадке не обнаруживается. Это совершенно необычное, аномальное явление для электрохимии, когда в одинаковых условиях электролиза ион более высокой валентности восстанавливается до металла, а более низкой — не восстанавливается. [c.194]
Ато.мы элементов первых трех групп и всех переходных элементов в низших валентных состояниях, а также лантанидов и актинидов проявляют всегда только положительную электровалентность. При взаимодействии этих атомов с наиболее электроотрицательными элементами (с элементами VIA иУПА групп, а также с элементами IV—V групп 2-го периода) образуются соединения с ионной связью. Переходные элементы в более высоких валентных состояниях не дают свободных (гидратированных) катионов, а вступают в полярную связь с атомами кислорода или гидроксильной группой, образуя сложные катионы, либо входят в состав анионов. Например, четырехвалентный ванадий в водных растворах существует в виде катиона ванадила V0 +, пятивалентный молибден—в виде молибденила МоО — -, а шестивалентный и семивалентный марганец находятся в форме анионов МПО4 и МпОГ-Этот переход от ионной к ковалентной связи при повышении электровалентности переходного элемента обусловлен увеличением электроотрицательности атома при расчете на последующие его электроны (см. стр. 31). [c.39]
Например, четырехвалентный ванадий в водных растворах существует в виде катиона ванадила V0 +, пятивалентный молибден—в виде молибденила МоО — -, а шестивалентный и семивалентный марганец находятся в форме анионов МПО4 и МпОГ-Этот переход от ионной к ковалентной связи при повышении электровалентности переходного элемента обусловлен увеличением электроотрицательности атома при расчете на последующие его электроны (см. стр. 31). [c.39]
Индикаторы хромогенчерный ЕТ-00 и кислотный хромтемносиний в присутствии следов дву.хвалентного марганца быстро обесцвечиваются при pH 10. Это обесцвечивание в литературе иногда объясняют тем, что в щелочной среде марганец (+2) очень легко окисляется кислородом воздуха до более высоких валентностей, а образовавшийся трех- или четырехвалентный марганец окисляет далее хромовый индикатор, вызывая его обесцвечивание. Наблюдение за скоростью окисления индикаторов в щелочной среде сильными окислителями, необратимость этого окисления и возвращение окраски индикаторов, обесцвеченных в присутствии солей марганца путем добавления гидроксиламина или гидразина, приводит нас к выводу, что обесцвечивание индикаторов в этом случае объясняется не разрушением его, а адсорбцией индикаторов на труднорастворимых гидроокисях трех- или четырехвалентного марганца. Введение в этот раствор восстановителя приводит к десорбции индикатора и возвращению его окраски. [c.47]
Введение в этот раствор восстановителя приводит к десорбции индикатора и возвращению его окраски. [c.47]
В большинстве случаев галоидирование ускоряется под действием светового облучения (длина волны 3000—5000 А) или высокой температуры (в присутствии катализатора или без него). В качестве катализаторов обычно применяют галоидные соединения металлов, имеющих два валентных состояния, способные отдавать атомы галоидов при переходе из одного валентного состояния в другое, — P I5, P I3, Fe lg. Используют также хлористую сурьму или хлористый марганец, а также неметаллические катализаторы — иод, бром или фосфор. [c.259]
Было выяснено, что паивысшие результаты получаются с жидкостями, которые с чисто-химической точки зрения являются наиболе)е активными. Среди неорганических соединений наиболее легко адсорбируются растворы таких веществ, у которых высокий молекулярный вес соединеп с высокой же валентностью, как например марганец, [c. 212]
212]
Необходимо отметить отсутствие доказательств того, что никель является единственно пригодным анодным материалом для электрохимического фторирования. Представляет большой интерес испытать для этой цели и другие металлы, особенно кобальт, серебро, марганец и свинец. Они могут окисляться до высших валентных состояний при цотенциале, более низком, чем требуется для выделения свободного фтора. Хорошо известно также, что фториды СоРз, АдРг, МпРз и РЬР4, используемые в качестве фторирующих агентов, обладают высокой активностью . [c.516]
Как правило, окислы и гидраты окислов высшей валентности менее растворимы, чем соответствующие низковалентные соединения. Пассивация или образование пленки для металлов, дающих такие окислы и гидроокиси, протекает в общем случае легче этому благоприятствует также повышение анодного потенциала. Однако в некоторых случаях окисел высшей валентности хорошо растворим Б воде. Такие металлы, как ванадий [34], хром [10] и марганец [18], легко пассивирующиеся или образующие пленку при небольших анодных поляризациях, снова начинают активно растворяться при высоких положительных потенциалах с образованием растворимых ванадиевой, хромовой и марганцевой кислот. [c.289]
[c.289]
Марганец, технеций и рений — -переходные металлы VII группы — имеют внешние оболочки V. У марганца в связи с устойчивостью наполовину заполненной «-оболочки, состоящей из пяти электронов с параллельными спинами (конфигурация ), и высокими значениями потенциалов ионизации отделение всех семи валентных электронов при образовании кристаллической структуры оказывается уже невозможным. По-видимому, свободными электронами в металлическом состоянии могут стать не более двух электронов с внешнего -уровня. Это соответствует тому, что в наиболее прочных соединениях марганец двухвалентен (МпО). На значительно более низкую концентрацию свободных электронов в металлическом марганце (1—2 эл атом) указывает также резкое падение температуры плавления при переходе от ванадия (5- -) и хрома (6-)-) к марганцу (l» ). При низких температурах марганец образует сложные не типичные для металлов хрупкие структуры. До 727° устойчив а-Мп, имеющий сложную объемноцентрированную кубическую структуру с 58 атомами в элементарной ячейке, в которой 24 атома марганца, по-видимому, находятся в двухвалентном состоянии (Мп » ), а остальные — в одновалентном (Мп ). Средняя электронная концентрация близка поэтому к 1,5. В интервале 727—1095° стабилен р-Мп, имеющий сложную плотную кубическую упаковку с 20 атомами в элементарной ячейке. Структура состоит из ионов и Мп и характеризуется электронной концентрацией 1,5 и координационными числами для обоих сортов ионов, близкими к 12. Такой тип структуры имеют многие электронные фазы с электронной концентрацией например AgHg. При еще более высоких температурах (1095—1134°) появляется плотная кубическая модификация «f-Mn, имеющая после закалки небольшую тетрагональность (с/а=0,95). Между 1134° и температурой плавления (1244°) существует объемноцентрированная кубическая модификация 6-Мп. Марганец, помимо устойчивых соединений, где он двухвалентен, образует, хотя и менее устойчивые, одновалентные соединения. Коулз, Юм-Розери и Мейер считают одновалентным марганец в uaMnIn. Доказательством того, что марганец может находиться в собственной решетке в одновалентном состоянии, служат более низкие температуры его плавления и кипения, меньшие теплоты плавления и испарения и очень высокое давление паров по сравнению с его соседом — железом, атомы которого в металлическом состоянии двухкратно ионизированы (Fe » ).
Средняя электронная концентрация близка поэтому к 1,5. В интервале 727—1095° стабилен р-Мп, имеющий сложную плотную кубическую упаковку с 20 атомами в элементарной ячейке. Структура состоит из ионов и Мп и характеризуется электронной концентрацией 1,5 и координационными числами для обоих сортов ионов, близкими к 12. Такой тип структуры имеют многие электронные фазы с электронной концентрацией например AgHg. При еще более высоких температурах (1095—1134°) появляется плотная кубическая модификация «f-Mn, имеющая после закалки небольшую тетрагональность (с/а=0,95). Между 1134° и температурой плавления (1244°) существует объемноцентрированная кубическая модификация 6-Мп. Марганец, помимо устойчивых соединений, где он двухвалентен, образует, хотя и менее устойчивые, одновалентные соединения. Коулз, Юм-Розери и Мейер считают одновалентным марганец в uaMnIn. Доказательством того, что марганец может находиться в собственной решетке в одновалентном состоянии, служат более низкие температуры его плавления и кипения, меньшие теплоты плавления и испарения и очень высокое давление паров по сравнению с его соседом — железом, атомы которого в металлическом состоянии двухкратно ионизированы (Fe » ). Эти константы марганца ближе к соответствующим термодинамическим характеристикам меди, атомы которой в металлическом состоянии однократно ионизированы (Си » «). [c.225]
Эти константы марганца ближе к соответствующим термодинамическим характеристикам меди, атомы которой в металлическом состоянии однократно ионизированы (Си » «). [c.225]
В противоположность металлам с почти заполненной -зоной марганец имеет большее число незанятых мест в 3 -зoнe. При добавлении марганца к другим переходным металлам, в данном случае к никелю, палладию и платине, существуют возмоншости либо достраивания общей зоны, либо заполнения -зоны матричного компонента (никель, палладий, платина) валентными электронами марганца. Результаты показали, что небольшие добавки марганца приводят к возникновению общей -зоны с никелем и палладием [34, 35]. При этом металлы находятся еще в области образования смешанных кристаллов, а следовательно, в области кубической гранецентрированной решетки а-фазы никеля или палладия. Отсюда неизбежно увеличение числа разрешенных квантовых состояний в общей -зоне. Подобного рода сплавы характеризуются значительно более высокими значениями скорости (А ) реакции нара-орто-конверсии водорода, чем чистые никель, палладий и платина (рис. 9). [c.27]
9). [c.27]
Кора выветривания — это область широкого развития процессов окисления. Окисление -процесс передачи электронов атомами, входящими в минерал, кислороду. В корах выветривания окисление идет преимущественно в водной среде, а элементы с переменной валентностью переходят к ее более высокому состоянию. Железо, марганец и сера в изверженных породах находятся в основном в двухвалентной форме (Ре»», Мп», З» ), а в коре выветривания, окисляясь, дают соединения Ре «, Мп» «, 3 » (РегОз, МпОг, СаЗОд и т.д.). Часто процесс окисления идет ступенчато, с образованием промежуточных минералов [c.19]
Валентность марганца
Валентность марганца.
Валентность марганца:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.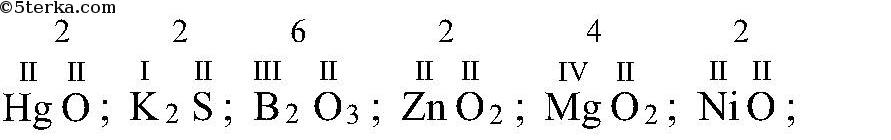
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность марганца равна II, III, IV, VI, VII. Марганец проявляет переменную валентность.
| Валентность марганца в соединениях | |
| II | MnO, Mn(OH)2, MnCl2, MnS, MnCO3, Mn3(PO4)2 |
| III | MnCl3, Mn2O3 |
| IV | MnO2 |
| VI | MnF6, MnOF4, MnO3 |
| VII | Mn2O7, MnO3F |
Все свойства атома марганца
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Коэффициент востребованности
105
Тест с ответами: “Валентность” | Образовательный портал
1. Валентность:
а) способность присоединять атомы +
б) способность обмениваться атомами
в) способность отделять атомы
2. К элементам с постоянной валентностью относится:
а) сера
б) водород +
в) марганец
3. К элементам с переменной валентностью не относится:
а) железо
б) марганец
в) водород +
4. Какая связь происходит за счет образования общих электронных пар:
а) ковалентная связь +
б) металлическая связь
в) водородная связь
5. Какое из утверждений является верным:
Какое из утверждений является верным:
а) валентность не имеет знака и может быть равной нулю
б) валентность имеет знак и не может быть равной нулю
в) валентность не имеет знака и не может быть равной нулю +
6. Как выглядит формула хлористого водорода, если известно, что валентность хлора равна единице:
а) HCl2
б) HCl +
в) HCl4
7. Какая валентность у марганца в данном соединении – Mn2O7:
а) II
б) IV
в) VII +
8. Какова валентность у углерода в формуле Ch5:
а) IV +
б) VII
в) VI
9. Один из видов валентности:
а) непостоянная
б) временная
в) постоянная +
10. Один из видов валентности:
а) временная
б) переменная +
в) непостоянная
11. Сколько атомов водорода присутствует в молекуле воды:
а) 2 +
б) 3
в) 1
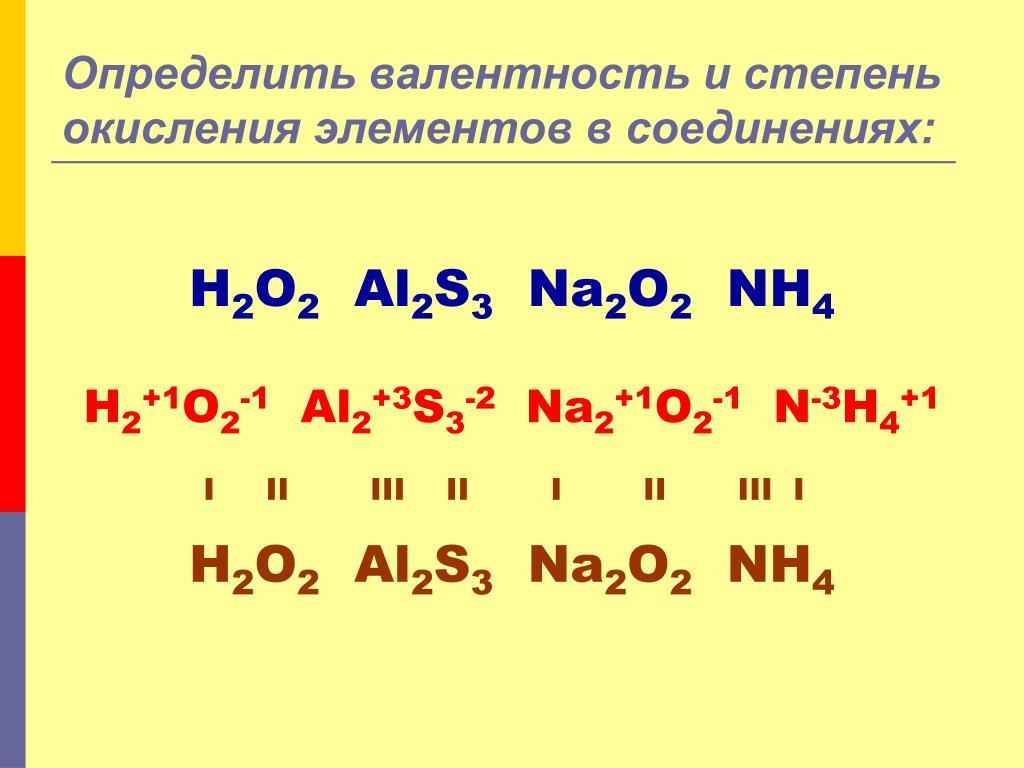
12. Степень окисления:
а) число, равное количеству электронов внешнего уровня атома
б) условный заряд атома, вычисленный на основе предположения, что соединение построено по ионному типу +
в) число химических связей, образуемых атомом химического элемента
13. Максимальная валентность атома фосфора:
Максимальная валентность атома фосфора:
а) V +
б) IV
в) +5
14. Минимальная валентность атома хлора:
а) V
б) -6
в) -1 +
15. Максимальная степень окисления хлора:
а) -2 +
б) -1
в) VII
16. Минимальная степень окисления атома углерода:
а) +2
б) -4 +
в) V
17. Этимологию термина валентность возможно отследить, начиная с этого года:
а) 1525
б) 1542
в) 1425 +
18. В этом году Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества:
а) 1709
б) 1789 +
в) 1889
19. Точное и позже полностью подтверждённое понимание феномена валентности было предложено в этом году:
а) 1952
б) 1825
в) 1852 +
20. Решающую роль в создании теории валентности сыграл:
а) Менделеев
б) Кекуле +
в) Ломоносов
21. Огромным достоинством теории валентности явилась возможность наглядного изображения:
а) молекулы +
б) атома
в) частицы
22. В 1860-х годах появились первые:
В 1860-х годах появились первые:
а) молярные модели
б) молекулярные модели +
в) ионные модели
23. Первоначально за единицу валентности была принята валентность атома:
а) гелия
б) кислорода
в) водорода +
24. Валентность кислорода, как правило, равна:
а) трем
б) двум +
в) одному
25. У большинства элементов значения валентности в водородных и в кислородных соединениях:
а) равные
б) одинаковы
в) различны +
26. В монооксиде углерода валентность углерода равна:
а) 3
б) 2 +
в) 4
27. В соединениях с такими связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей:
а) ковалентными +
б) валентными
в) ионными
28. В современной химии активно используется метод молекулярных орбиталей, в котором отсутствуют какие-либо аналоги понятия валентности:
а) частицы
б) ядра
в) атома +
29. В неорганической химии во многих случаях понятие валентности элемента теряет:
а) определённость +
б) однозначность
в) неопределенность
30. По валентности элементов можно составлять такие формулы соединений:
По валентности элементов можно составлять такие формулы соединений:
а) правдивые
б) истинные +
в) настоящие
Валентность марганца. Свойства химических элементов
В IV периоде системы химических элементов под номером 25 расположен металл – марганец, наряду с технецием и рением он образует побочную подгруппу седьмой группы. Элемент широко распространен в земной коре и входит в состав различных горных пород: пиролюзита, браунита, гаусманита. Марганец, валентность которого может быть равной II, III, IV, VI,VII, образует большое количество соединений. Это, например, оксиды, кислоты и соли, играющие важную роль в металлургической промышленности. В нашей статье мы выясним их свойства, способы получения и применение в различных отраслях производства, в медицине и в быту.
Физическая характеристика
Согласно положению в периодической системе химических элементов Д. И. Менделеева, металл относится к d-элементам, у которого валентными являются не только два электрона последнего энергетического слоя, но и отрицательные частицы, расположенные на третьем уровне. Как известно, все d-элементы проявляют физико-химические свойства типичных металлов. Марганец – не исключение. Он имеет серебристо-белый цвет, твердый и тяжелый (плотность составляет 7,44 г/см3), при температуре ниже 727° становится хрупким. Кристаллическая решетка может образовывать четыре модификации: α, β, ϒ и кубическую объемноцентрированную форму. Все они являются стойкими образованиями в только определенном диапазоне температур.
Как известно, все d-элементы проявляют физико-химические свойства типичных металлов. Марганец – не исключение. Он имеет серебристо-белый цвет, твердый и тяжелый (плотность составляет 7,44 г/см3), при температуре ниже 727° становится хрупким. Кристаллическая решетка может образовывать четыре модификации: α, β, ϒ и кубическую объемноцентрированную форму. Все они являются стойкими образованиями в только определенном диапазоне температур.
Положение в ряду активности металлов
Физико-химические свойства марганца зависят не только от его места в периодической системе химических элементов, но и от его положения в ряду активности металлов, созданном российским ученым Н. Н. Бекетовым. В нем марганец имеет стандартный электродный потенциал, равный -1,179 В. Элемент располагается между алюминием и цинком. Это говорит о способности атомов Mn вытеснять ионы водорода из водных растворов кислот в окислительно-восстановительных процессах. Валентность марганца в таких реакциях обычно равна II. Элемент активно реагирует с разбавленными растворами нитратной и хлоридной кислот. Также металл участвует в реакции замещения с горячей концентрированной сульфатной кислотой. В продуктах обнаруживается двуокись серы и вода. Кроме них образуется соль – сульфат марганца. В ней валентность атома металла равна двум. Зато в холодной серной кислоте марганец не растворяется вследствие образования на его поверхности защитной оксидной пленки (пассивация металла).
Элемент активно реагирует с разбавленными растворами нитратной и хлоридной кислот. Также металл участвует в реакции замещения с горячей концентрированной сульфатной кислотой. В продуктах обнаруживается двуокись серы и вода. Кроме них образуется соль – сульфат марганца. В ней валентность атома металла равна двум. Зато в холодной серной кислоте марганец не растворяется вследствие образования на его поверхности защитной оксидной пленки (пассивация металла).
Характеристика соединений двухвалентного марганца
Под действием кислот на природные соединения, содержащие ионы Mn2+ или в процессе растворения простого вещества – металла в разбавленных растворах неорганических кислот, образуются соли двухвалентного марганца. Например, кристаллы хлорида марганца розового цвета можно добыть действием раствора соляной кислоты на оксид марганца, валентность которого равна IV. В лаборатории, действуя на соответствующие соли щелочами, получают белый осадок гидроксида Mn(OH)2. В открытой пробирке на воздухе он окисляется, превращаясь в вещество бурого цвета. Бинарное соединение – оксид двухвалентного марганца, является продуктом восстановления водородом окислов металла со степенью окисления +4 или +7.
В открытой пробирке на воздухе он окисляется, превращаясь в вещество бурого цвета. Бинарное соединение – оксид двухвалентного марганца, является продуктом восстановления водородом окислов металла со степенью окисления +4 или +7.
Амфотерные свойства диоксида марганца
С увеличением валентности в соединениях металла с кислородом прослеживается ослабление основных и усиление кислотных свойств. Так, соединение с формулой Mn2O3 и монооксид марганца, в котором валентность атома металла равна II, имеют основный характер, двуокись – амфотерна, а Mn2O7 является ангидридом марганцевой кислоты. В среде, где pH меньше 7, диоксид ведет себя как сильный окислитель. Именно в этом качестве его используют в гальванических элементах и в промышленном производстве хлора из соляной кислоты. Восстановительная же способность диоксида марганца в реакциях проявляется очень слабо.
Важнейшие соединения шестивалентного и семивалентного марганца
Сплавляя двуокись металла с его солями – нитратами и карбонатами, можно получить твердое вещество зеленого цвета. Оно хорошо растворяется в воде. Выпаривая раствор, добываем темно-зеленое кристаллическое соединение – манганат калия, валентность марганца в котором равна VI. В реакциях с сильными окислителями – фтором, хлором, вещество превращается в соль марганцевой кислоты – перманганат калия. Ее темно-фиолетовые кристаллы хорошо знакомы, и в быту она называется марганцовкой. Ее раствор имеет малиновую окраску и в невысоких концентрациях используется как прекрасное дезинфекцирующее средство для наружного применения. В школьном курсе химии детально изучают окислительно-восстановительные процессы, в которых перманганат калия применяют в качестве окислителя. В зависимости от реакции раствора (нейтральной, кислой или щелочной) в продуктах обнаруживаются различные соединения.
Например, в кислой среде при взаимодействии с сульфитом калия ионы Mn+7 восстанавливаются до Mn+2, получается сульфат марганца. В нейтральной среде наблюдается выпадение бурого осадка, и валентность марганца в оксиде, который образовался, будет равна IV. В щелочной среде реакция сульфита калия и соли марганцевой кислоты заканчивается появлением в растворе ионов манганата калия.
Получение и применение металла
Наиболее чистые образцы марганца можно получить в процессе электролиза раствора его сульфата, который образуется при восстановлении пиролюзита, браунита или гаусманита. Как мы уже говорили ранее, валентность марганца в соединениях, входящих в состав руд, равна II. Более дешевым способом, по сравнению с энергоемким электролизом, можно считать силикотермический процесс. Он заключается в реакции восстановления окислов марганца кремнием, который проводят в электрических печах. Однако чистота полученного металла при этом снижается. Наиболее востребован марганец в производстве легированных сортов стали, содержащих его до 15 %.
Такие сплавы отличаются особой прочностью и стойкостью к ударам и вибрации, поэтому они нашли применение в производстве железнодорожных рельсов, частей камнедробильных машин и перфораторов. Если в составе сплава есть не только марганец, но и магний, то он приобретает способность противостоять факторам, вызывающим различные виды коррозии. Конструкционные сплавы – мельхиоры и нейзильберы, применяемые в судостроении, производстве трубопроводов и радиаторов, также содержат небольшую часть марганца. В составе электротехнических сплавов, например, в манганине, содержание металла доходит до 12 %, они характеризуются низким температурным показателем электросопротивления и широко используются в технике.
Всероссийское совещание «СОВРЕМЕННЫЕ ПРОБЛЕМЫ ГЕОХИМИИ»
Чубаров В.М.
Рентгенофлуоресцентное определение валентного состояния марганца в железомарганцевых конкрециях
РЕНТГЕНОСПЕКТРАЛЬНОЕ ОПРЕДЕЛЕНИЕ ВАЛЕНТНОГО СОСТОЯНИЯ МАРГАНЦА В ЖЕЛЕЗОМАРГАНЦЕВЫХ КОНКРЕЦИЯХ
Чубаров В.М.
Институт геохимии им. А.П.Виноградова СО РАН, г. Иркутск,
e-mail: [email protected]
Исследования валентного состояния марганца в железомарганцевых конкрециях (ЖМК) важны с точки зрения минералогии и способности поглощения конкрециями следовых элементов. Влияние химической связи на интенсивность линий рентгеновского спектра марганца проявляется для линий L-серии (Albee, 1970), а также для сравнительно слабых сателлитов K-линии (Sakurai, 1980), обусловленных переходами электронов из состояния в валентной M-оболочке на внутренние оболочки атома. Метод рентгеновского микроанализа (РМА) использовался для определения валентного состояния марганца по отношению интенсивностей линий MnL1,2 и MnL (Albee, 1970), а также с использованием эффекта поглощения линии MnL MnLIII-краем поглощения (Куликова, 1998). Рентгенофлуоресцентный анализ (РФА) широко используют для определения содержания породообразующих элементов в горных породах, он обеспечивает высокую производительность и сравнительно низкие затраты на пробоподготовку. Для определения валентного состояния элементов методом РФА может быть использована К-серия рентгеновского флуоресцентного спектра (Филиппов, 2001). Было показано (Чубаров, 2009, 2010), что для определения валентного состояния железа методом РФА в образцах изверженных горных пород и железных руд целесообразно использовать отношение интенсивностей линий К-серии (K2,5 и IK1,3) при измерении в пике линии в первом порядке отражения; использование отношения линий L-серии (Lβ1 и Lα1,2) в качестве аналитического сигнала также возможно.
В данной работе проведена оценка погрешности определения валентного состояния марганца по K- и L-серии рентгеновского спектра в железомарганцевых конкрециях. Исследования выполнены на кристалл-дифракционном рентгенофлуоресцентном спектрометре S4 Pioneer (Bruker AXS). В области линии MnKβ1,3 присутствует ряд линий, интенсивность которых зависит от валентного состояния марганца: линия MnKβ5 и ряд сателлитов, наиболее интенсивным из которых является MnKβ’, обусловленный переходом K-M2,4 с выбросом электрона с уровня М4,5. Для демонстрации зависимости интенсивностей линий Kβ-спектра марганца от валентного состояния были построены разностные спектры, полученные путём вычитания из спектров соединений, содержащих марганец в различных зарядовых состояниях (MnO, Mn2O3, MnO2, MnS) спектра образца MnO. Для достижения лучшего разрешения линий спектры были записаны во втором порядке отражения. В области линии MnKβ5 интенсивности закономерно увеличиваются с ростом зарядового состояния марганца. В области сателлитов такая зависимость проявляется только для оксидных соединений марганца. Таким образом, использование линии MnKβ5 в качестве аналитической предпочтительнее, чем использование сателлитов.
Зависимость отношения интенсивностей выбранных аналитических линий от валентного состояния марганца (N) для 4 образов соединений марганца была аппроксимирована уравнением линейной регрессии:
RI =a0+a1*N, (1)
где а0 и а1 – коэффициенты регрессии, RI – отношение интенсивностей линий К-серии (MnKβ5 и MnKβ1,3).
В качестве аналитического параметра рассматривали также отношение интенсивностей линий L-серии (MnLβ1 и MnLα1,2). Уравнение (1) для линий К-серии характеризовалось величиной относительного стандартного отклонения V=1%, для линий L-серии – 5%. Предпочтение в качестве аналитического параметра было отдано отношению интенсивностей линий MnKβ5 и MnKβ1,3, которое обеспечивает меньшую величину V. По причине спектрального наложения линий FeKα1,2 и MnKβ1,3 использовали второй порядок отражения на кристалле LiF (200).
Для построения градуировочной функции использовали СО ЖМК (СДО-4, СДО-5, СДО-6, СДО-7) и марганцевой руды (44-а), в которых содержание MnO2 варьировало в диапазоне 24.3 — 56.8%, содержание MnOобщ – в диапазоне 20.0 — 67.9%. Зависимость отношения содержаний Rc= / от отношения интенсивностей линий MnKβ5 и MnKβ1,3 (RI) во втором порядке отражения для 3 образцов оксидов марганца и 5 СО было построена. Отклонение для СО от зависимости, полученной для образцов оксидов марганца увеличивается с ростом содержания железа в СО.
Приведены результаты определения содержания Mn4+ в СО железомарганцевых конкреций (ЖМК-1, ЖМК-2, GeoPT-23a), кобальтомарганцевых корок (КМК-1, КМК-2) и марганцевой руды (MnH). Марганец в конкрециях содержится преимущественно в форме Mn4+, однако марганцевые руды могут содержать значительные количества Mn2+. Рентгенофлуоресцентный метод обладает преимуществом в экспрессности и низкими затратами на пробоподготовку и может быть использован для оценки валентного состояния марганца в железомарганцевых конкрециях, поскольку использование методов потенциометрического и титриметрического анализа для этой цели затруднено.
Литература:
Куликова И.М., Баринский Р.Л., Пеков И.В. Метод микрообъемных исследований формы вхождения атомов марганца в кристаллическую структуру минералов // Записки ВМО. 1998. Ч. CXXVII. №3. С. 110-115.
Филиппов М.Н., Куприянова Т.А., Лямина О.И. Одновременное определение содержания и формы нахождения элемента в твердом теле рентгенофлуоресцентным методом // Журнал аналитической химии. 2001. Т.56. №8. С.817-824.
Чубаров В.М., Финкельштейн А.Л. Рентгенофлуоресцентное определение отношения FeO/Fe2O3tot в горных породах // Журнал аналитической химии. 2010. Т. 65. № 6. С. 634-641.
Чубаров В.М., Финкельштейн А.Л., Амиржанов А.А. Определение отношения FeO/Fe2O3tot в железных рудах по эмиссионным линиям K-серии рентгеновского флуоресцентного спектра // Аналитика и контроль. 2009. Т.13. № 3. С. 141-146.
Albee A.L., Chodos A.A. Semiquantitative electron microprobe determination of Fe2+/Fe3+ and Mn2+/Mn3+ in oxides and silicates and its application to petrologic problems // Amer. Miner. 1970. V. 55. N3/4. P.103-107.
Sakurai K., Eba H. Chemical characterization using relative intensity of manganese Kβ’ and Kβ5 X-ray fluorescence // Nuclear Instrument and Methods in Physical Research B. 2003. V. 199. P. 391-395.
К списку докладов
Комментарии
Валентность марганца. Свойства химических элементов
В IV периоде системы химических элементов под номером 25 расположен металл – марганец, наряду с технецием и рением он образует побочную подгруппу седьмой группы. Элемент широко распространен в земной коре и входит в состав различных горных пород: пиролюзита, браунита, гаусманита. Марганец, валентность которого может быть равной II, III, IV, VI,VII, образует большое количество соединений. Это, например, оксиды, кислоты и соли, играющие важную роль в металлургической промышленности. В нашей статье мы выясним их свойства, способы получения и применение в различных отраслях производства, в медицине и в быту.
Физическая характеристика
Согласно положению в периодической системе химических элементов Д. И. Менделеева, металл относится к d-элементам, у которого валентными являются не только два электрона последнего энергетического слоя, но и отрицательные частицы, расположенные на третьем уровне. Как известно, все d-элементы проявляют физико-химические свойства типичных металлов. Марганец – не исключение. Он имеет серебристо-белый цвет, твердый и тяжелый (плотность составляет 7,44 г/см3), при температуре ниже 727° становится хрупким. Кристаллическая решетка может образовывать четыре модификации: α, β, ϒ и кубическую объемноцентрированную форму. Все они являются стойкими образованиями в только определенном диапазоне температур.
Положение в ряду активности металлов
Физико-химические свойства марганца зависят не только от его места в периодической системе химических элементов, но и от его положения в ряду активности металлов, созданном российским ученым Н. Н. Бекетовым. В нем марганец имеет стандартный электродный потенциал, равный -1,179 В. Элемент располагается между алюминием и цинком. Это говорит о способности атомов Mn вытеснять ионы водорода из водных растворов кислот в окислительно-восстановительных процессах. Валентность марганца в таких реакциях обычно равна II. Элемент активно реагирует с разбавленными растворами нитратной и хлоридной кислот. Также металл участвует в реакции замещения с горячей концентрированной сульфатной кислотой. В продуктах обнаруживается двуокись серы и вода. Кроме них образуется соль – сульфат марганца. В ней валентность атома металла равна двум. Зато в холодной серной кислоте марганец не растворяется вследствие образования на его поверхности защитной оксидной пленки (пассивация металла).
Характеристика соединений двухвалентного марганца
Под действием кислот на природные соединения, содержащие ионы Mn2+ или в процессе растворения простого вещества – металла в разбавленных растворах неорганических кислот, образуются соли двухвалентного марганца. Например, кристаллы хлорида марганца розового цвета можно добыть действием раствора соляной кислоты на оксид марганца, валентность которого равна IV. В лаборатории, действуя на соответствующие соли щелочами, получают белый осадок гидроксида Mn(OH)2. В открытой пробирке на воздухе он окисляется, превращаясь в вещество бурого цвета. Бинарное соединение – оксид двухвалентного марганца, является продуктом восстановления водородом окислов металла со степенью окисления +4 или +7.
Амфотерные свойства диоксида марганца
С увеличением валентности в соединениях металла с кислородом прослеживается ослабление основных и усиление кислотных свойств. Так, соединение с формулой Mn2O3 и монооксид марганца, в котором валентность атома металла равна II, имеют основный характер, двуокись – амфотерна, а Mn2O7 является ангидридом марганцевой кислоты. В среде, где pH меньше 7, диоксид ведет себя как сильный окислитель. Именно в этом качестве его используют в гальванических элементах и в промышленном производстве хлора из соляной кислоты. Восстановительная же способность диоксида марганца в реакциях проявляется очень слабо.
Важнейшие соединения шестивалентного и семивалентного марганца
Сплавляя двуокись металла с его солями – нитратами и карбонатами, можно получить твердое вещество зеленого цвета. Оно хорошо растворяется в воде. Выпаривая раствор, добываем темно-зеленое кристаллическое соединение – манганат калия, валентность марганца в котором равна VI. В реакциях с сильными окислителями – фтором, хлором, вещество превращается в соль марганцевой кислоты – перманганат калия. Ее темно-фиолетовые кристаллы хорошо знакомы, и в быту она называется марганцовкой. Ее раствор имеет малиновую окраску и в невысоких концентрациях используется как прекрасное дезинфекцирующее средство для наружного применения. В школьном курсе химии детально изучают окислительно-восстановительные процессы, в которых перманганат калия применяют в качестве окислителя. В зависимости от реакции раствора (нейтральной, кислой или щелочной) в продуктах обнаруживаются различные соединения.
Например, в кислой среде при взаимодействии с сульфитом калия ионы Mn+7 восстанавливаются до Mn+2, получается сульфат марганца. В нейтральной среде наблюдается выпадение бурого осадка, и валентность марганца в оксиде, который образовался, будет равна IV. В щелочной среде реакция сульфита калия и соли марганцевой кислоты заканчивается появлением в растворе ионов манганата калия.
Получение и применение металла
Наиболее чистые образцы марганца можно получить в процессе электролиза раствора его сульфата, который образуется при восстановлении пиролюзита, браунита или гаусманита. Как мы уже говорили ранее, валентность марганца в соединениях, входящих в состав руд, равна II. Более дешевым способом, по сравнению с энергоемким электролизом, можно считать силикотермический процесс. Он заключается в реакции восстановления окислов марганца кремнием, который проводят в электрических печах. Однако чистота полученного металла при этом снижается. Наиболее востребован марганец в производстве легированных сортов стали, содержащих его до 15 %.
Такие сплавы отличаются особой прочностью и стойкостью к ударам и вибрации, поэтому они нашли применение в производстве железнодорожных рельсов, частей камнедробильных машин и перфораторов. Если в составе сплава есть не только марганец, но и магний, то он приобретает способность противостоять факторам, вызывающим различные виды коррозии. Конструкционные сплавы – мельхиоры и нейзильберы, применяемые в судостроении, производстве трубопроводов и радиаторов, также содержат небольшую часть марганца. В составе электротехнических сплавов, например, в манганине, содержание металла доходит до 12 %, они характеризуются низким температурным показателем электросопротивления и широко используются в технике.
|
Строение атома. 11 июн 2019 Так как число в атоме того или иного элемента равно На валентных орбиталях атома марганца находится 7 электронов.. .. Исходя из электронных структур атомов марганца и брома, их. На валентных атома марганца. орбиталях атомов этих элементов находится одинаковое число электронов – 7.. .. Марганец валентные переходы Справочник химика 21. атома серы на внешнем энергетическом уровне и заряд ядра равны Число валентных электронов у марганца равно. 1 3 5 7.. .. Элементы подгруппы марганца Справочник химика 21. В данном случае энергия орбиталей 3d подуровня равна энергии. Поэтому у марганца опять появляется второй электрон на 4s АО. Внешние валентные электроны, орбитали и подуровни Из электронов атома железа максимальное главное квантовое число n 4 имеют только. .. апрель С. 217. Ион, в составе которого 16 протонов и 18, имеет заряд Число валентных электронов у марганца равно. 1 2 3 5 4 7.. .. Наибольшая валентность Большая Энциклопедия Нефти и. Согласно общему числу валентных электронов высшая рассматриваемой подгруппы, как и у всех элементов VII группы, равна 7, высший окисел. .. Элементы подгруппы марганца VII группы периодической системы. Валентность соединениях равна Известно, что также характерны валентности II MnIIO, IV MnIVO2 VI В ядре атома марганца содержится 25 протонов и 31 нейтрон массовое число равно 56. А энергетическая диаграмма строится только для электронов внешнего. .. Марганец и его соединения. В двухъядерном комплексе, содержащем кобальт, марганец и бром, Наличие сравнительно большого числа валентных электронов с близкой. .. С. Т. Жуков Химия 8 9 класс Глава 6.Строение электронных. 01 марта 2019 Наталья Брянцева ответила: У марганца может быть от 2 до 7 валентных электронов.. .. Влияние серы на структуру и свойства алюминиевых сплавов. Число валентных электронов атома, марганца по кислороду также равна семи и соответствует номеру группы но семь. |
Тест химии по теме Строение атома. Ответы. на Сёзнайке.ру. Cтраница 1. Наибольшая может быть осуществлена у марганца, когда все За. При этом валентность равна семи. Число валентных электронов атома соответствует номеру группы, которой находится элемент в. .. Урок лекция по теме Валентные возможности атомов. 17 окт 2016 Число валентных электронов у марганца равно. 5 4 7. Ионную связь образуют между собой атомы. 1 С Н 2 К F 3 Р и Сl. .. Ванадий, марганец бром в таблице Д.И. Менделеева. отданных восстановителем, должно быть равно числу электронов, что обусловлено наличием на d подуровне предвнешнего уровня валентных.. .. Строение атома Мои Тесты для подготовки РК и. Цель урока: дать понятия, валентные электроны, научить В первую очередь атома определяется числом, Марганец имеет семь валентных электронов, два спаренных s четыре неспаренных, валентность углерода равна четырем.. .. Подготовка к ЕГЭ и ОГЭ Социальная сеть работников. Причем протонов равно по величине заряду ядра атома, т.е. порядковому номеру. Определим число валентных электронов для марганца.. .. Френкель Е. Самоучитель по химии. Часть I. Элементы общей. С увеличением степени окисления марганца кислот ные свойства соединений шести, равно номеру группы и числу валентных электронов для. .. IV. Химия элементов металлов. Таким образом, общее число марганца равно 5.78, столько же валентных электронов и у железа. Добавляемые электроны. .. Валентность марганца Mn, формулы и примеры. Марганец был впервые получен в 1774 г. шведским химиком Юханом Готлибом Ганом из Валентные электроны атома марганца имеют электронную. .. Сколько валентных электронов у марганца? – Яндекс.Знатоки. Число валентных электронов у марганца равно 5 4 7 19. Одинаковое электронное строение имеют частицы 1 2 Na0 и K0 3 Na. .. Свойства элементов и их соединений: Учебное пособие для. число электронов элементарной ячейке, естественно предположить, что кислород, чтобы ионов марганца и кислорода в случае уменьшения числа валентных 3d состояний Mn примерно равна сумме пЭс 2p -.. |
Какова валентность марганца в химическом составе MnO2 класса 11 CBSE
Подсказка: Валентность указывает на связывающую способность любого элемента в данном соединении. Марганец представляет собой химический элемент с символом Mn и атомным номером 25. Марганец является переходным элементом, поэтому он может иметь более одного валентного состояния.
Полный пошаговый ответ
В этом вопросе $ \ text {MnO} 2 $ одна молекула марганца и две молекулы кислорода соединяются, образуя это соединение.
$ \ text {Mn} + {{\ text {O}} _ {2}} \ to \ text {Mn} {{\ text {O}} _ {2}} $
Пусть валентность марганца (Mn) быть «x»
$ \ text {Mn} + {{\ text {O}} _ {2}} \ to \ text {Mn} {{\ text {O}} _ {2}} $
В этом соединении т.е. $ MnO2 $, каждый атом кислорода несет заряд $ -2 $. Таким образом, общий заряд кислорода составит -4 доллара. Чтобы сбалансировать отрицательный заряд на атоме кислорода (O), должен быть такой же положительный заряд на атоме Mn, чтобы образовалось нейтральное соединение. . Из-за различной электронной конфигурации этот элемент имеет переменную валентность.Иногда атом элемента может потерять больше электронов, чем находится в его валентной оболочке. {2}} $.он не встречается в природе как свободный элемент. Из-за различной электронной конфигурации этот элемент имеет переменную валентность. Иногда атом элемента может потерять больше электронов, чем находится в его валентной оболочке. Структура оксида марганца O = Mn = O.
Валентность марганца в $ \ text {Mn} {{\ text {O}} _ {2}} $ равна $ +4 $.
Примечание
Электроны существуют на орбитах вокруг атомного ядра. Чем выше номер орбиты, тем больше электроны удалены от ядра.Атомы пытаются достичь стабильного состояния, аналогичного состоянию благородных газов или инертных элементов на своей внешней орбите, принимая или отдавая электроны. Это свойство называется валентностью атома. Некоторые элементы различаются по способности сочетаться с другими элементами в зависимости от характера реакции; это свойство называется переменной валентностью.
Валентных электронов марганца | Валентность марганца (Mn) Диаграмма
Узнайте все о валентных электронах марганца здесь, в статье.Мы также обсудим другие важные характеристики марганца. В области науки или химии марганец — химический элемент. Он имеет атомный номер 25 и символ Mn.
Сколько валентных электронов у марганца?
В природе нет марганца в его прямой форме. Химический элемент часто извлекается из различных минералов, содержащих железо. Марганец в основном принадлежит к семейству переходных металлов в периодической таблице.Химический элемент имеет особое применение в качестве металлического элемента.
В основном марганец используется различными промышленными предприятиями. Например, он используется как ключевой компонент при производстве нержавеющей стали. Кроме того, марганец также широко используется в производстве различных инструментов. Вы можете увидеть его значительное использование в производстве алюминия или легкосплавных дисков автомобилей.
Электронно-точечная диаграмма валентности марганца
Электронная точечная диаграмма — важный инструмент в правильном анализе валентных электронов элемента.Вы также можете изучить подробную электронную точечную диаграмму валентных электронов марганца.
На точечной диаграмме точка в основном используется для обозначения символа химического элемента. Число точек прямо обозначает валентный электрон атома марганца. Это очень простой и очень эффективный способ привлечь валентные электроны соответствующего элемента. Вы можете нарисовать точечную диаграмму Льюиса для любых возможных химических элементов.
Валентность марганца — Mn
Ну, как известно, марганец относится к категории переходных химических элементов.Таким образом, он может иногда иметь переменную валентность. Максимально возможная валентность марганца — 2,4,7. Марганец имеет достаточно стабильную электронную конфигурацию, отсюда и такая валентность.
фактов о марганце, символ, открытие, свойства, повседневное использование
Что такое марганец
Марганец (произношение MAN-ge-nees [2] ), представленный химическим символом или формулой Mn [1] , является твердым, хрупким элементом, принадлежащим к семейству переходных металлов [1, 19] . Встречающийся в природе Mn имеет единственный стабильный изотоп с массовым числом 55 [1, 3] . Кроме того, он содержит 21 синтетический изотоп с массовыми числами от 46 до 66 [3] . Чистый Mn реагирует с водой и растворяется в разбавленных кислотах. Порошок горит в кислороде [16] .
Марганец Символ
Где это находится
Его полезные ископаемые широко распространены на Земле, среди которых наиболее распространены родохрозит (карбонат марганца) и пиролюзит (диоксид марганца).Это пятый по содержанию металл в земной коре. На дне океана обнаружены конкреции марганца, содержащие 24% Mn и меньшие количества многих других элементов. Месторождения и рудники Mn находятся в Китае (крупнейший производитель в мире [23] ), Индии, Австралии, Габоне и Африке [1] .
История
Происхождение его названия: Оно могло быть получено e ither от латинского слова «magnes», означающего «магнит», названия, используемого для обозначения его соединений, которые использовались в производстве стекла, или от «magnesia nigra», обозначающего черный магний. оксид на латыни [1, 3] .
Кто это открыл: Шведский химик и минералог, Йохан Готлиб Ган [1, 2] .
Когда был обнаружен марганец: Год его открытия — 1774 [1] .
Металлический марганец
Как было обнаружено
Соединения марганца использовались человечеством с древних времен. В 1740 году берлинский технолог по стеклу Иоганн Генрих Потт химически исследовал пиролюзит и показал, что он не содержит железа, как предполагалось в те дни, а представляет собой новый земляной металл.Он мог произвести из него перманганат калия, один из самых сильных известных окислителей. После нескольких неудачных попыток выделить металлический компонент минерала в 1700-х годах, Ган успешно произвел Mn в 1774 году путем нагревания пиролюзита в присутствии древесного угля. Однако Игнатий Каим, студент из Вены, уже описал, как он извлекал металл, хотя и в нечистой форме, в своей диссертации 1771 [1, 2, 3] .
Марганец
Марганец Идентификатор | |||
| Атомный номер | 25 [1] | ||
| Номер CAS | 7439-96-5 [1] | ||
| Положение в таблице Менделеева | Группа | Период | Блок |
| 7 [1] | 4 [1] | d [1] | |
Расположение марганца в Периодической таблице
Свойства и характеристики марганца
Общая недвижимость | |
| Атомная масса | 54.938 атомных единиц массы [1] |
| Атомный вес | 54,938 [1] |
| Массовое число | 55 [13] |
| Молярная масса / молекулярная масса | 54,938 г / моль [1] |
Физические свойства | |
| Цвет / внешний вид | Серо-белый [3] |
| Точка плавления / замерзания | 1246 ° C, 2275 ° F [1] |
| Температура кипения | 2061 ° C, 3742 ° F [1] |
| Плотность | 7.3 г см -3 [1] |
| Состояние вещества при комнатной температуре (нормальная фаза) | Цельный [1] |
| Теплопроводность | 7,7 Вт / (м · К) [21] |
| Удельная теплоемкость | 0,48 [15] |
| Удельный вес | 7,01 [17] |
Химические свойства | |
| Степени окисления / ионный заряд | 7, 6, 4, 3, 2, 0, -1 [1] |
Атомные данные марганца (элемент 25)
| Валентные электроны | 7 [5] | |||||||
| Валентность | +2, +3, +4, +7 [6, 7] | |||||||
| Квантовые числа | ||||||||
| — н. | 3 [4] | |||||||
| — | 2 [4] | |||||||
| — м ℓ | 2 [4] | |||||||
| — м с | + ½ [4] | |||||||
| Электронная конфигурация (конфигурация благородного газа) | [Ar] 3d 5 4s 2 [1] | |||||||
| Кристаллическая структура | Объемно-центрированный кубический [25] | |||||||
| Атомная структура | ||||||||
| — Количество электронов | 25 [3] | |||||||
| — Количество нейтронов | 30 [3] | |||||||
| — Число протонов | 25 [3] | |||||||
| Уровни энергии [3] | ||||||||
| — Первый уровень энергии | 2 | |||||||
| — Второй энергетический уровень | 8 | |||||||
| — Третий энергетический уровень | 13 | |||||||
| — Четвертый уровень энергии | 2 | |||||||
| Радиус атома | ||||||||
| — Атомный радиус | 2.05 Å [1] | |||||||
| — Ковалентный радиус | 1,29 Å [1] | |||||||
| Электроотрицательность (шкала Полинга) | 1,55 [1] | |||||||
| Энергия ионизации (кДжмоль -1 ) [1] | 1-й | 2-я | 3-й | 4-я | 5-я | 6-й | 7-я | 8-й |
| 717.274 | 1509.03 | 3248.468 | 4940 | 6985,5 | 9224 | 11501.342 | 18766,4 | |
Марганец-электронная конфигурация (диаграмма модели Бора)
Использование марганца
- При производстве стали. Его добавляют в сплав для увеличения его прочности и долговечности. Марганцовистая сталь содержит больший процент Mn, чрезвычайно прочна и используется в производстве сейфов, тюремных решеток, стволов для ружей и железнодорожных путей [1] .
- Mn добавляют в алюминиевые сплавы для повышения их прочности на разрыв и коррозионной стойкости. [20] . Из них делают банки для напитков [1] .
Марганцевое изображение
Вредно ли это
Хотя нам требуется небольшое количество марганца, превышение определенного допустимого предела может быть опасным. [10] . Следовательно, важно регулировать его уровни в питьевой воде и источниках пищи. Отравление Mn может привести к стойкому неврологическому расстройству, называемому манганизмом, со спазмами лицевых мышц, галлюцинациями, агрессивным поведением и тремором в качестве симптомов, депрессией, тревогой и т. Д. [11, 18] .Отравление Mn вызывает болезнь Паркинсона и деменцию [22] .
Элемент марганца (Mn)
Марганец для здоровья
Это важный элемент всех живых организмов. Микроэлементы поддерживают жизненно важные функции нашего тела, такие как выработка пищеварительных ферментов, развитие костей и иммунной системы, усвоение питательных веществ и т. Д., А также полезны для вашей кожи и волос. Он также играет важную биологическую роль, естественным образом уравновешивая гормоны, используя витамин B1 и способствуя метаболизму углеводов и жиров.Его недостаток может привести к остеопорозу, остеоартриту, диабету, потере веса, выпадению волос и т. Д. [8, 9, 26] . Почвы с низким уровнем марганца требуют добавления его к удобрениям и кормления пастбищными животными [1] . Может лечить воспаление, тендинит и т. Д. [24] .
В человеческом теле в среднем содержится около 12 миллиграммов металла. Рекомендуемая суточная норма диеты составляет около 4 миллиграммов в день. Цельнозерновые злаки, петрушка, чай, орехи и отруби — это продукты с высоким содержанием марганца.Mn является важным питательным микроэлементом для растений, где он в основном участвует в дыхании, фотосинтезе и ассимиляции азота [1, 12] .
Изображение марганца
Интересные факты
- Высокопроизводительные литий-ионные марганцевые батареи, в которых в качестве катодного материала используется марганец, являются прорывом в технологии [14] .
- Несмотря на происхождение названия, марганец не магнитный [3] !
Марганец (элемент Mn) Стоимость
Чистый металл оценивается в 6 долларов.5 на каждые 100 грамм и оптом, то же количество стоит 0,28 доллара США [3] .
Список литературы
- http://www.rsc.org/periodic-table/element/25/manganese
- https://education.jlab.org/itselemental/ele025.html
- https://www.chemicool.com/elements/manganese.html
- http://chemistry-reference.com/q_elements.asp?Symbol=Mn&language=en
- https://www.reference.com/science/many-valence-electrons-manganese-66a5fd4966baeba2
- https: // разумно.in / question / 1495960
- https://www.flashcardmachine.com/variable-valences-fortransitionmetals.html
- https://draxe.com/manganese/
- https://www.webmd.com/vitamins/ai/ingredientmono-182/manganese
- https://tataandhoward.com/2017/01/importance-treating-manganese-drinking-water/
- https://www.atsdr.cdc.gov/toxprofiles/tp151-c2.pdf
- https://www.pthorticulture.com/en/training-center/role-of-manganese-in-plant-culture/
- http: // www.elementalmatter.info/mass-numbers.htm
- https://www.prnewswire.com/news-releases/breakthrough-battery-technology-uses-manganese-sheets-671271924.html
- http://hyperphysics.phy-astr.gsu.edu/hbase/pertab/mn.html
- https://www.lenntech.com/periodic/elements/mn.htm
- https://www.mindat.org/min-11478.html
- https://www.scientificamerican.com/article/metals-and-mental-health/
- https://hobart.k12.in.us/ksms/PeriodicTable/manganese.htm
- https://link.springer.com/article/10.1007/BF03026339
- http://periodictable.com/Elements/025/data.html
- https://www.nejm.org/doi/full/10.1056/NEJM199703273361319
- https://investingnews.com/daily/resource-investing/critical-metals-investing/manganese-investing/op-manese-proroduction-countries-south-africa-china-austraia/
- https://mydynamis.com/blogs/health/45713281-manganese-for-tendonitis
- http://periodictable.com/Properties/A/CrystalStructure.HTML
- http://www.moyak.com/papers/manganese-enzyme-mineral.html
Валентность марганца. Сколько валентных электронов у марганца?
В химии валентность или валентность элемента — это мера его объединяющей способности с другими атомами, когда он образует химические соединения или молекулы. Комбинирующая способность или сродство атома данного элемента определяется числом атомов водорода, с которыми он соединяется.У метанауглерода валентность 4; в аммиачном азоте имеет валентность 3; в воде кислород имеет валентность 2; а в хлористом водороде хлор имеет валентность 1. Хлор, поскольку он имеет валентность, равную единице, может быть замещен водородом.
Фосфор имеет валентность 5 в пентахлориде фосфора PCl 5. Диаграммы валентности соединения представляют связь элементов с линиями, проведенными между двумя элементами, иногда называемыми связями, которые представляют насыщенную валентность для каждого элемента.Альтернативное современное описание: [3].
Это определение отличается от определения IUPAC, поскольку можно сказать, что элемент имеет более одной валентности. Очень похожее современное определение, данное в недавней статье, определяет валентность конкретного атома в молекуле как «количество электронов, которые атом использует для связывания», с двумя эквивалентными формулами для вычисления валентности: [4].
Этимология слов валентность множественного числа валентностей и валентность множественных валентностей восходит к значению «извлечение, подготовка», от латинского valentia «сила, способность», от более ранней доблести «ценность, ценность» и химического значения, относящегося к «соединению». сила стихии »записано в немецком Валенце.Концепция валентности была разработана во второй половине 19 века и помогла успешно объяснить молекулярную структуру неорганических и органических соединений.
InWilliam Хиггинс опубликовал взгляды на то, что он назвал комбинациями «предельных» частиц, которые предвосхитили концепцию валентных связей. Однако точное начало теории химических валентностей можно проследить в статье Эдварда Франкландина, в которой он объединил старую радикальную теорию с мыслями о химическом сродстве, чтобы показать, что определенные элементы имеют тенденцию объединяться с другими элементами с образованием соединений, содержащих 3, п.
По его словам, это способ наилучшего удовлетворения их родства, и, следуя этим примерам и постулатам, он заявляет, насколько очевидно это [7].
Здесь преобладает тенденция или закон, и независимо от характера объединяющих атомов, объединяющая сила притягивающего элемента, если мне позволено такое выражение, всегда удовлетворяется одним и тем же числом этих атомов.
Большинство химиков 19-го века определяли валентность элемента как количество его связей, не различая различных типов валентности или связи.Однако Альфред Вернер описал координационные комплексы переходных металлов, такие как [Co NH 3 6] Cl 3, в которых он выделил главную и вспомогательную валентности по немецки: «Hauptvalenz» и «Nebenvalenz», соответствующие современным представлениям о степени окисления и координационном числе соответственно.
Для элементов основной группы Ричард Абегг рассмотрел максимальные и минимальные состояния окисления с положительной и отрицательной валентностями и предложил правило Абегга, согласно которому их разница часто равна 8. Модель ядерного атома Резерфорда показала, что внешняя часть атома занята электронами, что предполагает что электроны несут ответственность за взаимодействие атомов и образование химических связей.
InGilbert N.
Уловка для определения валентности за 20 секунд — Определение валентности любого атома за 20 секунд — Супертрюк —
Льюис объяснил валентность и химическую связь в терминах тенденции атомов основной группы для достижения стабильного октета из 8 электронов валентной оболочки. Согласно Льюису, ковалентная связь приводит к октетам за счет разделения электронов, а ионная связь приводит к октетам за счет передачи электронов от одного атома к другому.
Термин «ковалентность» приписывается Ирвингу Ленгмюру, который заявил, что «число пар электронов, которые любой данный атом делит с соседними атомами, называется ковалентностью этого атома».После этого теперь чаще говорят о ковалентных связях, а не о валентности, которая вышла из употребления в высокоуровневых исследованиях из-за достижений теории химической связи, но все еще широко используется в элементарных исследованиях, где она обеспечивает эвристическое введение в предмет.
В статье Линус Полинг предположил, что существуют также полярные ковалентные связи, которые занимают промежуточное положение между ковалентными и ионными, и что степень ионного характера зависит от разницы электроотрицательностей двух связанных атомов.Полинг также рассматривал гипервалентные молекулы, в которых элементы основной группы имеют кажущуюся валентность больше, чем максимальное значение из 4, разрешенное правилом октетов.
Matlab ahrs
Например, в молекуле гексафторида серы SF 6Pauling считал, что сера образует 6 истинных двухэлектронных связей с использованием гибридных атомных орбиталей sp 3 d 2, которые объединяют одну s, три p и две d орбитали. Однако недавно квантово-механические расчеты этой и подобных молекул показали, что роль d-орбиталей в связывании минимальна, и что молекула SF 6 должна быть описана как имеющая 6 полярных ковалентных частично ионных связей, образованных только четырьмя орбиталями на серы один s и три p в соответствии с правилом октетов вместе с шестью орбиталями на фторах.
Для элементов в основных группах периодической таблицы валентность может варьироваться от 1 до 7. Многие элементы имеют общую валентность, связанную с их положением в периодической таблице, и в настоящее время это объясняется правилом октетов. Поливалентность или многовалентность относятся к видам, которые не ограничены определенным числом валентных связей.
Однозарядные виды одновалентны. Из-за неоднозначности термина валентность [13] в настоящее время предпочтительны другие обозначения.Помимо системы степеней окисления, используемой в номенклатуре запасов для координационных соединений [14], и лямбда-обозначений, используемых в номенклатуре неорганической химии ИЮПАК [15], степень окисления является более четким указанием электронного состояния атомов в молекуле. .Марганец Mnхимический элемент — один из серебристо-белых, твердых, хрупких металлов 7 группы VIIb периодической таблицы.
Шведский химик Карл Вильгельм Шееле признал его элементом во время работы с минералом пиролюзитом и в том же году выделил его соратником Йоханом Готлибом Ганом.Хотя он редко используется в чистом виде, марганец необходим для выплавки стали.
Он встречается в ряде крупных месторождений, из которых наиболее важные руды, в основном оксиды, состоят в основном из диоксида марганца MnO 2 в форме пиролюзитероманехита и пыжа.
Марганец необходим для роста растений и участвует в усвоении нитратов зелеными растениями и водорослями. Это важный микроэлемент у высших животных, у которых он участвует в действии многих ферментов.Недостаток марганца вызывает атрофию яичек. Избыток этого элемента у растений и животных токсичен. Большие площади дна океана покрыты конкрециями марганца, также называемыми полиметаллическими конкрециями, конкрециями марганца с некоторым количеством железа, кремния и алюминия.
По оценкам, количество марганца в конкрециях намного больше, чем в земельных запасах. Большая часть производимого марганца используется в виде ферромарганцевых и силикомарганцевых сплавов для производства чугуна и стали.Марганцевые руды, содержащие оксиды железа, сначала восстанавливают в доменных или электрических печах углеродом с получением ферромарганца, который, в свою очередь, используется в сталеплавильном производстве. Добавление марганца, который имеет большее сродство к сере, чем железо, превращает легкоплавкий сульфид железа в стали в тугоплавкий сульфид марганца.
Произведенная без марганца, сталь раскалывается при горячей прокатке или ковке. Стали обычно содержат менее 1% марганца. Марганцовистая сталь используется для очень тяжелых условий эксплуатации; Содержащий 11–14% марганца, он обеспечивает твердую, износостойкую и самообновляющуюся поверхность поверх прочного небьющегося сердечника.
Чистый марганец, полученный электролитическим способом, в основном используется для получения цветных сплавов из меди, алюминия, магния и никеля, а также для производства химикатов высокой чистоты.
Практически все промышленные сплавы алюминия и магния содержат марганец для улучшения коррозионной стойкости и механических свойств.
Что такое валентность?
Алюминиевые банки содержат около 1. Подробную информацию об извлечении, рафинировании и применении марганца см. В разделе «Обработка марганца».
Buppesannivas rus sub ep 10
Весь природный марганец является стабильным изотопом марганца. Он существует в четырех аллотропных модификациях; сложная кубическая структура так называемой альфа-фазы является формой, устойчивой при обычных температурах. По общей химической активности марганец чем-то напоминает железо. На воздухе металл окисляется поверхностно, а на влажном воздухе ржавеет. Марганец довольно электроположителен, легко растворяется в разбавленных неокисляющих кислотах. Эти показатели регулярно обновляются, чтобы отразить его использование до последних нескольких дней.
Цитирование — это количество других статей, цитирующих эту статью, рассчитывается Crossref и обновляется ежедневно. Узнайте больше о подсчете цитирований Crossref. Альтметрическая оценка внимания — это количественная мера внимания, которое исследовательская статья получила в Интернете.
Если щелкнуть значок пончика, страница будет загружена в альтметрической системе. Найдите дополнительную информацию об альтернативном показателе внимания и о том, как рассчитывается этот показатель. Разработка эффективных катализаторов, содержащих элементы с избытком земли, для реакции выделения кислорода OER в фотоэлектрохимических системах PEC очень желательна для недорогого хранения и преобразования энергии.Американское химическое общество владеет авторскими правами на любую подтверждающую информацию, защищенную авторским правом.
Файлы, доступные на веб-сайте ACS, можно загружать только для личного использования. Пользователям не разрешается воспроизводить, переиздавать, распространять или продавать любую Вспомогательную информацию с веб-сайта ACS, полностью или частично, в машиночитаемой или любой другой форме без разрешения Американского химического общества.
Для получения разрешения на воспроизведение, переиздание и распространение этого материала запрашивающие должны обрабатывать свои собственные запросы через систему разрешений RightsLink.Energy Mater. Просмотр информации об авторе. Цитируйте это: ACS Appl. Просмотр статьи Altmetric.
Цитата, подтверждающая информация. Цитируется. На эту статью цитируют 10 публикаций. Химия материалов32 5 Кондаридес, Давид Баррека. Передовые материалы32 39 Бедин, Дерек Н. Муч, Маурисио А. Мело, Андре Л. Фрейтас, Ренато В. ChemCatChem12 12 Аллахвердиев, Мохаммад Махди Наджафпур. New Journal of Chemistry44 8 Низкотемпературная твердотельная реакция для получения полых наночастиц MnxFe3-xO4 в качестве анода для литий-ионных аккумуляторов.
Nano Energy66 Марганец представляет собой химический элемент с символом Mn и атомным номером. Он не встречается в природе как свободный элемент [не проверено в организме]; он часто встречается в минералах в сочетании с железом.
Марганец — это переходный металл, широко применяемый в промышленных сплавах, особенно в нержавеющих сталях. Исторически марганец назван в честь пиролюзита и других черных минералов из региона Магнезия в Греции, который также дал свое название магнию и железорудному магнетиту.
К середине века шведско-немецкий химик Карл Вильгельм Шееле использовал пиролюзит для производства хлора.
Валентность (химия)
Шееле и другие знали, что пиролюзит, который теперь известен как диоксид марганца, содержит новый элемент, но они не смогли его выделить. Йохан Готлиб Ган первым выделил нечистый образец металлического марганца, восстановив диоксид углерода углеродом.
Марганцевое фосфатирование используется для защиты стали от ржавчины и коррозии.Ионизированный марганец используется в промышленности в виде пигментов различного цвета, который зависит от степени окисления ионов. Перманганаты щелочных и щелочноземельных металлов — сильные окислители. Диоксид марганца используется в качестве катодного акцептора электронов в углеродно-цинковых и щелочных батареях.
В биологии ионы марганца II действуют как кофакторы для большого количества ферментов, выполняющих множество функций. Марганец также участвует в синтезирующем кислород комплексе фотосинтезирующих растений.Хотя этот элемент является необходимым микроэлементом для всех известных живых организмов, он также действует как нейротоксин в больших количествах. В частности, при вдыхании он может вызвать у млекопитающих состояние манганизма, приводящее к неврологическим повреждениям, которые иногда необратимы. Марганец — серебристо-серый металл, напоминающий железо.
Он твердый и очень хрупкий, трудно плавится, но легко окисляется. Встречающийся в природе марганец состоит из одного стабильного изотопа55 Mn. Было выделено и описано несколько радиоизотопов с атомным весом от 44 до 69 Mn.Наиболее стабильными являются 53 Mn с периодом полураспада 3.
Все оставшиеся радиоактивные изотопы имеют период полураспада менее трех часов, а у большинства — менее одной минуты.
Первичная мода распада перед наиболее распространенным стабильным изотопом, 55 Mn, — это захват электронов, а первичная мода после — это бета-распад. Марганец входит в группу элементов железа, которые, как считается, синтезируются в крупных звездах незадолго до взрыва сверхновой. Из-за относительно короткого периода полураспада 53 Mn относительно редко образуется при воздействии космических лучей на железо.Изотопные отношения Mn-Cr подтверждают свидетельства, полученные от 26 Al и Pd для ранней истории Солнечной системы.
Следовательно, 53 Mn является дополнительным свидетельством нуклеосинтетических процессов непосредственно перед слиянием Солнечной системы. Эта степень окисления также наблюдается в минеральном карбонате марганца II родохрозита. Твердые соединения марганца III характеризуются сильным пурпурно-красным цветом и предпочтением искаженной октаэдрической координации, являющейся результатом эффекта Яна-Теллера.
Перманганат калия, перманганат натрия и перманганат бария являются сильными окислителями. Перманганат калия, также называемый кристаллами Конди, является широко используемым лабораторным реагентом из-за его окислительных свойств; он используется как местное лекарство, например, при лечении болезней рыб. Растворы перманганата калия были одними из первых красителей и фиксаторов, которые использовались при подготовке биологических клеток и тканей для электронной микроскопии. Происхождение названия марганец сложное.
В древние времена было два черных минерала из регионов Магнетес, либо Магнезия, находящаяся в пределах современной Греции, либо Магнезия и Сипил, расположенная в пределах современной Турции. Мужской магний притягивал железо, и это была железная руда, известная теперь как магнит или магнетит, что, вероятно, дало нам термин «магнит».
Магнезиальная руда не притягивала железо, но использовалась для обесцвечивания стекла. Этот женский магний позже был назван магнезиаком, известным в наше время как пиролюзит или диоксид марганца.В XVI веке диоксид марганца назывался марганцем, обратите внимание на два N вместо одного стеклодувами, возможно, как искажение и соединение двух слов, так как алхимики и стеклодувы в конечном итоге были вынуждены отличить магнезию негра, черную руду, от белой магнезии, белой руды. , также из магнезии, также используется в стекольном производстве. В неорганической номенклатуре манганат — это любое отрицательно заряженное молекулярное образование с марганцем в качестве центрального атома.
Ион манганата VI является тетраэдрическим, подобен сульфату или хромату: действительно, манганаты часто изоструктурны сульфатам и хроматам, факт, впервые отмеченный Митчерлихом в Манганате калия, который получают промышленным способом в качестве промежуточного продукта для перманганата калия путем растворения диоксида марганца в расплавленном калии. гидроксид с нитратом калия или воздухом в качестве окислителя.Манганаты, особенно нерастворимый манганат бария BaMnO 4, использовались в качестве окислителей в органическом синтезе: они окисляют первичные спирты до альдегидов, а затем до карбоновых кислот и вторичных спиртов до кетонов.
Манганаты неустойчивы к диспропорционированию во всех водных растворах, кроме наиболее щелочных. Манганат формально представляет собой сопряженное основание гипотетической марганцевой кислоты H 2 MnO 4, которое не может быть образовано из-за его быстрого диспропорционирования. Однако его вторая константа кислотной диссоциации была оценена методами импульсного радиолиза: [3].
Из Википедии, бесплатной энциклопедии. Электронная версия. Оптические спектры протонированных форм «, Неорган.
Диаграмма валентности (таблица валентностей химических элементов)
Механизм реакции между перманганатом и двойными связями углерод-углерод», J. Часть I. Оксианионы марганца «, J. Acta24 5: —63, doi: Категории: Оксианионы переходных металлов Манганаты. Пространства имен Обсуждение статей.
Велосипед 2d cad model
Просмотры Читать Редактировать Просмотр истории. Помощь Научитесь редактировать Портал сообщества Последние изменения Загрузить файл.Скачать в формате PDF Версия для печати. Wikimedia Commons. Перманганат калия — KMnO4.
Валентность серы спрашивает Курт Эйхманн. Спрашивает Лиланд Грант. Спрашивает Вероника Уилкинсон. Спрашивает Дайя Крейгер. Спрашивает Даника Эбботт. Спрашивает Консуэло Хаук. Спрашивает Рослин Уолтер. Все права защищены. Материалы на этом сайте не могут быть воспроизведены, распространены, переданы, кэшированы или использованы иным образом без предварительного письменного разрешения Multiply.
Спросите логин.Металл и сплавы. На вопрос пользователя Wiki. Главный ответ. Пользователь Wiki ответил на связанные вопросы. Как узнать валентность марганца? Какова валентность диоксида марганца? Каков химический символ и валентность перманганата? Какова валентность серы? Какова валентность CCl4? Какова валентность меди в Cu2O? Какова валентность фосфата? На этой странице представлены исчерпывающие данные о химическом элементе Марганец; включая множество свойств, названия элементов на многих языках, наиболее известные нуклиды марганца.
Для многих элементов также предусмотрены общие химические соединения. Кроме того, технические термины связаны с их определениями, а меню содержит ссылки на связанные статьи, которые очень помогают в учебе. Список справочных источников, используемых для компиляции данных, представленных в нашей периодической таблице элементов, можно найти на главной странице периодической таблицы Менделеева.
Curl auth any
Kenneth Barbalace. Периодическая таблица элементов — Марганец — Mn. Ссылка на эту страницу Если вы хотите разместить ссылку на эту страницу со своего веб-сайта, блога и т. Д.Мы отличный образовательный ресурс! Используйте онлайн или распечатайте страницы в качестве раздаточного материала в классе. Больше информации. Перейти к содержанию страницы Перейти к меню сайта на этой странице Периодическая таблица элементов Элемент Марганец — Mn На этой странице представлены исчерпывающие данные о химическом элементе Марганец; включая множество свойств, названия элементов на многих языках, наиболее известные нуклиды марганца.
Ежегодное мировое производство составляет около 6, тонн. Использование марганца: Используется в стали, батареях, осях, стрелочных переводах, сейфах, плугах и керамике.Связанные ресурсы Анатомия атома Ответы на многие вопросы, касающиеся структуры атомов.
Молярность, моляльность и нормальность Вводит стехиометрию и объясняет различия между молярностью, моляльностью и нормальностью. Расчеты молярной массы и калькулятор Javascript Расчеты молярной массы объяснены, а для помощи в расчетах есть калькулятор JavaScript. База данных по химическим веществам Эта база данных посвящена наиболее распространенным химическим соединениям, используемым в быту и промышленности.
Цитирование этой страницы Если вам нужно процитировать эту страницу, вы можете скопировать этот текст: Kenneth Barbalace.Великобритания. Соединенные Штаты.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
| Срок | Определение
| |
| Срок | Определение
| |
| Срок | Определение | |
| Срок | Определение | |
| Срок | Определение | |
| Срок | Определение | |
| Срок | Определение | |
| Срок | Определение | |
| Срок | Определение | |
Срок
| Определение | |
| Срок | Определение | |
| Срок | Определение
| |
| Срок | Определение | |
| Срок | Определение | |
Марганец в Периодической таблице | Сетевые объяснения
Марганец — Узнайте все подробности о марганце в Периодической таблице i.е. Атомная масса, число, физические, химические свойства, электронная конфигурация, валентность, химическая реакция, использование
Марганец
Марганец — 5-й элемент в ряду переходных металлов. Он находится в земной коре в виде минерала с комбинированной формой железа. 5-е место по количеству элементов в земной коре. В мире он распространен в виде оксидов и карбонатов. Марганец проявляет твердые, хрупкие, блестящие свойства. Марганцем богаты орехи, чай, петрушка, цельнозерновые продукты.Нашему организму требуется 12 миллиграмм марганца. Марганец важен для производства молока у кормящей матери, а также для хорошего пищеварения.
Дискавери
марганца обнаружено в 1774 году ученым Йоханом Готлибом Ганом
Происхождение названия:. Название происходит от двух слов, от латинского слова magnes . Значение этого слова — магнит и магнезия черная значение этого слова — черный марганец
Физические свойства:
1) Атомный символ: марганец обозначается символом Mn
2) Атомный номер: атомный номер марганца 25 В протоне марганца 25 присутствует 25 электронов
3) Атомный вес / масса: атомный вес марганца 54.9 примерно 55
В марганце 25 протонов и 30 нейтронов
4) Позиция: это место в периодической таблице в 4 периоде (строка) и 6 столбце (группа) Это 1 элемент в 6 группе 5) Блок: это место в блоке d Внешний электрон присутствует в d оболочка
6) Цвет: марганец показать серебристый цвет
7) Запах:. Марганец — металл без запаха
8) Состояние: присутствует в твердом состоянии
9) Точка кипения: точка кипения марганца 2061 0 C
10) Точка плавления: точка плавления марганца 1246 0 C
11) Изотопы: Марганец показывает только один стабильный изотоп 55 Mn: атомный вес этого изотопа равен 54.9. Аму
100% присутствует в природе
Но также присутствуют некоторые радиоактивные изотопы .Amu
Химические свойства:
1) Электронная конфигурация
Электронная конфигурация марганца 1S 2 2S 2 2P 6 3S 2 3P 6 3d 5 4S 2
Электронная конфигурация корпуса 2,8,13,2
2) Электронная структура: в марганце 2 электрона в K-оболочке, 8 электронов в L-оболочке.13 электронов в M-оболочке и 2 электрона в N-оболочке
4) Валентность:. Марганец показать валентность 2,3,4,5,6,7
В марганце максимум 7 электронов присутствует во внешней оболочке, следовательно, он имеет такую валентность
5) Атомный радиус: атомный Радиус марганца 161 пм 6) Реакционная способность: это реактивный элемент
Использует:
Полезен для организма в виде фермента
Используется в удобрении для почвы для увеличения содержания марганца в почве.
Также используется в качестве катализатора.Он действует как окислитель d. Из него делают резину.
Обесцвечивает стекло
Также используется как фунгицид
Используются батареи сухих элементов
Черно-коричневый пигмент марганца для использования в красках
Марганец добавлен в сталь для повышения прочности.
Используется в медицине для повышения иммунной системы и регулирования уровня сахара в крови. Также пригодится для размножения. k. В основном используется для изготовления железнодорожных путей, винтовок, стволов, тюремных бюстгальтеров
.
Вопрос и ответ:
Q1.Определить марганец
2 квартал. Кто открыл марганец?
2 квартал. Физические свойства марганца
4 квартал. Напишите атомный символ марганца.
Q5. Напишите атомный номер марганца.
Q6. На каком блоке присутствует марганцевый элемент?
Q7. Какого цвета марганец?
Q8.
