Содержание
Урок 6. валентность химических элементов. определение валентности элементов по формулам бинарных соединений.составление химических формул бинарных соединений по валентности — Химия — 8 класс
Конспект
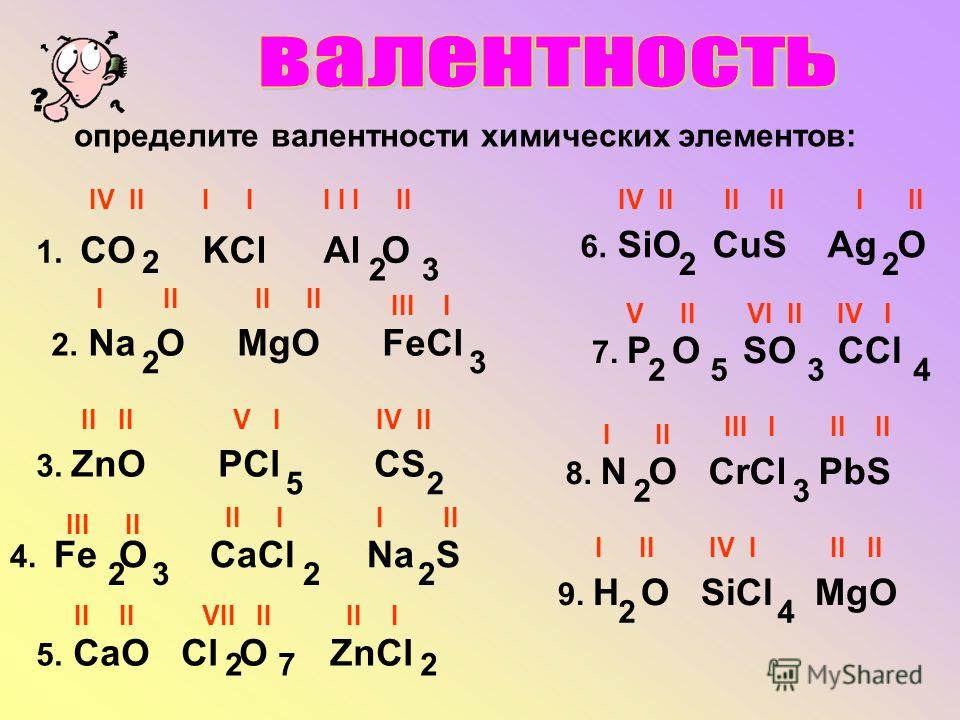
Валентность химических элементов Определение валентности химических элементов по химическим формулам их соединений. Составление химических формул веществ по известным валентностям химических элементов
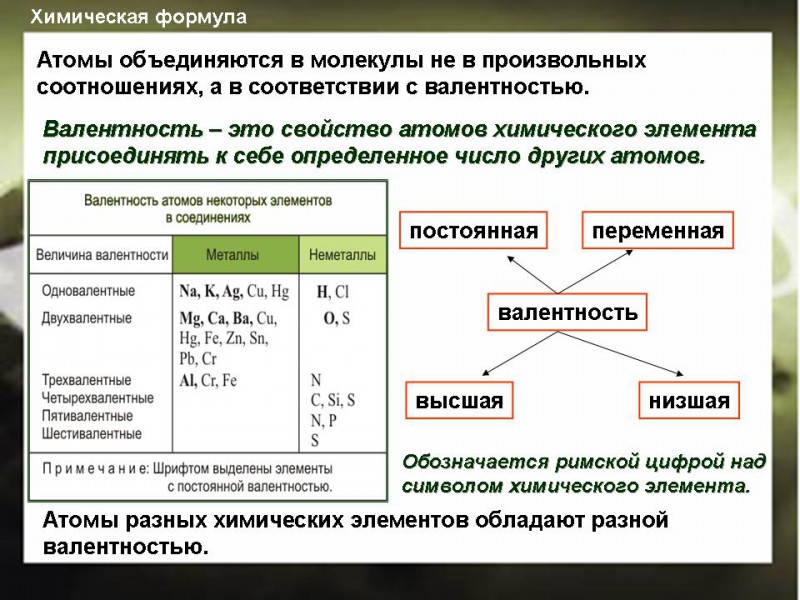
Состав вещества можно записать при помощи химической формулы. Как узнать, сколько атомов химических элементов входит в состав того или иного вещества? В молекуле хлороводорода на один атом водорода приходится один атом хлора – HCl, в молекуле воды на два атома водорода приходится один атом кислорода – h3O, а в молекуле аммиака на три атома водорода приходится один атом азота – Ch5. Такое различие в составе веществ объясняется свойством атомов химических элементов, которая называется валентность. Валентность – это свойство атома химического элемента присоединять или замещать определённое число атомов другого химического элемента. Валентность химических элементов обозначается римскими цифрами, которые, при необходимости, записываются над знаками химических элементов в веществе. У некоторых химических элементов валентность постоянная, у других – разная в различных соединениях.
Свойства веществ зависят от их состава. Вот два вещества, которые являются соединениями железа с кислородом: оксид железа FeO и оксид железа Fe2O3. Давайте определим валентности железа в этих веществах. Найдём элемент, валентность которого нам известна. В нашем случае это кислород, его валентность равна двум. Затем определим общее число валентностей – это произведение валентности химического элемента и его индекса: в первом случае – это 2, во втором – 6. Теперь определим валентность второго элемента. Для этого разделим общее число валентностей на число атомов второго химического элемента. В случае первого вещества мы должны два разделить на единицу, во втором случае, надо разделить шесть на два. У оксида железа FeO валентность железа будет равна II, у оксида железа Fe2O3 валентность железа будет равна III. Как мы видим, различие состава веществ связано с тем, что железо в этих веществах проявляет разную валентность.
У оксида железа FeO валентность железа будет равна II, у оксида железа Fe2O3 валентность железа будет равна III. Как мы видим, различие состава веществ связано с тем, что железо в этих веществах проявляет разную валентность.
Таким образом, для определения валентности химических элементов по химическим формулам их соединений необходимо:
1. Записать формулу, отметить валентность известного элемента.
2. Найти общее число единиц валентности (умножить индекс известного элемента на его валентность).
2. Найти общее число единиц валентности (умножить индекс известного элемента на его валентность).
А можно ли составить химическую формулу вещества, если известны валентности химических элементов? Да, можно.
Составим химическую формулу минерала корунд, зная, что это соединение алюминия и кислорода. Запишем символы химических элементов: Al O.
Над символом каждого из химических элементов поставим значение валентности.
Найдем общее число валентностей – это наименьшее общее кратное валентностей.
Определим индексы – это результат деления общего числа валентностей на валентность элемента.
Формула корунда – Al2O3.
Таким образом, для составления химических формул веществ по известным валентностям химических элементов необходимо:
1. Записать химические знаки элементов, входящих в соединение.
2. Проставить валентность.
3. Определить наименьшее общее кратное чисел, выражающих валентность обоих элементов.
4. Найти индексы элементов, разделив общее кратное на валентность каждого элемента.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Валентность химических элементов и структурные формулы
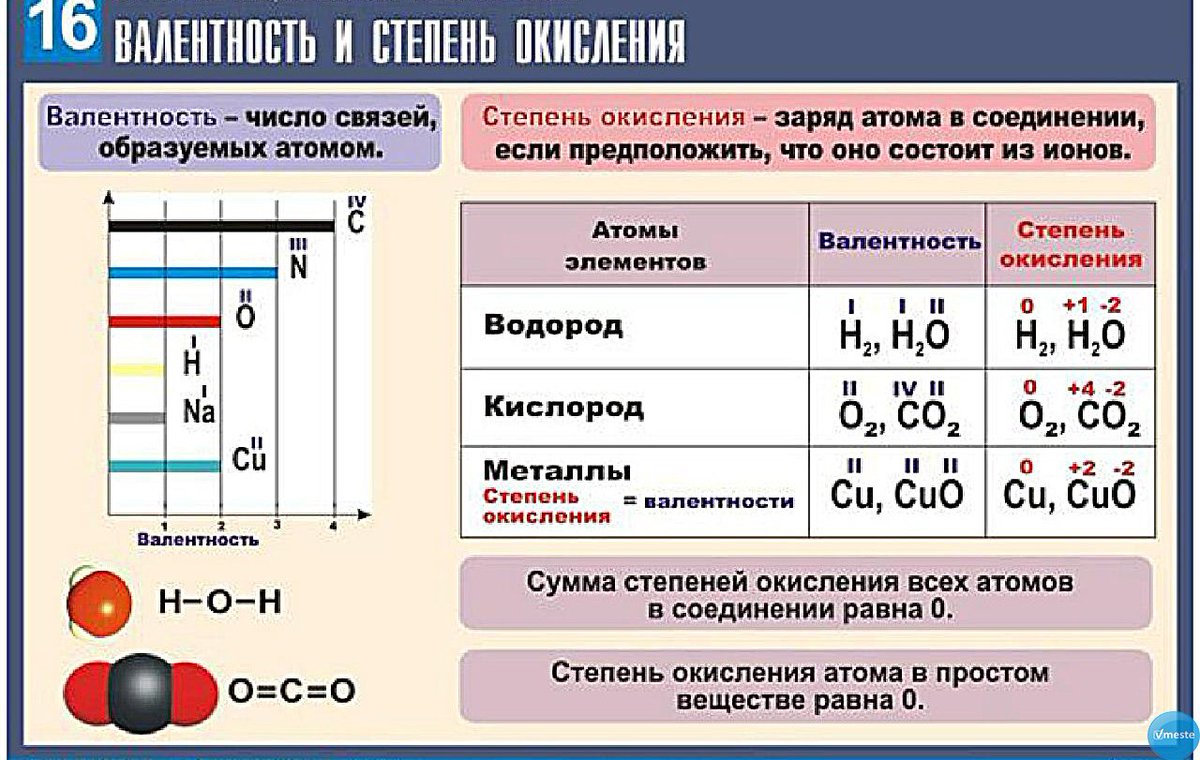
Изучая окислительно-восстановительные процессы, следует различать понятия валентность и степень окисления . Под валентностью элемента мы будем понимать способность его атомов образовывать химические связи без учета характера этих связей. Следовательно, количественно валентность равна числу связей без знака плюс или минус. Степень же окисления, как сказано выше, может иметь положительное, нулевое и отрицательное значение. Часто степень окисления элемента не совпадает с числом образуемых им связей, или, иными словами, не соответствует валентности данного элемента.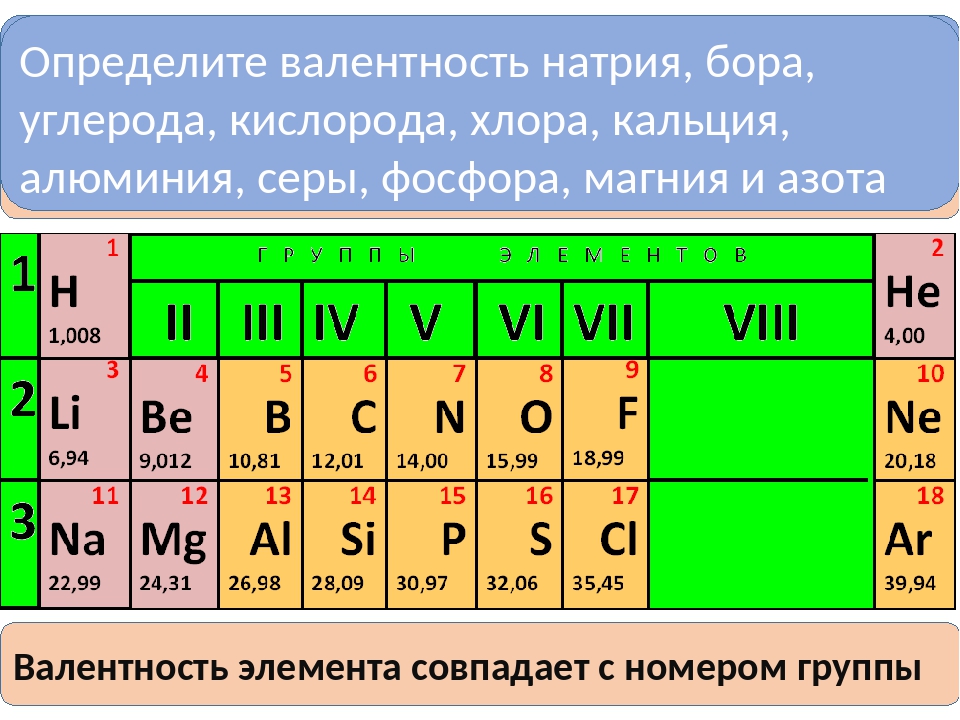 Например, в молекуле СЬ степень окисления атомов равна нулю, а с точки зрения спиновой теории валентности каждый атом хлора одновалентен. В метане СН4, метиловом спирте СН3ОН, формальдегиде СН2О, муравьиной кислоте НСООН и двуокиси углерода СО2 степени окисления углерода соответственно равны —4, —2, О, +2, 4-4, тогда как валентность его во всех этих веществах четыре. Для наглядности приведем их структурные формулы [c.46]
Например, в молекуле СЬ степень окисления атомов равна нулю, а с точки зрения спиновой теории валентности каждый атом хлора одновалентен. В метане СН4, метиловом спирте СН3ОН, формальдегиде СН2О, муравьиной кислоте НСООН и двуокиси углерода СО2 степени окисления углерода соответственно равны —4, —2, О, +2, 4-4, тогда как валентность его во всех этих веществах четыре. Для наглядности приведем их структурные формулы [c.46]
Химический эквивалент. Закон эквивалентов. Эквивалент элементов. Соотношение между эквивалентом, валентностью и атомным весом элемента. Структурная формула и нахождение по ней валентности и эквивалента отдельного элемента, входящего в данную молекулу. Эквивалент окисла, кислоты, основания и соли. Электрохимический эквивалент. Понятие об окислительно-восстановительном эквиваленте. Ионная и атомная связь. Расчетные и экспериментальные методы определения эквивалентов. [c.46]
Приведите структурные формулы 4-нитрофенола и гидросульфата аммония. Укажите характер химических связей в каждом из соединений, валентности и степени окисления элементов. [c.39]
Укажите характер химических связей в каждом из соединений, валентности и степени окисления элементов. [c.39]
Развитие начинается с вида атомов, у которых в электронной оболочке содержится минимум электронов и, естественно, такое же число протонов в ядре, т. е. Ер» = Ее = 0. Его местом на оси абсцисс является начало координат. На оси А при этом может быть несколько значений, так как она слагается из суммы А = Ер» + EN и при Ер» = О, А = ЕК. При ЕК = 1, А = 1 и т. д. Это ни что иное, как нейтрон — одна из структурных единиц ядра, лежащая в основе эволюции атомов. С него и начинается ряд химических элементов. Определение понятия химического элемента позволяет вполне законно считать нейтрон химическим элементом (видом атомов), предшествующим водороду, общей формулы оЭо. Далее логика построения системы проста. Если заполнение электронами квантового подслоя рассматривать как цикл, а цикл графически — круг, то фаза заполнения квантового подслоя идентифицируется с частью круга. Таким образом, полярный угол моделирует фазу заполнения электронного подслоя, наименьшей мерой которого является один электрон, он определяет еще и валентную группу. [c.157]
Структурные формулы служат для более наглядного изображения химического соединения. При таком изображении символы элементов соединены черточками, изображающими связующие электронные пары. Количество черточек у каждого элемента равно его валентности в данном соединении [c.28]
Химическая формула этана — СаНб. Обозначив валентность элементов валентными штрихами, изобразим молекулу этана в порядке соединения атомов, т. е. напишем ёе структурную формулу. В соответствии с теорией А. М. Бутлерова она будет иметь следующий вид [c.289]
Атомы элементов в структурных формулах обозначают их обычными химическими символами, а валентность атомов и связи между ними — черточками каждая такая черточка отвечает единице валентности атома. В соответствии с ранее установленным положением в теории строения принято, что углерод, как правило, четырехвалентен, причем все его валентные связи равноценны.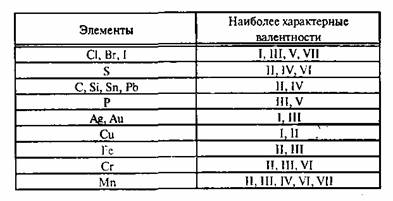 Это изображается следующим образом [c.20]
Это изображается следующим образом [c.20]
Понять физический смысл валентности и структурных формул помогает учение о строении атома и химической связи. Атомы элементов способны отдавать, присоединять электроны или образовывать общие электронные пары. Электроны, которые участвуют в образовании химических связей между атомами, называют валентными. Это наиболее слабо связанные в атоме электроны. [c.107]
Для изображения молекул органических соединений пользуются формулами строения, или структурными формулами, которые отражают порядок, последовательность соединения атомов в молекуле. В этих формулах символы (обозначения) элементов соединяют черточками. Каждая черточка означает химическую связь между атомами, а количество черточек соответствует их валентности. Атомы многовалентных элементов затрачивают на образование связей одну или несколько единиц валентности. Например, в органических веществах углерод, как правило, четырехвалентен. При соединении двух атомов углерода могут быть использованы одна, две и три валентности каждого из них. В зависимости от этого различают простую (или ординарную), двойную и тройную связи двойную и тройную связи называют часто кратными [c.15]
В зависимости от этого различают простую (или ординарную), двойную и тройную связи двойную и тройную связи называют часто кратными [c.15]
Структура молекулы изображается структурной формулой. Так, например, структура молекулы воды изображается формулой Н —О—Н. Каждый атом кислорода связан с двумя атомами водорода, сами же атомы водорода друг с другом непосредственно не связаны. Структурная формула едкого натра Na — U — Н показывает, чти атом натрия в этой молекуле связан с атомом кислорода, а этот последний с атомом водорода непосредственной же связи между атомами натрия и водорода нет. Таким образом, структурные формулы отображают, в какой последовательности связаны между собой атомы в молекуле, но не расположение атомов в пространстве. Судя по структурной формуле воды, нельзя сказать, лежат ли все три атома в одной плоскости и на одной прямой или нет, находятся ли атомы водорода на одинаковом расстоянии от атома кислорода или один расположен поближе, а другой — подальше от кислорода и т. п. Для того чтобы найти структурную формулу соединения, недостаточно знать молекулярную формулу и валентности элементов, входящих в его состав необходимо, кроме того, тщательно и всесторонне изучить химические свойства вещества и пути его образования. [c.11]
п. Для того чтобы найти структурную формулу соединения, недостаточно знать молекулярную формулу и валентности элементов, входящих в его состав необходимо, кроме того, тщательно и всесторонне изучить химические свойства вещества и пути его образования. [c.11]
Структурные формулы можно рассматривать как обобщение валовых формул. Символика структурной химии кроме знаков химических элементов и цифр включает также так называемые валентные штрихи, выражающие химическую связь между атомами. При этом вводятся различные символы для различных типов связей один штрих (—) одинарная связь, два штриха ( = ) — двойная связь, три штриха (=) — тройная связь. [c.43]
Последовательность связи атомов в молекуле стали выражать особыми структурными формулами. Для обозначения химических связей в структурных формулах служат черточки, число которых равно валентности элемента, например [c.54]
В структурных формулах единицу валентности принято изображать черточкой. Черточка приставляется к химическому знаку элемента, например [c.24]
Черточка приставляется к химическому знаку элемента, например [c.24]
Пользуясь этими обозначениями, можно представить соединение формулой, условно изображающей связь атомов в молекуле. Такие формулы называются формулами строения, или структурными формулами. Чтобы написать структурную формулу бинарного соединения (т. е. состоя- щего из двух элементов), нужно определить валентность элементов, входящих в состав соединения, записать химические знаки атомов, обладающих наибольшей валентностью, с соответствующим количеством черточек и присоединить к ним черточками же знаки атомов с меньшей валентностью. В этом виде одна черточка будет соответствовать единице валентности каждого из двух связанных атомов. [c.58]
Состав молекул часто изображается так называемыми структурными формулами. В этих формулах связи между атомами изображаются черточками. От химического знака каждого элемента отводят столько черточек, сколько единиц валентности имеет данный элемент, например, от Na — одну черточку, [c.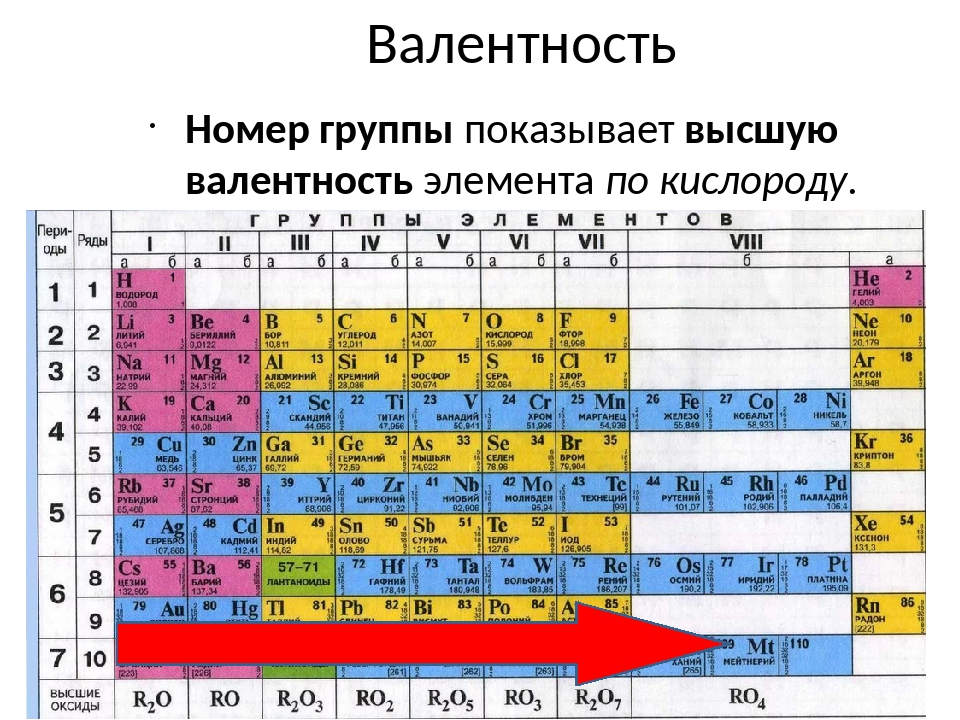 37]
37]
Таким образом, вопрос о взаимоотношении между квантовой химией и химиками-экспериментаторами естественным образом перешел в методологическую плоскость и превратился в вопрос о реальности представлений квантовой химии или, но сути, в вопрос о природе ее теоретических моделей — являются ли они структурными (изоморфными оригиналу — изучаемому объекту микромира) или они функциональные, или смешанные и если последнее правильно, то в чем заключается их структурность. В чем заключается реальность квантовой химии — этот вопрос задавал и Коулсон [122, с. 172]. Ответ на этот вопрос можно, но-видимому, сформулировать так квантовая химия представляет собою совокупность моделей (см. обзор [124]) с определенной иерархией, от фундаментальных (уравнения Шредингера и правила заполнения орбиталей на основании принципа Паули) до моделей частного характера, к которым принадлежит, например, модель Хюккеля. Большинство моделей квантовой химии органических соединений смешанные, поскольку сочетание чисто квантовомеханических моделей с моделями химического строения и стереохимии придает им элемент структурности (изоморфности), хотя чисто формальное сочетание квантовохимических представлений со структурными формулами, как в модели суперпозиции валентных схем в теории резонанса, не выводит модель из разряда функциональных [125]. [c.98]
Формулы строения, или структурные формулы, показывают последовательность соединения в молекуле атомов элементов между собой в соответствии с их валентностью и химической природой (химическими свойствами). В структурных формулах связь между атомами условно изображают черточками. Число черточек соответствует валентности элемента. Так, простейшие органические соеди- [c.9]
Выводы ТВС хорошо согласуются с экспериментально выясненными свойствами молекул, структура которых позволяет электронную плотность связывающих электронных пар считать локализованной между парами атомов. К таким молекулам относятся все двухатомные молекулы с четным числом электронов (На, Сг, N2, Fa, ВеО, MgO и пр.) и множество других молекул (НаО, Nh4, молекулы предельных и непредельных углеводородов и др.). Для этих молекул описание с точки зрения ТВС, во всяком случае в химии, предпочтительнее. Оно позволяет пользоваться удобным в химии понятием о валентности элементов и прочно вошедшими в химический обиход бутлеровскими структурными формулами. [c.195]
[c.195]
Для систематизации химии органических соединений фосфора представляется целесообразным прибегнуть к помощи тех аналогий и различий, которые можно установить между этой ветвью химии и химией углеводородов. Так как углерод является элементом 2-го ряда периодической системы химических элементов, химические связи его могут возникать лишь за счет использования 5- и р-орбиталей. Вследствие этого атом углерода может образовать только четыре р-связи, соответствующие 5р -гибриду. Для того чтобы образовались л-связи, должно уменьшиться координационное число (по сравнению с координационным числом атома углерода, связанного с-связями), что означает переход в состояние зр — или зр-гиб-ридизации. Для изображения упомянутых состояний пишут обычные структурные формулы с ординарными, двойными и тройными связями у атома углерода. Другая характерная особенность соединений углерода обусловлена тем, что атом углерода обладает четырьмя электронами в валентной оболочке. Следовательно, о-связи образуются парами электронов, отданных по одному каждым атомом, соединенны. м связью. [c.55]
м связью. [c.55]
Для изображения молекул органических соединений пользуются формулами строения, или структурными формулами, которые отражают порядок, последовательность соединения атомов в молекуле. Для написания структурной формулы любого органического соединения используют четыре основных свойства углерода. 1) четырехвалентность, 2) способность его атомов соединяться в цепи, 3) способность образовывать двойные и тройные связи и 4) способность образовывать циклы. В этих формулах символы (обозначения) элементов соединяют черточками. Каждая черточка означает химическую связь между атомами, а количество черточек соответствует их валентности. Атомы многовалентных элементов затрачивают на образование связей одну или несколько единиц валентности. При соединении двух атомов углерода могут быть использованы одна, две и три валентности каждого из них. В зависимости от этого- различают простую (или ординарную), двойную и тройную связи двойную и тройную связи называют часто кратными [c. 14]
14]
При установлении любой структурной формулы необходимо исходить из хорошо известного свойства элементов образовывать химическую связь с вполне определенным числом атомов других элементов. Это свойство обычно выражают тем, что приписывают данному элементу одну или несколько определенных валентностей. Так, например, водород, как известно, одновалентен, кислород в большинстве случаев двухвалентен (в оксониевых солях он может иметь, как мы увидим на стр. 151 другую валентность), азот — трех- и пятивалентен (или же координационно четырехвалентен) и т. п. В органической химии особо важную роль играет валентность углерода, который почти всегда бывает четырехвалентным, как видно, например, из существования простейших углеродных соединений СНь СС ь СОо, СЗг и т. п. Не четы-рехвалеитным углерод является лишь в очень немногих соединениях, обладаюиа,их специфическим строением, чрезвычайно ненасыщенным характером и часто неустойчивостью. С ними мы встретимся позднее в других главах этой книги. Исключением является окись углерода СО, известная уже из неорганической химии. [c.14]
Исключением является окись углерода СО, известная уже из неорганической химии. [c.14]
Теории валентности и стереохимия развивались в прошлом столетии в очень тесной связи, так что достижения одной обычно были результатом успехов другой. В 1852 г. Фрэнкленд предложил концепцию валентности и показал, что элементы при образовании соединений реагируют с определенными количествами других элементов, и эти количества теперь называют эктшвалентными. Кекуле в 1858 г. и Кольбе в 1859 г. расширили представление о валентности и постулировали, что атом углерода четырехвалентен. В 1858 г. Кекуле предположил, что атомы углерода соединяются друг с другом в неограниченном числе, образуя цепи в том же году Купер ввел концепцию валентной связи и нарисовал первые структурные формулы. Термин химическое строе-ние ввел в 1861 г. Бутлеров, который отметил важность написания простейших формул соединений, показывающих, как соединены атомы в молекулах. Он также установил, что свойства соединений определяются их молекулярным строением, п если известно строение, то можно предсказать свойства. Однако только в 1874 г. был сделан первый основной шаг к наглядному представлению молекулярного строения в трех измерениях. В этом же году Вант-Гофф и ле Бель независимо друг от друга постулировали тетраэдрическое расположение четырех связей атома углерода и таким образом дали возможность классической органической стереохимии по крайней мере. на двадцать лет опередить неорганическую стереохимию. [c.191]
Однако только в 1874 г. был сделан первый основной шаг к наглядному представлению молекулярного строения в трех измерениях. В этом же году Вант-Гофф и ле Бель независимо друг от друга постулировали тетраэдрическое расположение четырех связей атома углерода и таким образом дали возможность классической органической стереохимии по крайней мере. на двадцать лет опередить неорганическую стереохимию. [c.191]
Для сопоставления химического подобия однотипных неорганических простых веществ и соединений используют периодическую таблицу элементов Менделеева. Однотипными обычно считают соединения с аналогичной структурной формулой, различающиеся лишь одним элементом, который принадлежит общей подгруппе или ряду элементов периодической системы и имеет характерное одинаковое валентное состояние. Что касается однотипных химических реакций, то к Ним относят две (или более) реакции, в которых каждому компоненту одной реакции соответствует однотипный (химически подобный) компонент другой реакции. Важными общими признаками отнотипности реакций также являются одинаковое агрегатное состояние и одни и те же стехиометрические коэффициенты. [c.25]
Важными общими признаками отнотипности реакций также являются одинаковое агрегатное состояние и одни и те же стехиометрические коэффициенты. [c.25]
Некоторые элементы имеют нес10льк0 эквивалентов, поэтому они обладают переменной валентностью. Каждой единице валентности отвечает наличие одной химической связи между атомами, которую в структурных формулах изображают черточкой. При образовании молекулы атомы всегда соединяются к таких количествах, что общее число валентностей одного элемента равно числу валентностей другого, что нытекает из закона эквивалентов. Чтобы составить формулу по валентности, надо прежде всего найти наименьшее кратное валентностей соединяющихся, элементов в данном соединении. Частное от деления наименьшего хратного на валент- [c.32]
Во второй половине XIX в. был сформулирован принцип четырех-валентности углерода, ставший фундаментом органической химии. В таком виде понятие валентности вошло в теорию строения А. М. Бутлерова (1861), согласно которой каждую химическую связь считали направленной и строго локализованной между двумя атомами. Молекулы при этом изображали в виде структурных формул, в которых штрих отождествлял единицу валентности. Периодический закон Д. И. Менделеева расширил понятие валентности, связав его о поло-женпем элементов в группах. Однако с рождением химии комплексных соединений представления о строго определенной валентности атомов оказались недостаточными. [c.263]
М. Бутлерова (1861), согласно которой каждую химическую связь считали направленной и строго локализованной между двумя атомами. Молекулы при этом изображали в виде структурных формул, в которых штрих отождествлял единицу валентности. Периодический закон Д. И. Менделеева расширил понятие валентности, связав его о поло-женпем элементов в группах. Однако с рождением химии комплексных соединений представления о строго определенной валентности атомов оказались недостаточными. [c.263]
Более детальная классификация главных взаимодействий основана на понятии валентностп атома. Каждому эффективному атому химического элемента сопоставляется символ соответствующего химического элемента и приписывается определенное целое число (валентность), характеризующее способность атома к образованию химических связей. Предполагается, что на образование химической связи каждый партнер использует одинаковое число единиц валентностп. Эта величина называется кратностью связи. Инфор.мацпя об элементном составе молекулы, главных взаимодействиях эффективных атомов, кратностях этих взаимодействий моя ет быть представлена в виде структурной формулы — мульти-графа, в котором вершины соответствуют эффективным атомам, а ребра — связям, причем связям кратпостн п соответствует п ребер.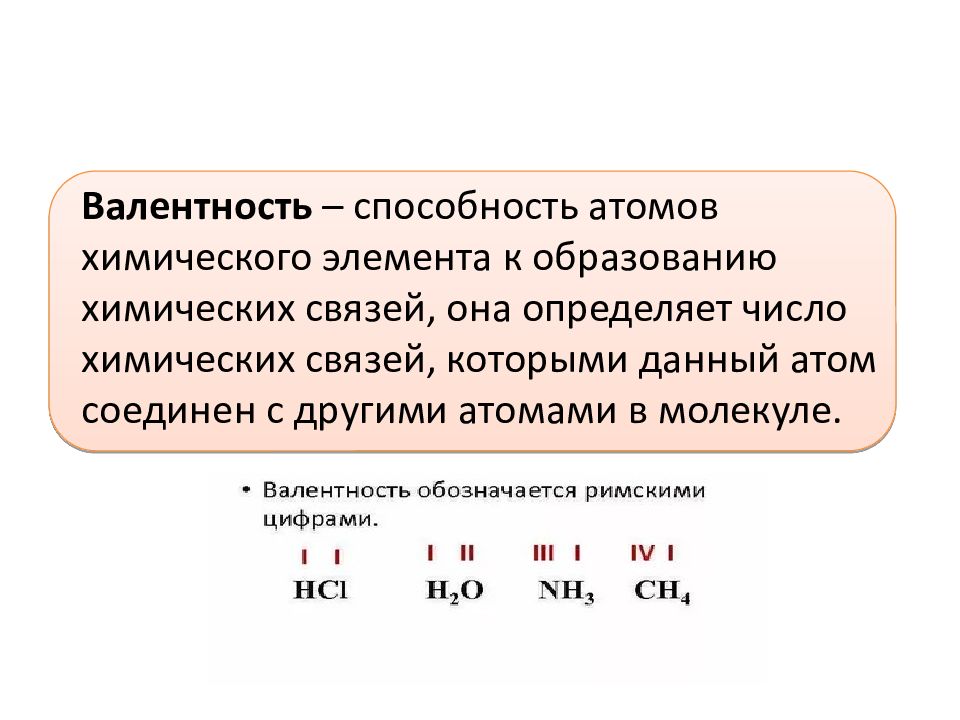 [c.13]
[c.13]
В химии давно используется метод моделирования. Сама химическая символика, первые формулы соединений (Берцелиуса) практически представляли собой знаковые модели, отражающие состав соединения, стехиометрические отношения между элементами. Появление теории химического строения обусловило возможность создания модели молекулы в виде структурной формулы, выражающей уже и порядок связей атомов. Эти знаковые модели химического строения молекулы позволяют наглядно представлять ее структуру, объяснять некоторые явления (например, изомерии) с точки зрения бутлеровской теории, опирающейся на принцип валентности, насыщаемости н взаимного влияния атомов. Модели химического строения давали возможность предсказывать, строить другие модели в виде структурных формул предполагаемых изомеров (предсказание Бутлеровым триметилкар- [c.313]
Валентность химических элементов | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Тема:
Химическая связь
Для того чтобы научиться составлять химические формулы необходимо выяснить закономерности, согласно которым атомы химических элементов соединяются между собой в определенных соотношениях. Для этого сравним качественный и количественный состав соединений, формулы которых HCl, H2O, NH3, CH4 (рис. 12.1)
Для этого сравним качественный и количественный состав соединений, формулы которых HCl, H2O, NH3, CH4 (рис. 12.1)
По качественному составу эти вещества схожи:в состав каждой из молекул входят атомы водорода. Тем не менее их количественный состав неодинаков. Атомы хлора, кислорода, азота, углерода соединены соответственно с одним, двумя, тремя и четырьмя атомами водорода
Эту закономерность подметил еще в начале XI в. Дж. Дальтон. Со временем И. Я. Берцелиус обнаружил, что наибольшее количество атомов, соединенных с атомом химического элемента, не превышает определенной величины. В 1858 г. Э. Франкленд назвал «соединительной силой» способность атомов связывать или замещать определенное число других атомов Термин «валентность» (от лат. valentia — «сила») предложил в 1868 г. немецкий химик К. Г. Вихельхауз.
Рис. 12. 1. 1. Хлороводород HCl. 2. Вода H2O. 3. Аммиак NH3. 4. Метан CH4 1. 1. Хлороводород HCl. 2. Вода H2O. 3. Аммиак NH3. 4. Метан CH4 |
Валентность — общее свойство атомов. Она характеризует способность атомов химически (валентными силами) взаимодействовать друг с другом.
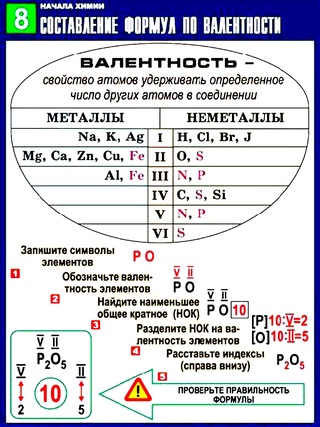
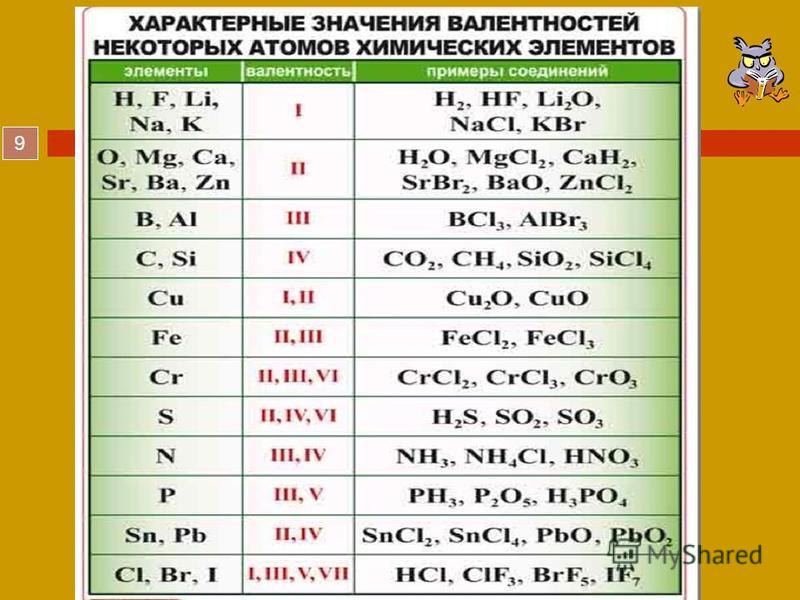
Валентность многих химических элементов определили на основе экспериментальных данных о количественном и качественном составе веществ. За единицу валентности была принята валентность атома водорода. Если атом химического элемента соединен с двумя одновалентными атомами, то его валентность равна двум. Если он соединен с тремя одновалентными атомами, то он — трехвалентен и т. д.
Наивысшее значение валентности химических элементов — VIII.
Валентность обозначают римскими цифрами. Обозначим валентность в формулах рассмотренных соединений:
|
I I
HCl
|
I II
H2O
|
III I
NH3
|
IV I
CH4
|
Также ученые обнаружили, что немало элементов в разных соединениях проявляют разные значения валентности. То есть существуют химические элементы с постоянной и переменной валентностью.
То есть существуют химические элементы с постоянной и переменной валентностью.
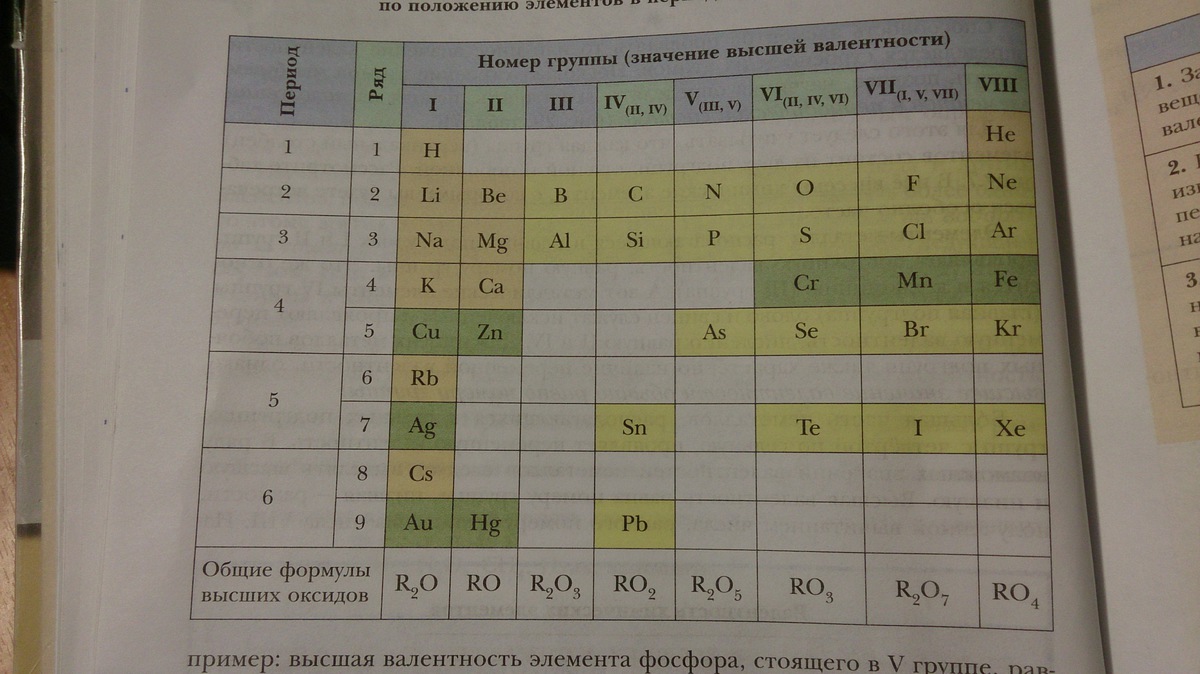
Можно ли определить валентность по положению химического элемента в периодической системе? Максимальное значение валентности элемента совпадает с номером группы периодической системы, в которой он размещен. Тем не менее бывают и исключения — азот, кислород, фтор, медь и некоторые другие элементы. Запомни: номер группы обозначен римской цифрой над соответствующим вертикальным столбиком периодической системы.
|
Элемент
|
Валентность
|
Элемент
|
Валентность
|
|
Водород (Н)
|
I
|
Кальций (Са)
|
II
|
|
Натрий (Na)
|
I
|
Барий (Ва)
|
II
|
|
Калий (К)
|
I
|
Цинк (Zn)
|
II
|
|
Фтор (F)
|
I
|
Кислород(O)
|
II
|
|
Бериллий(Be)
|
II
|
Алюминий (Al)
|
III
|
|
Магний (Mg)
|
II
|
Бор (В)
|
III
|
|
Элемент
|
Валентность
|
Элемент
|
Валентность
|
|
Хлор (Cl)
|
I, III, V, VII
|
Железо (Fe)
|
II, III, VI
|
|
Бром (Br)
|
I, III, V, VII
|
Сера (S)
|
II, IV, VI
|
|
Йод (I)
|
I, III, V, VII
|
Марганец (Mg)
|
II, IV, VII
|
|
Ртуть (Hg)
|
I, II
|
Хром (Cr)
|
II, III, VI Материал с сайта http://worldofschool.
|
|
Медь (Cu)
|
I,II
|
Азот (N)
|
II, I, III, IV
|
|
Серебро (Ag)
|
I, II
|
Фосфор (P)
|
III, V
|
|
Золото (Au)
|
III, I
|
Мышьяк (As)
|
III, V
|
|
Олово (Sn)
|
II, IV
|
Углерод (C)
|
IV, II
|
|
Свинец (Pb)
|
II, IV
|
Кремний (Si)
|
IV, II
|
На этой странице материал по темам:
Шпаргалка валентности химических элементов
Химия как определить валентность химических элементов
Валентность шпаргалка
Электроотрицательность.
 Степень окисления и валентность химических элементов.
Степень окисления и валентность химических элементов.
Что такое электроотрицательность. Степень окисления и валентность
Что такое электроотрицательность. Степень окисления и валентность химических элементов?
Электроотрицательность
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
зависимость электроотрицательности от порядкового номера элемента
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
Электроотрицательность при движении по подгруппе вниз — уменьшается, при движении вправо по периоду возрастает
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
Элементы, проявляющие постоянную СО | Значение постоянной СО этого элемента |
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления.
 К таким элементам относятся:
К таким элементам относятся:
Элемент | Степень окисления практически во всех соединениях | Исключения |
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы.
Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
Химический элемент | Номер группы | Высшая степень окисления |
| Кислород | VI | +2 (в OF 2 ) |
| Фтор | VII | 0 |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2 FeO 4 ) |
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
h3SO4
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF2). Расставим известные степени окисления:
электроотрицательность
Обозначим степень окисления серы как x:
как определять степени окисления
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
расчет степеней окисления в h3SO4
Т.е. мы получили следующее уравнение:
уравнение для установления степени окисления серы
Решим его:
степень окисления
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
(Nh5)2Cr2O7
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
степени окисления
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы Nh5+ (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона Nh5+ , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами Nh5+ и анионами Cr2O72-.
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
степени окисления элементов в катионе аммония и дихромат-ионе
Т.е. мы получаем два независимых уравнения:
установление степеней окисления элементов в дихромате аммония
Решая которые, находим x и y:
нахождение степеней окисления азота и хрома в дихромате аммония
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать здесь.
Валентность
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
- неспаренных электронов орбиталь с неспаренным электроном
- неподеленных электронных пар на орбиталях валентных уровней орбиталь с неподеленной парой электронов
- пустых электронных орбиталей валентного уровня вакантная орбиталь
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
электронно-графическая формула атома водорода
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
строение внешнего уровня атома углерода
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
строение внешнего уровня атома углерода в возбужденном состоянии
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
образование молекулы угарного газа
Резюмируя информацию по валентным возможностям атома углерода:
- Для углерода возможны валентности II, III, IV
- Наиболее распространенная валентность углерода в соединениях IV
- В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
внешний энергетический уровень атома азота
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (Nh4), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Действительно, валентность, равная трём, наблюдается в молекулах аммиака (Nh4), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной ( ) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
образование катиона аммония
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
строение молекул азотной кислоты и N2O5
Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
Резюмируя информацию по валентным возможностям атома азота:
- Для азота возможны валентности I, II, III и IV
- Валентности V у азота не бывает!
- В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
- В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония Nh5+, азотная кислота и д.р).
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
валентные возможности фосфора
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s-орбитали:
***электроотрицательность
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
***внешний электронный уровень атома кислорода
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
внешний электронный уровень невозбужденного атома серы
Два неспаренных электрона
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода h3S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
***валентность серы 4
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
***валентность серы VI
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, h3SO4, SO2Cl2 и т.д.
Валентность химических элементов в химии
Понятие «валентность»
Согласно обменному механизму метода валентных связей, валентность химических элементов определяется числом содержащихся в атоме неспаренных электронов. Для s- и p-элементов – это электроны внешнего уровня, для d-элементов – внешнего и предвнешнего уровней.
Спаренные (расположенные по два на атомных орбиталях) электроны при возбуждении могут разъединяться при наличии свободных ячеек того же уровня (разъединение электронов в какой-либо уровень невозможно). Например, валентность элементов главной подгруппы I группы равна единице, так ка на внешнем уровне атомы этих элементов имеют один электрон:
3Li 1s22s1
11Na 1s22s22p63s1
Валентность элементов главной подгруппы II группы
Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем энергетическом уровне нет неспаренных электронов:
4Be1s22s2
12Mg 1s22s22p63s2
При возбуждении этих атомов спаренные s-электроны разъединяются в свободные ячейки p-подуровня этого же уровня и валентность становится равной двум (II):
Be*
Mg*
Валентность кислорода и фтор в химических соединениях
Кислород и фтор во всех соединениях проявляют постоянную валентность, равную двум (II) для кислорода и единице (I) для фтора. Валентные электроны этих элементов находятся на втором энергетическом уровне, где нет более свободных ячеек:
8O 1s22s22p4
9F 1s22s22p5
В то же время сера – аналог кислорода – проявляет переменную валентность II, IV, VI; хлор – аналог фтора – проявляет валентность I, III, V, VII. Это объясняется наличием свободных d-ячеек на третьем энергетическом уровне.
Для большинства d-элементов валентность в невозбужденном состоянии равна нулю, так как на внешнем уровне нет неспаренных электронов и, чтобы определить валентность в этом случае, нужно знать, возможно ли для элемента возбужденное состояние.
Кроме этого значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
Примеры решения задач
Валентность химических элементов
Содержание:
Валентность химических элементов
- Валентность химических элементов Понятие валентности. Химические формулы могут быть получены из данных о составе веществ. Однако в большинстве случаев при создании химической формулы учитываются закономерности.
- Элементы следуют и соединяются друг с другом other. Чтобы вывести понятие «валентность», рассмотрим химическую формулу некоторых соединений, в том числе водорода и кислорода. Вси Н20 СН4 h4N Хлористого водорода, воды, аммиака метана C1207 P2O6 CO2 Диоксид хлора (VII) ’ фосфорная кислота (V) окись углерода (IV))
To чтобы понять суть этих законов, необходимо познакомиться со свойствами атомов, которые называются свойствами валентности.
Людмила Фирмаль
Как видно из приведенных примеров, атомы элементов хлора, кислорода, азота, углерода обладают свойством объединения не только одного из атомов водорода и кислорода, но и определенного числа. Другие элементы различных соединений обладают теми же свойствами.
Валентность-это свойство, с помощью которого атомы одного элемента объединяют определенное количество атомов другого. Атом водорода не может связывать более одного атома другого элемента, поэтому валентность водорода считается единичной.
- Валентность других элементов может быть выражена числом, указывающим на число атомов водорода, которые атомы конкретного элемента могут связать между собой. Например, в молекуле хлористого водорода хлор является одновалентным, поскольку атом хлора присоединен к 1 атому водорода. В связи с тем, что 1 атом объединяет 2 атома водорода, валентность кислорода равна 2(II).
Азот молекулы аммиака является трехвалентным (III), а углерод-четырехвалентным (IV). Валентность элементов также определяется кислородом. Например, Hg и CU CU с ртутью образуют оксиды HgO и CuO. Ртуть и медь также двухвалентны, потому что кислород двухвалентен, и эти оксиды имеют 1 атом кислорода на атом элемента. Вопрос 1-4 (стр. 29).
Кислород обычно двухвалентный.
Людмила Фирмаль
Смотрите также:
Решение задач по химии
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
Валентность | химия | Britannica
Валентность , также обозначаемая как валентность , в химии — свойство элемента, определяющее количество других атомов, с которыми атом элемента может соединяться. Этот термин, введенный в 1868 году, используется для обозначения как силы комбинации элемента в целом, так и числового значения силы комбинации.
Подробнее по этой теме
химическая связь: валентность
Химики 19 века установили большой объем эмпирической информации, ведущей к осознанию того, что закономерности существуют в…
Далее следует краткое рассмотрение валентности. Для полной обработки, см. химическая связь: теория валентной связи.
Объяснение и систематизация валентности было серьезной проблемой для химиков 19 века. В отсутствие какой-либо удовлетворительной теории его причины большая часть усилий была сосредоточена на разработке эмпирических правил для определения валентностей элементов. Характерные валентности элементов были измерены в терминах числа атомов водорода, с которыми атом элемента может соединяться или которые он может заменять в соединении.Однако стало очевидно, что валентности многих элементов в разных соединениях различаются. Первый большой шаг в разработке удовлетворительного объяснения валентности и химической комбинации был сделан американским химиком Г.Н. Льюис (1916) с идентификацией химической связи органических соединений с парой электронов, удерживаемых совместно двумя атомами и служащей для удержания их вместе. В том же году природу химической связи между электрически заряженными атомами (ионами) обсуждал немецкий физик В.Коссель. После развития подробной электронной теории периодической системы элементов теория валентности была переформулирована в терминах электронных структур и межатомных сил. Эта ситуация привела к введению нескольких новых понятий — ионной валентности, ковалентности, степени окисления, координационного числа, металлической валентности — соответствующих различным режимам взаимодействия атомов.
Валентность | Encyclopedia.com
В химии валентность относится к числу, присвоенному элементам, которое отражает их способность или способность реагировать (объединяться) с другими элементами.Это также относится к типу реакций, которым будет подвергаться элемент. Таким образом, значение валентности связано с количеством электронов, если таковые имеются, которые элемент теряет или принимает от другого атома во время химической реакции. Термин «валентность», также называемый валентностью или числом валентности, происходит от латинского слова «сила» и может отражать силу или сродство элемента к определенным типам реакций. Эта концепция была сформулирована в девятнадцатом веке как способ систематизировать формулы различных химических соединений.
Часто греческие префиксы используются для описания валентности атома или материала. Например, uni / mono означает 1, в то время как bi / di означает 2, tri — 3, а tetra — 4. Например, униметалл будет иметь валентность 1.
Электроны в атоме расположены в разных точках. уровни энергии. Электроны на самом высоком энергетическом уровне называются валентными электронами. В соответствии с правилом октетов — и чтобы стать более энергетически стабильными — атомы приобретают, теряют или делятся валентными электронами, пытаясь получить конфигурацию благородного газа в своей внешней оболочке.Конфигурация электронов на внешней оболочке атома определяет его способность и сродство вступать в химические реакции.
Число валентности элемента можно определить с помощью нескольких простых правил, касающихся расположения элемента в периодической таблице. В ионных соединениях (образованных между заряженными атомами или группами атомов, называемыми ионами) валентность атома — это количество электронов, которые атом получит или потеряет, чтобы получить полную внешнюю оболочку. В первой группе периодической таблицы элементам присвоено число валентности 1.Число валентности 1 означает, что элемент обычно реагирует, теряя один электрон, чтобы получить полную внешнюю оболочку. Элементам второй группы присваивается число валентности 2. Число валентности 2 означает, что элемент второй группы обычно реагирует, теряя два электрона, чтобы получить полную внешнюю оболочку. Элементам группы 17 присваивается отрицательное число валентности (-1). Валентное число -1 означает, что элемент второй группы обычно реагирует с получением одного электрона для получения электронной конфигурации благородного газа.Отражая неспособность реагировать с другими элементами, газам Nobel, уже поддерживающим стабильное расположение электронов, приписывается валентность ноль (O).
Термин валентность может также относиться к заряду или степени окисления атома. Например, в атомах магния (Mg + 2) валентность равна +2. Атом или ион с зарядом +2 называется двухвалентным.
В ковалентных соединениях валентность атома может быть менее очевидной. В данном случае это количество образованных связей, то есть, являются ли связи одинарными, двойными или тройными.Атом углерода с двумя одинарными связями и одной двойной связью имеет валентность четыре (4). В воде (H 2 O) валентность кислорода равна 2, а валентность водорода равна 1. В обоих случаях валентное число указывает количество связей, которые образует каждый атом.
Теория валентных связей похожа на теорию молекулярных орбиталей в том, что она касается образования ковалентных связей. Теория валентных связей описывает связи в терминах взаимодействий между внешними орбиталями и гибридизированными орбиталями для объяснения образования соединений.
Теория отталкивания электронных пар валентной оболочки (VSEPR) — одна из популярных моделей для объяснения ковалентных связей. Эта теория утверждает, что молекулы будут иметь такую форму, чтобы минимизировать отталкивание, которое происходит между валентными электронами. Поскольку все они заряжены отрицательно, электроны валентной оболочки отталкиваются друг от друга. Теория VSEPR утверждает, что атомы молекулы будут располагаться и принимать форму вокруг центрального атома, чтобы минимизировать отталкивание между валентными электронами.
См. Также модели Atomic; Атомный номер; Атомная теория; Химическая связь; Химия.
Валентных электронов — Периодическая таблица изменений химических свойств с группой и строкой
Валентные электроны — это электроны на самом высоком занятом основном энергетическом уровне атома.
Элементы сгруппированы по периодам и группам, причем период соответствует основному уровню энергии, а группа — степени заполнения подоболочек. Свойства атома напрямую связаны с количеством электронов на различных орбиталях. Валентные электроны , электроны во внешней или валентной оболочке, важны, поскольку они дают представление о химических свойствах элемента и являются электронами, полученными, потерянными или разделенными во время химической реакции. В общем, атомы наиболее стабильны и наименее реактивны, когда их внешняя электронная оболочка заполнена. Электроны внутренней оболочки не принимают непосредственного участия в реакционной способности элемента или в образовании соединений.
Помните, что элементы расположены в периодической таблице в соответствии с их атомными номерами.В нейтральном атоме количество электронов будет равно количеству протонов. Кроме того, положение элемента в периодической таблице — его столбец или группа и строка или период — предоставляет полезную информацию о том, как расположены эти электроны.
Рассматривая первые три строки таблицы, каждая строка соответствует заполнению другой электронной оболочки: гелий и водород помещают свои электроны в оболочку 1n, в то время как элементы второй строки, такие как Li, начинают заполнять оболочку 2n, а третья строка такие элементы, как Na, продолжают оболочку 3n.Точно так же номер столбца элемента дает информацию о его количестве валентных электронов и реакционной способности. В общем, количество валентных электронов в столбце одинаково и увеличивается слева направо в строке. Элементы группы 1 имеют только один валентный электрон, а элементы группы 18 — восемь (за исключением гелия, у которого всего два электрона). Таким образом, номер группы является хорошим предиктором того, насколько реактивным будет каждый элемент.
Периодическая таблица Менделеева может быть разбита на различные блоки в зависимости от того, какие орбитали занимают их валентные электроны.Они названы в честь орбиталей, поэтому есть s-блок, p-блок, d-блок и f-блок.
Практические вопросы
Ханская академия
Официальная подготовка MCAT (AAMC)
Пакет вопросов по химии Отрывок 19, вопрос 106
Ключевые точки
• Валентные электроны — это самый внешний электрон в электронной конфигурации.
• Валентные электроны определяют многие химические свойства, реакционную способность и связь
• Номера групп (столбцы) периодической таблицы указывают общее количество внешних электронов в валентной оболочке
• Точки (строки) периодической таблицы указывают количество оболочек, окружающих ядро.
Ключевые термины
Электроны внутренней оболочки: Те электроны, которые не находятся во внешней оболочке и не участвуют в реакционной способности элемента.
Валентные электроны: Электроны на самом высоком занятом основном энергетическом уровне атома.
атомов — Как получить валентности элементов?
Валентность — это понятие, которое описывает способность элемента связываться с другими элементами. В золотой книге ИЮПАК есть официальное определение:
.
валентность
Максимальное количество одновалентных атомов (первоначально атомов водорода или хлора), которые могут объединяться с атомом рассматриваемого элемента, или с фрагментом, или для которых атом этого элемента может быть замещен.
Итак, в принципе невозможно узнать валентность только из электронной конфигурации, но вы также должны знать химию, которую она выполняет. Также примечательно, что согласно этому определению все элементы имеют только одно значение своей валентности.
В первом периоде, согласно определению, водород одновалентен, т.е. $ \ ce {h3} $ или $ \ ce {HCl} $. С другой стороны, гелий технически двухвалентен, поскольку $ \ ce {HHeF} $ был теоретически предсказан, см. Википедию.Но можно с уверенностью предположить, что гелий инертен и, следовательно, нульвалентен.
Во втором периоде, где выполняется правило октетов, это количество неспаренных электронов в валентной оболочке, за исключением углерода. К сожалению, поведение этого периода больше всего отличается от остальной части таблицы Менделеева. Так что лучший способ здесь — просто изучить их как исключения: $ \ ce {NaCl} $ (mono-), $ \ ce {BeCl2} $ (di-), $ \ ce {BCl3} $ (tri-), $ \ ce {CCl4} $ (тетра-), $ \ ce {NCl3} $ (три-), (1) $ \ ce {Cl2O} $ или $ \ ce {h3O} $ (ди-), $ \ ce {FCl} $ или $ \ ce {F2} $, $ \ ce {Ne} $ нульвалентны.
Под второй строкой становится немного более предсказуемо. Для большинства элементов основной группы это количество электронов в валентной оболочке. Это, очевидно, совпадает с наивысшей стабильной степенью окисления.
Некоторые примеры могут проиллюстрировать это. Для первой группы известны все бинарные составы щелочного элемента $ \ ce {A} $ состава $ \ ce {ACl} $. Это также максимальное количество атомов хлора, которое может нести любой из этих элементов, поэтому все они одновалентны.
То же самое относится к щелочноземельным соединениям $ \ ce {Ea} $.{(VI)}} $.
Галогены $ \ ce {Hal} $ просто удивительны, и если вы изучите межгалогенные соединения, вы, скорее всего, вспомните многие из них. Для хлора сообщалось о межгалогенах $ \ ce {ClF _ {\ {1,3,5 \}}} $, что делает его пятивалентным. Для брома то же самое: $ \ ce {BrF _ {\ {1,3,5 \}}} $. Наблюдается только $ \ ce {BrCl} $. Однако это делает бром также пятивалентным. Для йода был обнаружен бесцветный газ $ \ ce {IF7} $, что делает его единственным семивалентным элементом ряда.Что касается астата, известно лишь несколько соединений, и в настоящее время считается, что он является одновалентным.
Что касается благородных газов, $ \ ce {Ng} $, известно несколько соединений, и их валентность увеличивается по всей группе. Хотя аргон можно считать не более чем двухвалентным из-за открытия крайне нестабильного $ \ ce {HArF} $, двухвалентная природа криптона, несомненно, доказана $ \ ce {KrF2} $. Ксенон является наиболее реактивным и сильнодействующим благородным газом, и его можно считать шестивалентным в соответствии с приведенным выше определением, поскольку $ \ ce {XeF6} $ действительно существует.Однако также известен $ \ ce {XeO4} $, что делает его октавалентным согласно другому определению. (2)
Переходные металлы — это совсем другая история, и трудно найти для них обобщенное правило или наблюдение, поскольку определение ИЮПАК очень строгое по данному вопросу. Необходимо детально рассмотреть все элементы. Это, безусловно, превзойдет цель этого ответа.
Чтобы проиллюстрировать проблему, взгляните на марганец. Известны различные соединения, такие как $ \ ce {MnCl2} $ (двухвалентный), $ \ ce {MnF3} $ (трехвалентный) и даже $ \ ce {MnF4} $ (четырехвалентный).О бинарных гидридах еще не сообщалось. Однако существуют оксиды различного состава, от двухвалентного до семивалентного.
Банкноты
- Пятивалентная молекула $ \ ce {NCl5} $ была предложена теоретически, см. Википедию и ссылки в ней.
Более современная интерпретация концепции валентности позволяет элементам иметь более одного значения. Следовательно, это всегда зависит от соединения, в котором он рассматривается.Очень краткое резюме можно найти в Википедии.
Наиболее характерным химическим свойством элемента является его валентность. Существует множество критериев валентности, каждая из которых имеет свою область полезности и применимости. Простые определения относятся к количеству атомов водорода, которые могут соединяться с элементом в бинарном гидриде, или к удвоенному количеству атомов кислорода, соединяющихся с элементом в его оксиде (ах).
(Н. Н. Гринвуд и Эрншоу: химия элементов.Второе издание. Баттерворт-Хайнеманн, 1997. Глава 2, с. 27.)
Как валентные электроны элемента соотносятся с его группой в Периодической таблице?
В 1869 году Дмитрий Менделеев опубликовал статью «О связи свойств элементов с их атомным весом». В этой статье он произвел упорядоченное расположение элементов, перечислив их в порядке увеличения веса и сгруппировав их в группы на основе схожих химических свойств. Хотя до открытия деталей атомной структуры оставалось еще много десятилетий, таблица Менделеева уже организовала элементы с точки зрения их валентности.
Элементы и атомный вес
Во времена Менделеева атомы считались неделимыми, уникальными объектами. Некоторые из них были тяжелее других, и казалось разумным упорядочить элементы, увеличивая вес. У этого подхода есть две проблемы. Во-первых, измерение веса — непростая задача, и многие из принятых во времена Менделеева гирь не были правильными. Во-вторых, оказывается, что атомный вес на самом деле не является важным параметром. В современной периодической таблице элементы расположены в порядке их атомного номера, который равен числу протонов в ядре.Во времена Менделеева протоны еще не были открыты.
Элементы и химические свойства
Менделеев писал, что «расположение в соответствии с атомным весом соответствует валентности элемента и в определенной степени различию в химическом поведении». Валентность, в понимании Менделеева, была показателем способности элемента сочетаться с другими элементами. Менделеев объединил порядок атомного веса с общими валентностями, чтобы организовать элементы в таблице.То есть он организовал элементы в группы в соответствии с их химическими характеристиками. Поскольку эти свойства повторяются очень часто, результатом стала периодическая таблица, в которой каждый вертикальный столбец, называемый группой, содержит элементы с аналогичными характеристиками, а каждая горизонтальная строка, называемая точкой, упорядочивает элементы по весу, увеличиваясь слева направо. и сверху вниз.
Структура атома
Примерно через 50 лет после создания первой периодической таблицы Менделеева ученые обнаружили, что атом построен вокруг ядра с положительно заряженными протонами и нейтральными нейтронами, которые относительно тяжелы.Положительно заряженное ядро окружено облаком отрицательно заряженных электронов. Число протонов, также называемое атомным номером, обычно совпадает с числом электронов. Оказывается, количество электронов в элементе во многом определяет его химические свойства. Таким образом, правильный порядок в периодической таблице определяется количеством электронов, а не весом, как первоначально предполагал Менделеев.
Валентные электроны
Электроны в облаке, окружающем ядро элемента, расположены слоями, называемыми оболочками.Каждая оболочка может удерживать определенное количество электронов. Когда каждая оболочка заполнена, добавляется новая оболочка, пока не будут учтены все электроны. Электроны во внешней оболочке называются валентными электронами, потому что именно их взаимодействия определяют химические свойства элемента. Столбцы, которые были настроены для группировки элементов по схожим химическим свойствам, оказались точно такими же столбцами, определяемыми числом валентных электронов. Элементы в группе 1A имеют только один валентный электрон, и каждый столбец группы A справа добавляет еще один валентный электрон.Организация становится немного туманной с элементами группы B, но каждый из них также сгруппирован по количеству валентных электронов.
Валентность — электроны, атомы, связи и оболочка
Валентность относится к числу, присвоенному элементам, которое отражает их способность реагировать с другими элементами и тип реакций, которым будет подвергаться элемент. Термин «валентность» происходит от латинского слова «сила» и может отражать силу элемента или его склонность к определенным типам реакций.
Электроны в атоме расположены на различных уровнях энергии . Электроны на самом высоком энергетическом уровне называются валентными электронами. В соответствии с правилом октетов — и чтобы стать более энергетически стабильными — атомы приобретают, теряют или делятся валентными электронами, пытаясь получить конфигурацию благородного газа в своей внешней оболочке. Конфигурация электронов на внешней оболочке атома определяет его способность и сродство вступать в химические реакции .
Число валентности элемента можно определить с помощью нескольких простых правил, касающихся расположения элемента в периодической таблице .В ионных соединениях (образованных между заряженными атомами или группами атомов, называемыми ионами) валентность атома — это количество электронов, которые атом получит или потеряет, чтобы получить полную внешнюю оболочку. В первой группе периодической таблицы элементам присваивается число валентности, равное 1. Число валентности 1 означает, что элемент обычно реагирует на потерю одного электрона для получения полной внешней оболочки. Элементам второй группы присваивается число валентности 2. Число валентности 2 означает, что элемент второй группы обычно реагирует, теряя два электрона, чтобы получить полную внешнюю оболочку.Элементам группы 17 присваивается число валентности отрицательное значение единица (-1). Валентное число -1 означает, что элемент второй группы обычно реагирует с получением одного электрона для получения электронной конфигурации благородного газа. Отражая неспособность реагировать с другими элементами, газам Nobel, уже поддерживающим стабильное расположение электронов, приписывается валентность ноль (O).
Термин «валентность» может также относиться к заряду или степени окисления атома. В атомах магния (Mg + 2 ) валентность равна +2.Атом или ион с зарядом +2 называется двухвалентным.
В ковалентных соединениях валентность атома может быть менее очевидной. В данном случае это количество образованных связей, то есть, являются ли связи одинарными, двойными или тройными. Атом углерода с двумя одинарными связями и одной двойной связью имеет валентность четыре (4). В воде (H 2 O) валентность кислорода равна 2, а валентность водорода равна 1. В обоих случаях число валентности указывает количество связей, которые образует каждый атом.
Теория валентной связи похожа на теорию молекулярных орбиталей в том, что она касается образования ковалентных связей. Теория валентных связей описывает связи в терминах взаимодействий между внешними орбиталями и гибридизированными орбиталями для объяснения образования соединений.
Теория отталкивания электронных пар валентной оболочки (VSEPR) — одна из популярных моделей для объяснения ковалентных связей. Эта теория утверждает, что молекулы будут иметь такую форму, чтобы минимизировать отталкивание, которое имеет место между валентными электронами.Поскольку все они заряжены отрицательно, электроны валентной оболочки отталкиваются друг от друга. Теория VSEPR утверждает, что атомы молекулы будут располагаться и принимать форму вокруг центрального атома, чтобы минимизировать отталкивание между валентными электронами.
Валентность (химия) — точка назначения
В химии валентность , также обозначаемая как « валентность », обычно представляет собой количество электронов, необходимое для заполнения внешней оболочки атома. Слово, появившееся в 1868 году, используется для обозначения как объединенной мощности элемента в целом, так и числового значения объединенной мощности.Более общее понятие валентности — это количество электронов, с которыми обычно связывается данный атом, или количество связей, образующих атом, потому что бывают исключения. Например, ряд соединений водорода, таких как Nh4, N2h5, N3H, образован азотом, в котором атомы азота имеют валентности 3, 2 и 1/3 соответственно. Поэтому идея валентности как простого числа была неясной.
Следовательно, валентность позже была определена как количество химических связей в молекуле, образованной атомом.Количество атомов водорода, с которыми он сочетается, определяет объединяющий потенциал или сродство атома данного элемента. В метане углерод имеет валентность 4; азот имеет валентность 3 в аммиаке; кислород имеет валентность 2 в воде, а хлор имеет валентность 1. в хлористом водороде. Хлор может быть заменен водородом, поскольку он имеет валентность, равную единице. Описание и систематизация Валанса были серьезной проблемой для химиков XIX века. Большая часть усилий была сосредоточена на разработке эмпирических правил для определения валентности элементов в отсутствие какой-либо адекватной теории их причины.
Электроотрицательность валентности
В основной группе периодической таблицы атомы элементов могут иметь валентность от 1 до 7 (поскольку 8 — это полный октет).
- Группа 1 (I) — обычно показывает валентность 1. Пример: Na в NaCl
- Группа 2 (II) — Типичная валентность 2. Пример: Mg в MgCl2
- Группа 13 (III) — Обычная валентность 3. Пример: Al в AlCl3
- Группа 14 (IV) — Обычная валентность равна 4. Пример: C в CO (двойная связь) или Ch5 (одинарные связи)
- Группа 15 (V) — Обычные валентности 3 и 5.Примеры: N в Nh4 и P в PCl5
- Группа 16 (VI) — типичные валентности 2 и 6. Пример: O в h3O
- Группа 17 (VII) — обычные валентности 1 и 7. Примеры: Cl в HCl
В пентахлориде фосфора PCl5 фосфор имеет 5-валентность. Связность элементов представлена диаграммами валентности соединения с линиями, проведенными между двумя элементами, также называемыми связями, что указывает на насыщенную валентность для каждого элемента. Характерные валентности элементов были рассчитаны с точки зрения числа атомов водорода, которые могут быть объединены или замещены в соединении атомом элемента.Однако стало очевидно, что валентности нескольких элементов в разных соединениях различаются. В 1425 году от латинского слова valentia, что означает сила или мощь, было определено слово «валентность». Чтобы прояснить химические связи и молекулярную структуру, принцип валентности был разработан во второй половине 19 века.
Американский химик Г.Н. сделал первый важный шаг в создании удовлетворительного описания валентности и химической комбинации. Льюис (1916) описал химическую связь органических соединений с парой электронов, которые удерживают вместе два атома и служат для их удержания.В том же году природу химической связи между электрически заряженными атомами (ионами) обсуждал немецкий физик В. Коссель. IUPAC (Международный союз чистой и прикладной химии) описывает валентность как:
«Максимальное количество одновалентных атомов (первоначально атомов водорода или хлора), которые могут объединяться с атомом рассматриваемого элемента, или с фрагментом, или для которого атом этого элемента можно заменить ».
Что касается электронных структур и межатомных сил, теория валентности была переформулирована после развития подробной электронной теории периодической системы элементов.Это условие привело к введению многих новых терминов, а именно ионной валентности, ковалентности, степени окисления, числа координации, металлической валентности, соответствующих различным способам взаимодействия атомов. Валентность элемента определялась большинством химиков XIX века как количество его связей без различения различных форм валентности или связи. Однако в 1893 году Альфред Вернер описал координационные комплексы переходных металлов, такие как (Co (NH 3 ) 6 ) Cl 3 , в которых он выделил основную и вспомогательную валентности (нем. «Hauptvalenz» и «Nebenvalenz»), соответствующие современным представлениям о степени окисления и координационном числе соответственно.
Валентность отличается от степени окисления и не имеет символа NO. Следовательно, валентность азота равна 3, а степень окисления может варьироваться от -3 до +5. Степень окисления — это гипотетический заряд молекулы или иона атома, и это мера его кажущейся способности внутри этого вещества приобретать или терять электроны. Многие элементы имеют определенную валентность, связанную с их местом в периодической таблице, и сегодня это рационализируется правилом октетов. Положительный заряд можно получить, отдав электрон, а отрицательный заряд — наоборот, потеряв электрон, или электронное усиление, называемое зарядом атома.Итак, у Валентности нет символа, есть как положительные, так и отрицательные знаки для вознаграждения.
Важность валентности: Внешняя оболочка сначала вступает в контакт, когда два атома вступают в реакцию, и, таким образом, электрон внешней оболочки обычно участвует в химической реакции. Чтобы сбалансировать свою валентную оболочку, атомы обмениваются валентными электронами в химической реакции. В настоящее время предпочтение отдается другим обозначениям из-за неопределенности слова валентность. В дополнение к схеме степеней окисления, используемой в номенклатуре запасов координационных соединений и лямбда-обозначениям, используемым в номенклатуре ИЮПАК по неорганической химии, степень окисления лучше отражает электронное состояние атомов в молекуле.Валентность элементов в высокой степени окисления может быть больше четырех. Например, хлор имеет семь валентных связей в перхлоратах; рутений имеет восемь валентных связей в степени окисления +8 в четырехокиси рутения.






 Химические элементы с переменной валентностью
Химические элементы с переменной валентностью ru
ru