Содержание
Урок 12. медь. цинк. титан. хром. железо. никель. платина — Химия — 11 класс
Химия, 11 класс
Урок № 12. Медь. Цинк. Титан. Хром. Железо. Никель. Платина
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению основных металлов побочной подгруппы или Б-группы: меди, цинка, титана, хрома, железа, никеля и платины, их физическим и химическим свойствам, способам получения и применению.
Глоссарий
Катализатор – вещество, которое ускоряет химическую реакцию.
Пассивация – переход металла в неактивное состояние из-за образования на его поверхности оксидной плёнки. Может усиливаться концентрированными кислотами.
Проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек.
Хромирование/никелирование – покрытие поверхности металла другим, более устойчивым, для предотвращения коррозии.
Цинковая обманка (ZnS) – сложно идентифицируемое соединение цинка, подверженное сильному влиянию примесей на ее внешний вид.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Медь
Электронная конфигурация
Медь является металлом, расположенным в I группе побочной подгруппе и имеет следующую электронную конфигурацию:
1s2
Рисунок 1 – Электронная конфигурация атома меди
Мы видим, что у меди наблюдается проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек.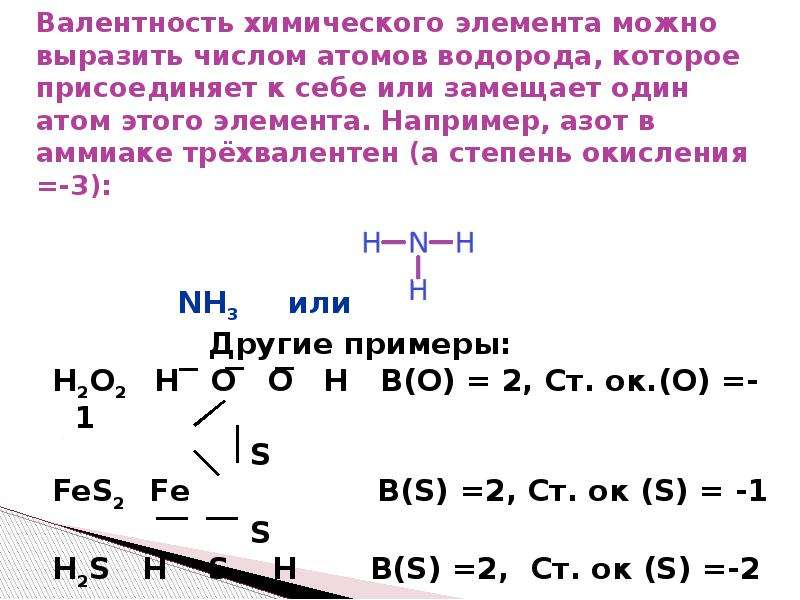 По принципу наименьшей энергии электронные орбитали должны заполняться в следующем порядке:
По принципу наименьшей энергии электронные орбитали должны заполняться в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d …
Но для некоторых атомов энергетически более выгодно иметь наполовину (5 электронов, дальше увидим у хрома) или полностью заполненную (10 электронов, как у меди) 3d-орбиталь.
Медь имеет две валентности: 1 и 2 и проявляет степени окисления +1 и +2.
Физические свойства
Медь обладает следующими физическими свойствами
Таблица 1 – Основные физические свойства меди
Свойство | Значение |
Цвет | Светло-розовый |
Структура | Тягучая, вязкая, легко прокатывается |
Температура плавления, °С | 1083 |
Нахождение в природе
В природе медь встречается в самородном виде, а также в составе некоторых минералов:
- медный блеск, Cu2S;
- куприт, Cu2O;
- медный колчедан, CuFeS;
- малахит, (CuOH)2CO3.
Способы получения меди
Основными способами получения меди являются:
- Восстановление коксом и оксидом углерода (II). Таким образом получают медь из куприта:
Cu2O + С = 2Сu + CO
Cu2O + CO = 2Cu + CO2
- Обжиг в специальных печах до оксидов. Данный способ подходит для сульфидных и карбонатных руд.
- Электролиз. Единственный из перечисленных способов, который позволяет получить медь без примесей.
Химические свойства
При комнатной температуре медь не вступает в реакции с большинством соединений. При повышенной температуре ее реакционная способность резко возрастает.
Реакции с простыми веществами:
2Cu + O2 = 2CuO
2Cu + Cl2 = 2CuCl2
Cu + S = CuS
Реакции со сложными веществами:
Cu + 2H2SO4(конц) = CuSO4 + SO2↑ +2H2O
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Применение
Широкое применение находит как сама медь, так и её соединения. В чистом виде она используется для производства проводов, кабелей, теплообменных аппаратов, а также входит в состав многих сплавов.
В чистом виде она используется для производства проводов, кабелей, теплообменных аппаратов, а также входит в состав многих сплавов.
Соединения меди, например, медный купорос CuSO4∙5H2O используется для защиты растений, а гидроксид меди является качественным реагентом для определения альдегидной группы у органических соединений, а также наличия глицерина (дает голубое окрашивание раствора).
Цинк
Электронная конфигурация
Цинк является металлом, расположенным в II группе побочной подгруппе, и имеет следующую электронную конфигурацию:
Рисунок 2 – Электронная конфигурация атома цинка
В связи с тем, что 4s-орбиталь заполнена, цинк может находиться в единственной степени окисления, равной +2.
Физические свойства
Цинк обладает следующими физическими свойствами
Таблица 2 – Основные физические свойства цинка
Свойство | Значение |
Цвет | Голубовато-серебристый |
Структура | Хрупок |
Температура плавления, °С | 419,5 |
Нахождение в природе
В природе цинк встречается только в связанном состоянии, а именно в цинковом шпате ZnCO3 и цинковой обманке ZnS. Свое название цинковая обманка получила за то, что его сложно идентифицировать, поскольку он может выглядеть совершенно по-разному: быть различного цвета и структуры в зависимости от посторонних примесей.
Свое название цинковая обманка получила за то, что его сложно идентифицировать, поскольку он может выглядеть совершенно по-разному: быть различного цвета и структуры в зависимости от посторонних примесей.
Способы получения цинка
Чистый цинк получают обжигом с последующим восстановлением:
ZnS + O2 = ZnO + SO2↑
ZnO + C = Zn + CO↑
Химические свойства
Цинк является довольно устойчивым металлом, поскольку на воздухе покрывается оксидной пленкой, и в дополнение практически не взаимодействует с водой при нормальных условиях. Но так же, как и медь, становится более активным при повышении температуры.
Реакции с простыми веществами:
2Zn + O2 = 2ZnO
2Zn + Cl2 = 2ZnCl2
Zn + S = ZnS
Реакции со сложными веществами:
Zn + 2NaOH(крист) = NaZnO2 + H2↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Применение
Цинк является коррозионно-устойчивым металлом, поэтому он нашёл применение в производстве защитных покрытий металлов, гальванических элементов, а также как компонент сплавов.
Титан
Электронная конфигурация
Титан является элементом IV группы побочной подгруппы и имеет следующее электронное строение:
Рисунок 3 – Электронная конфигурация атома титана
Данная конфигурация позволяет атому титана проявлять две степени окисления: +2 и +4.
Физические свойства
Титан обладает следующими физическими свойствами:
Таблица 3 – Основные физические свойства титана
Свойство | Значение |
Цвет | Серебристо-белый |
Структура | Высокая прочность и взякость |
Температура плавления, °С | 1665 |
Нахождение в природе
В природе титан можно найти в составе таких минералов, как:
- титаномагнетит, FeTiO3∙Fe3O4;
- ильменит, FeTiO3;
- рутил, TiO2.
Способы получения титана
В связи с тем, что в природе не существует титановых руд, человеку приходится извлекать его путём хлорирования рудных концентратов с их последующим восстановлением с помощью магния или натрия.
TiCl4 + 2Mg = Ti + 2MgCl2
Для удаления примесей магния и его соли полученную смесь продуктов нагревают под вакуумом.
Химические свойства
Титан является очень активным металлом, но его оксидная пленка не даёт ему взаимодействовать при нормальных условиях ни с морской водой, ни даже с «царской водкой». Поэтому все реакции протекают при повышенных температурах.
Реакции с простыми веществами:
Ti + 2Cl2 = TiCl4
Ti + O2 = TiO2
Азотная кислота действует на титан только в форме порошка, в то время как разбавленная серная кислота реагирует с металлом:
2Ti + 3H2SO4 = Ti2(SO4)3 + 3H2↑
Применение
Титан и его сплавы отличает не только коррозионная стойкость, но и лёгкость, прочность. В связи с этим он активно используется при построении космических ракет, самолётов, подлодок и морских судов. Титан не взаимодействует с тканями организмов, из-за чего используется в хирургии.
Хром
Электронная конфигурация
Хром находится в IV группе побочной подгруппе и имеет следующее электронное строение:
Рисунок 4 – Электронная конфигурация атома хрома
Так как для атома хрома энергетически более выгодно иметь наполовину заполненную 3d-орбиталь, у него, как и у меди, наблюдается проскок электрона, что позволяет ему находиться в степенях окисления от +1 до +6, но наиболее устойчивыми являются +2, +3, +6.
Физические свойства
Хром обладает следующими физическими свойствами:
Таблица 4 – Основные физические свойства хрома
Свойство | Значение |
Цвет | Серебристо-белый с металлическим блеском |
Структура | Твердый |
Температура плавления, °С | 1890 |
Нахождение в природе
В природе большая часть хрома заключена в составе хромистого железняка Fe(CrO2)2. Иногда может встречаться в виде оксида хрома (III) и других соединениях.
Иногда может встречаться в виде оксида хрома (III) и других соединениях.
Способы получения хрома
Из хромистого железняка путем восстановлением углем при высоких температурах получают смесь железа и хрома – феррохром:
FeO + Cr2O3 + 3C = Fe + 2Cr + 3CO↑
Для получения чистого хрома проводят восстановление оксида хрома (III) алюминием:
Cr2O3 + 2Al = 2Cr + Al2O3
Химические свойства
Как и все вышеописанные металлы, хром покрыт оксидной плёнкой, которую трудно растворить даже сильными кислотами. Благодаря ней он обладает высокой стойкости к коррозии, поэтому начинает реагировать с разбавленными растворами кислот лишь спустя время. Концентрированные кислоты, такие как HNO3 и H2SO4, пассивируют оксидную пленку (укрепляют ее).
Применение
Благодаря своей коррозионной стойкости, хром используют в качестве защитных покрытий (хромируют поверхности металлов и сплавов). Также используется для создания легированных сталей, речь о которых пойдет в следующем уроке.
Также используется для создания легированных сталей, речь о которых пойдет в следующем уроке.
Железо
Железо – металл, с которым мы чаще всего сталкиваемся в нашей жизни, поэтому переоценить его значимость для человека невозможно. Он является самым распространенным после алюминия и составляет 5% земной коры. Теперь перейдем к рассмотрению его строения и свойств.
Электронная конфигурация
Железо находится в VII группе Б-подгруппе и имеет такое электронное строение, которое позволяет ему находиться в двух степенях окисления: +2 и +3. Конечно, в теории железо может выступать в качестве шестивалентного металла, но из-за пространственных затруднений ему не удается образовать такое количество связей. Поэтому такое состояние является неустойчивым для данного металла.
Рисунок 5 – Электронная конфигурация атома железа
Физические свойства
Железо обладает следующими физическими свойствами:
Таблица 5 – Основные физические свойства железа
Свойство | Значение |
Цвет | Серебристо-белый |
Структура | Мягкий, пластичный |
Температура плавления, °С | 1539 |
Нахождение в природе
Встречается железо в виде различных соединений: оксидов, сульфидов, силикатов. В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
Способы получения железа
Существует множество способов получения железа, и отличаются они друг от друга степенью его чистоты и требуемым типом конечного продукта.
- Восстановлением из оксидов (железо пирофорное).
- Электролизом водных растворов его солей (железо электролитическое).
- Разложением пентакарбонила железа Fe(CO)5 при нагревании до t 250°С.
- Методом зонной плавки (получение особо чистого железа).
- Технически чистое железо (около 0,16% примесей углерода, кремния, марганца, фосфора, серы и др.) выплавляют, окисляя компоненты чугуна в мартеновских сталеплавильных печах и в кислородных конверторах.
- Сварочное или кирпичное железо получают, окисляя примеси малоуглеродистой стали железным шлаком или путём восстановления руд твёрдым углеродом.
Химические свойства
Под воздействием высоких температур железо взаимодействует с простыми веществами:
2Fe + 3O2 = Fe2O3 ∙FeO
В ходе данной реакции происходит получение смеси оксидов, которую иногда записывают в виде общей формулы Fe3O4.
2Fe + 3Cl2 = 2FeCl3
Fe + S = FeS
Взаимодействует с разбавленными кислотами, причем с соляной кислотой происходит образование соли только двухвалентного железа:
Fe + 2HCl(разб) = FeCl2 + H2↑
При комнатной температуре железо пассивируется концентрированными кислотами, но при высоких температурах вступает в реакцию окисления:
2Fe + 6H2SO4(конц) = Fe2(SO4)3 + 3SO2 + 6H2O
Вступает в реакцию обмена с солями, образованными катионами более слабых металлов:
Fe + CuSO4 = FeSO4 + Cu↓
Применение
Про области применения железа можно говорить достаточно долго, поэтому выделим основные направления:
- В связи с его способностью быстро намагничиваться, его используют в трансформаторах и электромоторах.
- Основная масса железа расходуется на производство различных сплавов, таких как чугун и сталь.

Никель и платина
Далее стоит обратить на два металла: никель и платина. Как нам известно, они имеют схожие области применения, но отличаются по цене и качеству, потому предлагаю сравнить их.
Электронная конфигурация
Электронное строение металлов выглядит следующим образом:
Ni …3s2 3p6 3d8 4s2
Характерные степени окисления: + 2 и +3, но последняя является неустойчивой.
Pt …5s2 5p6 5d9 6s1
Характерные степени окисления: + 2 и +4.
Физические свойства
Таблица 5 – Основные физические свойства железа
Свойство | Значение | |
Ni | Pt | |
Цвет | Серебристо-белый | Белый |
Структура | Очень твердый | Пластичный |
Температура плавления, °С | 1453 | 1769 |
Химические свойства
Никель при повышенных температурах реагирует с галогенами с образованием солей, и с кислородом с образованием оксида никеля (II), в то время как платина очень устойчива к любым взаимодействиям. Реагирует с серой и галогенами в мелкораздробленном виде.
Реагирует с серой и галогенами в мелкораздробленном виде.
Никель медленно взаимодействует с разбавленными кислотами, когда платина реагирует только с «царской водкой».
Применение
Оба металла активно используются в переработке нефти в качестве катализаторов.
Катализатор – вещество, которое ускоряет химическую реакцию.
Каждые 2-3 года закупаются тонны реагентов, в составе которых всего несколько десятых процента платины или никеля, но именно они определяют их стоимость.
Также они используются в составе высококачественных сплавов, а никель – как антикоррозионное покрытие.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на вычисление количества исходного реагента.
Условие задачи: При растворении меди в растворе концентрированной азотной кислоты выделилось 2 л газа. Вычислите массу прореагировавшей меди.
Шаг первый. Напишем уравнение реакции и определим, какой газ выделился, расставим коэффициенты.
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
Шаг второй. Вычислим количество вещества газа:
Шаг третий. Вычислим количество вещества меди:
По уравнению реакции: n(Cu) = 0,5n(NO2), тогда
n(Cu) = 0,5 ∙ 0,089 = 0,044 (моль)
Шаг четвёртый. Вычислим массу меди:
m(Cu) = 0,044 ∙ 46 = 2,024 (г)
Ответ: 2,024 (г).
- Решение задачи на выход продукта.
Условия задачи: при обжиге 8,515 г сульфида цинка с последующим восстановлением оксида с помощью угля выделилось 3,45 л газа. Рассчитайте выход реакции обжига, если выход реакции восстановления равен 60%.
Шаг первый. Запишем уравнения реакций и вычислим молярные массы компонентов:
ZnS + O2 = ZnO + SO2↑
ZnO + C = Zn + CO↑
M (ZnO) = 81 г/моль
Шаг второй. Вычислим количество вещества газа:
Шаг третий. Вычислим массу оксида цинка:
Так как выход реакции составил 60%, то
n (ZnO) = 0,6n (CO) = 0,6 ∙ 0,154 = 0,0924 (моль)
Шаг четвёртый. Вычислим массу оксида цинка:
Вычислим массу оксида цинка:
Шаг пятый. Вычислим выход реакции:
Ответ: 87, 89%.
Валентность меди
Валентность меди.
Валентность меди:
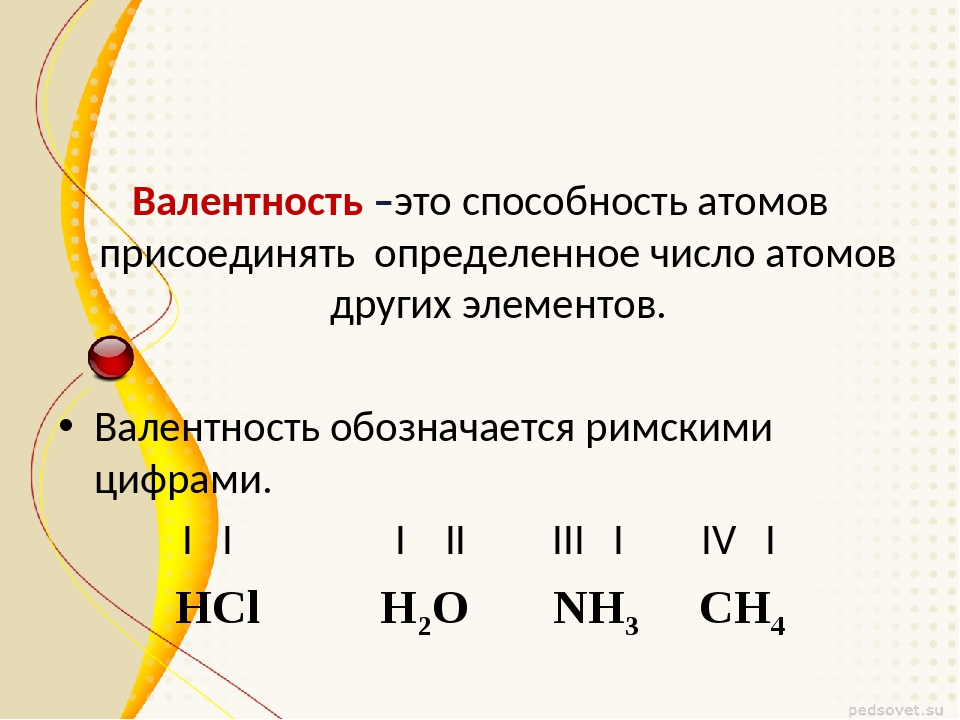
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность меди равна I, II. Медь проявляет переменную валентность.
| Валентность меди в соединениях | |
| I | Cu2O, CuOH |
| II | CuO, Cu(OH)2, CuSO4 |
Все свойства атома меди
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Коэффициент востребованности
122
Почему внешний вид медного радиатора PAJĄK меняется cо временем?
В 2016 году среди предлагаемых компанией Терма радиаторов появилась новая модель — изготовленный из медных профилей радиатор Pająk. Данная модель является лауреатом II премии в конкурсе Terma Design 2014. Её дизайн ссылается на традиции польских декоративных форм, так называемых пауков — сложных пространственных форм в изготовлении которых применялись легко доступные материалы.
Выполненная из меди конструкция радиатора Pająk отлично подходит к стилистике лофтов, а в обычных квартирах станет интересным элементом интерьера. Использование меди позволяет со временем получить уникальный оригинальный эффект, связанный с натуральным для этого материала изменением цвета.
Использование меди позволяет со временем получить уникальный оригинальный эффект, связанный с натуральным для этого материала изменением цвета.
Чистая медь имеет оранжево-красный цвет, в результате окисления на воздухе её цвет меняется со временем (может стать темнее, или в зависимости от атмосферы изменить цвет, например на синий или зеленый). Характерный цвет меди, является результатом перехода электронов между валентными слоями. Энергия, которая выделяется во время этих переходов, равна энергии света имеющего оранжевый цвет, что дает свое отражение в необычном цвете. Что интересно, точно такой же механизм отвечает за желтый цвет золота.
Медь на воздухе покрывается тонким слоем оксида меди, в результате чего темнеет и приобретает красноватую или красно-коричневую окраску. В атмосфере, содержащей карбонаты, оксиды азота или серы, медь может принять голубой или зеленый цвет.
Элементы радиатора, естественным образом покрываются патиной, что приводит к изменению цвета. Изменение цвета может происходить по-разному и с разной скоростью, что является естественной особенностью данного изделия из-за отсутствия дополнительного покрытия на его поверхности. Стоит иметь в виду, что изменения в цвете зависят от условий эксплуатации радиатора: сушка полотенца, случайное попадание брызг воды, или хотя бы прикосновение ладонью — все эти действия будут влиять на изменения в цвете радиатора в местах соприкосновения. Несмотря на визуальные изменения, химические свойства материала при этом не только не нарушаются, но создается слой патины препятствующий дальнейшей, более глубокой коррозии. Радиатор выполнен из меди, при правильном использовании, является прочным, устойчивым к коррозии, долговечным элементом интерьера.
Изменение цвета может происходить по-разному и с разной скоростью, что является естественной особенностью данного изделия из-за отсутствия дополнительного покрытия на его поверхности. Стоит иметь в виду, что изменения в цвете зависят от условий эксплуатации радиатора: сушка полотенца, случайное попадание брызг воды, или хотя бы прикосновение ладонью — все эти действия будут влиять на изменения в цвете радиатора в местах соприкосновения. Несмотря на визуальные изменения, химические свойства материала при этом не только не нарушаются, но создается слой патины препятствующий дальнейшей, более глубокой коррозии. Радиатор выполнен из меди, при правильном использовании, является прочным, устойчивым к коррозии, долговечным элементом интерьера.
Кроме того, стоит помнить, что медь, как и серебро обладает сильными бактерицидными свойствами.
На протяжении веков ее используют для разных целей, в том числе и для защиты погружаемой части судов от разрушений связанных с воздействием живых организмов. Подобное применение меди нашлось и при изготовлении рыболовных снастей и других элементов, которые подвержены обрастанию растениями. Биостатические свойства меди приводят к тому, что это материал массово используется также и при изготовлении дверных ручек. Радиаторы изготовленные из медных профилей дают уверенность в том, что полотенца размещенные на них для сушки остаются гигиенически чистыми.
Подобное применение меди нашлось и при изготовлении рыболовных снастей и других элементов, которые подвержены обрастанию растениями. Биостатические свойства меди приводят к тому, что это материал массово используется также и при изготовлении дверных ручек. Радиаторы изготовленные из медных профилей дают уверенность в том, что полотенца размещенные на них для сушки остаются гигиенически чистыми.
В квартирах и лофтах, покрываясь со временем естественной патиной, Pająk приобретет дополнительный шарм и благородный внешний вид. Данная анимация показывает, как радиатор Pająk изменяется с течением времени, становясь уникальным элементом любого интерьера.
Управление процессом травления проводников печатных плат
Для управления процессом линия травления содержит блок перманентного экстракционного извлечения избытка меди из травильного раствора, чтобы поддерживать его состав на границе «травление/отсутствие травления» («на грани фола»). Фронтальный напор струй в сочетании с граничными условиями травления создают условия растворения металла только на дне зазора между проводниками. В этом случае боковые стенки зазора почти не подвергаются растворению, что обеспечивает минимальный боковой подтрав проводников схемы при относительно большой толщине вытравливаемого металла (меди фольги и гальваники). Кроме условий получения прецизионного рисунка проводников печатной схемы предлагаемая технология создает условия для снижения экологической нагрузки на сооружения очистки промышленных стоков вод.
В этом случае боковые стенки зазора почти не подвергаются растворению, что обеспечивает минимальный боковой подтрав проводников схемы при относительно большой толщине вытравливаемого металла (меди фольги и гальваники). Кроме условий получения прецизионного рисунка проводников печатной схемы предлагаемая технология создает условия для снижения экологической нагрузки на сооружения очистки промышленных стоков вод.
В производстве печатных плат перепробовано много составов травильных растворов в сочетании с резистами, создающими избирательность растворения металлов2, 3. Все они основаны на окислении вытравливаемых металлов и последующем растворении их окислов. Если в качестве травящих растворов используются вещества с переменной валентностью, как например, медь или железо, персульфаты процесс окисления и растворения окислов осуществляется в одном цикле. В итоге в производстве печатных плат установилось использование кислых растворов на основе хлорной меди в сочетании с органическими резистами и щелочные растворы на основе аммиачного комплекса хлорной или сернокислой меди в сочетании с металлорезистами на основе олова (олово, олово-никель, олово-свинец)4, 5.
Все существующие процессы травления рисунка проводников печатных плат относятся к изотропным процессам, т.е. они растворяют металл во всех направлениях одинаково. В процессе травления проводников схемы кроме вертикального травления, т. е. травления по глубине зазора, происходит также и горизонтальное травление, так называемый боковой подтрав. Всегда желательно уменьшить боковое подтравливание, чтобы добиться прямоугольной формы сечения вытравленного проводника.
Процессы травления могут быть погружными и струйными.
Основное преимущество погружного травления – это равные условия травления для двух сторон заготовки. По всей заготовке наблюдается одинаковый боковой подтрав, и скорость травления примерно одинаковая при условии перемешивания раствора или возвратно-поступательного перемещения заготовки в растворе. Но и при этом обмен раствора на поверхности заготовки минимальный, а боковой подтрав получается большим, так как процесс травления как в ширину, так и в глубину идет с одинаковой скоростью. Такие условия травления при изготовлении прецизионных печатных плат не устраивают современное производство из-за повышенного бокового подтравливания. Задача конструктора и технолога при проектировании оборудования для травления печатных плат добиться наибольшей скорости травления в глубину, а не в сторону под металлорезист или органический резист (фоторезист).
Такие условия травления при изготовлении прецизионных печатных плат не устраивают современное производство из-за повышенного бокового подтравливания. Задача конструктора и технолога при проектировании оборудования для травления печатных плат добиться наибольшей скорости травления в глубину, а не в сторону под металлорезист или органический резист (фоторезист).
Струйный метод травления является наиболее эффективным как по скорости процесса, так и по снижению величины бокового подтравливания. Струйное травление обычно осуществляется в конвейерных установках, в которых на заготовки печатных плат, перемещаемых по транспортеру, сверху и снизу подаются струи травильного раствора.
Рассмотрим этапы травления рисунка, локально защищенного резистом.
Начало процесса травления (рис 1): поверхность меди покрыта рисунком из защитного резиста. Здесь травящая среда омывает, травит и удаляет те участки меди, которые не защищены резистом. Промежуточные этапы, показанные на рис 2 и 3, демонстрируют дальнейший ход этого процесса.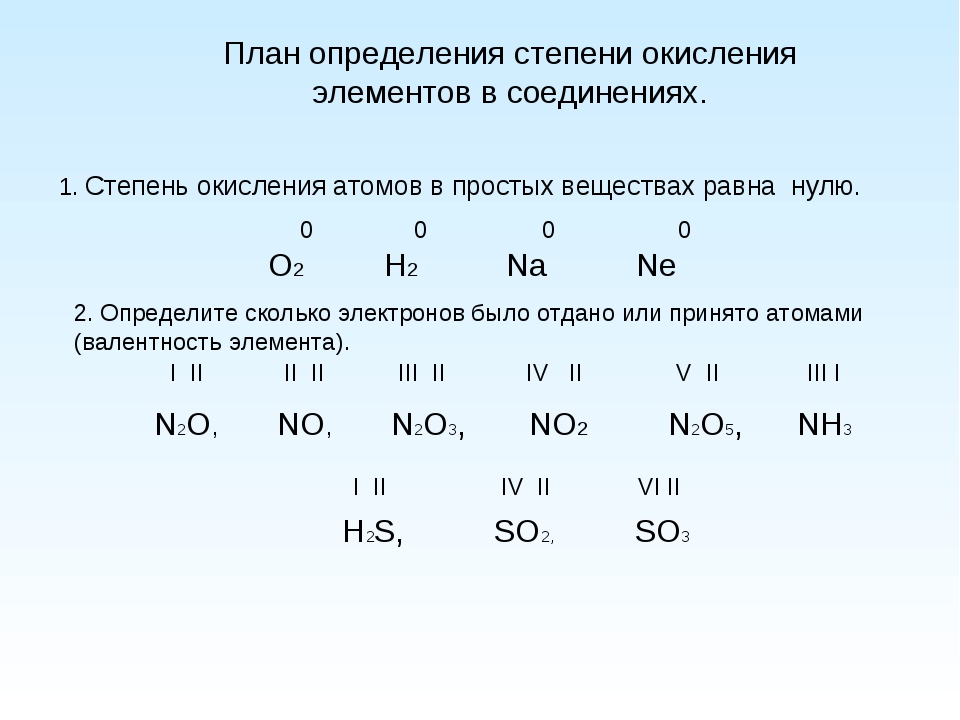
Следующий этап (рис 4): медь здесь уже полностью удалена до поверхности базового материала. Но чтобы уверенно гарантировать разделение смежных печатных проводников, а также исключить ситуации, когда остатки меди в зазоре локально уменьшают расстояние между печатными проводниками, процесс травления продолжается.
Если в качестве защитного резиста используется металлорезист, за счет контактной разницы в электрохимическом потенциале меди и металлорезиста (олова) медь удаляется главным образом из-под резиста, и здесь в наибольшей степени проявляется эффект бокового подтрава в сочетании с нависанием металлорезиста на кромках проводников.
Для оценки качества травления используется такое понятие как фактор травления. Этот параметр отражает отношение толщины протравленного медного проводника к максимальной величине бокового подтрава по одной стороне (рис 5).
F = H / L,
где F – фактор травления (или коэффициент бокового подтравливания),
H – толщина меди,
L – боковой подтрав.
Обычно фактор травления для травильных машин струйного типа F = 2 – 2,5.
Чем больше фактор травления, тем меньше боковой подтрав, и тем более тонкие проводники можно воспроизводить. Задача технологов – уменьшить величину бокового подтрава проводников и за счет этого улучшить разрешающую способность литографии рисунка печатных плат. Для этого нужно создать условия для поддержания травящих свойств раствора «на грани фола», т.е. в состоянии, когда раствор активен только в местах удара струй о травящуюся поверхность. Эти условия реализованы в конструкции травильной машины, в которой форсунки распыляют травящий раствор строго перпендикулярно травящей поверхности (рис 6).
Для управления процессом необходимо создать аппендикс к блоку травления, удаляющий излишки меди из травящего раствора по мере её растворения (насыщения раствора медью).
Пограничные режимы травления обеспечиваются поддержанием состава раствора с постоянным содержанием меди меньше 70 г/л, но не ниже 65 г/л при рН = 7,8 – 8. Обычно при поддержании такого состава происходит первоначальное растворение меди, затем его быстрый останов за счет пассивации медной поверхности. При значительном повышении давлении на форсунках, мощная струя свежего травильного раствора постоянно активирует медную поверхность, и пассивация медной поверхности не успевает образоваться. Таким образом, травление меди в глубину будет происходить непрерывно, а боковые поверхности, не подвергаясь мощному давлению струй раствора, пассивируются и не травятся. Таким образом, происходит уменьшение бокового подтравливания, что приводит к улучшению фактора травления6.
Обычно при поддержании такого состава происходит первоначальное растворение меди, затем его быстрый останов за счет пассивации медной поверхности. При значительном повышении давлении на форсунках, мощная струя свежего травильного раствора постоянно активирует медную поверхность, и пассивация медной поверхности не успевает образоваться. Таким образом, травление меди в глубину будет происходить непрерывно, а боковые поверхности, не подвергаясь мощному давлению струй раствора, пассивируются и не травятся. Таким образом, происходит уменьшение бокового подтравливания, что приводит к улучшению фактора травления6.
Управление процессом травления в описываемой системе состоит в жестком поддержании состава раствора, рН, концентрации меди и температуры раствора. Кроме того, для уменьшения величины бокового подтрава по предлагаемой методике нужно значительно увеличить напор струй травящего раствора.
В процесс прецизионного травления вмешивается еще один существенный фактор – на верхней поверхности заготовки образуются лужи, мешающие обмену раствора. Из-за этого создаются неравные условия травления на верхней и нижней поверхности заготовки платы. Снизу заготовки травильный раствор постоянно обновляется за счет гравитации, он легко отделяется от поверхности и падает вниз. А на верхней поверхности заготовки платы неизбежно собирается лужа и, чем выше расход травильного раствора, тем больше ее собирается в центре заготовки. На краях раствор будет накапливаться в меньшей степени, и здесь условия для обмена раствора будут лучше. В центре заготовки обмен раствора затруднен, а образующаяся лужа раствора создает условия изотропности процесса травления, т.е. будут неизбежно созданы условия для усиленного бокового подтравливания.
Из-за этого создаются неравные условия травления на верхней и нижней поверхности заготовки платы. Снизу заготовки травильный раствор постоянно обновляется за счет гравитации, он легко отделяется от поверхности и падает вниз. А на верхней поверхности заготовки платы неизбежно собирается лужа и, чем выше расход травильного раствора, тем больше ее собирается в центре заготовки. На краях раствор будет накапливаться в меньшей степени, и здесь условия для обмена раствора будут лучше. В центре заготовки обмен раствора затруднен, а образующаяся лужа раствора создает условия изотропности процесса травления, т.е. будут неизбежно созданы условия для усиленного бокового подтравливания.
Таким образом, процессы травления на верхней и нижней поверхностях заготовки сильно отличаются. Чем больше площадь заготовки, тем сильнее будет проявляться эта разница.
Для устранения данного негативного эффекта и достижения равномерности травления используется вакуумный отсос травильного раствора с верхней поверхности заготовки.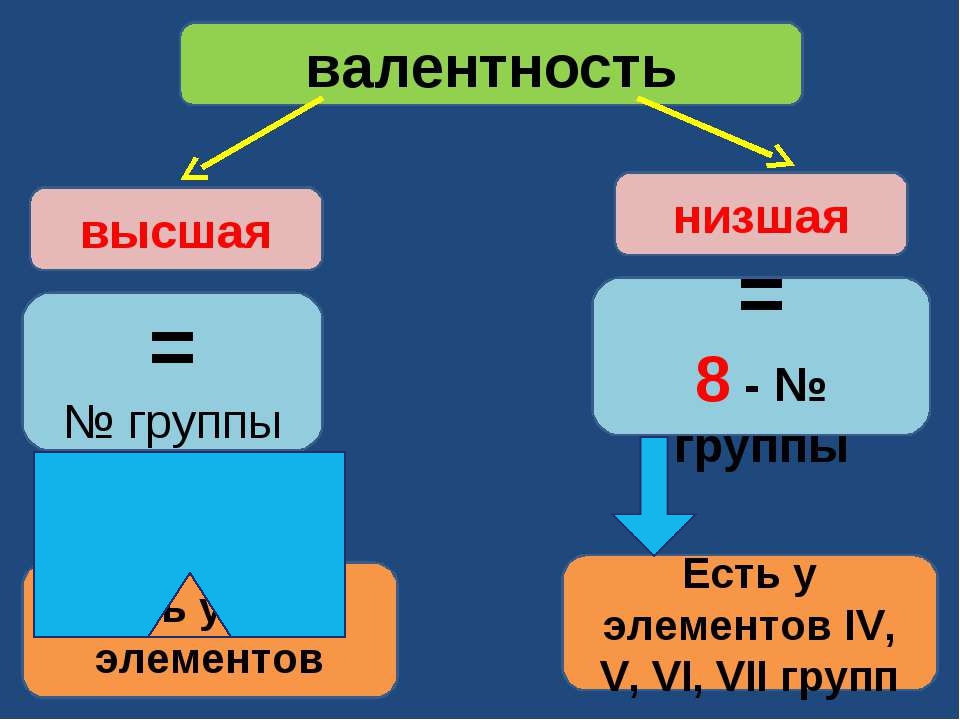 Вакуумные отсосы встраиваются в приводные ролики на конвейере и называются гидродинамическими. За счет этих вакуумных отсосов застой травильного раствора полностью удаляется, а новые порции из форсунок каждый раз бьют по обнаженной поверхности заготовки. Таким образом создаются абсолютно одинаковые скорости травления как снизу, так и сверху заготовки.
Вакуумные отсосы встраиваются в приводные ролики на конвейере и называются гидродинамическими. За счет этих вакуумных отсосов застой травильного раствора полностью удаляется, а новые порции из форсунок каждый раз бьют по обнаженной поверхности заготовки. Таким образом создаются абсолютно одинаковые скорости травления как снизу, так и сверху заготовки.
Повышенный напор струй достигается за счет применения мощных насосов (5 кВт) и уменьшения расстояния от форсунки до поверхности платы. В результате энергия и давление струи травильного раствора в контакте с поверхностью заготовки печатной платы увеличивается. При проведении проектных работ на специальном испытательном стенде было выбрано оптимальное расстояние от форсунки до медной поверхности с учетом угла распыления форсунки так, чтобы соседние струи пересекались не более чем на 15-20 %. Увеличение мощности насосов, увеличение давления подачи раствора при относительно малой активности травильного раствора («на грани фола») позволили достигнуть нормальной скорости травления и подавить боковой подтрав.
Управление составом раствора обеспечивается применением новой системы регенерации. Принцип работы этой системы основан на органической экстракции меди из медно-аммиачного комплекса с помощью органического экстрагента, который после разрушения медно-аммиачного комплекса насыщается ионами меди. Для этого применяется экстрагент, серийно выпускаемый для промышленной добычи меди. Он является крупнотоннажным продуктом, и его стоимость не сильно сказывается на себестоимости процесса регенерации меди.
В дальнейшем происходит разрушение насыщенного медью экстрагента раствором серной кислоты. В этом процессе ионы меди переходят в раствор серной кислоты. По мере накопления меди в растворе электролит подвергается электрохимической регенерации, где медь в виде особо чистой меди высаживается на катодах. Экстракция меди из рабочего травильного раствора и стадия извлечения меди из экстракта разделены. Поэтому процесс электрохимического восстановления меди никак не влияет на скорость травления. Применение специальных высокоточных датчиков измерения плотности раствора травления позволяет с точностью ±2 г/л поддерживать содержание меди в травильном растворе.
Применение специальных высокоточных датчиков измерения плотности раствора травления позволяет с точностью ±2 г/л поддерживать содержание меди в травильном растворе.
Описываемый процесс регенерации значительно отличается от традиционных процессов, применяемых при производстве печатных плат. В традиционном процессе регенерация меди происходит порционно в гальванической ванне. Этот процесс ступенчатый, он не может быть непрерывным. Периодический отбор травильного раствора для регенерации и добавление свежего раствора меняют концентрацию меди в травильной машине, а значит меняется активность раствора в ходе травления. Чтобы выровнять процесс, необходимо использовать дополнительные буферные емкости на входе и выходе регенерируемого раствора. Но применение такого приема ведет к отсутствию условий управляемости процессом травления, удорожанию оборудования и неудобствам в эксплуатации.
Главное достоинство описываемого комплекса прецизионного травления – управляемость процессом и простота эксплуатации. Запуск процессов травления и регенерации происходит с одной кнопки. Все режимы устанавливаются автоматически. Оператору до начала работы необходимо только ввести в интерфейс машины толщину вытравливаемого металла. Установка автоматически выставит оптимальные режимы для получения прецизионного рисунка.
Запуск процессов травления и регенерации происходит с одной кнопки. Все режимы устанавливаются автоматически. Оператору до начала работы необходимо только ввести в интерфейс машины толщину вытравливаемого металла. Установка автоматически выставит оптимальные режимы для получения прецизионного рисунка.
При работе установки каждый квадратный метр печатной платы уносит около 200 мл раствора и меняет его рН. В предлагаемой системе коррекция травильного раствора для поддержания рН происходит автоматически водным раствором аммиака непосредственно при травлении. Газообразный аммиак не используется, т.к. является взрывоопасным газом. Для предотвращения уноса испаряющегося аммиака установка травления имеет герметичную конструкцию. Вытяжная вентиляция подключена через автоматический клапан для автоматического поддержания рН.
В процессе работы установки предусмотрено не только управление составом травильного раствора, но и регенерация аммиачной промывки. В процессе аммиачной промывки происходит накопление меди в растворе, и он может превратиться в травильный раствор. Чтобы предотвратить этот эффект содержание меди в аммиачной промывке поддерживается не более 6 г/л.
Чтобы предотвратить этот эффект содержание меди в аммиачной промывке поддерживается не более 6 г/л.
Так как скорость травления поддерживается всегда постоянной, можно применять автоматические погрузчики-разгрузчики, т. е. управление процессом травления происходит практически без участия персонала.
Таким образом спроектирована и предлагается серия установок анизотропного травления рисунка печатных плат с активированной вертикальной составляющей, названной Frezer Style (рис 7). Они обеспечивают полную управляемость процессом, простоту обслуживания и имеют оригинальный дизайн. Эксплуатация в условиях реального производства показала, что Frezer Style идеально подходит для травления узких зазоров и формирования проводников с минимальным размером и допуском по ширине. Применение динамической системы контроля и поддержания плотности и состава раствора травления в комплекте с экстракционной системой извлечения излишней меди из состава медноаммиачного травильного раствора, названной «СЭМАР» (рис 8), позволяют достичь минимального бокового подтрава проводников при сохранении производительности линии за счет увеличения вертикальной составляющей обработки при пограничных режимах травления.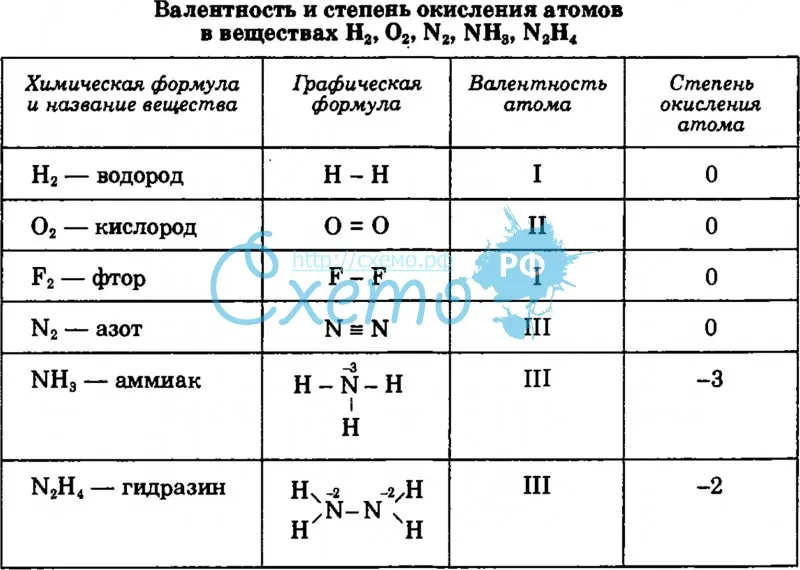
Конструкция динамических прижимных валов с вакуумным отсосом раствора дает возможность быстро удалять травильный раствор («лужи») с поверхности обрабатываемой заготовки (рис 9), обеспечивая тем самым лучшие результаты при большой толщине фольги (фактор травления до 5).
Управление установкой серии Frezer Style осуществляет PLC-контроллер с сенсорным экраном, на котором выполняются все настройки, например, выставляется толщина медной фольги и отслеживается состояние всех элементов установки и режимов травления. Вывод установки на рабочий режим производится автоматически. Все подключения – вода для промывки, вода для охлаждения, слив промывных вод, слив раствора – осуществляются в одной зоне доступа.
Для удобства и технологичности использования в установках серии Frezer Style предусмотрены:
- Независимая регулировка давления по рядам форсунок (рис 10).
- Предотвращение разворотов заготовок: положение на выходном конвейере соответствует входному.

- Форсунки с байонетным креплением, обеспечивающие быстроту их демонтажа/монтажа при профилактических работах. Коллекторы обслуживаются без разбора установки.
- Система датчиков для измерения площади обрабатываемой заготовки и управления режимом экономии воды и электроэнергии.
- Возможность обработки тонких заготовок и заготовок малого размера благодаря конструкции конвейера: ролики на смежных валах взаимно смещены, что позволяет обеспечить минимально возможное расстояние между валами.
- Автоматическая система контроля и поддержания рН. Автоматическая система дозирования корректирующего раствора.
- Система поддержания температуры в рабочих камерах.
- Насосы повышенной мощности в комплекте со щелевыми и специальными форсунками, обеспечивающие наиболее подходящую для данного процесса струю раствора.
- Двойные прозрачные крышки из минерального стекла с датчиком открытия.
- Многоступенчатая система фильтрации, обеспечивающая чистоту форсунок в процессе эксплуатации и способствующая равномерности процесса травления.

- Все баки снабжены системой контроля уровня раствора, связанной с системой управления, для обеспечения надежной работы насосов. Все баки имеют окна для визуального контроля уровня раствора.
- Автоматическая система управления клапаном вытяжки и система улавливания паров для уменьшения уноса аммиака в вытяжную вентиляцию.
- Модуль горячей сушки.
Установка СЭМАР обеспечивает регенерацию раствора медно-аммиачного травления печатных плат и аммиачной промывки. Система состоит из двух основных модулей: экстракционного и электролизного. Схема работы установки приведена на рис 11.
Установка СЭМАР предназначена для:
- Поддержания постоянства состава медно-аммиачного травильного раствора.
- Автоматической регенерации с извлечением металлической меди из травильного раствора.
- Автоматической регенерации с извлечения меди из раствора аммиачной промывки.
- Демпфирования колебаний концентрации меди при импульсной загрузке травильной машины с большим количеством стравливаемой меди в короткий промежуток времени.
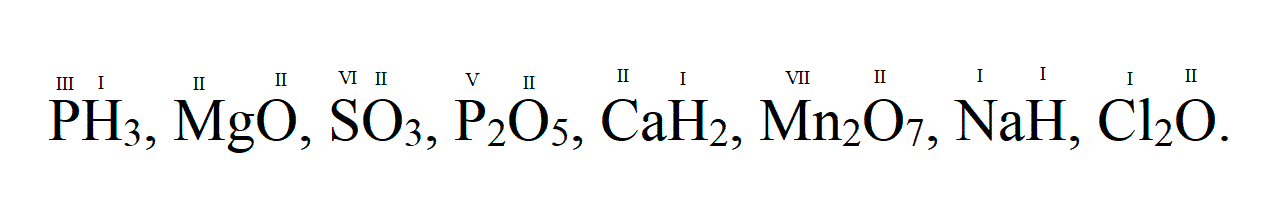
- Специализированной регенерации медно-аммиачных травильных растворов с выделением чистой металлической меди в региональных центрах.
Преимущества:
- Постоянное поддержание состава травильного раствора с высокой точностью.
- Отсутствие отходов травильного раствора и аммиачной промывки.
- Предотвращение попадания ионов меди в промывные воды.
- Не требуются специальные добавки в травильный раствор.
- Особо чистая медь, получаемая в результате экстракции (99,99 %).
Экстракционный блок обеспечивает экстракцию меди из травильного раствора и аммиачной промывки с последующим переводом меди из органической фазы в водный раствор серной кислоты. Электролизный блок – электровыделение металлической меди из сернокислого электролита.
Экстракционные аппараты включаются в технологическую схему по принципу «перетракции», разработанном и опробованном ранее в РХТУ им.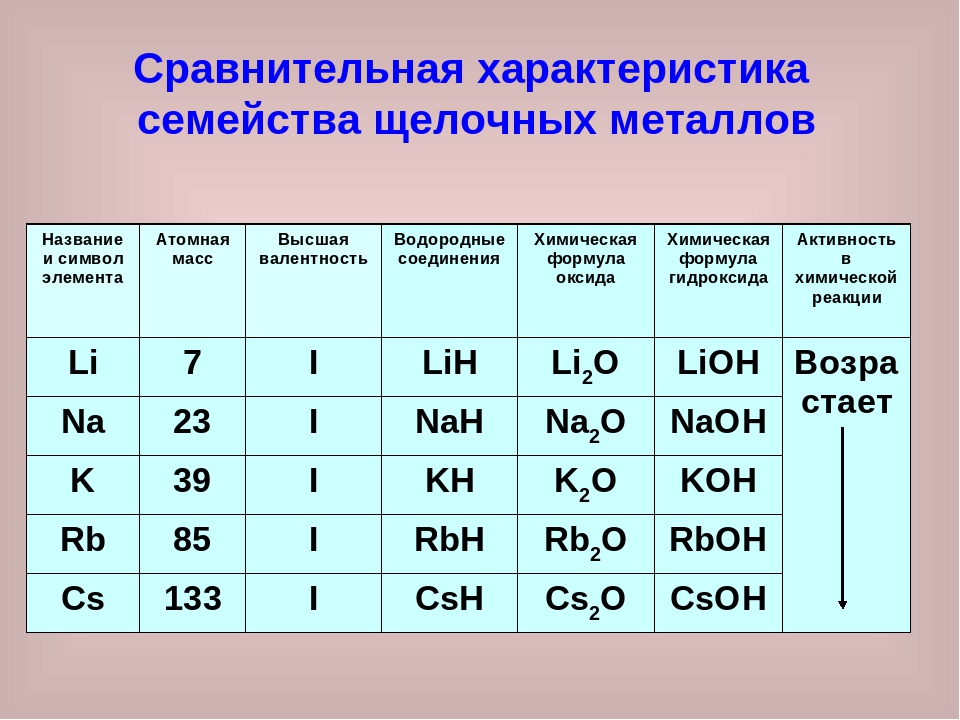 Д. И. Менделеева. Этот принцип подразумевает транспорт ионов меди из одного водного раствора в пространственно-отделенный от него другой водный раствор, с не смешивающимся с ними органическим экстрагентом (свободной жидкой мембраной). При этом, в отличие от классической жидкостной экстракции, органическая фаза не является накопителем ионов меди, а выступает лишь в роли переносчика, извлекая ионы из одной водной фазы и отдавая их в другую.
Д. И. Менделеева. Этот принцип подразумевает транспорт ионов меди из одного водного раствора в пространственно-отделенный от него другой водный раствор, с не смешивающимся с ними органическим экстрагентом (свободной жидкой мембраной). При этом, в отличие от классической жидкостной экстракции, органическая фаза не является накопителем ионов меди, а выступает лишь в роли переносчика, извлекая ионы из одной водной фазы и отдавая их в другую.
При щелочном травлении заготовок печатных плат у технологов возникает вопрос: а как же хлор? Он ведь будет выделяться? Однако этого не случается в силу своеобразного химизма процессов травления и регенерации, которые происходят в установках Frezer Style и СЭМАР. Как показано в статье «Прецизионное травление печатных плат»7, хлор выделяться не будет, он находится всегда в связанном состоянии.
Из приведенных данных по механизму регенерации следует, что экстракционно-электрохимическая схема несмотря на многостадийность процесса обеспечивает полную регенерацию травильного раствора.
Испытания показали минимальную величину подтрава при травлении рисунка печатных плат на комплексе Frezer Style и СЭМАР (F = 5) по сравнению с аналогичным оборудованием, предлагаемым рынком. Эксплуатация комплекса подтвердила его технические характеристики:
- Производительность по меди: до 2 кг/час.
- Точность поддержания концентрации меди в растворе травления: ± 2 г/л.
- Точность поддержания значения pH раствора: ± 0,1.
- Точность поддержания температуры в травильной машине по объему: ± 1 °C.
Опытная эксплуатация системы прецизионного травления рисунка проводников печатных плат в реальном производстве показала полную состоятельность предложенных идей для разработки системы, обеспечивающей улучшенный фактор травления, регенерацию меди и полное автоматическое управление процессом.
1 ГОСТ Р 53429‑2009. Платы печатные. Основные параметры конструкции
Основные параметры конструкции
2 Clyde F. Coombs Printed Circuits Handbook McGraw–Hill Professional, 2007
3 Печатные платы: Справочник / Под ред. К. Ф. Кумбза. Перевод с англ. М.: Техносфера, 2011
4 Jump up to: Charles A. Harper, Electronic materials and processes handbook, McGraw-Hill, 2003
5 «The Rise of High Density Interconnect PCBs – HDI PCBs».
6 Медведев А.М. Печатные платы. Процессы травления рисунка//Технологии в электронной промышленности. 2013. № 8
7 Шкундина С. Прецизионное травление печатных плат // Производство электроники: Технологии. Оборудование. Материалы. 2011. № 6
внутриклеточное преобразование сульфата меди в одноатомную медь / Блог компании ua-hosting.company / Хабр
Планету Земля часто называют колыбелью жизни, и в этом титуле совсем мало преувеличений. Жизнь можно найти и в вечнозеленых тропиках, и в знойных пустынях, и на бескрайних ледяных просторах, и даже в жерлах подводных вулканов. Как сказал Ян Малкольм в фильме «Парк Юрского периода»: «life finds a way». Ученые из Хьюстонского университета провели исследование любопытных бактерий, проживающих в шахтах Бразилии и способных преобразовывать ионы сульфата меди (CuSO4) в одноатомную нуль-валентную медь (Cu0). Чем столь интересен это процесс, и как его можно применить в мире людей? Ответы на эти вопросы мы найдем в докладе ученых. Поехали.
Жизнь можно найти и в вечнозеленых тропиках, и в знойных пустынях, и на бескрайних ледяных просторах, и даже в жерлах подводных вулканов. Как сказал Ян Малкольм в фильме «Парк Юрского периода»: «life finds a way». Ученые из Хьюстонского университета провели исследование любопытных бактерий, проживающих в шахтах Бразилии и способных преобразовывать ионы сульфата меди (CuSO4) в одноатомную нуль-валентную медь (Cu0). Чем столь интересен это процесс, и как его можно применить в мире людей? Ответы на эти вопросы мы найдем в докладе ученых. Поехали.
Основа исследования
Тяжело представить современный мир без меди. Электрические, магнитные, оптические, антимикробные и каталитические свойства позволяют применять медь во множестве отраслей, от солнечных элементов до антимикробных покрытий. При этом химический синтез одноатомной металлической меди является крайне сложным процессом, требующим инертных или восстановительных условий, а также использования токсичных реагентов.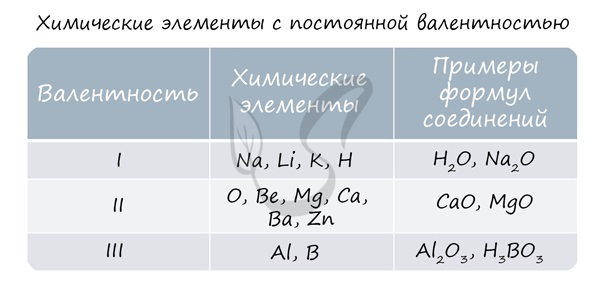 Но вот некоторые организмы способны делать это без труда.
Но вот некоторые организмы способны делать это без труда.
Недавние исследования показали, что многие микроорганизмы, такие как бактерии и грибы, могут продуцировать неорганические наночастицы (НЧ): Ag, Au, Cu, CuO, магнетит и т.д. Особенно любопытны труды, где описан синтез наночастиц меди в диапазоне от 10 до 40 нм внутри- и внеклеточно с использованием бактерий. В данном случае использовались ферменты редуктазы, такие как NADPH (восстановленная форма никотинамидадениндинуклеотидфосфата, C21H29N7O17P3), обладающих окислительно-восстановительным потенциалом для восстановления ионов металлов. Но то, как микроорганизмы естественным образом синтезируют CuO (в размере от 170 до 179 мкм), ранее было неясно.
Почему синтез одноатомной меди столь привлекателен? Дело в том, что отдельные атомы можно использовать и в катализе, и в легировании, и в энергетике. Однако, как мы уже знаем, одноатомный синтез сопряжен с рядом трудностей, среди которых необходимость в использовании токсичных реагентов.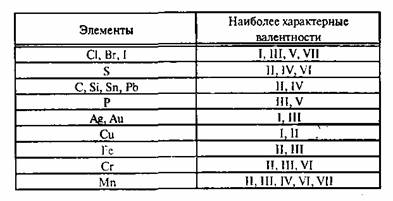 Альтернативные методы (осаждение из паровой фазы, распыление и фемтосекундная лазерная абляция) пока еще остаются малоэффективными.
Альтернативные методы (осаждение из паровой фазы, распыление и фемтосекундная лазерная абляция) пока еще остаются малоэффективными.
Именно потому ученые решили детально изучить бактерии, которые самостоятельно выполняют одноатомный синтез меди без каких-либо токсичных реагентов.
Результаты исследования
В качестве подопытных были выбраны бактерии, обитающие в рудниках Бразилии (6°27′15.848″ ю.ш. и 50°4′37.507 ″ з.д.).
Изображение №1
Обнаружение изолята из рода Bacillus, способного продуцировать одноатомную медь внутриклеточно, было зарегистрировано с помощью визуального наблюдения изменений цвета среды для роста бактерий с CuSO4 через 48 часов. Изменение цвета с зеленого (CuSO4 + бактерии) на оранжевый указывает на преобразование CuSO4 в Cu0 (1A). Дополнительным подтверждением наличия Cu0 стали результаты просвечивающей электронной микроскопии (ПЭМ), где показаны бактерии после 48 часов инкубации в сульфате меди (1B). На 1C и 1D показаны снимки бактерии с большим и меньшим увеличением соответственно. Также на 1D отчетливо видны отдельные атомы меди.
На 1C и 1D показаны снимки бактерии с большим и меньшим увеличением соответственно. Также на 1D отчетливо видны отдельные атомы меди.
Для определения габаритов атомов меди было проанализировано около 13000 атомов (1E). Радиус каждого атома находился в пределах от 1.7 до 1.85 Å. На диаграмме размаха (1F) суммированы фактическое распределение населенности и размеры всех измеренных атомов, обнаруженных на ПЭМ снимках. Более 75% атомов меди имели радиус 1.89 ± 0.19 Å. Более крупные размеры ученые рассматривают как перекрытие атомов меди на снимках, когда один атом находится слишком близко к другому.
Данные размеры говорят о том, что обнаруженные атомы это именно нейтральные атомы меди (с нулевой валентностью, Cu0). Радиусы Cu1+, Cu2+ и Cu3+ находятся в диапазоне от 0.54 до 0.63, т.е. не попадают в диапазон наблюдаемых радиусов. Это дополнительно подтверждает, что присутствующая в образцах медь это именно Cu0.
Распределение элементов в клетках было определено с помощью энергодисперсионной спектроскопии (EDS от energy dispersive spectroscopy). Молибденовая сетка гарантировала, что все медные сигналы, обнаруженные EDS, принадлежат исключительно бактериям (снимки ниже).
Изображение №2
Визуализация в режиме обратного рассеяния показывает четкий контраст между более тяжелыми и более легкими атомами, в данном случае между медью и углеродом, азотом и кислородом.
Следовательно, медь является одним из наиболее распространенных элементов в образце, а Cu0 — самым распространенным типом меди. Это было дополнительно подтверждено анализом результатов рентгеновской фотоэлектронной спектроскопии (3A).
Изображение №3
На графиках 3B и 3C показана спектроскопия характеристических потерь энергии электронами (EELS от electron energy loss spectroscopy) меди. В первом EELS спектре (3B) можно увидеть присутствие углерода, азота и кислорода, которые являются типичными компонентами органического вещества, входящего в состав бактерий.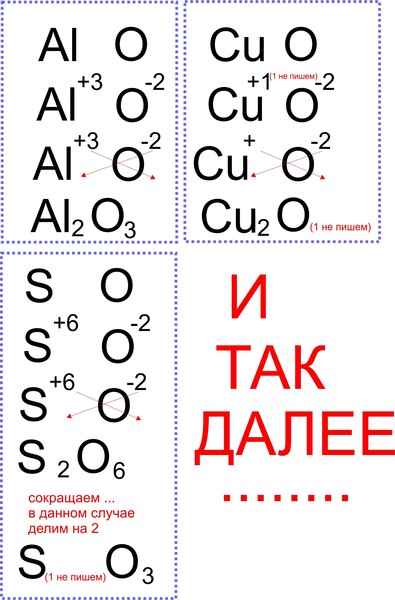 Уровень энергии для каждого из этих элементов составил: 290 эВ — углерод; 400 эВ — азот и 530 эВ — кислород.
Уровень энергии для каждого из этих элементов составил: 290 эВ — углерод; 400 эВ — азот и 530 эВ — кислород.
Медь обычно обнаруживается в диапазоне от 931 до 953 эВ. Но в данном случае обнаружить ее с помощью EELS было невозможно (3C). Ученые объясняют это толщиной одноатомной меди, что является известным ограничением этого метода. Однако с помощью EELS удалось установить, что атомы меди распространены в клетках остаточно равномерно, а вероятность их кластеров крайне мала в отличие от углерода, азота и кислорода.
На графиках 3D—3F показаны результаты рентгеновской фотоэлектронной спектроскопии C 1s, O 1s и Cu 2p на уровне ядра, полученные от меди, синтезированной Bacillus, спустя 48 часов инкубации.
Спектр C 1s (3D) представляет три компонента при 285.8, 287 и 288.9 эВ, соответствующих связям между белком/пептидами и атомарной медью. Область XPS-спектров O 1s на уровне ядра (3E) показывает максимум энергии связи при 532.8 эВ, соответствующий карбоксильным группам, которые принадлежат белкам на поверхности атомарной меди. Cu 2p показывает два пика при 932.3 и при 952.0 эВ, которые соответствуют энергиям связи 2p3/2 и 2p1/2 электронов Cu0 (3F). Эти наблюдения указывают на то, что тип меди, синтезируемой бактериями, это именно одноатомная медь, т.е. Cu0.
Cu 2p показывает два пика при 932.3 и при 952.0 эВ, которые соответствуют энергиям связи 2p3/2 и 2p1/2 электронов Cu0 (3F). Эти наблюдения указывают на то, что тип меди, синтезируемой бактериями, это именно одноатомная медь, т.е. Cu0.
Полностью удостоверившись в том, что бактерии производят одноатомную медь, ученым осталось понять, как именно это происходит.
Сначала белки бактерий идентифицировали в двух различных условиях роста: культивирование без сульфата меди (контрольная группа) и с сульфатом меди (CuSO4; 100 мг/л). В контрольной группе было зафиксировано экспрессию 652 белков, а в группе с CuSO4 — 458 белка. Из этих 458 белков 313 одинаково экспрессировались в обоих условиях роста, а 145 белков экспрессировались только в присутствии сульфата меди.
Большинство белков (102 белка) участвовали в первичном метаболизме (углерод и энергия). Следовательно, Cu влияет на клетку негативным образом, вызывая выработку большей энергии, дабы пережить это воздействие.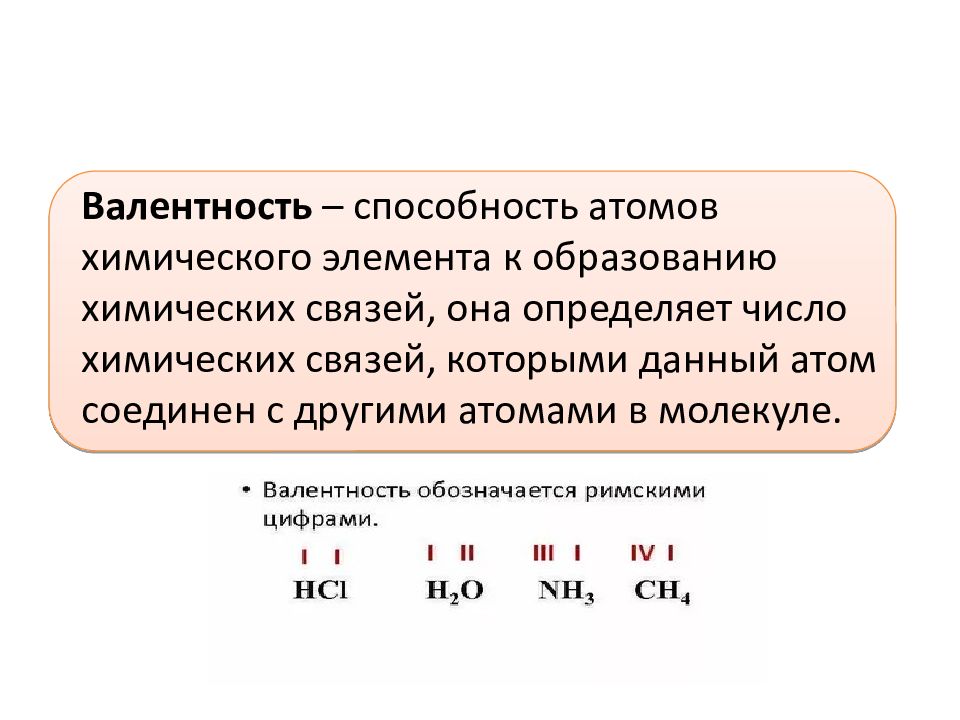 Пятнадцать белков участвовали в функциях устойчивости и стресса, а три из них выполняли функции транспорта и поглощения Cu клеткой.
Пятнадцать белков участвовали в функциях устойчивости и стресса, а три из них выполняли функции транспорта и поглощения Cu клеткой.
Среди белков, задействованных в транспорте меди, были регулируемый железом транспортер SufB, переносящая медь аденозинтрифосфатаза P-типа (ATPase) и Copz.
Copz — это шаперонный* белок, выполняющий роль внутриклеточной секвестрации (накопления) и транспорта Cu+ из цитоплазмы* в периплазму*.
Шапероны* — белки, выполняющие функцию восстановления правильной нативной третичной или четвертичной структуры белка, а также образование и диссоциация белковых комплексов.
Цитоплазма* — полужидкое содержимое клетки.
Периплазма* — обособленный компартмент клеток грамотрицательных бактерий.
Остальные 11 белков, идентифицированные в присутствии сульфата меди, были белками, которые могут участвовать в биосинтезе и стабилизации одноатомной меди. Шесть из них восстанавливают либо сульфат, либо металлы: тиолдисульфид изомераза / тиоредоксин; тиоредоксинредуктаза (TRXR), дикластер 4Fe-4S, ферредоксин 4Fe-4S, дисульфидредуктаза семейства TlpA и сульфатаденилилтрансфераза.
Учитывая функции этих белков, можно предположить, что они восстанавливают сульфат из CuSO4, оставляя свободную токсичную медь (Cu2+) внутри клеток.
Изображение №4
Продукция наночастиц Se с помощью Stenotrophomonas maltophilia показала возможную ассоциацию с алкогольдегидрогеназой. В рамках данного исследования в бактериях Bacillus были идентифицированы два белка-гомолога: NADH (восстановленная форма никотинамидадениндинуклеотида) — зависимая бутанолдегидрогеназа А и NADH-зависимая бутанолдегидрогеназа.
Подобная находка указывает на то, что белки могут участвовать в биогенном синтезе одноатомной меди. Также в бактериях были выявлены белки семейства Ferritin Dps и индуцируемый голоданием ДНК-связывающий белок (Dps от DNA binding protein). Ранее высказывалось мнение, что пути синтеза наночастиц с участием этих белков включают процессы автоокисления, гидроксилирования или восстановления. Но пока это лишь теория.
В данном труде ученые предположили, что в процессе преобразования Cu2+ в Cu0 важную роль играет белок ферритин*.
Ферритин* — сложный белковый комплекс, выполняющий роль основного внутриклеточного хранилища железа.
Вероятно, комбинация этого белка и других белков, экспрессируемых в Bacillus, в среде с добавлением сульфата меди напрямую связано с биосинтезом одноатомной меди (изображение №4).
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В данном труде ученые исследовали довольно любопытный организм — бактерию Bacillus, способную внутриклеточно синтезировать одноатомную медь (Cu0) из сульфата меди (CuSO4). Данный процесс, являющийся естественным для бактерий, крайне сложно воспроизвести с помощью даже самых современных технологий и методик. Для производства одноатомной меди люди вынуждены применять токсичные реагенты, тогда как бактерии в этом не нуждаются.
По словам авторов труда, их результаты позволяют лучше понять, как столь малые организмы способны регулировать столь сложные химические реакции. Кроме того, это исследование может стать основой для промышленного производства атомарной меди, которое будет лишено прежних недостатков, но обретет новые преимущества, такие как снижение стоимости производства.
Учитывая, что медь используется во многих направлениях (от антибактериального покрытия до электроники), подобного рода открытия действительно несут в себе немалый потенциал.
Важно отметить и то, что изученные бактерии могут быть далеко не единственными микроорганизмами, способными синтезировать одноатомные металлы, которые найдут свое применение в науке, технике и медицине.
Благодарю за внимание, оставайтесь любопытствующими и хорошей всем рабочей недели, ребята. 🙂
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
Медь – свойства, применение, характеристики медных сплавов
Медь – это пластичный металл с золотисто-розовым оттенком, занимает 29 место в периодической таблице химических элементов Д. И. Менделеева и обозначается как Cu (Cuprum). Латинское название меди пошло от острова Кипр, где в древности находились крупнейшие медные рудники.
История меди
Человечество начало добывать медь несколько тысячелетий назад. Самые древние изделия, найденные из этого металла, датируются 7-6 веками до нашей эры. Среди них – украшения, инструменты, посуда и орудия труда.
Большим шагом вперед в развитии металлургии было открытие сплава меди с оловом – бронзы. Этот материал отличался повышенной прочностью и способностью к ковке, благодаря чему все изделия из данного медного сплава получались более качественными.
На территории нашей страны медь издавна добывают на Урале, Алтае и в Сибири. Из нее отлиты известнейшие культурные памятники: Царь-пушка, Царь-колокол, Медный всадник.
Физические характеристики
Характерный цвет медь приобретает в результате взаимодействия с кислородом и образования тонкой оксидной пленки. Более тонкие пластины на просвет выглядят зеленовато-голубыми. Наиболее ярко выраженные физические свойства меди:
- высокая электро- и теплопроводность (уступает только серебру),
- мягкость,
- пластичность,
- легко поддается вытягиванию и обработке,
- коррозионная стойкость.
Из прочих характеристик меди стоит отметить хорошую невосприимчивость к внешним природным факторам (температура, ультрафиолет, химическое воздействие) и приятный внешний вид (возможность патирования). В случаях, когда необходимо использовать более твердый материал, в ход идут латунь и бронза – сплавы меди с цинком и оловом соответственно. Медная продукция обладают высокой плотностью, может прокатываться в проволоку, пруток или лист любой толщины.
Химические свойства
В условия низкой влажности медь почти не демонстрирует каких-либо особенных химических свойств. Однако при контакте с водой и углекислым газом она быстро вступает в окислительную реакцию, на ее поверхности образуется пленка, защищающая ее от разрушения. Также окисление происходит при нагреве до 375 градусов.
Металл вступает в активную реакцию с неметаллами галогеновой группы, селеном и серой. В паре с последней, к примеру, он воспламеняется. Медь с валентностью I и II участвует в создании комплексных соединений (двойных солей и аммиачных смесей), обладающих высокой стойкостью и применяемых во многих промышленных сферах.
Методы добычи
Медь добывают открытым и закрытым способом. Первый актуален, если руда находится в толще до 500 метров. Для более глубоких залежей строят специальные подземные шахты. Чистую медь получают в основном пирометаллургическим способом, реже – гидрометаллургическим.
Пирометаллургическая методика условно подразделяется на два этапа, и в качестве исходного сырья использует халькопирит (медный купорос). Первая стадия – флотация или окислительный обжиг. Целью этой технологии является обогащение медной руды, в которой повышена концентрация серы. В процессе обработки, сера удаляется до 1%, другие содержащиеся в руде металлы переводятся в оксидные соединения.
Химические формулы процесса:
- ZnS + 1.5O2 = ZnO + SO2 + Q – реакция протекает при температуре, превышающей +800 градусов;
- ZnS + 2O2 = ZnSO2 + Q – оптимальная температура варьируется в пределах +600/+700 градусов.
После этого, обогащённая руда плавится в шахтных печах при температуре + 14 500 градусов, преобразуясь в сплав, состоящий из сульфидов железа и меди (штейн). Чтобы повысить качество, проводится конвертерный обдув без подачи топлива. Содержание меди в таком сплаве составляет примерно 91%. Вторая стадия – рафинирование, после чего медная составляющая увеличивается до 99.9%.
Гидрометаллургический способ основывается на выщелачивании. Для этого руду дробят на небольшие куски, и заливают растворителями:
В результате получается раствор, в котором выделяется медь и другие металлы. Формулы процесса:
- CuO+h3SO4>CuSO4+h3O – выщелачивание серной кислотой;
- CuSO4+2Fe2SO4>4FeSO4+2CuSO+S – применение сульфата железа;
- Cu2S + 2 Fe2 (SО4)3>2 СuSO4 + 4 FeSO4 + S – выщелачивание сернокислым железом.
Полученный раствор проходит последующую обработку для извлечения металла. Например, может использоваться методика цементации: CuSО4 + Fe>FeSО4 + Cu. Здесь в состав добавляются куски железа, заменяющие медную составляющую в сернокислых солях.
Область применения
Медная плита находит широкое применение в строительстве, автомобильной, корабельной и железнодорожной промышленности.
Медный лист применяется при возведении кровель, фасадов, заборов и ограждений. А из-за бактерицидности металлической поверхности изделий из меди делают предметы для использования в больницах: двери, ручки, поручни, перила и даже посуду.
Медная труба предназначена для транспортировки жидких и воздушных сред в системах водо- и газоснабжения, отопления, кондиционирования, а также в теплообменниках и холодильных установках. Помимо бытовых инженерных коммуникаций, такие трубы применяются в судостроении и энергетике.
Медная проволока идет на производство кабельной продукции и проводов с невысоким сопротивлением и особенными магнитными свойствами.
Медная лента используется в приборостроении, электротехнике и радиоэлектронике, при изготовлении проводников, обмотков, силовых трансформаторов.
Медный пруток также нередко применяется в строительной и промышленной отрасли. Из него могут готовить подшипники, стеклоподъемники, водозапорную арматуру, декоративные конструкции в архитектуре и интерьере зданий.
Особенности популярных медных сплавов
Сплав М1 изготавливается в соответствии с ГОСТ 859-2014, является высокопластичным и хорошо обрабатываемым металлом, отличается наибольшим содержанием меди (99,9%). В качестве дополнительных элементов встречаются цинк, никель, фосфор, железо, мышьяк, кислород, олово, висмут (суммарно не более 0,1%). Удельное электрическое сопротивление составляет 0,018 мкОм. Сплав может быть двух типов – твердый (М1т) и мягкий (М1м), они различаются по пределам прочности и текучести. Металлопрокат востребован в автомобиле- и авиастроении, при создании проводников тока, криогенной техники, проволоки и прутков.
Сплав М2 имеет меньший коэффициент меди в составе (99,7%). Остальные 0,3% приходятся на никель, железо, сурьму, кислород, олово, свинец, серу, мышьяк. Данная марка пластична и не поддается ржавлению, превосходно обрабатывается под давлением и применяется для изготовления сплавов на медной основе и деталей холодильной техники.
Сплав М3 – это медь техническая, она включает наименьший процент металла среди представленных (99,5%). В качестве легирующих компонентов используются те же элементы, что и в М2, только в большей пропорции (до 0,5%), что делает этот сплав самым доступным по стоимости. Оптимально подходит для металлических изделий, которые реализуются прокатным способом, а также литейных сплавов.
Биологическая ценность для человека
Медь относится к категории жизненно-необходимых элементов, и в организме взрослого человека, содержится около 100 граммов этого металла. Переоценка токсичности данного вещества проводилась в 2003 году Всемирной Организацией Здравоохранения. Исследования установили, что медь не является причиной заболеваний пищеварительного тракта, и не провоцирует развитие болезни Вильсона-Коновалова (гепатоцеребральная дистрофия, поражающая печень и головной мозг), как считалось ранее. Учёные пришли к выводу, что для здоровья человека больше вреден недостаток меди, а не её переизбыток.
Бактерицидность меди известна давно, а последние исследования в этой области подтвердили эффективность металла в профилактике свиного гриппа, поражения золотистым стафилококком. В экспериментах было установлено, что на медной поверхности погибает 99% болезнетворных бактерий в течение 2-х часов. Поэтому медь и её сплавы широко применяется для обеззараживания воды. В Европе из этого металла изготавливаются дверные ручки, замки, петли и перила, которые устанавливаются в медучреждениях и местах общего пользования.
Электролиз. Законы Фарадея
5 Молярная масса серебра μ1 =0,108 кг/моль, его валентность z1 = 1 и электрохимический эквивалент . Найти электрохимический эквивалент золота k2, если молярная масса золота μ2 = 0,197 кг/моль, его валентность z2 = 3.
Решение:
По второму закону Фарадея имеем
отсюда электрохимический эквивалент золота
6 Найти массы веществ, выделившихся за время τ = 10 ч на катодах трех электролитических ванн, включенных последовательно в сеть постоянного тока. Аноды в ваннах — медный, никелевый и серебряный — опущены соответственно в растворы CuSO4, NiSО4 и AgNО3. Плотность тока при электролизе j=40 А/м2, площадь катода в каждой ванне S= 500 см2. Электрохимические эквиваленты меди, никеля и серебра
Решение:
Ток в ваннах I=jS. По первому закону Фарадея массы выделившихся при электролизе веществ
7 При никелировании изделий в течение времени τ = 2 ч отложился слой никеля толщины l=0,03 мм.
Найти плотность тока при электролизе. Электрохимический эквивалент никеля , его плотность
Решение:
8 Амперметр, включенный последовательно с электролитической ванной, показывает ток I0=1,5А. Какую поправку надо внести в показание амперметра, если за время τ = 10 мин на катоде отложилась масса меди m= 0,316 г? Электрохимический эквивалент меди .
Решение:
По первому закону Фарадея m = kIτ, где I-ток в цепи; отсюда I=m/kτ=1,6 А, т.е. в показание амперметра надо внести поправку
9 Желая проверить правильность показаний вольтметра, его подключили параллельно резистору с известным сопротивлением R= 30 Ом. Последовательно в общую цепь включили электролитическую ванну, в которой ведется электролиз серебра. За время τ = 5 мин в этой ванне выделилась масса серебра m = 55,6 мг. Вольтметр показывал напряжение Vo = 6 В. Найти разность между показанием вольтметра и точным значением падения напряжения на резисторе. Электрохимический эквивалент серебра .
Решение:
По первому закону Фарадея m = klτ, где I-ток в цепи. Точное значение падения напряжения на сопротивлении V=IR = mR/kτ= 4,91 В. Разность между показанием вольтметра и точным значением падения напряжения
10 Для серебрения ложек через раствор соли серебра в течение времени τ = 5 ч пропускается ток I=1,8 А. Катодом служат n=12 ложек, каждая из которых имеет площадь поверхности S=50 см2. Какой толщины слой серебра отложится на ложках? Молярная масса серебра μ = 0,108 кг/моль, его валентность z = 1 и плотность .
Решение:
Толщина слоя
11 Две электролитические ванны включены последовательно. В первой ванне находится раствор хлористого железа (FeCl2), во второй — раствор хлорного железа (FeCl3). Найти массы выделившегося железа на катодах и хлора на анодах в каждой ванне при прохождении через ванну заряда . Молярные массы железа и хлора .
Решение:
В первой ванне железо двухвалентно (z1=2), во второй — трехвалентно (z2 = 3). Поэтому при прохождении через растворы одинаковых зарядов выделяются различные массы железа на катодах: в первой ванне
во второй ванне
Так как валентность атомов хлора z=1, то на аноде каждой ванны выделяется масса хлора
квантовая химия — Сколько валентных электронов у атома меди?
квантовая химия — Сколько валентных электронов у атома меди? — Обмен химического стека
Сеть обмена стеков
Сеть Stack Exchange состоит из 176 сообществ вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру.
Посетить Stack Exchange
0
+0
- Авторизоваться
Зарегистрироваться
Chemistry Stack Exchange — это сайт вопросов и ответов для ученых, преподавателей, преподавателей и студентов в области химии.Регистрация займет всего минуту.
Зарегистрируйтесь, чтобы присоединиться к этому сообществу
Кто угодно может задать вопрос
Кто угодно может ответить
Лучшие ответы голосуются и поднимаются наверх
Спросил
Просмотрено
20к раз
$ \ begingroup $
На этот вопрос уже есть ответ :
Закрыт 5 лет назад.{10}} $. Согласно этому ответу будет 11 долларов, но разве это не должно быть 1 доллар, поскольку оболочка d уже заполнена?
Создан 28 окт.
пользователь3882522
10522 золотых знака22 серебряных знака99 бронзовых знаков
$ \ endgroup $
0
$ \ begingroup $
Да, медь имеет только 1 валентный электрон.Помните: валентные электроны включают только электроны в оболочке с наивысшей энергией (n).
Создан 29 окт.
$ \ endgroup $
1
Chemistry Stack Exchange лучше всего работает с включенным JavaScript
Ваша конфиденциальность
Нажимая «Принять все файлы cookie», вы соглашаетесь с тем, что Stack Exchange может хранить файлы cookie на вашем устройстве и раскрывать информацию в соответствии с нашей Политикой в отношении файлов cookie.
Принимать все файлы cookie
Настроить параметры
валентных электронов меди | Валентность меди (Cu) с точечной диаграммой
Здесь вы можете прочитать все о Валентных электронах меди для вашего знания.Мы также обсудим и опишем другие характеристики этого элемента в статье. Медь — один из наиболее известных химических элементов в химии. Этот элемент пользуется большой популярностью благодаря широкому применению.
Сколько валентных электронов у меди?
Медь имеет атомный номер 29 и символическое обозначение Cu. По своему составу медь имеет структуру мягкого ковкого металла. Цвет свежеоткрытой меди обычно остается оранжевым.Медь — одна из самых проводящих сред электричества.
Медь остается очень востребованной и широко используемой из-за ее высокой электропроводности. В большинстве электрических проводов и компонентов есть медь.
Медь прямо встречается в природе во многих странах мира. Кроме того, медь имеет множество применений с самых древних времен. Более того, медь даже является неотъемлемой частью человеческого тела.Это значительная часть органов человека, как дыхательные ферменты.
Электронная диаграмма валентности меди
Вы можете лучше понять валентные электроны по точечной диаграмме. Мы называем точечную диаграмму точечной диаграммой Льюиса для валентных электронов элементов. Точечная диаграмма просто представляет количество валентных электронов атомов. Он рисует точки вокруг символа меди, чтобы показать валентные электроны.
Число точек остается равным числу валентных электронов атомов.Точечная диаграмма Льюиса может помочь вам в правильном анализе валентных электронов меди.
Валентность меди
Валентность меди в общем сценарии остается либо +1, либо +2. Медь является переходным металлом, поэтому у нее нет очевидной валентности.
Металлические элементы, такие как медь, не образуют ковалентных связей. Таким образом, валентность этих элементов остается у соответствующих соединений.
Как найти валентные электроны переходных металлов?
Это не очевидно. Валентные электроны — это те, которые важны для химической связи. Для переходных металлов слово «важный» будет варьироваться в зависимости от контекста.
Проще и практичнее описать, какие орбитали являются валентными орбиталями, когда речь идет о переходных металлах (хотя с лантаноидами и актинидами это затруднительно).
В общем, переходные металлы первого ряда имеют набор валентных орбиталей, которые включают их # 4s # и # 3d #, но количество валентных электронов будет варьироваться.(2 -) #).
С другой стороны, мы, , можем легко сказать, что ОРБИТАЛИ валентности переходных металлов первого ряда являются орбиталями # 4s # и # 3d #.
В общем, я бы сказал, что количество валентных электронов для переходных металлов (а также лантаноидов и актинидов) меняется непредсказуемым образом, но валентные орбитали иногда можно предсказать с достаточной химической интуицией.
ОТКАЗ ОТ ОТВЕТСТВЕННОСТИ: Однако в целом для лантаноидов и актинидов трудно предсказать, какие орбитали являются валентными.
Например, у актинидов орбитали # 5f # и # 6d # очень близки по энергии к их орбитали # 7s #, поэтому мы можем УГАДАТЬ и включить # 7s #, # 6d # И # 5f # в валентное пространство. (даже если орбитали # 6d # пусты) при выполнении вычислений атомной энергии.
у.е. валентные электроны
Валентные электроны — это внешние электроны, которые участвуют в связывании. 39 терминов. Обеспечивает количественную индикацию реакционной способности элемента и основывается на заряде валентных электронов и ионном радиусе. Какой электрон находится на самом высоком энергетическом уровне? Подсчет d-электронов — эффективный способ понять геометрию и реакционную способность комплексов переходных металлов. Фестиваль жертвоприношений: прошлое и настоящее исламского праздника Ид аль-Адха.Атомы с 0 валентными электронами называются благородными газами и не образуют связей. Доступ онлайн: 2 декабря 2020 г. https://EnvironmentalChemistry.com/yogi/periodic/Cu.html. $ \ begingroup $ @CopperKettle, если вы определяете «валентные электроны» так, как это делает книга, цитируемая в ответе, тогда вы бы сказали: «Cu имеет один валентный электрон, но невалентные электроны участвуют в связывании».
Следовательно … Цезий не является нейтральным, потому что это не благородный газ. Общие химические соединения также предусмотрены для многих элементов.Эти частицы Cu + на поверхности Cu / Ti (He) могут более эффективно улавливать электроны, чем частицы Cu 2+ (как на поверхности Cu / Ti (UP)), потому что потенциал восстановления Cu + / Cu 0 (0,52 эВ) равен более положительный, чем у Cu 2+ / Cu 0 (0,34 эВ). Химический тест Глава 6. Медь обычно образует голубовато-зеленый раствор. На самом деле химики рассматривают только электроны на s- и p-орбиталях на энергетическом уровне, который в настоящее время заполняется, как валентные электроны. Напечатано с https://EnvironmentalChemistry.com, Расчет молярной массы и калькулятор Javascript, Двуокись азота, Озон и ведущий партнер по повышению опасности загрязнения для городских детей, Дровяные печи и бойлеры на открытом воздухе с тепловым воздействием, Рекомендации ADA по фториду в детском питании, Асбест , Краткая история его использования и рисков для здоровья, Асбест, его химические и физические свойства, Асбест: производственная опасность для здоровья, относящаяся к доисторическим временам.Медь — это химический элемент с атомным номером 29, что означает, что в атомной структуре 29 протонов и 29 электронов. Четыре электрона в атоме имеют наборы квантовых чисел, указанные ниже. Объясняются расчеты молярной массы, и есть калькулятор JavaScript для помощи в расчетах. Подсчет d электронов — это химический формализм, используемый для описания электронной конфигурации валентных электронов центра переходного металла в координационном комплексе. Глобальные тенденции в инновационных энергетических технологиях, Водородные топливные элементы: энергия будущего, от Бхопала до соответствия требованиям по опасным отходам, Love Canal NY: Взрослые не делают Blue Goo, Новый Орлеан, ураган Катрина и нефтяная промышленность, Экологическая справедливость и NIMBY Принцип.Определение валентного электрона, электрон атома, расположенный во внешней оболочке (валентной оболочке) атома, который может быть передан другому атому или разделен с ним. Электронная конфигурация для Cu, Cu + и Cu2 + (медь и ионы меди) При написании электронной конфигурации для меди первые два электрона будут двигаться на 1s-орбитали. Количество электронов в валентной оболочке определяет электрические характеристики материала. В химии и физике валентный электрон — это электрон внешней оболочки, который связан с атомом и может участвовать в образовании химической связи, если внешняя оболочка не замкнута; в одинарной ковалентной связи оба атома в связи вносят один валентный электрон для образования общей пары.Валентный электрон — это электрон, который с наибольшей вероятностью участвует в химической реакции. Его теплопроводность уступает только серебру, потому что единственный атом на своей внешней валентной орбитали легко взаимодействует, заполняя оболочку относительно стабильной конфигурацией двух электронов. ), Тайная наука разгадывания кроссвордов, расистские фразы, которые нужно удалить из своего ментального лексикона. 77 терминов. Мы отличный образовательный ресурс! На этой странице представлены исчерпывающие данные о химическом элементе Медь; включая множество свойств, названия элементов на многих языках, наиболее известные нуклиды меди.Электрический ток определяется как движение электронов. Таблица Менделеева. Он определяется уравнением: (-эВ) = kn / r. «Электроны заряжены отрицательно, а ядро имеет положительный заряд из-за протонов. ВАМ ТАКЖЕ МОЖЕТ ПОНРАВИТЬСЯ … 30 терминов. Валентные электроны — это те электроны, которые находятся во внешней оболочке, окружающей атомное ядро. Поскольку 1s может удерживать только два электрона, следующие 2 электрона для меди уходят на 2s-орбиталь. Таким образом, электронная точечная диаграмма углерода выглядит следующим образом: ПРОСТО.Эти электроны участвуют в химических реакциях, в которых участвуют фотоны, соответствующие видимому свету. Внутренним электронам для высвобождения требуется гораздо более высокая энергия, и они не участвуют в химических реакциях. Медь имеет 29 изотопов, которые имеют разное количество валентных электронов. Можно ли управлять луговыми собачками, используя экологию примирения? Например, у фтора семь валентных электронов, поэтому он, скорее всего, получит один электрон, чтобы сформировать ион с зарядом 1. Медь — мягкий, ковкий и пластичный металл с очень высокой теплопроводностью и электропроводностью.При формировании ионов элементы обычно получают или теряют минимальное количество электронов, необходимое для достижения полного октета. Для меди конфигурация немного тревожит — более стабильной конфигурацией было бы 10 электронов в трехмерной оболочке, и это… Но не намного. Медь имеет 9 3d-электронов и 2 4s-электрона, если вы следуете правилам Оффбау для размещения, но поскольку ей нужен только еще один электрон для заполнения своих d-орбиталей, она делает это, беря один с 4s-орбитали. Протоны притягивают и удерживают электроны, но чем дальше электроны, тем меньше сила притяжения.Более низкая проводимость Fe делает его менее полезным для электропроводки и кухонной посуды. Следующие шесть электронов войдут… Хорошо выглядеть, плохо себя чувствовать; или в чем проблема с Perc? Эта база данных посвящена наиболее распространенным химическим соединениям, используемым в быту и промышленности. Отвечает на многие вопросы о строении атомов. Узнать больше. Более низкая пластичность и пластичность Fe затрудняет формование проволоки или листов. Посмотреть ответ. 76 терминов. Химический символ меди — Cu. Проверка фактов: какова на самом деле власть президента над губернаторами штатов? Элемент медь имеет 11 валентных электронов, распределенных между крайними d- и s-орбиталями.Контроль луговых собачек: нелетальные методы. Больше информации. Только электроны на s- и p-орбиталях являются валентными электронами, поэтому данный атом может иметь от 0 до 7 валентных электронов. Для валентного электрона в меди квантовые числа таковы: A. Идеально подходят для учащихся средних и старших классов. Увеличивает ли кризис коронавируса передозировку наркотиков в Америке? Объяснение того, как найти количество валентных электронов для молекул. Валентная конфигурация оболочки меди отвечает за ее лучшую проводимость среди металлов.9. Определение валентного электрона — это одиночный электрон или один из двух или более электронов во внешней оболочке атома, который отвечает за химические свойства атома. Как правило, это электроны с наибольшим значением главного квантового числа n. Другой способ думать о валентных электронах — это то, что они являются самыми удаленными электронами в атоме, поэтому они наиболее восприимчивы к участию в образовании химической связи или ионизации. Элемент медь имеет 11 валентных электронов, распределенных между крайними d- и s-орбиталями.Электронная конфигурация в основном состоянии для кремния (Si) Конфигурация электронов в основном состоянии Для меди (Cu) один электрон будет… Однако обычно мы рисуем точки для двух p-электронов с разных сторон. Это демонстрируется показанным здесь принципом Ауфбау-1s 2 2s 2 2p 6 3s 2 3p 2. При добавлении электронов нижние энергетические уровни всегда заполняются первыми. Эта конфигурация 4s1 3d19 немного стабильнее, чем 4s2 3d9. … Сколько электронов находится на самом высоком занятом энергетическом уровне меди? Отличный визуальный обзор валентных электронов! Элемент медь имеет 11 валентных электронов, распределенных между крайними d- и s-орбиталями.2. Расстройства нервного развития у детей: аутизм и СДВГ, ртуть в рыбе против пользы рыбьего жира, лосось, выращиваемый на норвежских фермах, вызывает глобальную озабоченность. Повлияет ли 5G на наши планы сотовой связи (или на наше здоровье?! Луговые собачки: вид, находящийся под угрозой, или проблема общественного здравоохранения? Электроотрицательность меди Электроотрицательность меди составляет 1,9. Copyright 1995-2020 Kenneth L Barbalace (. Почему эти электроны особенные? Эти электроны) те, которые участвуют в химических реакциях, в которых участвуют фотоны, соответствующие видимому свету.Внешняя оболочка атома называется оболочкой Валентности. 5. Мы можем использовать этот метод, чтобы… Список справочных источников, используемых для компиляции данных, представленных в нашей периодической таблице элементов, можно найти на главной странице периодической таблицы. Валентные электроны меди: десять электронов во внутреннем кольце и один во внешнем кольце, что составляет одиннадцать валентных электронов. Соответственно, валентные электроны напрямую влияют на поведение элементов в химической реакции. Используйте онлайн или распечатайте страницы в качестве раздаточного материала в классе.Псевдонаука: угроза нашей окружающей среде, Закон о чистом воздухе, способствующий проблеме ртути, Дровяные печи и котлы на открытом воздухе с тепловым покрытием, Повышенный уровень ртути, связанный с промышленной деятельностью, Загрязнение окружающей среды реки Конкорд, Пластмассы — от мусорной корзины до нового продукта, RoHS : Европейская инициатива по контролю технологических отходов, химия полихлорированных дифенилов, расчет молярной массы и калькулятор молекулярной массы, стехиометрия: молярность, моляльность и нормальность, что вы делаете и не знаете о фторе, компакт-диск с плакатами USDOT HazMat и учебные модули, J .K. Barbalace, inc., Разработка веб-сайтов, плагиат, нарушение авторских прав и добросовестное использование, ремонт кухни — ожидается в 2010 или 2011 годах, луговые собачки: мелкие млекопитающие, большой спор. Fe имеет более низкую проводимость, чем Cu. 1995-2020 гг. Медь (Cu) имеет две валентности. Cu I (медь) имеет один валентный электрон, а Cu II (медь) имеет два валентных электрона. Fe имеет меньше валентных электронов, чем Cu. Fe менее податлив и пластичен, чем Cu. Вводит стехиометрию и объясняет различия между молярностью, молярностью и нормальностью.Кроме того, технические термины связаны с их определениями, а меню содержит ссылки на связанные статьи, которые очень помогают в учебе. Внутренним электронам для высвобождения требуется гораздо более высокая энергия, и они не участвуют в химических реакциях. Периодическая таблица элементов — Медь — Cu. Как обычно, мы нарисуем две точки вместе с одной стороны, чтобы представить 2s-электроны. Если вы хотите разместить ссылку на эту страницу со своего веб-сайта, блога и т. Д., Скопируйте и вставьте этот код ссылки (красный) и измените его в соответствии со своими потребностями: echo Periodic Table of Elements: Copper — Cu (EnvironmentalChemistry.com) — На этой странице представлена исчерпывающая информация об элементе Медь — Cu, включая множество свойств, названия элементов на многих языках, наиболее известные нуклиды и технические термины, связанные с их определениями. ВНИМАНИЕ: Ссылки на статьи приветствуются, НАШИ СТАТЬИ ЗАПРЕЩАЕТСЯ КОПИРОВАТЬ ИЛИ ПОВТОРНО Публикация НА ДРУГОМ ВЕБ-САЙТЕ ПРИ ЛЮБЫХ ОБСТОЯТЕЛЬСТВАХ. Сколько валентных электронов в атоме фосфора? 1. Потому что, когда два атома взаимодействуют, электроны в… валентных электронах — это электроны, расположенные на внешней оболочке атома.ПОЖАЛУЙСТА, если вам понравилась опубликованная нами статья, просто дайте ссылку на нее на нашем веб-сайте, не публикуйте ее повторно. EnvironmentalChemistry.com. … Какое максимальное количество электронов может быть размещено в атоме, в котором наибольшее значение главного квантового числа равно 4. Сколько валентных электронов имеет медь. Возможно, вы уже знаете, что электрон — это отрицательно заряженная частица атома. Поделитесь и / или дайте ссылку на эту страницу, если вы считаете ее полезной или информативной. Валентный электрон — это электрон, который «живет» в последней электронной оболочке (или валентной оболочке) атома.Глава 6-химия. Компактные люминесцентные лампы (КЛЛ): стоят ли они выключателя? Эти электроны участвуют в химических реакциях, в которых участвуют фотоны, соответствующие видимому свету. Для углерода имеется четыре валентных электрона, два в подоболочке 2s и два в подоболочке 2p. Существуют ли реалистичные альтернативы химической чистке перхоти? Сколько валентных электронов в атоме магния? химический тест 1-26-16. Проводник — это материал, через который может проходить электрический ток.
% PDF-1.2
%
6639 0 объект
>
эндобдж
xref
6639 90
0000000016 00000 н.
0000002155 00000 н.
0000002907 00000 н.
0000003167 00000 н.
0000003472 00000 н.
0000004576 00000 н.
0000004848 00000 н.
0000005128 00000 н.
0000006238 00000 п.
0000006435 00000 н.
0000006458 00000 п.
0000007384 00000 п.
0000007406 00000 н.
0000007539 00000 н.
0000007561 00000 н.
0000007842 00000 н.
0000008955 00000 н.
0000009086 00000 н.
0000009108 00000 н.
0000009238 00000 п.
0000009260 00000 н.
0000009393 00000 н.
0000009415 00000 н.
0000010525 00000 п.
0000010807 00000 п.
0000010938 00000 п.
0000010960 00000 п.
0000011092 00000 п.
0000011114 00000 п.
0000011157 00000 п.
0000011289 00000 п.
0000011311 00000 п.
0000011440 00000 п.
0000011462 00000 п.
0000011595 00000 п.
0000011617 00000 п.
0000011748 00000 п.
0000011770 00000 п.
0000011899 00000 п.
0000011921 00000 п.
0000012053 00000 п.
0000012075 00000 п.
0000012207 00000 п.
0000012229 00000 п.
0000012361 00000 п.
0000012383 00000 п.
0000012517 00000 п.
0000012539 00000 п.
0000012672 00000 п.
0000012694 00000 п.
0000012827 00000 п.
0000012851 00000 п.
0000013971 00000 п.
0000013995 00000 п.
0000023359 00000 п.
0000023382 00000 п.
0000024043 00000 п.
0000024066 00000 п.
0000024620 00000 н.
0000024644 00000 п.
0000026200 00000 н.
0000026223 00000 п.
0000026907 00000 п.
0000026930 00000 п.
0000027745 00000 п.
0000027769 00000 п.
0000030400 00000 п.
0000030423 00000 п.
0000030999 00000 н.
0000031022 00000 п.
0000031637 00000 п.
0000031660 00000 п.
0000032552 00000 п.
0000032575 00000 п.
0000033226 00000 п.
0000033249 00000 п.
0000034106 00000 п.
0000034129 00000 п.
0000034708 00000 п.
0000034731 00000 п.
0000035327 00000 п.
0000035350 00000 п.
0000036229 00000 п.
0000036252 00000 п.
0000036906 00000 п.
0000036929 00000 п.
0000037805 00000 п.
0000037828 00000 п.
0000002259 00000 н.
0000002884 00000 н.
трейлер
]
>>
startxref
0
%% EOF
6640 0 объект
>
эндобдж
6727 0 объект
>
поток
HloPŏƃ \ F] P0 TEQZL6mNwHhiS7i TЭc $ `b
l84p $
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
