Содержание
Валентность хлора fecl2, felc3 | То что Интересно!
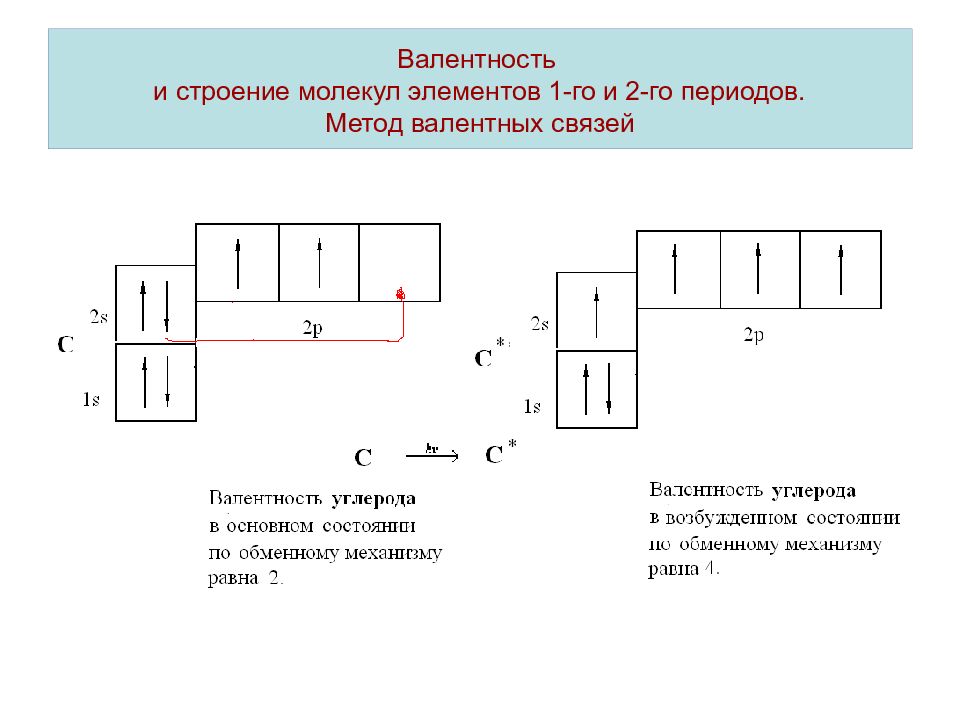
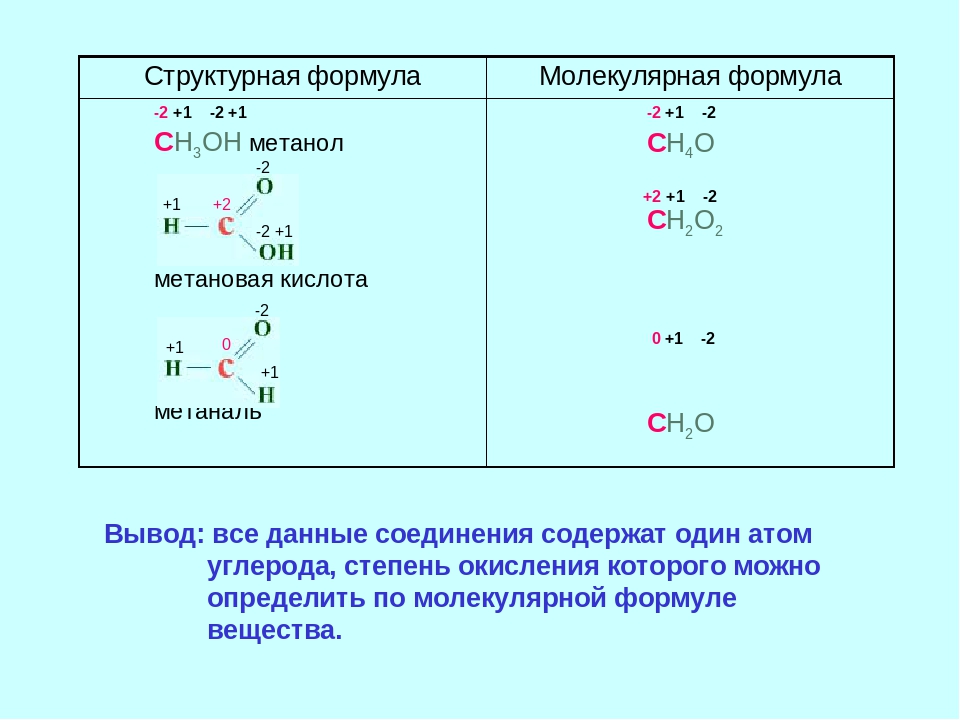
Валентностью называется способность элементов присоединять к себе другие элементы.
Т. е. валентность – это число, демонстрирующее количество элементов, которое может притянуть к себе конкретный атом. Определяется числом неспаренных электронов невозбуждённого и возбуждённого атома.
Хлор, является элементом седьмой группы главной подругппы, третьего периода периодической системы химических элементов Менделеева. Атомный номер хлора – 17. Записывается он как Cl от Chlorum. Хлор является активным неметаллом и входит в группу галогенов.
Валентность и степень окисления атомов хлора в его молекуле
Если сравнивать степень окисления с валентностью, то степень окисления является более универсальным понятием. Степень окисления характеризует ряд соединений, таких как ионная связь, химическая или металлическая, однако не зависит от вида химической связи. Степень окисления — это условный заряд на атоме в веществе.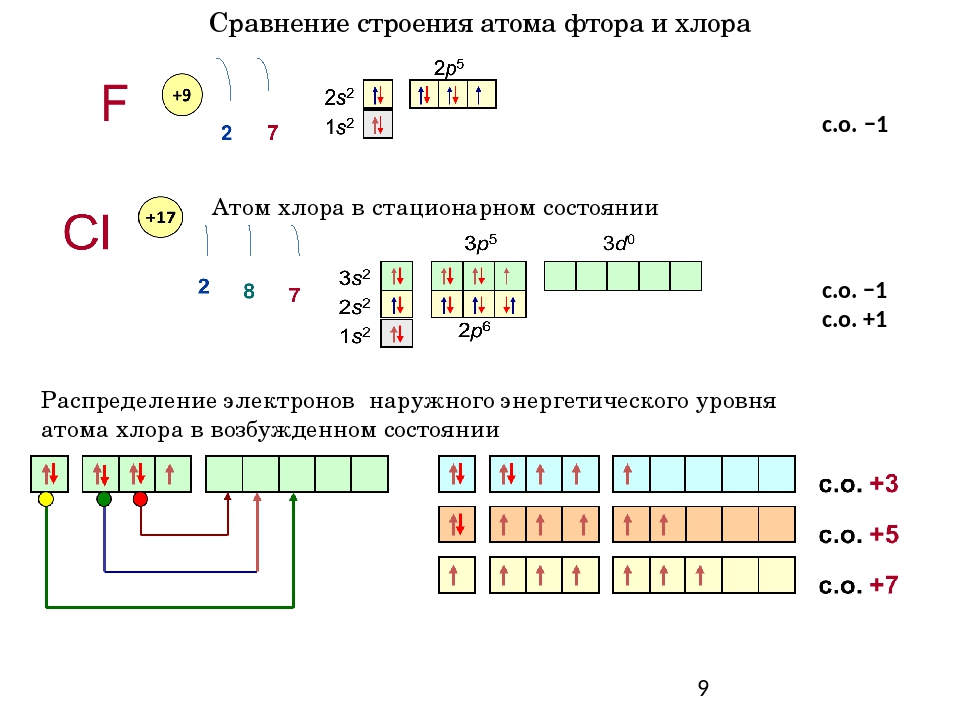 Определяют степень окисления исходя из допущения, о том, что соединение состоит исключительно из ионных связей. Степень окисления, в отличии от валентности, встречается не только положительной, но также нулевой, а порой и отрицательной.
Определяют степень окисления исходя из допущения, о том, что соединение состоит исключительно из ионных связей. Степень окисления, в отличии от валентности, встречается не только положительной, но также нулевой, а порой и отрицательной.
Степень окисления численно обозначается тем, в каком состоянии находится атом в соединении. Также её именуют окислительным числом. Определяя которое условно полагают, что в простых ковалентных соединениях значение положительной степени окисления элемента равняется количеству оттянутых от атома связывающих электронных пар, а значение отрицательной степени окисления — числом притянутых электронных пар. Поэтому, определяя степень окисления принято считать, что, соединения состоят только из положительно и отрицательно заряженных ионов.
Степень окисления — это условный заряд атома в соединении, который возник бы, если бы связи в этом соединении были бы ионными, а электроны смещены к наиболее электроотрицательному элементу.
Говоря о хлоре, его валентности и степени окисления в его молекуле, получаются следующие значения:
- Валентность – 1.
- Степень окисления — 0
Какова валентность азота фосфора кремния
Какова же валентность других веществ, нередко взаимодействующих с хлором?
- Валентность азота. Азот в таблице Менделеева обозначен буквой N. Он может существ овать в самом разном валентном виде завися от соединения. Встречается даже дробная валентность. Это можно прекрасно посмотреть на примере окисления азота: N2O — одновалентный азот (веселящий газ) NO — двухвалентный. NO2 (диоксид азота, бурый газ). Соединения азота в степени окисления +5 — оксид азота (V) N2O5, азотная кислота и её соли — нитраты, и др.
Тем не менее, валентность самого азота = 3.
- Фосфор (Р) стоит в 3-м периоде, V группы, основной подгруппы периодической системы Менделеева. Валентность фосфора также может быть разной, всё, как и с любым другим веществом, упирается в то, с каким веществом случиться химическая связь фосфора.
 Тем не менее валентность самог фосфора бывает III, V.
Тем не менее валентность самог фосфора бывает III, V. - Кремний (Si) – стоит в 3 периоде, IV группе главной подгруппы периодической системы. Валентность – 2, 4.
Валентность хлора в органических соединениях, в возбужденном состоянии, в хлороводороде, в высшем оксиде
Валентность хлора в органических соединениях может быть различной, в зависимости, собственно, от соединения.
Основные реакции хлора с органическими веществами:
- С насыщенными соединениями:
Ch4-Ch4 + Cl2 → C2H5Cl + HCl
- Присоединяется к ненасыщенным соединениям по кратным связям:
Ch3=Ch3 + Cl2 → Cl-Ch3-Ch3-Cl
- Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl3 или FeCl3):
C6H6 + Cl2 → C6H5Cl + HCl
В невозбужденном состоянии у атома хлора на 3 энергетическом уровне находится 1 неспаренный электрон, таким образом невозбужденный атом хлора может показывать валентность 1.
В возбужденном состоянии — валентность 3.
Зная валентность 1 химического элемента, всегда можно узнать валентность остальных атомов в соединении. Если атомы водорода в любое время одновалентные, то в молекуле хлороводорода HCl валентность атомов хлора также будет равняться одному, ведь атом хлора связан только с атомом водорода и не может образовывать с ним больше 1 связи.
Высшим оксидом является оксид, где элемент проявляет высшую степень окисления.
Cl2O7 — оксид хлора (VII) — ст. окисл. Cl (+7) — высший оксид.
Валентность хлора с металлами, с фосфором, с серебром, с натрием, с водородом, с кислородом, с кальцием, с алюминием, с неметаллами, с железом
Вообще валентность – одна из самых сложных тем в химии, чтобы в этом разобраться, придётся проштудировать немало материала. Не зная элементарных законов и правил химии, никто не сможет понять, что же такое валентность, а уж тем более научиться определять её.
Вообще, чтобы знать валентность того или иного вещества, достаточно просто уметь читать таблицу Менделеева, т. к. там схематически написано в сё и обо всех химических веществах. Это необходимо, чтобы решать задачи по химии и ставить опыты. Валентность всех веществ, в том числе и хлора, подчиняется строгим правилам, выучив которые, можно с лёгкостью определять валентность любого интересующего вещества.
к. там схематически написано в сё и обо всех химических веществах. Это необходимо, чтобы решать задачи по химии и ставить опыты. Валентность всех веществ, в том числе и хлора, подчиняется строгим правилам, выучив которые, можно с лёгкостью определять валентность любого интересующего вещества.
Взаимодействие с металлами:
Хлор непосредственно вступает в реакцию фактически со всеми металлами, однако для реакции с некоторыми необходима влага или нагревание.
Взаимодействие с неметаллами:
C неметаллами (кроме углерода, азота, фтора, кислорода и инертных газов), образует соответствующие хлориды.
В различных соединениях валентность хлора также различается, с металлами (серебро, натрий, железо, алюминий) валентность хлора = 1, с неметаллами имеет различную валентность, но, чаще всего, также 1. В соединениях с водородом валентность хлора = 1.
Вообще CL всегда имеет валентность 1, соединяясь с веществами, исключения составляют вещества с валентностью VII.
Укажите характерные валентности атомов следующих элементов в органических
Познач рядок у якому немає оксидів
А) СО2, Н2О, КСІ
Б) Н2, О2, Zn
B) SO2, S, KNO3
Запишите уравнения реакций.А) Mg (OH)2 + H,SO4, —Б) NaOH + FeSO4 -B) CaO+h3O
ПОМОГИТЕЕЕЕЕЕЕ!Из перечисленных суждений о чистых веществах и смесях выберите верное(-ые). 1) Гранит является чистым веществом. 2) Смесь растительного
…
масла и воды является неоднородной смесью. 3) Раствор иода, используемый для обработки ран, является смесью веществ. 4) Кефир является смесью веществ.
Заполните таблицу распределив формулы вещества SI,KCI,CO2,CAO,C,h30
Хелп плиз
5.11 даны случайные события А,В и С.Каков смысл равенства :АВС=А 2)А+В+С=A?
P2O5 —- X —— Y вниз стрелочка
В поле ответа введите химическую формулу вещества X . Используйте только латинские символы, формулу вводите без п
…
робелов и знаков препинания. Пример записи ответа: Ba3(PO4)2
В поле ответа введите химическую формулу вещества Y . Используйте только латинские символы, формулу вводите без пробелов и знаков препинания. Пример записи ответа: Ba3(PO4)2
Используйте только латинские символы, формулу вводите без пробелов и знаков препинания. Пример записи ответа: Ba3(PO4)2
срочнооооооооооооо пожалуйста даю 27 баллов
На рисунках 1-3 представлены ситуации, в которых применены некоторые из способов разделения смесей (действие магнитом, отстаивание, дистилляция (перег
…
онка), выпаривание, центрифугирование, фильтрование, кристаллизация): Каким из способов, которые показаны на рисунках, можно разделить смесь, состоящую из:1. хлорида натрия и воды2. железных и медных опилокУкажите номера рисунков, соответствующих способам, которые необходимо применить в каждом из приведенных выше примеров.Ответ должен быть вида:Смесь — Способ очистки — Номер рисунка
Расставьте коэффициенты. Сколько электронов алюминий отдает йоду в реакции Al2 + I2 = 2AlI?
Определите, какая масса и какой объем (н.у.) водорода выделятся при взаимодействии 11,7 г цинка с избытком хлороводородной кислоты? Запишите массу (в
…
граммах) водорода с точностью до сотых. Например: 50,05 Запишите объем (в литрах) водорода с точностью до тысячных. Например: 1,111
Например: 50,05 Запишите объем (в литрах) водорода с точностью до тысячных. Например: 1,111
даю 25 баллов . срочно СРОЧНО ПОЖАЛУЙСТА .
Скласти ланцюг комплементарності
АГГТТАГТЦТЦЦ
І-РНК АГГ…
Т-РНК УЦЦ…
Хлор
|
Хлор | |
|---|---|
|
Атомный номер |
17 |
|
Внешний вид простого вещества |
Газ жёлто-зеленого цвета с резким запахом. Ядовит. |
|
Свойства атома | |
|
Атомная масса (молярная масса) |
35,4527 а.е.м.(г/моль) |
|
Радиус атома |
100 пм |
|
Энергия ионизации (первый электрон) |
1254.  9(13.01) 9(13.01) кДж/моль (эВ) |
|
Электронная конфигурация |
[Ne] 3s2 3p5 |
|
Химические свойства | |
|
Ковалентный радиус |
99 пм |
|
Радиус иона |
(+7e)27 (-1e)181 пм |
|
Электроотрицательность (по Полингу) |
3.16 |
|
Электродный потенциал |
0 |
|
Степени окисления |
7, 6, 5, 4, 3, 1, −1 |
|
Термодинамические свойства простого вещества | |
|
Плотность |
(при −33.6 °C)1,56 г/см³ |
|
Молярная теплоёмкость |
21.  838 Дж/(K·моль) 838 Дж/(K·моль) |
|
Теплопроводность |
0.009 Вт/(м·K) |
|
Температура плавления |
172.2 K |
|
Теплота плавления |
6.41 кДж/моль |
|
Температура кипения |
238.6 K |
|
Теплота испарения |
20.41 кДж/моль |
|
Молярный объём |
18.7 см³/моль |
|
Кристаллическая решётка простого вещества | |
|
Структура решётки |
орторомбическая |
|
Параметры решётки |
a=6,29 b=4,50 c=8,21 Å |
|
Отношение c/a |
— |
|
Температура Дебая |
n/a K |
|
CI |
17 |
|
35,4527 | |
|
[Ne]3s23p5 | |
|
Хлор | |
Хлор (χλωρός — зелёный) — элемент главной подгруппы седьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 17. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов (первоначально название «галоген» использовал немецкий химик Швейгер для хлора [дословно «галоген» переводится как солерод], но оно не прижилось, и впоследствии стало общим для VII группы элементов, в которую входит и хлор).
И. Менделеева, с атомным номером 17. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов (первоначально название «галоген» использовал немецкий химик Швейгер для хлора [дословно «галоген» переводится как солерод], но оно не прижилось, и впоследствии стало общим для VII группы элементов, в которую входит и хлор).
Простое вещество хлор (CAS-номер: 7782-50-5) при нормальных условиях — ядовитый газ желтовато-зелёного цвета, с резким запахом. Молекула хлора двухатомная (формула Cl2).
Схема атома хлора
Впервые хлор был получен в 1772 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
-
4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты. Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
Распространение в природе
В природе встречаются два изотопа хлора 35Cl и 37Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCI, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6h3O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
На долю хлора приходится 0,025 % от общего числа атомов земной коры, кларковое число хлора — 0,19%, а человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
Изотопный состав
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37. Доли их содержания соответственно равны 75,78 % и 24,22 %.
|
Изотоп |
Относительная масса, а.е.м. |
Период полураспада |
Тип распада |
Ядерный спин |
|---|---|---|---|---|
|
35Cl |
34.968852721 |
Стабилен |
— |
3/2 |
|
36Cl |
35.  9683069 9683069 |
301000 лет |
β-распад в 36Ar |
0 |
|
37Cl |
36.96590262 |
Стабилен |
— |
3/2 |
|
38Cl |
37.9680106 |
37,2 минуты |
β-распад в 38Ar |
2 |
|
39Cl |
38.968009 |
55,6 минуты |
β-распад в 39Ar |
3/2 |
|
40Cl |
39.97042 |
1,38 минуты |
β-распад в 40Ar |
2 |
|
41Cl |
40.  9707 9707 |
34 c |
β-распад в 41Ar |
|
|
42Cl |
41.9732 |
46,8 c |
β-распад в 42Ar |
|
|
43Cl |
42.9742 |
3,3 c |
β-распад в 43Ar |
|
Физические и физико-химические свойства
При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Некоторые его физические свойства представлены в таблице.
Некоторые физические свойства хлора
|
Свойство |
Значение |
|---|---|
|
Температура кипения |
−34 °C |
|
Температура плавления |
−101 °C |
|
Температура разложения (диссоциации на атомы) |
~1400°С |
|
Плотность (газ, н. 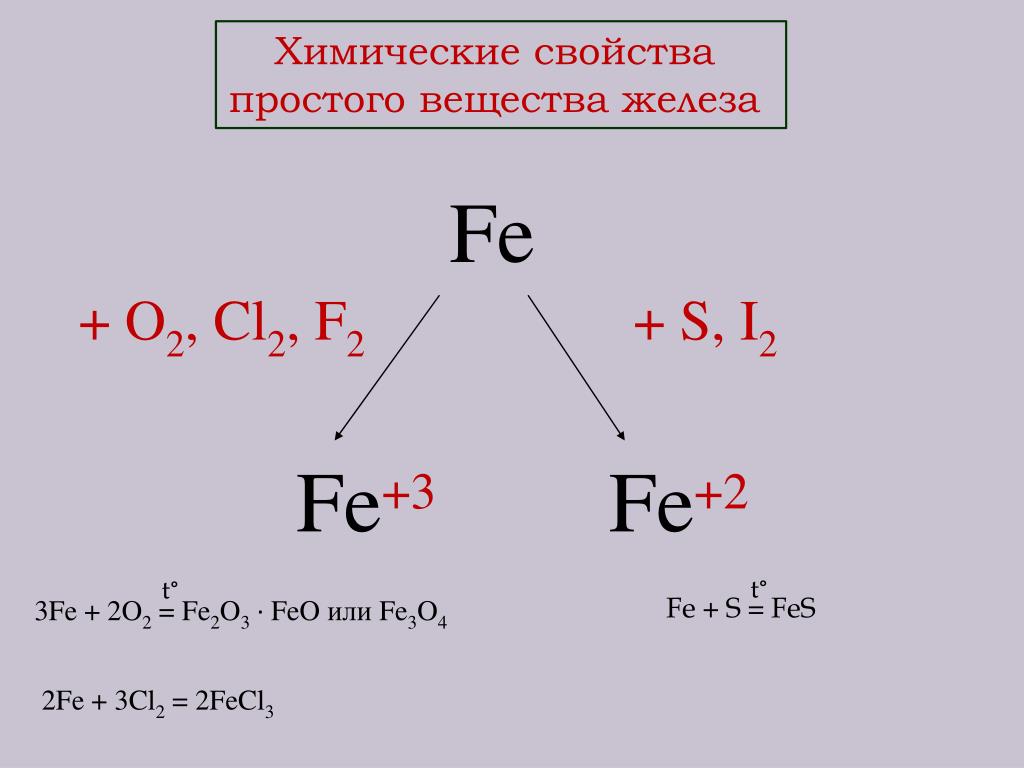 у.) у.) |
3,214 г/л |
|
Сродство к электрону атома |
3,65 эВ |
|
Первая энергия ионизации |
12,97 эВ |
|
Теплоемкость (298 К, газ) |
34,94 (Дж/моль·K) |
|
Критическая температура |
144 °C |
|
Критическое давление |
76 атм |
|
Стандартная энтальпия образования (298 К, газ) |
0 (кДж/моль) |
|
Стандартная энтропия образования (298 К, газ) |
222,9 (Дж/моль·K) |
|
Энтальпия плавления |
6,406 (кДж/моль) |
|
Энтальпия кипения |
20,41 (кДж/моль) |
При охлаждении хлор превращается в жидкость при температуре около 239 К, а затем ниже 113 К кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a=6,29 Å b=4,50 Å, c=8,21 Å. Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a=8,56 Å и c=6,12 Å.
Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a=8,56 Å и c=6,12 Å.
Растворимость
|
Растворитель |
Растворимость г/100 г |
|---|---|
|
Бензол |
Растворим |
|
Вода (0 °C) |
1,48 |
|
Вода (20 °C) |
0,96 |
|
Вода (25 °C) |
0,65 |
|
Вода (40 °C) |
0,46 |
|
Вода (60 °C) |
0,38 |
|
Вода (80 °C) |
0,22 |
|
Тетрахлорметан (0 °C) |
31,4 |
|
Тетрахлорметан (19 °C) |
17,61 |
|
Тетрахлорметан (40 °C) |
11 |
|
Хлороформ |
Хорошо растворим |
|
TiCl4, SiCl4, SnCl4 |
Растворим |
Степень диссоциации молекулы хлора Cl2 → 2Cl.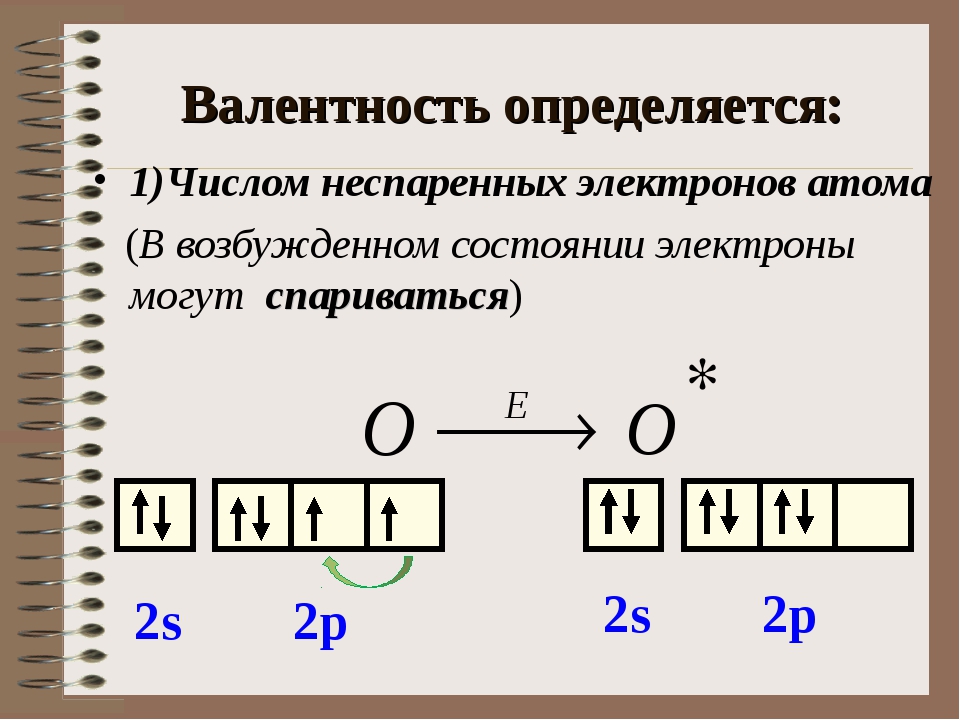 При 1000 К равна 2,07*10-4%, а при 2500 К 0,909 %.
При 1000 К равна 2,07*10-4%, а при 2500 К 0,909 %.
Порог восприятия запаха в воздухе равен 0,003 (мг/л).
В реестре CAS — номер 7782-50-5.
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хуже серебра. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
Химические свойства
Строение электронной оболочки
На валентном уровне атома хлора содержится 1 неспаренный электрон: 1S² 2S² 2p6 3S² 3p5, поэтому валентность равная 1 для атома хлора очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и другие валентности. Схема образования возбуждённых состояний атома:
Также известны соединения хлора, в которых атом хлора формально проявляет валентность 4 и 6, например ClO2 и Cl2O6. Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Взаимодействие с металлами
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
-
Cl2 + 2Na → 2NaCl -
3Cl2 + 2Sb → 2SbCl3 -
3Cl2 + 2Fe → 2FeCl3
Взаимодействие с неметаллами
C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды.
На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованием хлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C. :
:
-
Cl2 + H2 → 2HCl -
5Cl2 + 2P → 2PCl5 -
2S + Cl2 → S2Cl2
С кислородом хлор образует оксиды в которых он проявляет степень окисления от +1 до +7: Cl2O, ClO2, Cl2O6, Cl2O7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
При реакции с фтором, образуется не хлорид, а фторид:
-
Cl2 + 3F2 (изб.) → 2ClF3
Другие свойства
Хлор вытесняет бром и иод из их соединений с водородом и металлами:
-
Cl2 + 2HBr → Br2 + 2HCl -
Cl2 + 2NaI → I2 + 2NaCl
При реакции с монооксидом углерода образуется фосген:
-
Cl2 + CO → COCl2
При растворении в воде или щелочах, хлор дисмутирует, образуя хлорноватистую (а при нагревании хлорную) и соляную кислоты, либо их соли:
-
Cl2 + H2O → HCl + HClO -
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
Хлорированием сухого гидроксида кальция получают хлорную известь:
-
Cl2 + Ca(OH)2 → CaCl(OCl) + H2O
Действие хлора на аммиак можно получить трёххлористый азот:
-
4NH3 + 3Cl2 → NCl3 + 3NH4Cl
Окислительные свойства хлора
Хлор очень сильный окислитель.
-
Cl2 + H2S → 2HCl + S
Реакции с органическими веществами
С насыщенными соединениями:
-
CH3-CH3 + Cl2 → C2H6-xClx + HCl
Присоединяется к ненасыщенным соединениям по кратным связям:
-
CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl3 или FeCl3):
-
C6H6 + Cl2 → C6H5Cl + HCl
Хлор способы получения хлора
Промышленные методы
Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой:
-
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
-
4HCl + O2 → 2H2O + 2Cl2
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли:
-
2NaCl + 2H2О → H2↑ + Cl2↑ + 2NaOH -
Анод: 2Cl— — 2е— → Cl20↑ -
Катод: 2H2O + 2e— → H2↑ + 2OH—
Так как параллельно электролизу хлорида натрия проходит процесс электролиз воды, то суммарное уравнение можно выразить следующим образом:
-
1,80 NaCl + 0,50 H2O → 1,00 Cl2↑ + 1,10 NaOH + 0,03 H2↑
Применяется три варианта электрохимического метода получения хлора.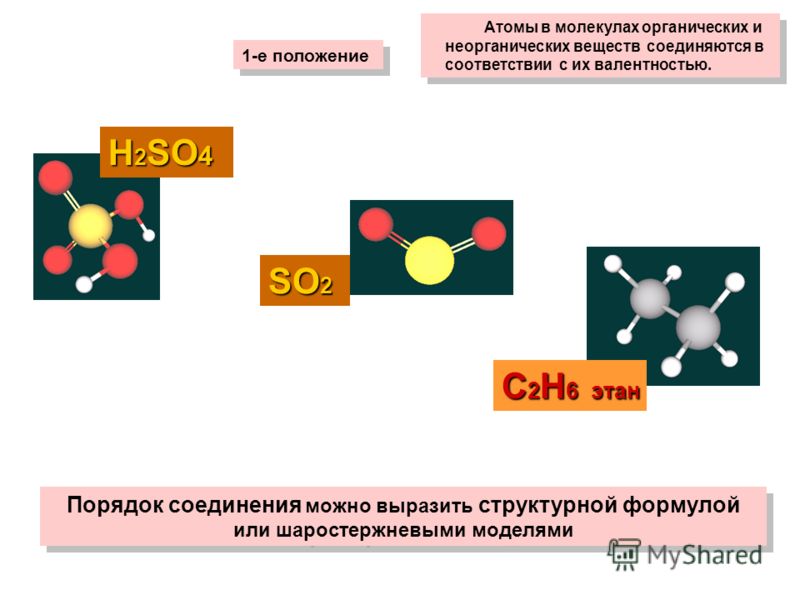 Два из них электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути.
Два из них электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути.
Диафрагменный метод с твердым катодом
Полость электролизера разделена пористой асбестовой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом. В анодное пространство диафрагменного электролизера непрерывно поступает поток насыщенного анолита (раствора NaCl). В результате электрохимического процесса на аноде за счёт разложения галита выделяется хлор, а на катоде за счёт разложения воды — водород. При этом прикатодная зона обогащается гидроксидом натрия.
Мембранный метод с твердым катодом
Мембранный метод по сути, аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной полимерной мембраной. Мембранный метод производства эффективнее, чем диафрагменный, но сложнее в применении.
Ртутный метод с жидким катодом
Процесс проводят в электролитической ванне, которая состоит из электролизера, разлагателя и ртутного насоса, объединённых между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизера служит поток ртути. Аноды — графитовые или малоизнашивающиеся. Вместе с ртутью через электролизер непрерывно течет поток анолита — раствора хлорида натрия. В результате электрохимического разложения хлорида на аноде образуются молекулы хлора, а на катоде выделившийся натрий растворяется в ртути образуя амальгаму.
Лабораторные методы
В лабораториях для получения хлора обычно используют процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия):
-
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ +8H2O -
K2Cr2O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2O
Хранение хлора
Производимый хлор хранится в специальных «танках» или закачивается в стальные баллоны высокого давления.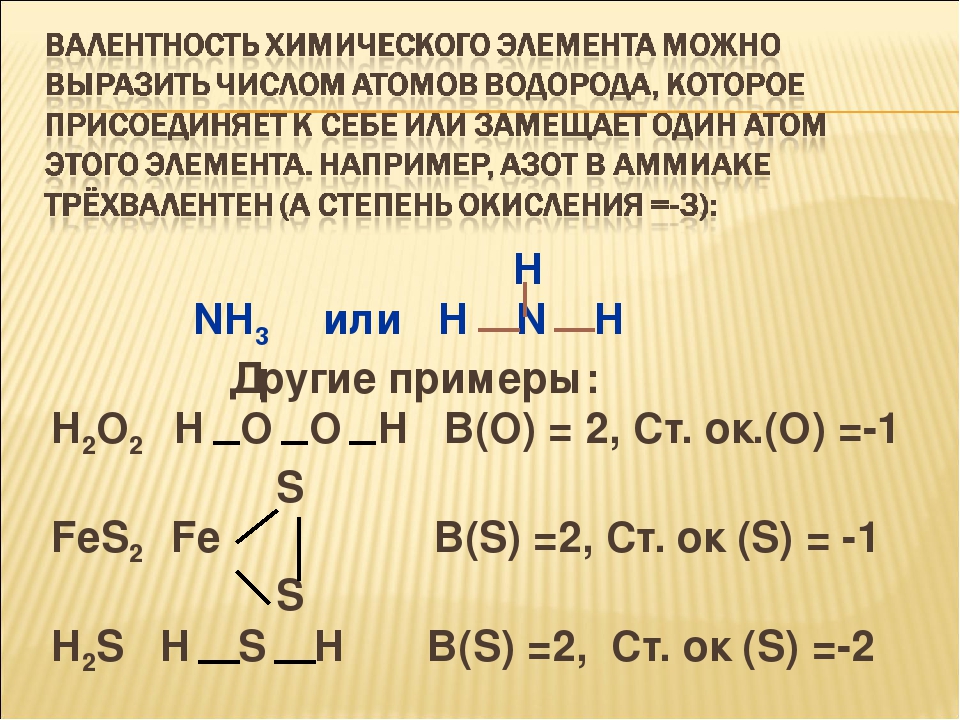 Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Стандарты качества хлора
Согласно ГОСТ 6718-93 «Хлор жидкий. Технические условия» производятся следующие сорта хлора
|
Наименование показателя ГОСТ 6718-93 |
Высший сорт |
Первый сорт |
|---|---|---|
|
Объемная доля хлора, не менее, % |
99,8 |
99,6 |
|
Массовая доля воды, не более, % |
0,01 |
0,04 |
|
Массовая доля треххлористого азота, не более, % |
0,002 |
0,004 |
|
Массовая доля нелетучего остатка, не более, % |
0,015 |
0,10 |
Применение
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:
-
В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы. Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан.
Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан. -
Отбеливающие свойства хлора известны с давних времен, хотя не сам хлор «отбеливает», а атомарный кислород, который образуется при распаде хлорноватистой кислоты: Cl2 + H2O → HCl + HClO → 2HCl + O•. Этот способ отбеливания тканей, бумаги, картона используется уже несколько веков. -
Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасные для растений. На получение средств защиты растений расходуется значительная часть производимого хлора. Один из самых важных инсектицидов — гексахлорциклогексан (часто называемый гексахлораном). Это вещество впервые синтезировано ещё в 1825 г. Фарадеем, но практическое применение нашло только через 100 с лишним лет — в 30-х годах нашего столетия. -
Использовался как боевое отравляющее вещество, а так же для производства других боевых отравляющих веществ: иприт, фосген.
-
Для обеззараживания воды — «хлорирования». Наиболее распространённый способ обеззараживания питьевой воды; основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов катализирующие окислительно-восстановительные процессы. Для обеззараживания питьевой воды применяют: хлор, двуокись хлора, хлорамин и хлорную известь. СанПиН 2.1.4.1074-01 устанавливает следующие пределы (коридор)допустимого содержания свободного остаточного хлора в питьевой воде централизованного водоснабжения 0.3 — 0.5 мг/л. Ряд учёных и даже политиков в России критикуют саму концепцию хлорирования водопроводной воды, но альтернативы дезинфицирующему последействию соединений хлора предложить не могут. Материалы, из которых изготовлены водопроводные трубы, по разному взаимодействуют с хлорированной водопроводной водой. Свободный хлор в водопроводной воде существенно сокращает срок службы трубопроводов на основе полиолефинов: полиэтиленовых труб различного вида, в том числе сшитого полиэтилена, большие известного как ПЕКС (PEX, PE-X). В США для контроля допуска трубопроводов из полимерных материалов к использованию в водопроводах с хлорированной водой вынуждены были принять 3 стандарта: ASTM F2023 применительно к трубам из сшитого полиэтилена (PEX) и горячей хлорированной воде, ASTM F2263 применительно к полиэтиленовым трубам всем и хлорированной воде и ASTM F2330 применительно к многослойным (металлополимерным) трубам и горячей хлорированной воде. Положительную реакцию в части долговечности при взаимодействии с хлорированной водой демонстрируют медные трубы.
В США для контроля допуска трубопроводов из полимерных материалов к использованию в водопроводах с хлорированной водой вынуждены были принять 3 стандарта: ASTM F2023 применительно к трубам из сшитого полиэтилена (PEX) и горячей хлорированной воде, ASTM F2263 применительно к полиэтиленовым трубам всем и хлорированной воде и ASTM F2330 применительно к многослойным (металлополимерным) трубам и горячей хлорированной воде. Положительную реакцию в части долговечности при взаимодействии с хлорированной водой демонстрируют медные трубы. -
В пищевой промышленности зарегистрирован в качестве пищевой добавки E925. -
В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений. -
В металлургии для производства чистых металлов: титана, олова, тантала, ниобия. -
Как индикатор солнечных нейтрино в хлор-аргонных детекторах.
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.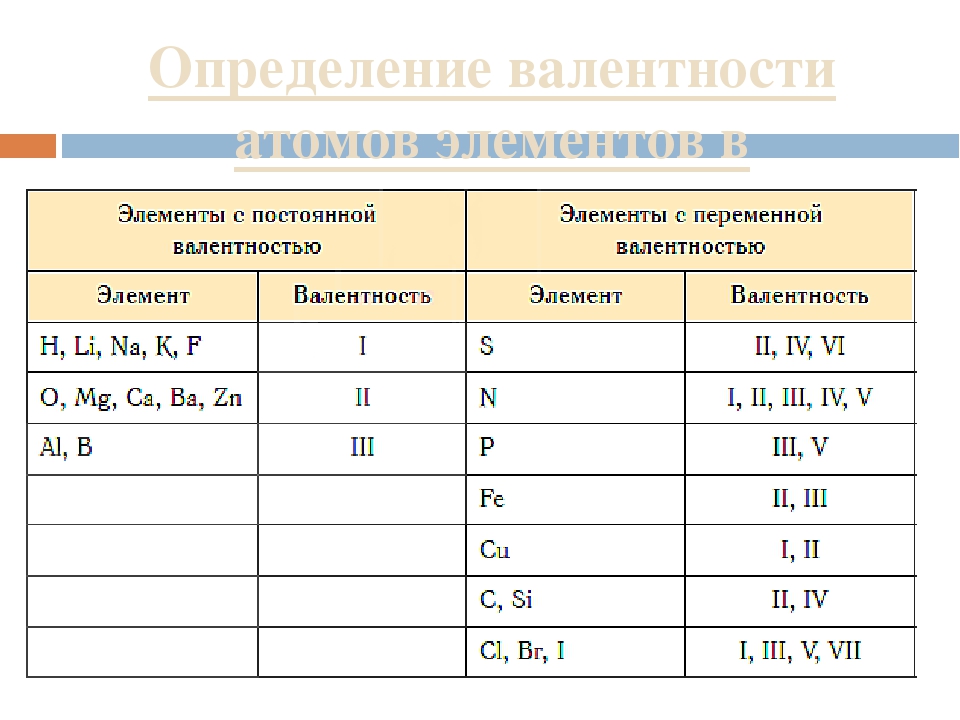
Биологическая роль хлора
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов.
У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании постоянного осмотического давления и регуляции водно-солевого обмена. Под воздействием ГАМК (нейромедиатор) ионы хлора оказывают тормозящий эффект на нейроны путём снижения потенциала действия. В желудке ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока. Хлорные каналы представлены во многих типах клеток, митохондриальных мембранах и скелетных мышцах. Эти каналы выполняют важные функции в регуляции объёма жидкости, трансэпителиальном транспорте ионов и стабилизации мембранных потенциалов, участвуют в поддержании рН клеток. Хлор накапливается в висцеральной ткани, коже и скелетных мышцах. Всасывается хлор, в основном, в толстом кишечнике. Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na+/K+ — АТФ-азы. В клетках аккумулируется 10-15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах. Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90-95 %), калом (4-8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно с HCO3— (кислотно-щелочной баланс).
Всасывается хлор, в основном, в толстом кишечнике. Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na+/K+ — АТФ-азы. В клетках аккумулируется 10-15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах. Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90-95 %), калом (4-8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно с HCO3— (кислотно-щелочной баланс).
Человек потребляет 5-10 г NaCl в сутки. Минимальная потребность человека в хлоре составляет около 800 мг в сутки. Младенец получает необходимое количество хлора через молоко матери, в котором содержится 11 ммоль/л хлора. NaCl необходим для выработки в желудке соляной кислоты, которая способствует пищеварению и уничтожению болезнетворных бактерий. В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований. Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20-0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20-0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений, активируя окислительное фосфорилирование. Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами, стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии. Хлор положительно влияет на поглощение корнями кислорода, соединений калия, кальция, магния. Чрезмерная концентрация ионов хлора в растениях может иметь и отрицательную сторону, например, снижать содержание хлорофилла, уменьшать активность фотосинтеза, задерживать рост и развитие растений.
Но существуют растения, которые в процессе эволюции либо приспособились к засолению почв, либо в борьбе за пространство заняли пустующие солончаки на которых нет конкуренции. Растения произрастающие на засоленных почвах называются — галофиты, они накапливают хлориды в течение вегетационного сезона, а потом избавляются от излишков посредством листопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду притеняя поверхнисти от солнечного света. В России галофиты произрастают на соляных куполах, выходах соляных отложений и засоленных понижениях вокруг соляных озёр Баскунчак, Эльтон.
Растения произрастающие на засоленных почвах называются — галофиты, они накапливают хлориды в течение вегетационного сезона, а потом избавляются от излишков посредством листопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду притеняя поверхнисти от солнечного света. В России галофиты произрастают на соляных куполах, выходах соляных отложений и засоленных понижениях вокруг соляных озёр Баскунчак, Эльтон.
Среди микроорганизмов, так же известны галофилы — галобактерии — которые обитают в сильносоленых водах или почвах.
Особенности работы и меры предосторожности
Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.
На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.
ПДК хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,1 мг/м³; в рабочих помещениях промышленного предприятия — 1 мг/м³.
Дополнительная информация
Производство хлора в России
Хлорид золота
Хлорная вода
Хлорная известь
Хлорид первого основания Рейзе
Хлорид второго основания Рейзе
Соединения хлора
Гипохлориты
Перхлораты
Хлорангидриды
Хлораты
Хлориды
Хлорорганические соединения
Анализ хлора, выявление хлора — анализируется
— При помощи аналитического лабораторного оборудования, лабораторных и промышленных электродов, в частности: электродов сравнения ЭСр-10101 анализирующих содержание Cl— и К+.
Хлорные запросы, нас находят по запросам хлор
Взаимодействие, отравление, воде, реакции и получение хлора
-
оксид -
раствор -
кислоты -
соединения -
свойства -
определение -
диоксид -
атом -
формула -
масса -
активный -
жидкий -
вещество -
применение -
действие -
степень окисления -
соли -
гидроксид
Строение органических веществ — урок. Химия, 8–9 класс.
Атомы углерода отличаются от атомов других элементов тем, что способны образовывать устойчивые химические связи друг с другом. Они могут связываться в цепи разной длины.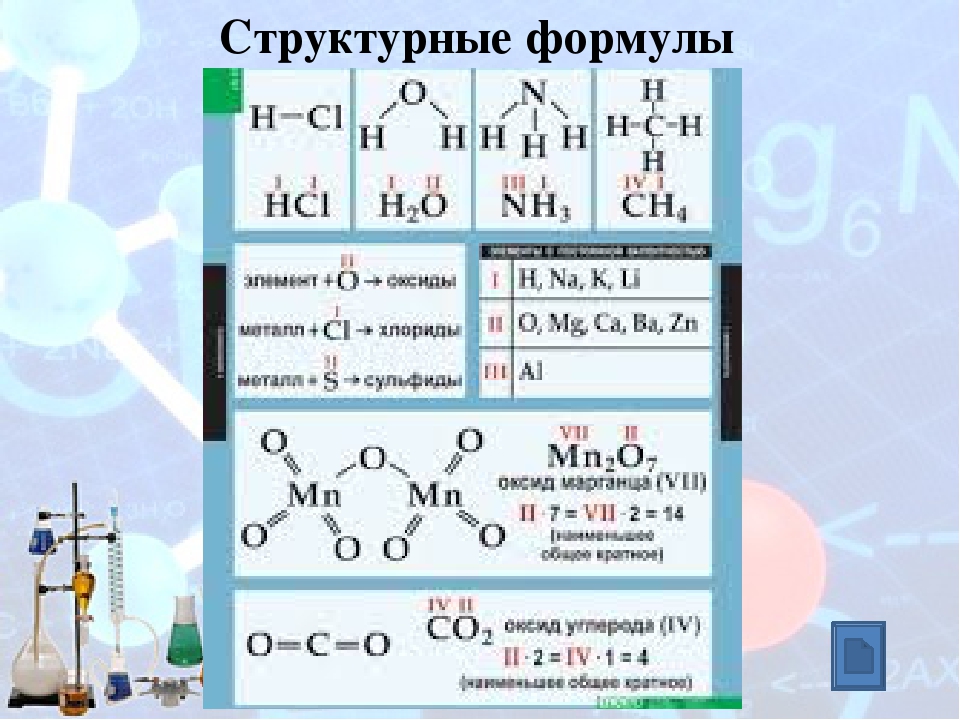 Цепи бывают линейные и разветвлённые. Атомы углерода соединяются также в циклы разной величины.
Цепи бывают линейные и разветвлённые. Атомы углерода соединяются также в циклы разной величины.
Между атомами углерода могут образовываться одинарные, двойные и тройные связи.
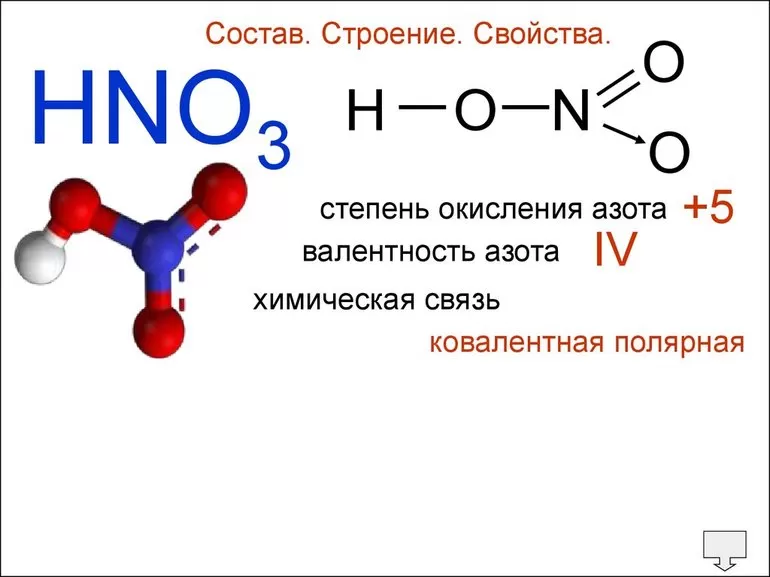
Молекулы органических веществ состоят обычно из атомов неметаллов, поэтому в них присутствуют ковалентные связи. Число ковалентных связей, которые образует атом, определяет его валентность.
В основе органической химии лежит теория химического строения органических веществ А. М. Бутлерова. Её основные положения:
Атомы в молекулах органических веществ соединены в определённом порядке в соответствии с их валентностью.
Углерод в органических соединениях всегда четырёхвалентен, кислород — двухвалентен, а водород и галогены — одновалентны.
В молекуле метилового спирта атом углерода соединён ковалентными связями с четырьмя другими атомами, атом кислорода — с двумя, а каждый атом водорода образует одну ковалентную связь.
Свойства веществ зависят не только от состава молекул, но и от порядка соединения атомов в них,
т. е. от химического строения.
Рассмотрим второе положение на примере вещества, имеющего состав: C2h5Cl2.
Состав веществ одинаковый, а порядок соединения атомов в них разный. В молекуле первого вещества атомы хлора соединены с разными атомами углерода, а в молекуле второго — с одним. Свойства веществ отличаются. Так, температура кипения первого вещества — \(–96,7\) °С, а второго — \(–42,0\) °С.
При составлении структурных формул органических веществ сначала записывают символы углерода, связывая их между собой; затем с учётом четырёхвалентности атома углерода записывают символы других элементов.
Структурная формула углеводорода, состоящего из трёх атомов углерода и восьми атомов водорода, строится следующим образом:
Источники:
Габриелян О.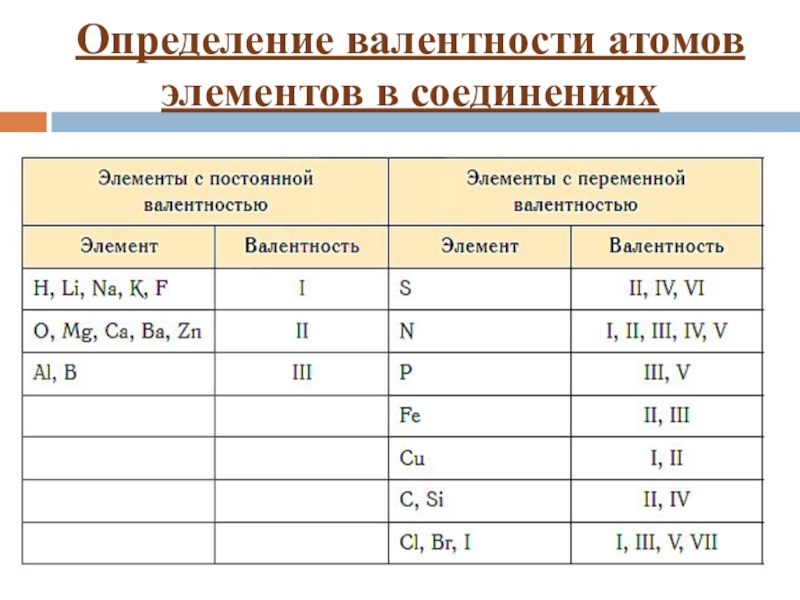 С. Химия. 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2011. — 193 с.
С. Химия. 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2011. — 193 с.
Приемная комиссия БГМУ
ПРОГРАММЫ ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ ДЛЯ ПОСТУПАЮЩИХ В БГМУ
ПРОГРАММА ПО ХИМИИ
Общие указания
На экзамене по химии поступающий в ВУЗ должен:
— показать знание основных теоретических положений химии как одной из важнейших естественных наук, лежащих в основе научного понимания природы;
— уметь применять теоретические положения химии при рассмотрении классов неорганических и органических веществ и их соединений;
— уметь раскрывать зависимость свойств веществ от их состава и строения;
— знать свойства важнейших веществ, применяемых в народном хозяйстве и в быту;
— понимать научные принципы важнейших химических производств (не углубляясь в детали устройства различной аппаратуры)
— решать типовые и комбинированные задачи по основным разделам химии.
На экзамене можно пользоваться следующими таблицами:
— «Периодическая система химических элементов Д.И.Менделеева»,
— «Растворимость оснований, кислот и солей в воде»,
— «Электрохимический ряд стандартных электродных потенциалов».
При решении задач разрешается пользоваться калькулятором.
Теоретические основы химии.
Предмет и задачи химии. Место химии среди естественных наук.
1. Основные понятия химии.
Основы атомно-молекулярного учения. Понятие атома, элемента, вещества. Простое вещество, сложное вещество. Понятие об аллотропных модификациях. Относительная атомная и относительная молекулярная масса. Стехиометрия: закон сохранения массы вещества, постоянство состава. Моль. Молярная масса. Закон Авогадро и его следствие. Уравнение Менделеева-Клапейрона. Явления физические и химические. Валентность и степень окисления.
2. Периодический закон и периодическая система элементов Д. И. Менделеева. Строение атома. Химическая связь. Строение вещества.
И. Менделеева. Строение атома. Химическая связь. Строение вещества.
Строение ядер и электронных оболочек атомов химических элементов (s-, p-, d-элементов). Периодический закон химических элементов Д.И. Менделеева и строение периодической системы. Изотопы. Характеристика отдельных химических элементов главных подгрупп на основании положения в периодической системе и строения атома. Значение периодического закона для понимания научной картины мира, развития науки и техники.
Виды химической связи: Ковалентная (полярная и неполярная), ионная, металлическая, водородная. Механизм образования и примеры соединений. Модель гибридизации орбиталей. Агрегатные состояния веществ, вещества аморфные и кристаллические. Типы кристаллических решеток.
3. Основные закономерности протекания химических реакций.
Классификация химических реакций: реакции соединения, разложения, замещения, ионного обмена. Окислительно–восстановительные реакции, важнейшие окислители и восстановители.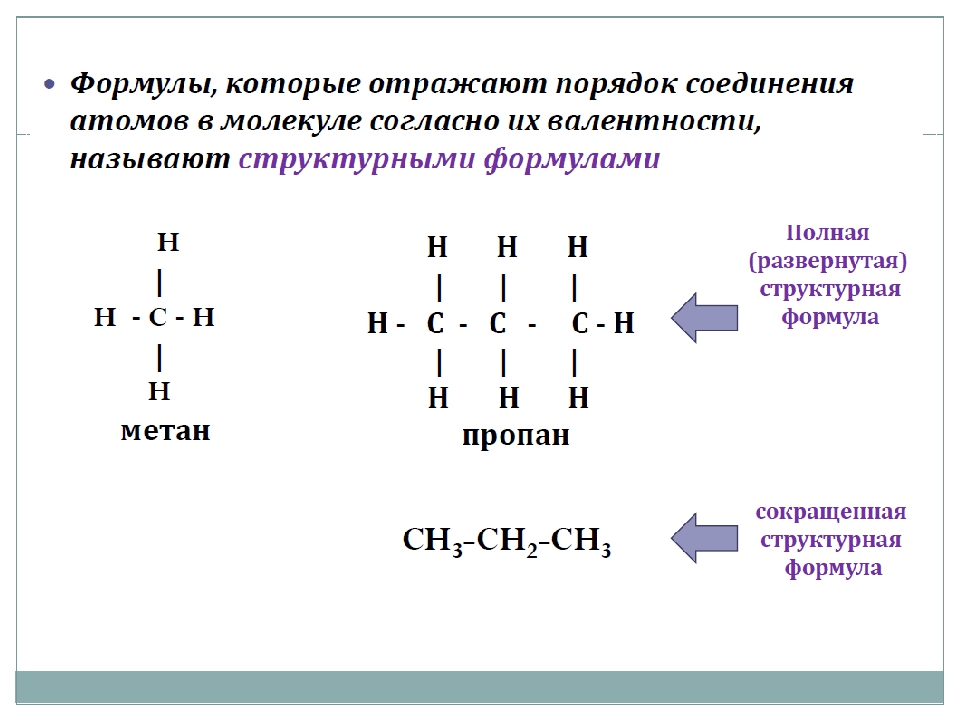 Электролиз. Тепловые эффекты химических реакций. Термохимические уравнения. Закон Гесса и следствия из него. Скорость химических реакций. Зависимости скорости от природы реагирующих веществ, концентрации, температуры. Катализ. Обратимость химических реакций. Химическое равновесие и условия его смещения.
Электролиз. Тепловые эффекты химических реакций. Термохимические уравнения. Закон Гесса и следствия из него. Скорость химических реакций. Зависимости скорости от природы реагирующих веществ, концентрации, температуры. Катализ. Обратимость химических реакций. Химическое равновесие и условия его смещения.
4. Растворы. Электролитическая диссоциация.
Растворы. Растворимость веществ. Зависимость растворимости веществ от их природы, температуры, давления. Типы растворов. Выражение состава раствора (массовая доля, объемная доля, молярная концентрация). Значение растворов в промышленности, медицине, быту. Электролитическая диссоциация. Степень диссоциации. Сильные и слабые электролиты. Ионные уравнения реакций.
Неорганическая химия.
1. Основные классы неорганических соединений.
Оксиды, кислоты, гидроксиды, соли: классификация, номенклатура, способы получения и свойства. Амфотерность. Гидролиз солей.
Амфотерность. Гидролиз солей.
2. Неметаллы.
Водород, его химические и физические свойства.
Вода. Физические, химические свойства. Кристаллогидраты. Значение воды в промышленности, сельском хозяйстве, быту, природе. Охрана водоемов от загрязнения.
Общая характеристика элементов YII группы главной подгруппы. Хлор. Физические, химические свойства. Свойства и способы получения галогеноводородов, галогенидов, кислородсодержащих соединений хлора.
Общая характеристика элементов главной подгруппы YI группы. Кислород, его получение, сравнение физических и химических свойств кислорода и озона. Окислительно–восстановительные реакции с участием пероксида водорода. Сера, ее физические и химические свойства. Соединения серы: сероводород, оксиды серы (IY, YI). Серная и сернистая кислоты, их свойства, соли серной и сернистой кислот. Производство серной кислоты.
Общая характеристика элементов Y группы главной подгруппы. Азот. Физические и химические свойства. Свойства аммиака и солей аммония, оксидов азота (I, II, IY), азотистой кислоты и нитритов, азотной кислоты и нитратов. Производство аммиака и азотной кислоты. Фосфор, его физические и химические свойства. Свойства соединений фосфора: фосфороводорода, фосфидов, оксида фосфора (Y), фосфорной кислоты и фосфатов.
Физические и химические свойства. Свойства аммиака и солей аммония, оксидов азота (I, II, IY), азотистой кислоты и нитритов, азотной кислоты и нитратов. Производство аммиака и азотной кислоты. Фосфор, его физические и химические свойства. Свойства соединений фосфора: фосфороводорода, фосфидов, оксида фосфора (Y), фосфорной кислоты и фосфатов.
Общая характеристика элементов IY группы главной подгруппы. Углерод, его аллотропные модификации, физические и химические свойства.. Свойства соединений углерода: оксидов (II, IY), угольной кислоты и ее солей. Свойства кремния, оксида кремния, кремниевой кислоты и силикатов.
3. Металлы.
Положение в периодической системе. Особенности строения атомов металлов. Металлическая связь. Характерные физические и химические свойства. Электрохимический ряд напряжений металлов. Коррозия металлов.
Общая характеристика IА- и IIА- групп периодической системы. Свойства натрия, калия, кальция и магния и их соединений.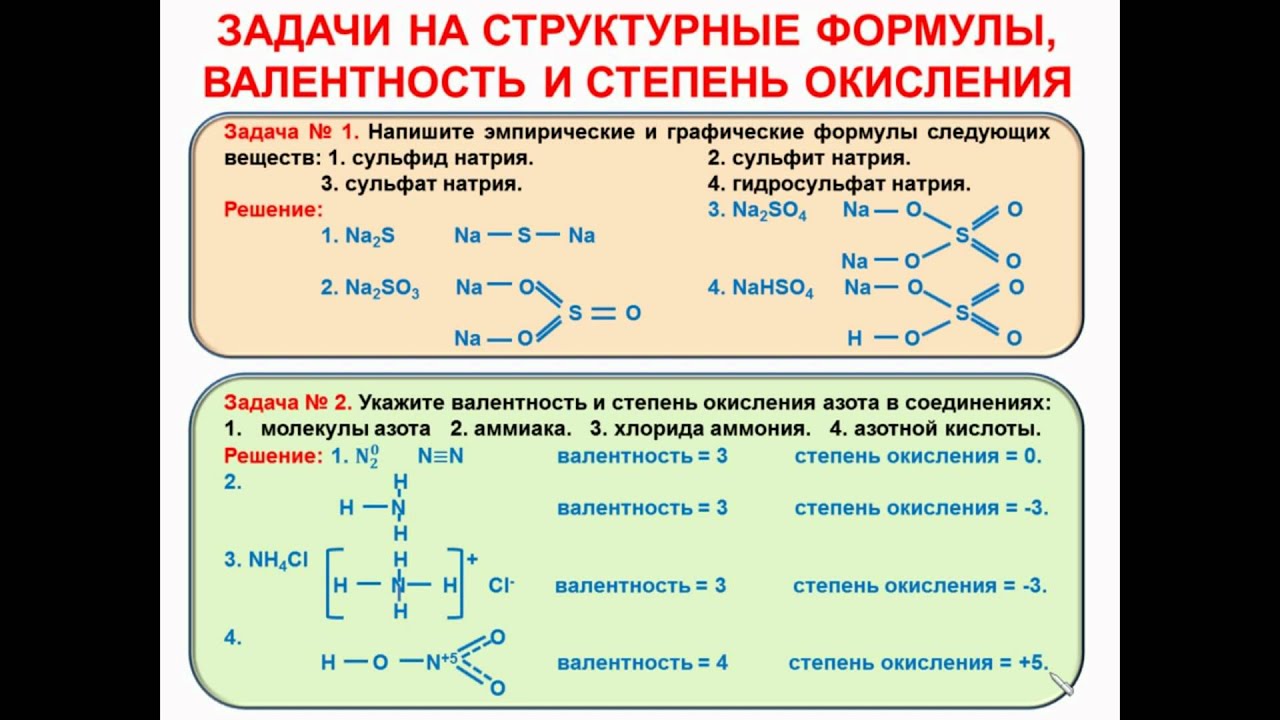 Жесткость воды и способы ее устранения. Свойства алюминия и его соединений. Свойства железа, оксидов, гидроксидов и солей железа (II и III). Природные соединения железа. Свойства перманганата калия: восстановление перманганат иона в кислой, нейтральной и щелочной средах.
Жесткость воды и способы ее устранения. Свойства алюминия и его соединений. Свойства железа, оксидов, гидроксидов и солей железа (II и III). Природные соединения железа. Свойства перманганата калия: восстановление перманганат иона в кислой, нейтральной и щелочной средах.
Медико-биологическое значение соединений указанных металлов.
Органическая химия.
1. Теоретические положения органической химии.
Основные положения теории химического строения А.М. Бутлерова. Зависимость свойств веществ от химического строения. Виды изомерии. Электронная природа химических связей в молекулах органических соединений, способы разрыва связей, понятие о свободных радикалах.
2. Основные классы органических соединений.
Углеводороды.
Гомологический ряд предельных углеводородов, их электронное и пространственное строение (sp3-гибридизация). Номенклатура, физические и химические свойства, способы получения предельных углеводородов. Циклоалканы.
Номенклатура, физические и химические свойства, способы получения предельных углеводородов. Циклоалканы.
Гомологический ряд этиленовых углеводородов. Двойная связь: σ– и p – связи, sp2–гибридизация. Изомерия углеродного скелета и положение двойной связи. Номенклатура этиленовых углеводородов. Физические и химические свойства, способы получения. Природный каучук, его строение и свойства.
Гомологический ряд ацетиленовых углеводородов. Тройная связь, sp–гибридизация. Номенклатура, физические и химические свойства, способы получения. Получение ацетилена карбидным способом и из метана.
Ароматические углеводороды (арены). Бензол, электронное и пространственное строение, химические свойства. Гомологи бензола. Понятие о взаимном влиянии атомов на примере толуола.
Природные источники углеводородов: нефть, природный газ и попутные нефтяные газы, уголь. Фракционная перегонка нефти. Крекинг. Ароматизация нефтепродуктов.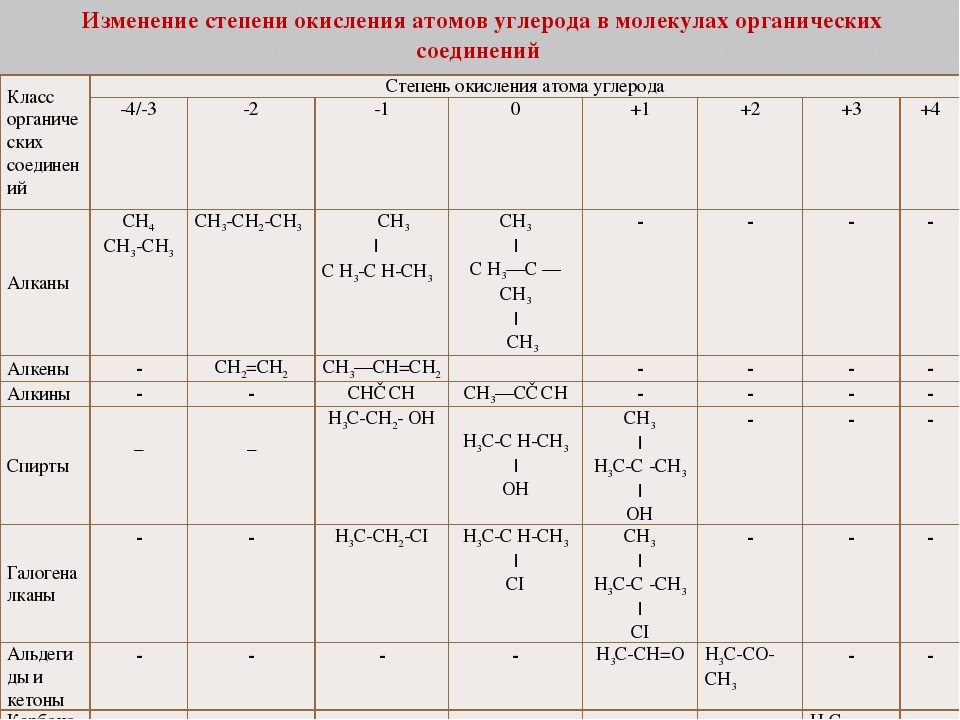 Охрана окружающей среды при нефтепереработке.
Охрана окружающей среды при нефтепереработке.
Кислородсодержащие соединения.
Спирты, их строение. Номенклатура, химические свойства, способы получения спиртов. Многоатомные спирты, номенклатура, особые свойства (этиленгликоль, глицерин). Ядовитость спиртов, их губительное действие на организм человека. Фенол, его строение, физические и химические свойства фенола.
Альдегиды, их строение. Номенклатура, физические и химические свойства. Получение и применение муравьиного и уксусного альдегидов. Понятие о кетонах.
Карбоновые кислоты, их строение. Карбоксильная группа, взаимное влияние карбоксильной группы и углеводного радикала. Физические и химические свойства карбоновых кислот. Муравьиная, уксусная, стеариновая, олеиновая, бензойная кислоты. Получение и применение карбоновых кислот. Сложные эфиры. Строение, химические свойства. Реакция этерификации.
Азотсодержащие соединения.
Амины алифатические и ароматические, их строение. Номенклатура, химические свойства, способы получения аминов.
Номенклатура, химические свойства, способы получения аминов.
Аминокислоты. Строение, химические свойства, изомерия.
Понятие об азотсодержащих гетероциклических соединениях на примере пиридина и пиррола.
3. Важнейшие природные соединения.
Жиры, строение, химические свойства, их роль в природе.
Углеводы: строение и свойства глюкозы, рибозы, дезоксирибозы, сахарозы, крахмала и целлюлозы. Применение целлюлозы и её производных. Понятие об искусственных волокнах.
Синтез пептидов, их строение. Строение, структура и свойства белков. Успехи в изучении и синтезе белков. Значение микробиологической промышленности. Строение нуклеотидов и полинуклеотидов. Различие в строении РНК и ДНК. Биологическая роль указанных классов соединений.
Типовые расчетные задачи
1. Вычисление массовой или объемной доли компонента.
2. Вычисление молярной концентрации.
3. Вычисление относительных плотностей веществ в газообразном состоянии.
4. Вычисление объема газообразного вещества известной массы или известного количества при нормальных условиях.
5. Установление молекулярной формулы вещества по массовой доле элементов или по массам продуктов сгорания.
6. Вычисление массы (объема, количества вещества) одного из участников реакции по известной массе (объему, количеству вещества) другoгo участника реакции.
7. То же, с предварительным нахождением, какое из веществ вступает в реакцию полностью.
8. То же, с учетом выхода продукции реакции в процентах от теоретически возможного.
9. То же, с учетом массовой доли примесей в реагенте.
10. Определение состава соли (кислая или средняя) по массам веществ, вступающих в реакцию.
11. Определение состава двухкомпонентной смеси по массам веществ, образующихся в ходе одной или нескольких реакций.
Все расчетные задачи могут быть как в прямом, так и в обратном вариантах (например, расчет массовой доли вещества по его массе и известной массе раствора или же расчет массы вещества по известной массовой доле и массе раствора).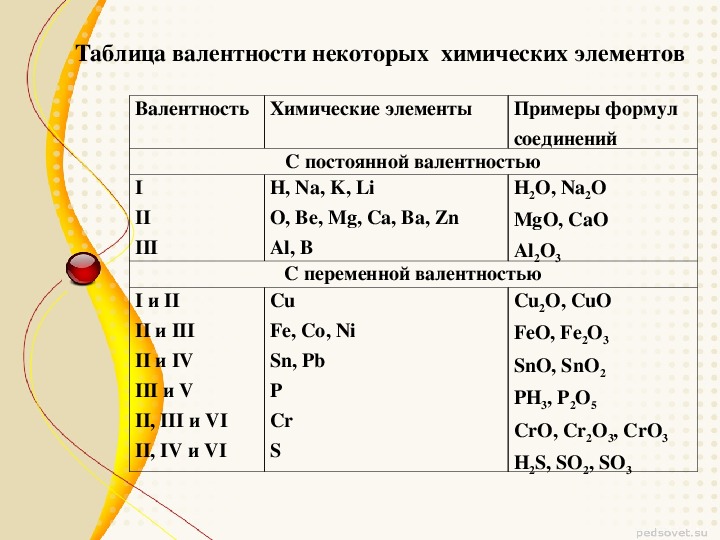 Сложные задачи включают в себя две или больше перечисленных типовых задач.
Сложные задачи включают в себя две или больше перечисленных типовых задач.
Рекомендуемая литература:
1. Рудзитис Г.Е., Фельдман Ф.Г. Химия для 8–11 классов. М.: «Просвещение», 2011.
- Гузей Л.С. и др. Химия для 8-11 классов. М., «Дрофа», 2004.
- В.В. Еремин, Н.Е. Кузьменко, А.А. Дроздов, В.В. Лунин. Химия для 8-11 классов. М.: Дрофа, 2008
- Габриелян О.С. Химия для 8-11 классов. М., «Дрофа», 2005.
- Гольдфарб Я.Л., Ходаков Ю.Б., Додонов Ю.Б. Сборник задач и упражнений по химии. — М.: «Дрофа», 2005.
- Е.А. Еремина, О.Н. Рыжова Справочник школьника по химии. Еремина М.: Издательство «Экзамен», 2006.
Дополнительная литература:
1. Хомченко Г.П. Химия для поступающих в ВУЗы. М.: «Высшая школа», 2003.
2. Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в ВУЗы. М.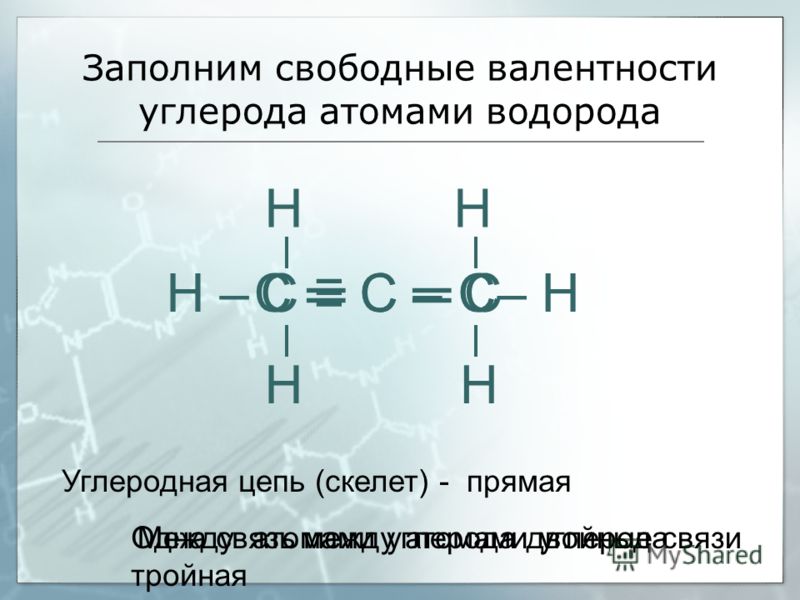 , «Высшая школа», 2005.
, «Высшая школа», 2005.
3. Кузьменко Н.Е., Магдесиева Н.Н., Еремин В.В. Задачи по химии для абитуриентов. Курс повышенной сложности. – М: «Высшая школа», 2004.
4. Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия для школьников старших классов и поступающих в ВУЗы. М., «Дрофа», 2008.
5. Егоров А.С., Дионисьев В.Д., Ермакова В.К. и др. Химия. Пособие – репетитор. Ростов-на-Дону, «Феникс», 2006.
Программа вступительных испытаний по биологии
1. Биология как наука.
Биология — наука о живой природе. Вклад биологии в формирование современной научной картины мира и общей культуры личности. Значение биологической науки для сельского хозяйства, промышленности, медицины, охраны природы. Методы биологии. Уровни организации живого: молекулярный, клеточный, организменный, популяционно-видовой, экосистемный, биосферный. Свойства живых систем: особенности химического состава, обмен веществ и энергии, открытость, рост, самовоспроизведение, наследственность и изменчивость, раздражимость, саморегуляция; их проявление уживотных, растений, грибов и бактерий.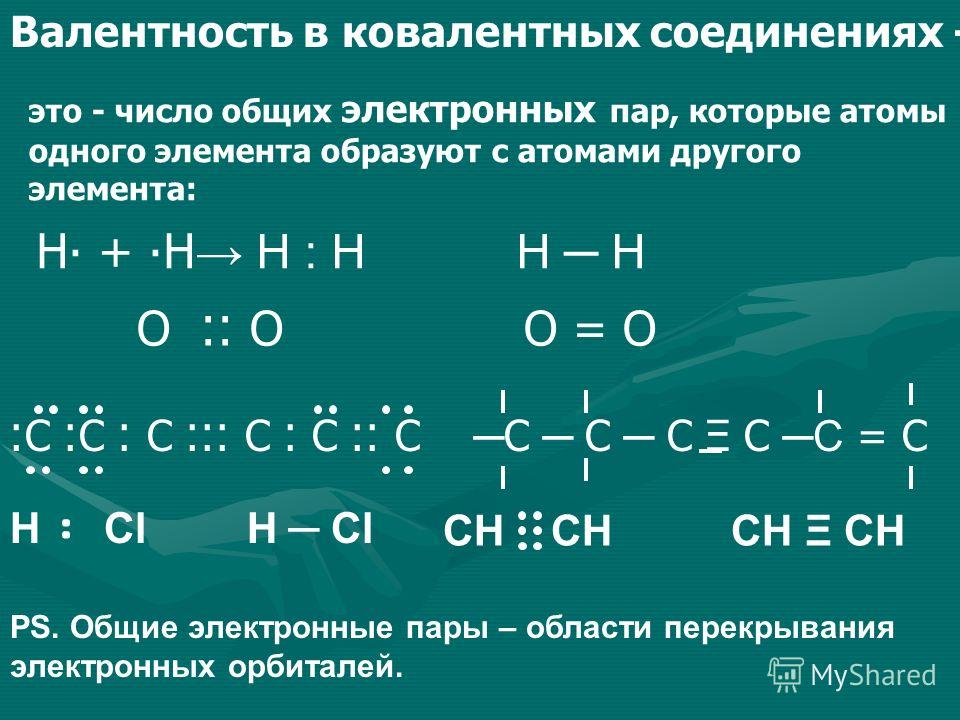
2. Строение и функционирование клетки.
Основные положения клеточной теории, ее значение в современной науке. Клетка — структурная и функциональная единица живого. Клеточное строение организмов как отражение единства живой природы.
Химический состав клеток. Содержание химических элементов в клетке. Вода, минеральные соли и другие неорганические вещества, их роль в жизнедеятельности. Особенности структуры и функции органических веществ: белков, углеводов, липидов, нуклеиновых кислот в связи с их функциями. Строение и функции органоидов клетки; взаимосвязь этих компонентов как основа ее целостности.
Многообразие клеток. Прокариотные и эукариотные клетки. Особенности строения клеток растений, животных и грибов. Вирусы — неклеточные формы. Роль вирусов как возбудителей заболеваний, их профилактика.
Клеточный метаболизм и его составляющие — ассимиляция (анаболизм) и диссимиляция (катаболизм). Пластический и энергетический обмен. Ферменты, их свойства и роль в метаболизме.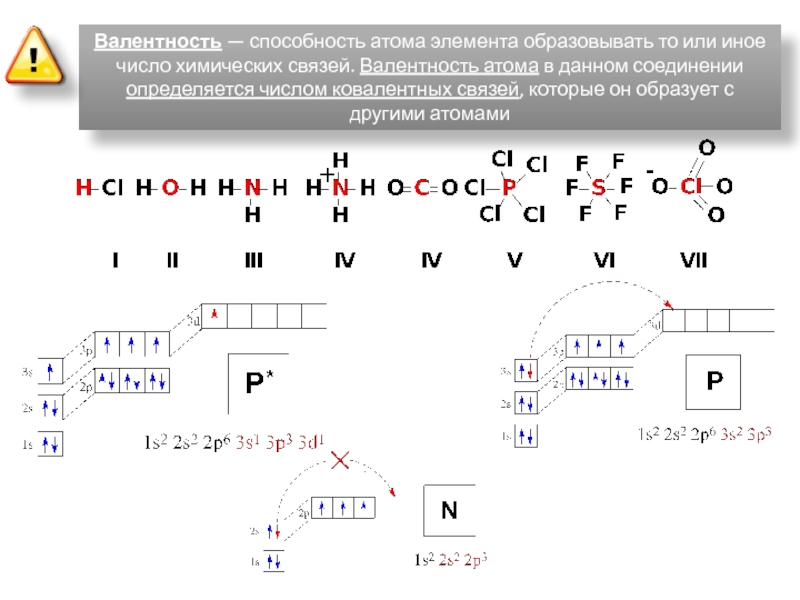 Основные этапы пластического обмена. Репликация ДНК. Гены. Генетический код и его свойства. Транскрипция. Трансляция. Роль матричных процессов в реализации наследственной информации. Автотрофные и гетеротрофные организмы. Этапы фотосинтеза и роль хлорофилла в этом процессе. Биосферное значение фотосинтеза. Хемосинтез. Основные этапы энергетического обмена. Брожение и клеточное дыхание, метаболическая роль кислорода. Роль АТФ в энергетическом и пластическом обмене. Взаимосвязь энергетического и пластического обмена.
Основные этапы пластического обмена. Репликация ДНК. Гены. Генетический код и его свойства. Транскрипция. Трансляция. Роль матричных процессов в реализации наследственной информации. Автотрофные и гетеротрофные организмы. Этапы фотосинтеза и роль хлорофилла в этом процессе. Биосферное значение фотосинтеза. Хемосинтез. Основные этапы энергетического обмена. Брожение и клеточное дыхание, метаболическая роль кислорода. Роль АТФ в энергетическом и пластическом обмене. Взаимосвязь энергетического и пластического обмена.
3. Размножение и индивидуальное развитие организмов.
Деление клетки — основа роста, развития и размножения организмов. Митоз и мейоз — основные способы деления эукариотной клетки. Интерфаза. Этапы митоза и мейоза. Значение митоза и мейоза. Половое и бесполое размножение, их роль в природе. Способы бесполого размножения у животных, растений и грибов. Развитие половых клеток. Оплодотворение у животных и растений. Двойное оплодотворение — особенность цветковых растений. Чередование полового и бесполого поколений (гаметофита и спорофита) у растений.
Чередование полового и бесполого поколений (гаметофита и спорофита) у растений.
Онтогенез – индивидуальное развитие организма, основные этапы онтогенеза. Эмбриональное и постэмбриональное развитие. Основные этапы развития зародыша (на примере животных). Прямое развитие и развитие с метаморфозом (непрямое). Понятие жизненного цикла.
4. Основы генетики и селекции.
Генетика — наука о наследственности и изменчивости организмов. Основные методы генетики. Гибридологический анализ, моно-, ди- и полигибридное скрещивание. Основные понятия генетики: ген, аллель, признак, гомозигота и гетерозигота, доминантность и рецессивность, генотип, фенотип и норма реакции. Законы наследственности, установленные Г. Менделем, и условия их выполнения. Цитологические основы выполнения законов Г.Менделя. Полное и неполное доминирование.
Хромосомная теория наследственности. Сцепленное наследование и его цитологические основы, нарушение сцепления. Кроссинговер (перекрест хромосом) и его значение.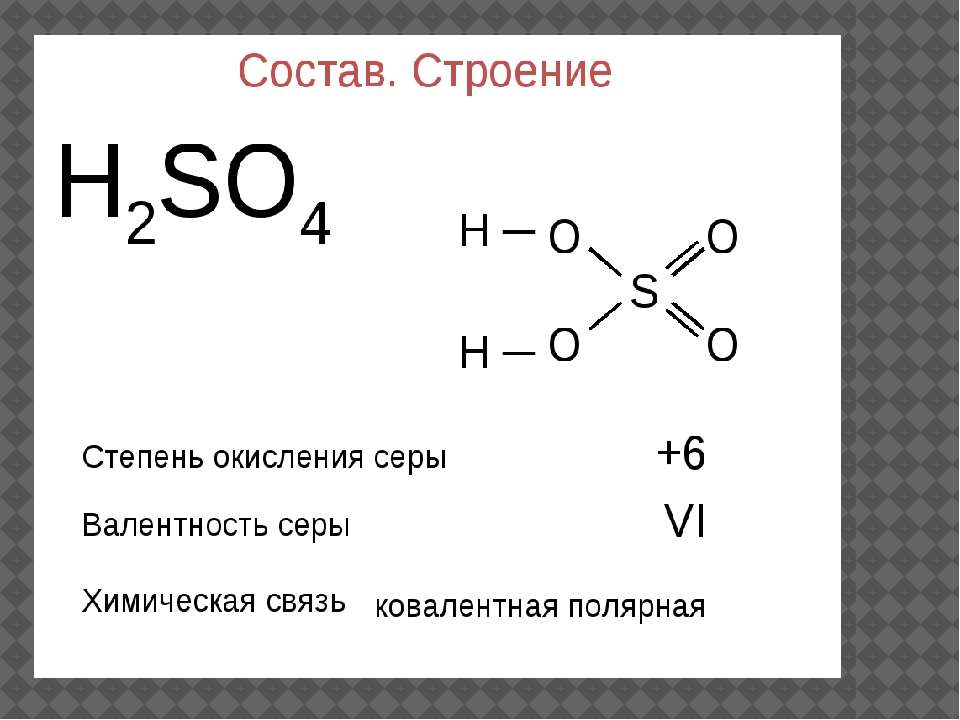 Генетическое определение пола, половые хромосомы и аутосомы, наследование признаков, сцепленных с полом. Генотип как целостная исторически сложившаяся система. Понятие о взаимодействии и множественном действии генов. Роль генотипа и факторов внешней среды в формировании фенотипа.
Генетическое определение пола, половые хромосомы и аутосомы, наследование признаков, сцепленных с полом. Генотип как целостная исторически сложившаяся система. Понятие о взаимодействии и множественном действии генов. Роль генотипа и факторов внешней среды в формировании фенотипа.
Формы изменчивости организмов: модификационная и наследственная изменчивость, мутационная и комбинативная изменчивость, их роль в природе. Причины мутаций. Влияние окружающей среды на мутационный процесс, мутагены. Главные источники комбинативной изменчивости: независимое поведение гомологичных хромосом в мейозе, кроссинговер, оплодотворение. Значение генетики для здравоохранения. Наследственные заболевания человека и меры их профилактики. Влияние радиоактивного излучения и химических мутагенов (в том числе никотина, алкоголя и наркотических веществ) на наследственность человека.
Генетика — теоретическая основа селекции. Порода животных и сорт растений. Основные методы селекции растений и животных: мутагенез, полиплоидия, гибридизация, искусственный отбор. Современные биотехнологии: генная и клеточная инженерия, микробиологический синтез, их роль в развитии здравоохранения, промышленности, сельского хозяйства и охраны природы.
Основные методы селекции растений и животных: мутагенез, полиплоидия, гибридизация, искусственный отбор. Современные биотехнологии: генная и клеточная инженерия, микробиологический синтез, их роль в развитии здравоохранения, промышленности, сельского хозяйства и охраны природы.
5. Многообразие живой природы.
5.1. Система органического мира
Классификация организмов и роль К.Линнея как основоположника научной систематики. Основные систематические категории: вид, род, семейство, отряд (порядок), класс, тип (отдел), царство. Особенности строения и функционирования представителей основных царств живой природы: бактерий, растений, животных и грибов.
5.2. Царство бактерий
Основные черты строения и жизнедеятельности бактерий, их размножение. Споры. Роль бактерий в биосфере. Значение бактерий для сельского хозяйства, промышленности и медицины. Болезнетворные бактерии и борьба с ними.
5.3. Царство грибов.
Формы вегетативного тела грибов. Шляпочные грибы, их строение, питание, размножение. Плесневые грибы. Дрожжи. Экологические группы грибов. Грибы-паразиты, вызывающие болезни растений, животных и человека. Микориза. Роль грибов в биосфере и значение для человека.
Лишайники – организмы симбиотического происхождения, образованные микобионтом (гриб) и фикобионтом (цианобактерия или зеленая одноклеточная водоросль). Строение лишайников. Экологические и морфологические группы. Питание. Размножение. Роль лишайников в биосфере и значение для человека.
5.4. Царство растений.
Общая характеристика растений. Роль растений в структуре экосистемы и значение для человека. Классификация растений. Низшие и высшие растения. Жизненный цикл у растений, чередование поколений спорофита и гаметофита. Эволюция жизненного цикла у растений.
Низшие растения (Водоросли). Эволюция и формы вегетативного тела.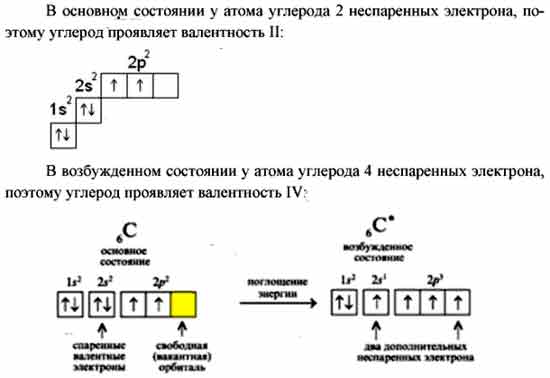 Основные отделы водорослей – Зеленые, Бурые и Красные. Строение и жизнедеятельность одноклеточных водорослей (хламидомонада). Нитчатые водоросли (Улотрикс) и водоросли с пластинчатым слоевищем. Размножение водорослей и жизненные циклы. Роль водорослей в биосфере и значение для человека.
Основные отделы водорослей – Зеленые, Бурые и Красные. Строение и жизнедеятельность одноклеточных водорослей (хламидомонада). Нитчатые водоросли (Улотрикс) и водоросли с пластинчатым слоевищем. Размножение водорослей и жизненные циклы. Роль водорослей в биосфере и значение для человека.
Выход растений на сушу. Понятие о тканях и органах у растений. Характеристика отдела Риниевых (Псилофитов).
Отдел Моховидные. Зеленые мхи. Строение, размножение и жизненный цикл кукушкина льна. Мох сфагнум, особенности его строения. Образование торфа, его значение.
Отделы Плауновидные, Хвощевидные, Папоротниковидные: характеристика, основные представители, их строение и биология. Жизненный цикл и размножение папоротника.
Отдел Голосеменные: характеристика строения и размножения. Распространение хвойных. Биологическое значение семени. Роль голосеменных в биосфере и значение для человека.
Отдел Покрытосеменные (цветковые). Строение цветка. Семезачаток. Двойное оплодотворение. Образование семян и плодов. Роль покрытосеменных в биосфере и значение для человека. Классификация Покрытосеменных: классы Двудольных и Однодольных, их особенности. Отличительные признаки растений основных семейств; их биологические особенности (семейства Крестоцветные, Розоцветные, Бобовые, Пасленовые, Сложноцветные, Лилейные, Злаки). Основные группы тканей растений (образовательные, покровные, механические, проводящие, основные). Вегетативные органы высших растений. Строение и функции корня, виды корней, типы корневой системы, видоизменения (метаморфозы) корня. Побег. Почки. Стебель. Ветвление побега. Строение и функции стебля, видоизменения побегов (корневище, клубень, луковица). Строение и функции листа, типы листьев, листорасположение, типы жилкования.
Двойное оплодотворение. Образование семян и плодов. Роль покрытосеменных в биосфере и значение для человека. Классификация Покрытосеменных: классы Двудольных и Однодольных, их особенности. Отличительные признаки растений основных семейств; их биологические особенности (семейства Крестоцветные, Розоцветные, Бобовые, Пасленовые, Сложноцветные, Лилейные, Злаки). Основные группы тканей растений (образовательные, покровные, механические, проводящие, основные). Вегетативные органы высших растений. Строение и функции корня, виды корней, типы корневой системы, видоизменения (метаморфозы) корня. Побег. Почки. Стебель. Ветвление побега. Строение и функции стебля, видоизменения побегов (корневище, клубень, луковица). Строение и функции листа, типы листьев, листорасположение, типы жилкования.
Генеративные органы цветковых растений. Строение цветка в связи со способами опыления. Цветки однополые и обоеполые. Формула цветка. Соцветия и их биологическое значение. Строение и классификация семян (на примере однодольного и двудольного растения) и плодов. Типы прорастания семян, питание и рост проростка. Распространение плодов и семян. Значение цветков, плодов и семян в природе и жизни человека. Происхождение растений. Основные этапы эволюции растительного мира: возникновение фотосинтеза, возникновение одноклеточных и многоклеточных водорослей, выход растений на сушу (псилофиты), появление споровых и семенных растений. Филогенетические связи в растительном мире.
Строение и классификация семян (на примере однодольного и двудольного растения) и плодов. Типы прорастания семян, питание и рост проростка. Распространение плодов и семян. Значение цветков, плодов и семян в природе и жизни человека. Происхождение растений. Основные этапы эволюции растительного мира: возникновение фотосинтеза, возникновение одноклеточных и многоклеточных водорослей, выход растений на сушу (псилофиты), появление споровых и семенных растений. Филогенетические связи в растительном мире.
5.5. Царство животных
Простейшие животные. Общая характеристика простейших: строение клеток, питание, дыхание, выделение, движение, поведение и размножение. Разнообразие простейших: обыкновенная амеба, эвглена зеленая и гетеротрофные жгутиконосцы, инфузория-туфелька и другие. Отличия простейших от многоклеточных животных. Их значение в природе и жизни человека. Паразитические простейшие – возбудители заболеваний человека и животных.
Многоклеточные животные. Особенности строения многоклеточных животных. Основные ткани, органы и их системы. Типы симметрии тела животных. Двухслойные и трехслойные животные.
Типы Кишечнополостные, Плоские черви, Круглые черви, Кольчатые черви. Характеристика их строения и основных процессов жизнедеятельности (внешнее строение, система покровов, движение и мускулатура, питание и пищеварительная система, дыхание, выделение и выделительная система, распределение веществ в организме, полость тела, нервная система, особенности поведения, половая система и способы размножения). Жизненные циклы важнейших представителей. Характеристика основных классов. Роль в экосистемах и жизни человека. Паразитические представители плоских и круглых червей, их значение для здравоохранения и сельского хозяйства. Профилактика паразитарных заболеваний.
Тип Членистоногие. Характеристика строения и основных процессов
жизнедеятельности. Классы: Ракообразные, Паукообразные, Насекомые. Особенности членистоногих в связи с освоением наземно-воздушной среды обитания. Основные отряды насекомых: Прямокрылые, Жесткокрылые, Чешуекрылые, Двукрылые, Перепончатокрылые. Насекомые с полным и неполным превращением. Многообразие насекомых, их роль в экосистемах и жизни человека. Методы борьбы с насекомыми — вредителями сельскохозяйственных культур и переносчиками заболеваний. Охрана насекомых.
Классы: Ракообразные, Паукообразные, Насекомые. Особенности членистоногих в связи с освоением наземно-воздушной среды обитания. Основные отряды насекомых: Прямокрылые, Жесткокрылые, Чешуекрылые, Двукрылые, Перепончатокрылые. Насекомые с полным и неполным превращением. Многообразие насекомых, их роль в экосистемах и жизни человека. Методы борьбы с насекомыми — вредителями сельскохозяйственных культур и переносчиками заболеваний. Охрана насекомых.
Тип Моллюски. Характеристика строения и основных процессов жизнедеятельности, основные классы (Брюхоногие, Двустворчатые, Головоногие). Роль моллюсков в водных и наземных экосистемах.
Тип Хордовые. Общая характеристика типа. Основные классы хордовых: Ланцетники, Хрящевые рыбы, Костные рыбы, Земноводные, Пресмыкающиеся, Птицы, Млекопитающие. Характеристика их строения и основных процессов жизнедеятельности в связи с особенностями среды обитания и образа жизни. Происхождение основных классов и эволюция позвоночных. Выход позвоночных на сушу и освоение ими наземно-воздушной среды обитания. Характеристика основных отрядов. Роль различных хордовых в экосистемах и жизни человека, охрана и регуляция численности. Основные домашние и сельскохозяйственные животные: происхождение, биологические основы их содержания, кормления, разведения.
Выход позвоночных на сушу и освоение ими наземно-воздушной среды обитания. Характеристика основных отрядов. Роль различных хордовых в экосистемах и жизни человека, охрана и регуляция численности. Основные домашние и сельскохозяйственные животные: происхождение, биологические основы их содержания, кормления, разведения.
Эволюция животного мира.
Происхождение Простейших и Многоклеточных животных. Происхождение основных типов животного царства. Усложнение строения и жизнедеятельности животных в процессе эволюции. Положение человека в системе царства животных, доказательства его систематической принадлежности.
6. Человек и его здоровье.
Общий обзор организма человека: основные ткани и системы органов. Значение знаний о строении, жизнедеятельности организма и гигиене человека для охраны его здоровья.
Органы и системы органов человека.
Система покровов. Строение и функции кожи. Производные кожи: волосы и ногти.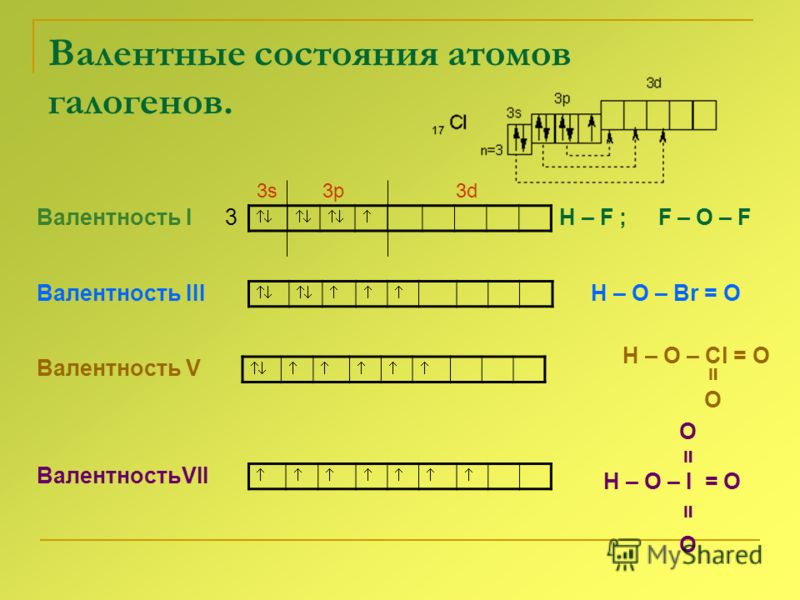 Роль кожи в терморегуляции, закаливание организма. Гигиена кожи, профилактика и первая помощь при ожогах, обморожениях, и механических травмах.
Роль кожи в терморегуляции, закаливание организма. Гигиена кожи, профилактика и первая помощь при ожогах, обморожениях, и механических травмах.
Опорно-двигательная система и движение. Основные элементы опорно-двигательной системы человека. Части скелета: осевой скелет, скелет конечностей и их поясов. Строение костей и их функции. Основные типы костей и их соединений. Суставы. Хрящи, сухожилия, связки. Строение мышц и их функции. Основные группы мышц человека. Первая помощь при ушибах, растяжении связок, переломах и вывихах.
Кровь и кровообращение. Понятие внутренней среды организма, значение постоянства внутренней среды. Кровь, лимфа и тканевая жидкость. Состав крови человека: плазма крови и различные форменные элементы, их строение и функции. Иммунитет и его типы. Антигены и антитела. Роль И.И. Мечникова в создании учения об иммунитете. Инфекционные заболевания и борьба с ними.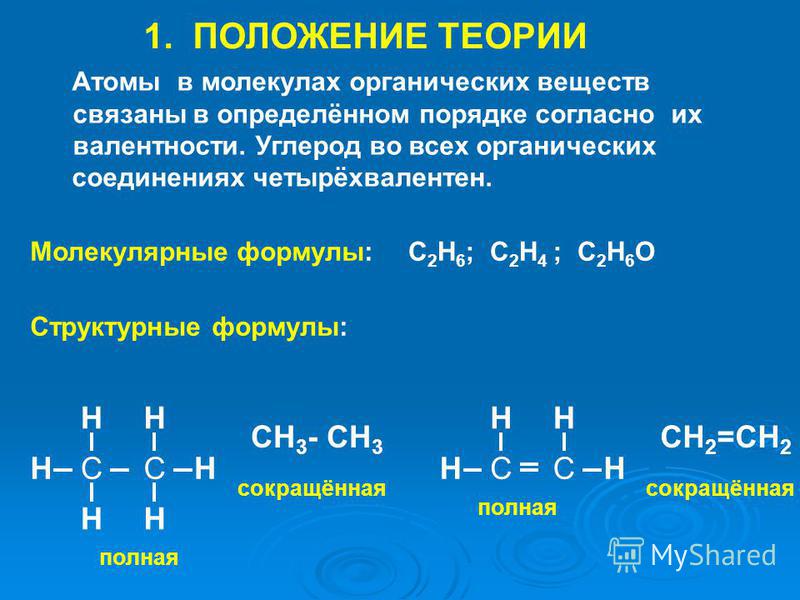 Прививки и их роль в профилактике инфекционных заболеваний. Группы крови. Переливание крови, донорство. Свертывание крови. Строение системы кровообращения: сердце и сосуды (артерии, капилляры, вены). Большой и малый круги кровообращения. Предупреждение сердечно-сосудистых заболеваний. Первая помощь при кровотечениях. Вредное влияние курения, употребления алкоголя и наркотиков на сердечно-сосудистую систему.
Прививки и их роль в профилактике инфекционных заболеваний. Группы крови. Переливание крови, донорство. Свертывание крови. Строение системы кровообращения: сердце и сосуды (артерии, капилляры, вены). Большой и малый круги кровообращения. Предупреждение сердечно-сосудистых заболеваний. Первая помощь при кровотечениях. Вредное влияние курения, употребления алкоголя и наркотиков на сердечно-сосудистую систему.
Дыхательная система и газообмен. Основные компоненты дыхательной системы. Строение легких, механизм вдоха и выдоха, газообмен. Значение дыхания. Гигиена органов дыхания. Заболевания органов дыхания и их профилактика. Предупреждение распространения инфекционных заболеваний. Чистота атмосферного воздуха как фактор здоровья. Приемы первой помощи при отравлении угарным газом и спасении утопающего.
Органы пищеварения и питание. Строение и функции пищеварительной системы. Отделы пищеварительного тракта и их функции. Пищеварительные железы. Роль ферментов в пищеварении. Регуляция пищеварения, исследования И.П. Павлова. Пищевые продукты и питательные вещества: белки, липиды, углеводы, минеральные вещества, вода, витамины. Гигиена органов пищеварения, рациональное питание. Значение питания и пищеварения. Обмен веществ и энергии в организме человека, профилактика нарушений метаболизма. Роль витаминов в организме, их содержание в пищевых продуктах. Профилактика пищевых отравлений, кишечных инфекций и паразитарных заболеваний.
Пищеварительные железы. Роль ферментов в пищеварении. Регуляция пищеварения, исследования И.П. Павлова. Пищевые продукты и питательные вещества: белки, липиды, углеводы, минеральные вещества, вода, витамины. Гигиена органов пищеварения, рациональное питание. Значение питания и пищеварения. Обмен веществ и энергии в организме человека, профилактика нарушений метаболизма. Роль витаминов в организме, их содержание в пищевых продуктах. Профилактика пищевых отравлений, кишечных инфекций и паразитарных заболеваний.
Выделение. Строение мочевыделительной системы человека. Органы мочевыделительной системы и их функции. Образование первичной и вторичной мочи. Профилактика заболеваний. Роль других систем органов в выделении продуктов метаболизма.
Размножение и развитие. Мужская и женская половая система, их строение и функция. Образование половых клеток. Основные этапы индивидуального развития человека. Причины нарушения индивидуального развития; наследственные болезни, их причины и предупреждение.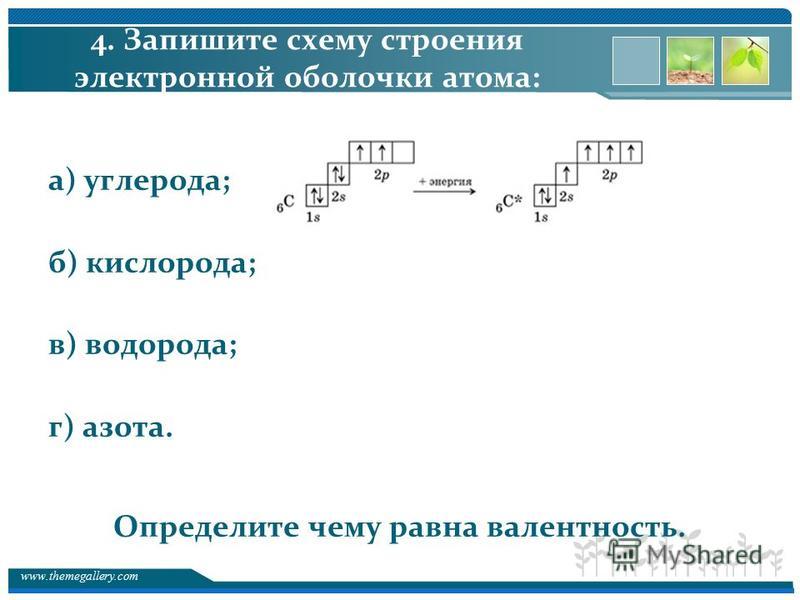 Инфекции, передающиеся половым путем, их профилактика.
Инфекции, передающиеся половым путем, их профилактика.
Нервная и гуморальная регуляция процессов жизнедеятельности. Основные железы внутренней секреции и их значение для роста, развития и регуляции функций организма. Основные гормоны человека. Строение нервной системы, ее отделы: центральная и периферическая нервная система. Строение и функции головного и спинного мозга. Соматическая и вегетативная нервная система. Органы чувств, их строение и функции. Анализаторы. Нарушения работы анализаторов и их профилактика. Условные и безусловные рефлексы, рефлекторные дуги. Высшая нервная деятельность, речь и мышление. Сознание как функция мозга. Социальная и биологическая обусловленность поведения человека. Роль И.М. Сеченова и И.П. Павлова в создании учения о высшей нервной деятельности. Нарушения деятельности нервной системы и их предупреждение. Сон, его значение и гигиена. Взаимосвязь процессов нервной и гуморальной регуляции.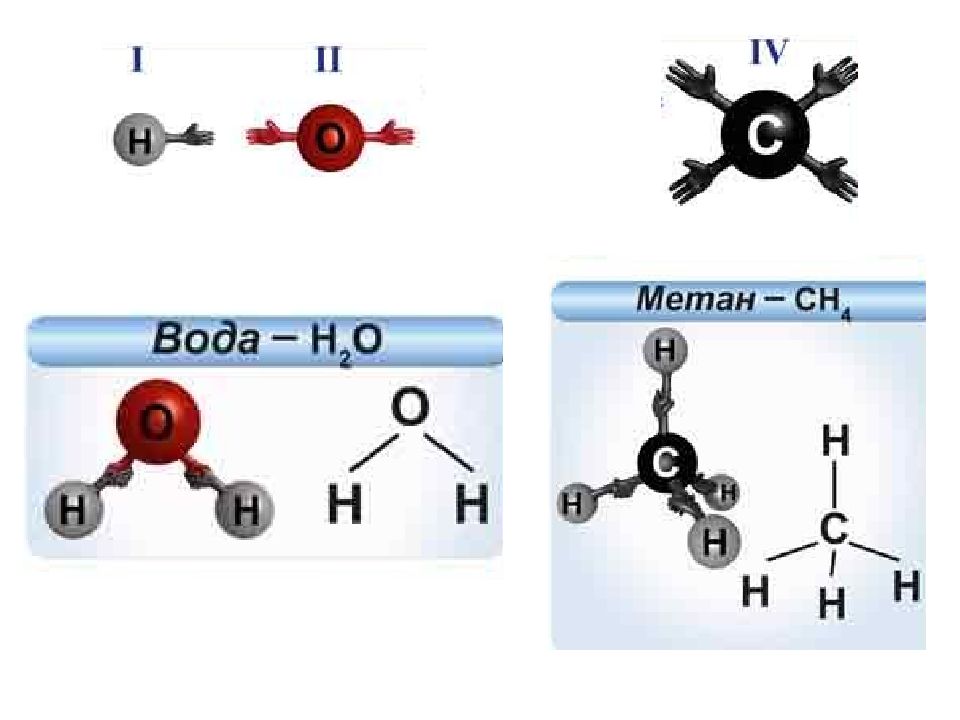
7. Эволюция органического мира.
Доказательства эволюции живой природы. История эволюционного учения; К. Линней, Ж.Кювье, Ж.-Б.Ламарк и их роль в развитии науки. Основные положения теории Ч. Дарвина, ее значение. Популяции и их структура. Численность популяций, возрастной и половой состав, формы совместного существования особей. Изменчивость в популяциях. Факторы (движущие силы) эволюции. Естественный отбор — направляющий фактор эволюции. Формы естественного отбора (движущий, стабилизирующий, разрывающий). Борьба за существование. Роль экологии в изучении механизмов эволюционных преобразований. Возникновение приспособленности, ее относительный характер. Вид и его критерии. Механизмы видообразования. Изоляция и ее типы, роль географической изоляции. Микроэволюция и макроэволюция, соотношение их механизмов. Роль изучения онтогенеза в познании механизмов эволюции органического мира. Биогенетический закон. Биологический прогресс и регресс. Ароморфоз, идиоадаптация, общая дегенерация; соотношение путей эволюции. Эволюционные параллелизмы и конвергенция, их причины. Гомологичные и аналогичные органы. Основные этапы эволюции жизни. Происхождение жизни на Земле. Наиболее важные ароморфозы в эволюции живой природы. Происхождение и эволюция человека. Доказательства происхождения человека от животных. Этапы эволюции человека. Движущие силы антропогенеза. Возникновение человеческих рас. Биологическое и социальное в природе человека.
Биологический прогресс и регресс. Ароморфоз, идиоадаптация, общая дегенерация; соотношение путей эволюции. Эволюционные параллелизмы и конвергенция, их причины. Гомологичные и аналогичные органы. Основные этапы эволюции жизни. Происхождение жизни на Земле. Наиболее важные ароморфозы в эволюции живой природы. Происхождение и эволюция человека. Доказательства происхождения человека от животных. Этапы эволюции человека. Движущие силы антропогенеза. Возникновение человеческих рас. Биологическое и социальное в природе человека.
8. Организм и окружающая среда. Экосистемы. Биосфера.
Экология — наука о взаимоотношении организмов и окружающей среды, значение экологии. Понятие окружающей среды и экологического фактора, классификация экологических факторов. Действие экологических факторов. Ограничивающие факторы. Понятие экологической ниши. Основные абиотические факторы: свет, температура, влажность, их роль в жизни организмов.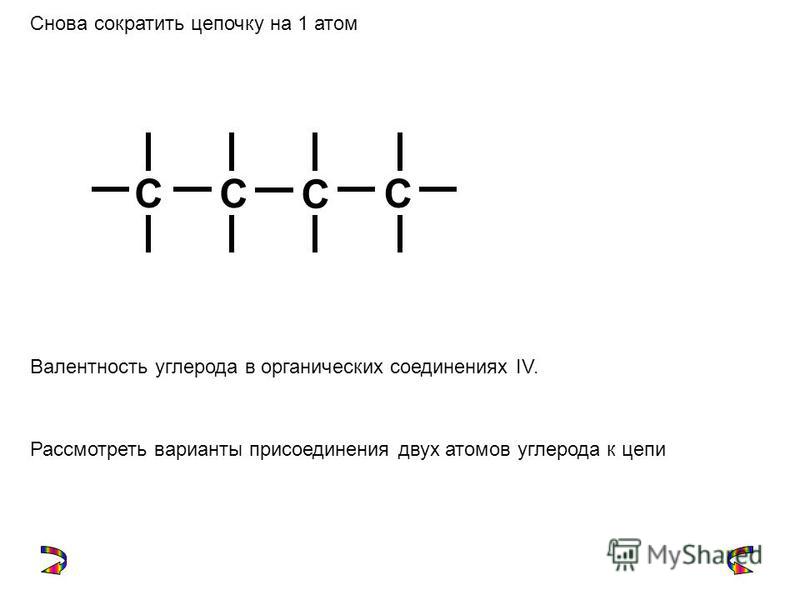 Периодические явления в жизни природы: биологические ритмы, фотопериодизм. Типы межвидовых взаимоотношений: конкуренция, хищничество, паразитизм, симбиоз. Разнообразие популяций, их возрастная и половая структура. Динамика численности популяций и ее причины. Биологические сообщества — многовидовые системы, взаимосвязь организмов в сообществе. Экосистема и биогеоценоз. Видовая и пространственная структура экосистем. Роль редких видов в природе и меры по их охране. Трофическая структура экосистем: продуценты, консументы, редуценты. Правило экологической пирамиды. Пищевые цепи и сети. Круговорот веществ и превращение энергии в экосистемах. Саморегуляция — одно из важнейших свойств экосистем. Внешние и внутренние причины изменения экосистем, экологическая сукцессия. Влияние человека на природные экосистемы, специфика действия антропогенных факторов. Сравнение естественных и искусственных экосистем. Агроэкосистемы и экосистемы городов.
Периодические явления в жизни природы: биологические ритмы, фотопериодизм. Типы межвидовых взаимоотношений: конкуренция, хищничество, паразитизм, симбиоз. Разнообразие популяций, их возрастная и половая структура. Динамика численности популяций и ее причины. Биологические сообщества — многовидовые системы, взаимосвязь организмов в сообществе. Экосистема и биогеоценоз. Видовая и пространственная структура экосистем. Роль редких видов в природе и меры по их охране. Трофическая структура экосистем: продуценты, консументы, редуценты. Правило экологической пирамиды. Пищевые цепи и сети. Круговорот веществ и превращение энергии в экосистемах. Саморегуляция — одно из важнейших свойств экосистем. Внешние и внутренние причины изменения экосистем, экологическая сукцессия. Влияние человека на природные экосистемы, специфика действия антропогенных факторов. Сравнение естественных и искусственных экосистем. Агроэкосистемы и экосистемы городов. Значение биологического разнообразия для нормального функционирования естественных экосистем, сохранение биологического разнообразия. Значение природоохранных мероприятий и рационального природопользования. Биосфера как глобальная экосистема, ее границы. Вклад В.И.Вернадского в разработку учения о биосфере. Функции живого вещества. Особенности распределения биомассы в биосфере. Биологический круговорот. Эволюция биосферы. Глобальные изменения в биосфере и их причины. Влияние деятельности человека на эволюцию биосферы.
Значение биологического разнообразия для нормального функционирования естественных экосистем, сохранение биологического разнообразия. Значение природоохранных мероприятий и рационального природопользования. Биосфера как глобальная экосистема, ее границы. Вклад В.И.Вернадского в разработку учения о биосфере. Функции живого вещества. Особенности распределения биомассы в биосфере. Биологический круговорот. Эволюция биосферы. Глобальные изменения в биосфере и их причины. Влияние деятельности человека на эволюцию биосферы.
Общие указания
На экзамене по биологии поступающий в высшее учебное заведение должен показать:
- знание главнейших понятий, закономерностей и законов, касающихся строения, жизни и развития растительного, животного и человеческого организмов, развития живой природы;
- знание строения и жизни растений, животных, человека, основных групп растений и классификации животных;
- умение обосновывать выводы, оперировать понятиями при объяснении явлений природы с приведением примеров из практики сельскохозяйственного и промышленного производства, здравоохранения и т.
 д. Этому умению придается особое значение, так как оно будет свидетельствовать об осмысленности знаний, о понимании излагаемого материала экзаменующимся.
д. Этому умению придается особое значение, так как оно будет свидетельствовать об осмысленности знаний, о понимании излагаемого материала экзаменующимся.
Рекомендуемая литература:
1. Каменский А.А. Общая биология 10-11 класс. М.: Дрофа, 2013г.
2. Пономарева И.Н. Биология 10 класс. Профильный уровень. М.: Вентана-Граф, 2013.
3. Трайтак Д.И. Биология 5-6 класс. М.: Мнемозина, 2013. ФГОС.
4. Пасечник В.В. Биология 7 класс. М.: Просвещение, 2015 г. ФГОС.
5. Рохлов В.С. Биология. Человек 8 класс. М.: Дрофа, 2010 г.
6. Пасечник В.В. Биология. Человек 8 класс. М.: Просвещение, 2011.
7. Каменский А.А. Биология. Введение в экологию. М.: Дрофа, 2011.
8. Бородин П.М., Высоцкая Л.В., Дымшиц Г.М. и др. Биология (профильный уровень). 10-11 класс. В 2-х частях. М.: Просвещение, 2014.
9. Дубинина Н.В., Пасечник В.В. Биология. Бактерии, грибы, растения. 6 класс. М.: Дрофа, 2014.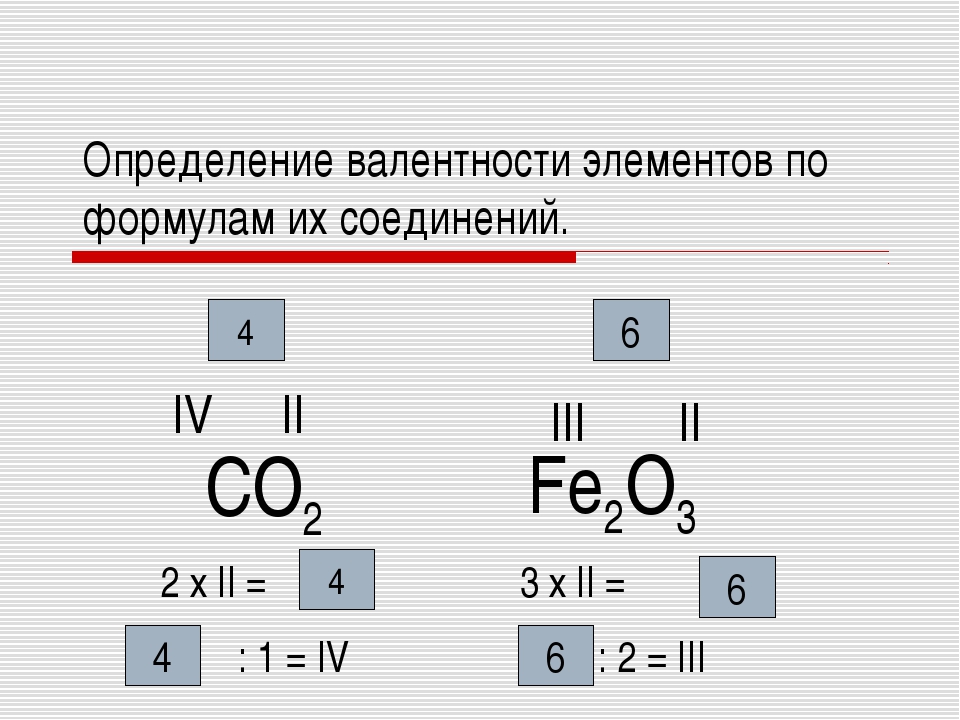
10. Каменский А.А., Криксунов Е.А., Пасечник В.В. Биология. Общая биология. 10-11 класс. М.: Дрофа, 2014.
11. Колесов Д.В., Маш Р.Д., Беляев И.Н. Биология. Человек. 8 класс. М.: Дрофа, 2014.
12. Пасечник В.В. Биология. 7 класс (серия «Линия жизни»). М.: Просвещение, 2013.
13. Пасечник В.В., Каменский А.А., Швецов Г.Г. (под ред. Пасечника В.В.) Биология. 8 класс. М.: Просвещение, 2013.
14. Пасечник В.В., Суматохин С.В., Калинова Г.С. (под ред. Пасечника В.В.) Биология. 7 кл. М.: Просвещение, 2013.
ПРОГРАММЫ ПО РУССКОМУ ЯЗЫКУ
Программы по русскому языку составлена в соответствии со школьной программой.
Цель: выявить наиболее грамотных абитуриентов, знающих орфографические и пунктуационные правила, культуру речи, умеющих точно выражать мысли, используя разнообразную лексику и различные грамматические конструкции.
ПРОГРАММА ПО РУССКОМУ ЯЗЫКУ
1.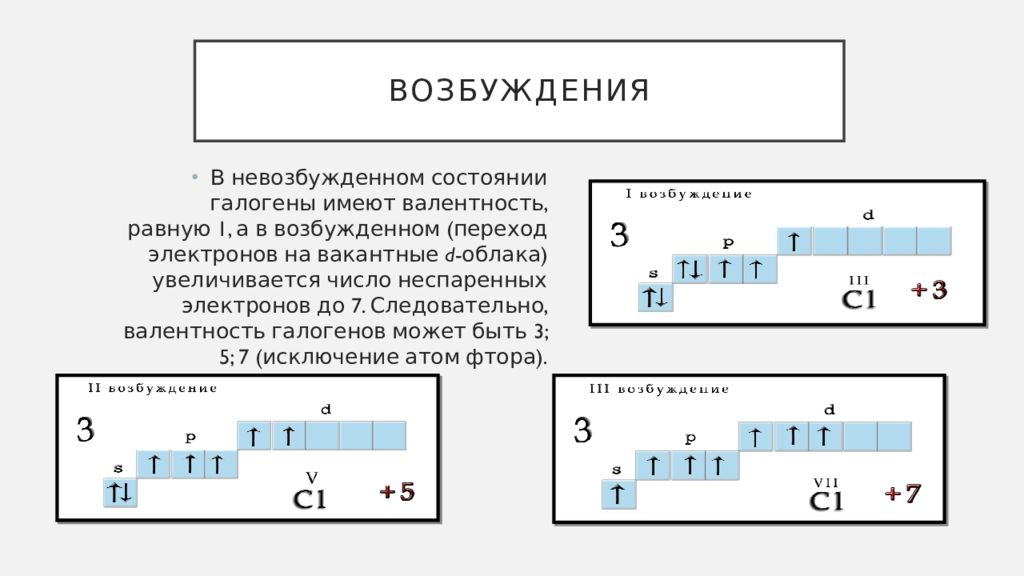 Орфография
Орфография
1. Правописание гласных в корне. Проверяемые безударные гласные. Непроверяемые безударные гласные. Чередующиеся гласные а-о, и-е. Гласные после шипящих. Гласные после ц. Буквы э — е. Буква й..
2. Правописание согласных в корне. Звонкие и глухие согласные. Двойные согласные в корне и на стыке приставки и корня. Непроизносимые согласные.
3. Употребление прописных букв. Прописные буквы в начале текста. Собственные имена лиц. Клички животных, наименования видов растений, сортов вин. Имена действующих лиц в произведениях. Названия документов, памятников старины, произведений искусства. Наименование должностей и званий. Названия литературных произведений и органов печати и др.
4. Разделительныеъ и ь. Употребление ъ. Употребление ь.
5. Правописание приставок. Приставки на з~. Приставка с-. Приставки пре- и при-. Гласные ы и и после приставок.
Приставка с-. Приставки пре- и при-. Гласные ы и и после приставок.
6. Гласные после шипящих и ц в суффиксах и окончаниях. Гласные о и епосле шипящих. Гласные после ц.
7. Правописание имен существительных. Окончания имен существительных. Суффиксы имен существительных. О и Е после шипящих в корне.
8. Правописание имен прилагательных. Окончания имен прилагательных. Суффиксы имен прилагательных.
9. Правописание сложных слов. Соединительные гласные о и е. Сложные слова без соединительной гласной. Правописание сложных существительных. Правописание сложных прилагательных.
10. Правописание имен числительных. Числительные количественные, порядковые, собирательные, дробные. Числительное пол-.
11. Правописание местоимений. Отрицательные местоимения.
Отрицательные местоимения.
12. Правописание глаголов. Личные окончания глаголов. Употребление ь в глагольных формах. Суффиксы глаголов.
13. Правописание причастий. Гласные в суффиксах причастий. Правописание н и нн в причастиях и отглагольных прилагательных.
14. Правописание наречий. Гласные на конце наречий. Наречия на шипящую. Отрицательные наречия. Слитное написание наречий. Дефисное написание наречий. Раздельное написание наречных сочетаний.
15. Правописание предлогов. Сложные предлоги. Слитное написание предлогов и предложных словосочетаний.
16. Правописание союзов. Слитное написание союзов. Раздельное написание союзов.
17. Правописание частиц.
2. Пунктуация
1. Знаки препинания в конце предложения и при перерыве речи.
2. Тире между членами предложения.
3. Знаки препинания в предложениях с однородными членами.
4. Знаки препинания при повторяющихся словах.
5. Знаки препинания в предложениях с обособленными членами.
6. Знаки препинания в предложениях с уточняющими, пояснительными и присоединительными членами предложения.
7. Знаки препинания при словах, грамматически не связанных с членами предложения.
8. Знаки препинания при междометиях, частицах, утвердительных, отрицательных и вопросительно-отрицательных словах.
9. Знаки препинания в сложносочиненных предложениях.
10. Знаки препинания в сложноподчиненных предложениях.
11. Знаки препинания при оборотах, не являющихся придаточными предложениями.
12. Знаки препинания в бессоюзных сложных предложениях.
13. Знаки препинания при прямой речи.
14. Знаки препинания при цитатах.
15. Употребление кавычек.
3. Культура речи.
1. Нормативный аспект культуры речи. Языковые нормы: орфоэпические (произношение), акцентологические (ударение), орфографические (написание), словообразовательные, лексические, морфологические, синтаксические, пунктуационные.
2. Функциональные стили русского языка: научный, официально-деловой, газетно-публицистический, художественный, разговорный.
Примеры тестов.
Задание 1. Укажите номер слова, в котором пропущена буква А.
1. Р…птание
2. Раств…рить
3. Г…ворливый
4. Утв…рь
Задание 2. Укажите номер слова, в котором пропущена И.
1. Об…скивать
2. Пред…нфарктный.
3. Спорт…гра.
4. С…скной.
Задание 3. Укажите номер предложения, в котором между подлежащим и сказуемым на месте подчеркнутого пробела тире не ставится.
1. Самое большое счастье для человека _ приносить людям радость.
2. Офицер этот _ не чета вам.
3. Любить тайгу _ значит восстанавливать ее богатства.
4. Трижды пять _ пятнадцать.
Задание 4. Укажите номер предложения с обстоятельством, в котором на месте подчеркнутого пробела запятая не ставится.
1. Очнувшись _ я некоторое время не мог опомниться.
2. Ворча и оглядываясь _ Каштанка вошла в комнату.
3. Он знал, что бросается _ очертя голову _ в омут, куда и заглядывать не стоило.
4. Отправляя Метелицу в разведку _ Левинсон наказал ему вернуться той же ночью.
Задание 5. Ударение неправильно поставлено в слове:
1) цепочка
2) оптовый
3) каталог
4) афиняне
5) свекла
Задание 6. Нормы сочетаемости слов нарушены в словосочетании:
1) основать выводы
2) разъяснять ошибки
3) беспокоиться за родителей
4) оплатить за проезд
5) мириться с недостатками
Литература
1. Баранов М.Т. Русский язык. Справочные материалы: пособие для учащихся общеобразовательных организаций / М.Т. Баранов, Т.А. Костяева, А.В. Прудникова; под ред. Н.М. Шанского. – 13-е изд.- М.: Просвещение, 2014. — 285 с.
2. Введенская Л.А. Русский язык и культура: учебное пособие/ Л.А. Введенская, М.Н. Черкасова. = Изд. 14-е, стер. — Ростов н/Д.: Феникс, 2013. – 38, [1] c.
3. Голуб И.Б. Русский язык: справочник/ И.Б. Голуб. – М.: КНОРУС, 2014. — 190 с.
4. Греков В.Ф. Пособие для занятий по русскому языку в старших классах/ В.Ф. Греков, С.Е. Крючков, Л.А. Чешко. — М., Просвещение, любое издание.
5. Розенталь Д.Э. Русский язык. Сборник правил и упражнений/ Д.Э. Розенталь. – М.: ЭКСМО. 2014. – 432 с.
Органическая химия 2 | Взаимное влияние атомов в молекулах органических соединений
Продолжаем разбирать основы органической химии. В теории Бутлерова сказано, что одна из особенностей строения веществ — взаимное влияние атомов друг на друга. Химические связи определяют свойства соединений. Например, в зависимости от радикалов и полярности связей в бензольном кольце новые атомы замещаются в разных положениях. Теория взаимного влияния атомов в молекуле — достаточно сложная тема. В статье мы разберем ее основы. Если вы хотите понимать химию лучше, запишитесь на курсы подготовки к ЕГЭ, где каждый раздел изучается подробно.
Химические связи в органических веществах
Прежде чем изучать влияние атомов друг на друга, нужно разобраться в природе связей в молекулах органических соединений. Вещества в органике образованы неметаллами — углеродом, кислородом, водородом, азотом, серой. Элементы связаны между собой ковалентными полярными связями. Они образуются в результате появления общих электронных пар. Рассмотрим на примере неорганического вещества — HCl. Водород имеет всего один электрон. Он и участвует в образовании соединений. У хлора на внешнем уровне 7 валентных электронов. Происходит объединение, при котором образуется общая плотность с 8 электронами. Хлор — более электроотрицательный элемент, поэтому он оттягивает на себя электронную плотность.
Это влияет на свойства органических соединений. Когда молекула HCl распадается (например, в водных растворах), хлор забирает себе электроны и становится анионом с зарядом —. Он будет взаимодействовать с электроположительными областями, то есть является нуклеофилом. Водород лишается электрона, поэтому становится катионом с зарядом +. В реакциях он выступает в роли электрофила, взаимодействуя с электроотрицательными участками. Напомним, что при распаде молекул с неполярной связью образуются радикалы — нейтральные частицы.
Смещение электронной плотности
Разберем влияние атомов в молекуле на примере хлорметана Ch4Cl. В нем присутствуют три типа связей: С-С, С-Н и С-Cl. Связь С-С неполярна, поэтому ее мы рассматривать не будем. В группе Ch4- углерод является более электроотрицательным элементом. Электронные плотности всех трех атомов водорода стянуты к нему. Они приобретают частично положительный заряд, а углерод — частично отрицательный. В связи C-Cl более электроотрицательным является хлор. Он забирает на себя электронную плотность со всей группы -Ch4. В химии это обозначают стрелками: Ch4→Cl. Метильный радикал передает электроны хлору, то есть является донором. Хлор, в свою очередь, выступает в роли акцептора. Если мы рассмотрим этан Ch4-Ch4, то не увидим такого явного донорно-акцепторного взаимодействия. Небольшое смещение наблюдается только по направлению от Н к С. В органических молекулах донорами являются все углеводородные радикалы. Акцепторами — группы, содержащие кислород, азот, галогены.
Индуктивный эффект
Первый вариант взаимного влияния атомов в молекулах органических веществ — индуктивный эффект. Он характеризует смещение плотности по сигма-связям. Эффект возникает в полярных молекулах, распространяется в одном направлении и быстро затухает. Пример индуктивного влияния — рассмотренный нами хлорметан Ch4→Cl. Метильная группа — это электрофильный (донорный) участок, обладающий положительным индуктивным эффектом +I. Галоген выступает в роли нуклеофильного участка с отрицательным эффектом -I. Важный момент: в акцепторной области всегда есть элемент с высокой электроотрицательностью (O, N, Hal).
Мезомерный эффект
Перед изучением мезомерного влияния атомов в молекулах органических веществ разберемся в таком понятии, как π-система. Как вам наверное известно, π-связь — часть кратной. Если в молекуле есть одна двойная или тройная связь, то она локализована, так как взаимодействует только с ядрами соседних атомов. Если же таких связей несколько и они разделены одним простым (сигма) переходом, то они делокализуются. Электронная плотность распределяется между всеми атомами, благодаря чему образуется сопряженная система. Простейшей π-системой является бутадиен-1,3. Кроме того, она реализуется в бензольном кольце. Сопряженные связи являются чем-то средним между одинарными и двойными. Они меняют свойства органических веществ.
Мезомерный эффект — это взаимное влияние атомов в молекуле с π-связями. В случае отрицательного эффекта электронная плотность притягивается атомом, в случае положительного — отталкивается.
Определение свойств веществ
Разберем примеры взаимного влияния атомов в молекулах. Сравним кислотные свойства фенола, этанола и азотной кислоты. Все три соединения можно описать общей формулой Х-О-Н. При этом электронная плотность смещается к более отрицательному кислороду, что обеспечивает отщепление водорода и, соответственно, кислотные свойства: Х-О←Н. Осталось определить, насколько сильно это взаимодействие:
-
В азотной кислоте есть нитрогруппа -NO2, обладающая отрицательными мезомерным и индуктивным эффектами. Азот — электроотрицательный элемент, он стягивает на себя электронную плотность, поэтому водород становится еще более активным. Вещество является сильной кислотой.
-
У этанола вместо Х стоит углеводородный радикал. Он обладает положительным индуктивным эффектом, из-за чего полярность связи О-Н снижается. У вещества очень слабые кислотные свойства.
-
Особенность фенола — наличие бензольного кольца. У кислорода есть неподеленная электронная пара, которая вступает в сопряжение с π-системой. Благодаря этому электронная плотность стягивается в кольцо, водород становится более подвижным. Кислотные свойства фенола сильнее, чем у этанола, но слабее азотной кислоты.
Итак, мы разобрались с взаимным влиянием атомов в молекуле, узнали о мезомерном и индуктивном эффектах. Эти термины не встречаются в ЕГЭ по химии, но они позволяют лучше понимать природу соединений и предсказывать их химические свойства. Разберитесь с теорией из статьи, а также уделите время практике, определяя эффекты у разных веществ. Это можно делать самостоятельно, а можно записаться на курсы и решать задачи под руководством преподавателя. В любом случае мы уверены — при должной подготовке вы сможете набрать высокие баллы на ЕГЭ.
Валентность (химия) — Valence (chemistry)
Мера объединяющей способности элемента с другими атомами, когда он образует химические соединения или молекулы
В химии , то валентность или валентность из элемента является мерой его способности комбинирования с другими атомами , когда она образует химические соединения или молекулу .
Описание
Комбинирующая способность или сродство атома данного элемента определяется количеством атомов водорода, с которыми он соединяется. В метане углерод имеет валентность 4; в аммиаке азот имеет валентность 3; в воде кислород имеет валентность 2; а в хлористом водороде хлор имеет валентность 1. Хлор, поскольку он имеет валентность, равную единице, может быть замещен водородом. Фосфор имеет валентность 5 в пентахлориде фосфора PCl 5 . Диаграммы валентности соединения представляют связь элементов с линиями, проведенными между двумя элементами, иногда называемыми связями, представляющими насыщенную валентность для каждого элемента. В двух таблицах ниже показаны некоторые примеры различных соединений, их диаграммы валентности и валентности для каждого элемента соединения.
| Сложный | H 2 Водород | CH 4 Метан | C 3 H 8 Пропан | C 2 H 2 ацетилен |
|---|---|---|---|---|
| Диаграмма | ||||
| Валентности |
|
|
|
Современные определения
Валентность определяется IUPAC как:
- Максимальное количество одновалентных атомов (первоначально атомов водорода или хлора), которые могут объединяться с атомом рассматриваемого элемента или с фрагментом, или для которых атом этого элемента может быть замещен.
Альтернативное современное описание:
- Число атомов водорода, которые могут соединяться с элементом в бинарном гидриде, или удвоенное число атомов кислорода, соединяющихся с элементом в его оксиде или оксидах.
Это определение отличается от определения IUPAC, поскольку можно сказать, что элемент имеет более одной валентности.
Очень похожее современное определение, данное в недавней статье, определяет валентность конкретного атома в молекуле как «количество электронов, которые атом использует для связывания», с двумя эквивалентными формулами для вычисления валентности:
- валентность = количество электронов в валентной оболочке свободного атома — количество несвязывающих электронов на атоме в молекуле ,
и
- валентность = количество облигаций + формальный заряд .
Историческое развитие
Этимологии из слов валентности (множественное число валентностей ) и валентности (множественное число валентностей ) восходит к 1425 году , что означает «экстракт, препарат», от латинского Валентии «сила, способность», от ранее доблесть «стоит, значение», так и химические вещества значение, относящееся к «объединяющей силе элемента», записано с 1884 года в немецком Валенце .
Концепция валентности была разработана во второй половине 19 века и помогла успешно объяснить молекулярную структуру неорганических и органических соединений. Поиски основных причин валентности привели к современным теориям химической связи, включая кубический атом (1902 г.), структуры Льюиса (1916 г.), теорию валентных связей (1927 г.), молекулярные орбитали (1928 г.), теорию отталкивания электронных пар валентных оболочек. (1958) и все передовые методы квантовой химии .
В 1789 году Уильям Хиггинс опубликовал взгляды на то, что он называл комбинациями «предельных» частиц, которые предвосхитили концепцию валентных связей . Если, например, согласно Хиггинсу, сила между конечной частицей кислорода и конечной частицей азота составляла 6, тогда сила силы была бы разделена соответственно, и аналогично для других комбинаций конечных частиц (см. Иллюстрацию) .
Однако точное начало теории химических валентностей можно проследить до работы Эдварда Франкленда 1852 года , в которой он объединил старую радикальную теорию с мыслями о химическом сродстве, чтобы показать, что определенные элементы имеют тенденцию соединяться с другими элементами, чтобы образуют соединения, содержащие 3, т. е. в группах с 3 атомами (например, NO 3 , NH 3 , NI 3 и т.д.) или 5, т. е. в группах с 5 атомами (например, NO 5 , NH 4 O, PO 5 и др.), Эквиваленты присоединяемых элементов. По его словам, именно так их родство удовлетворяется лучше всего, и, следуя этим примерам и постулатам, он заявляет, насколько очевидно, что
Тенденция или закон преобладает (здесь), и что, независимо от характера объединяющих атомов, объединяющая сила притягивающего элемента, если мне позволят термин, всегда удовлетворяется одним и тем же числом этих атомов. .
Эта «объединяющая сила» была впоследствии названа квантивалентностью или валентностью (и валентностью американские химики). В 1857 году Август Кекуле предложил фиксированные валентности для многих элементов, таких как 4 для углерода, и использовал их, чтобы предложить структурные формулы для многих органических молекул, которые до сих пор приняты.
Большинство химиков 19-го века определяли валентность элемента как количество его связей, не различая различных типов валентности или связи. Однако в 1893 году Альфред Вернер описал координационные комплексы переходных металлов, такие как [Co (NH 3 ) 6 ] Cl 3 , в которых он выделил основную и вспомогательную валентности (нем. «Hauptvalenz» и «Nebenvalenz»), соответствующие современным представлениям о степень окисления и координационное число соответственно.
Для элементов основной группы в 1904 году Ричард Абегг рассмотрел положительные и отрицательные валентности (максимальное и минимальное состояния окисления) и предложил правило Абегга, согласно которому их разница часто равна 8.
Электроны и валентность
Модель Резерфорда ядерного атома (1911) показала , что внешний вид атома занимают электроны , что свидетельствует , что электроны ответственны за взаимодействие атомов и образование химических связей. В 1916 году Гилберт Н. Льюис объяснил валентность и химическую связь в терминах тенденции атомов (основной группы) к достижению стабильного октета из 8 электронов валентной оболочки. Согласно Льюису, ковалентная связь приводит к октетам за счет разделения электронов, а ионная связь приводит к октетам за счет передачи электронов от одного атома к другому. Термин «ковалентность» приписывается Ирвингу Ленгмюру , который в 1919 году заявил, что «количество пар электронов, которые любой данный атом делит с соседними атомами, называется ковалентностью этого атома». Приставка co- означает «вместе», так что ковалентная связь означает, что атомы имеют общую валентность. После этого теперь чаще говорят о ковалентных связях, а не о валентности , которая вышла из употребления в высокоуровневых исследованиях из-за достижений теории химической связи, но все еще широко используется в элементарных исследованиях, где он обеспечивает эвристическое введение в предмет.
В 1930-х годах Линус Полинг предположил, что существуют также полярные ковалентные связи , которые занимают промежуточное положение между ковалентными и ионными, и что степень ионного характера зависит от разницы электроотрицательностей двух связанных атомов.
Полинг также рассматривал гипервалентные молекулы , в которых элементы основной группы имеют кажущуюся валентность больше, чем максимальное значение из 4, разрешенное правилом октетов. Например, в молекуле гексафторида серы (SF 6 ) Полинг считал, что сера образует 6 истинных двухэлектронных связей с использованием гибридных атомных орбиталей sp 3 d 2 , которые объединяют одну s, три p и две d орбитали. Однако недавно квантово-механические расчеты этой и подобных молекул показали, что роль d-орбиталей в связывании минимальна, и что молекула SF 6 должна быть описана как имеющая 6 полярных ковалентных (частично ионных) связей, образованных всего из четырех орбитали на сере (одна s и три p) в соответствии с правилом октетов вместе с шестью орбиталями на фторах. Подобные расчеты на молекулах переходных металлов показывают, что роль p-орбиталей незначительна, поэтому для описания связи достаточно одной s и пяти d-орбиталей на металле.
Общие валентности
Для элементов в основных группах в периодической таблице , валентность может варьироваться от 1 до 7.
Многие элементы имеют общую валентность, связанную с их положением в периодической таблице, и в настоящее время это объясняется правилом октетов . Префиксы греческих / латинских цифр (моно- / уни-, ди- / би-, три- / тер- и т. Д.) Используются для описания ионов в зарядовых состояниях 1, 2, 3 и т. Д. Соответственно. Поливалентность или многовалентность относятся к видам , которые не ограничены определенным числом валентных связей . Однозарядные виды одновалентны (одновалентны). Например, катион Cs + является одновалентным или одновалентным катионом, тогда как катион Ca 2+ является двухвалентным катионом, а катион Fe 3+ является трехвалентным катионом. В отличие от Cs и Ca, Fe также может существовать в других зарядовых состояниях, особенно 2+ и 4+, и поэтому известен как многовалентный (поливалентный) ион. Переходные металлы и металлы справа обычно многовалентны, но не существует простой схемы, предсказывающей их валентность.
† Те же прилагательные также используются в медицине для обозначения валентности вакцины с той небольшой разницей, что в последнем смысле квадри- более распространен, чем тетра- .
‡ Судя по количеству посещений в веб-поиске Google и поисковой системе Google Книг (по состоянию на 2017 г.).
§ Некоторые другие формы можно найти в больших англоязычных корпусах (например, * quintavalent, * quintivalent, * decivalent ), но они не являются общепринятыми формами в английском языке и поэтому не входят в основные словари.
Валентность в зависимости от степени окисления
Из-за двусмысленности термина валентность в настоящее время предпочтительны другие обозначения. Помимо системы степеней окисления, используемых в номенклатуре запасов для координационных соединений , и лямбда-обозначений, используемых в номенклатуре неорганической химии ИЮПАК , степень окисления является более четким показателем электронного состояния атомов в молекуле.
Степень окисления атома в молекуле дает количество валентных электронов, которые он получил или потерял. В отличие от числа валентности, степень окисления может быть положительной (для электроположительного атома) или отрицательной (для электроотрицательного атома).
Элементы с высокой степенью окисления могут иметь валентность выше четырех. Например, в перхлоратах хлор имеет семь валентных связей; рутений в степени окисления +8 в четырехокиси рутения имеет восемь валентных связей.
Примеры
* Одивалентный перхлорат-ион ( ClO —
4 ) имеет валентность 1.
** Оксид железа присутствует в кристаллической структуре , поэтому типичная молекула не может быть идентифицирована.
В закиси железа Fe имеет степень окисления II, в оксиде железа — степень окисления III.
| Сложный | Формула | Валентность | Состояние окисления |
|---|---|---|---|
| Хлор | Cl 2 | Cl = 1 | Cl = 0 |
| Пероксид водорода | Н 2 О 2 | Н = 1 О = 2 | H = +1 O = -1 |
| Ацетилен | С 2 Н 2 | С = 4 Н = 1 | С = -1 H = +1 |
| Хлорид ртути (I) | Hg 2 Cl 2 | Hg = 2 Cl = 1 | Hg = +1 Cl = -1 |
Валентности также могут отличаться от абсолютных значений степеней окисления из-за разной полярности связей. Например, в дихлорметане , CH 2 Cl 2 , углерод имеет валентность 4, но степень окисления 0.
Определение «Максимальное количество облигаций»
Франкланд придерживался мнения, что валентность (он использовал термин «атомарность») элемента — это единственное значение, которое соответствует максимальному наблюдаемому значению. Число неиспользуемых валентностей на атомах того, что сейчас называется p-блочными элементами, как правило, одинаково, и Франкланд предположил, что неиспользованные валентности насыщают друг друга. Например, азот имеет максимальную валентность 5, при образовании аммиака две валентности остаются несвязанными; сера имеет максимальную валентность 6, при образовании сероводорода четыре валентности не присоединяются.
Международный союз теоретической и прикладной химии (ИЮПАК) сделал несколько попыток , чтобы прийти к однозначному определению валентности. Текущая версия, принятая в 1994 году:
- Максимальное количество одновалентных атомов (первоначально атомов водорода или хлора), которые могут объединяться с атомом рассматриваемого элемента или с фрагментом, или для которых атом этого элемента может быть замещен.
Первоначально водород и хлор использовались в качестве примеров одновалентных атомов, поскольку по своей природе они образуют только одну одинарную связь. Водород имеет только один валентный электрон и может образовывать только одну связь с атомом, имеющим неполную внешнюю оболочку . Хлор имеет семь валентных электронов и может образовывать только одну связь с атомом, который отдает валентный электрон для завершения внешней оболочки хлора. Однако хлор также может иметь степень окисления от +1 до +7 и может образовывать более одной связи, отдавая валентные электроны .
Водород имеет только один валентный электрон, но он может образовывать связи более чем с одним атомом. В бифторид- ионе ( [HF
2 ] —
), например, он образует трехцентровую четырехэлектронную связь с двумя атомами фторида:
- [F – HF — ↔ F — H – F]
Другой пример — трехцентровая двухэлектронная связь в диборане (B 2 H 6 ).
Максимальные валентности элементов
Максимальные валентности элементов основаны на данных из списка степеней окисления элементов .
Смотрите также
Рекомендации
Формальных зарядов в органической химии
Прежде чем перейти к формальным зарядам, давайте вспомним валентность элементов в органической химии.
Взгляните на эти молекулы и попытайтесь найти схему связи для каждого элемента:
Вы могли заметить, что углерод имеет четыре связи в каждой молекуле, кислород имеет две, азот-три и галогены вместе с водородом обычно имеют только одна облигация. Теперь то, что вы наблюдаете, это, по сути, валентность этих атомов.
Проще говоря, валентность — это количество связей , которые данный элемент образует чаще всего . Это не означает, например, что углерод никогда не может иметь менее четырех связей или кислород никогда не будет связываться более чем с двумя атомами. Однако валентность указывает на количество связей, которые любит образовывать каждый элемент. Ниже приведена диаграмма, показывающая валентность углерода, азота, кислорода, галогенов и водорода.
Запомните эти числа! Они очень помогут вам сэкономить время при рисовании правильных органических структур и определении того, является ли структура Льюиса неправильной / неполной.
Вкратце: формальный заряд — это разница между валентными электронами атома и тем, сколько электронов он «владеет» в этой конкретной структуре Льюиса. Помните, что количество валентных электронов определяется просто в соответствии с номером группы атома.
Например, азот ниже формально имеет отрицательный заряд. Это потому, что он имеет пять валентных электронов, но владеет шестью — двумя неподеленными парами и одним электроном от каждой связи:
Мы упоминали выше, что иногда структуры Льюиса могут быть неправильными или неполными.Это может быть потому, что атомы неправильно соединены или / и электроны не распределены так, как они должны быть в соответствии с валентностью элементов.
Ниже представлена неполная структура Льюиса метоксид-иона:
Обратите внимание, это ион. Итак, где заряд и какой заряд; это положительно, это отрицательно? Это может быть углерод, водород или кислород, но вы не хотите тратить целый день на определение формального заряда конструкции.
Вместо этого сосредоточьтесь на элементах, которые не соответствуют своей валентности.В данном случае это кислород, поскольку он имеет только одну связь.
Формальный заряд можно рассчитать по следующей формуле:
FC = V — (N + B)
Где:
V — количество валентных электронов
N — количество не -связывающие электроны
B — количество связей
Итак, формальный заряд кислорода будет
FC (O) = 6 — (6 + 1) = -1
Это также может можно найти на диаграмме выше: кислород любит иметь две связи с двумя неподеленными парами электронов, и это когда он не имеет формального заряда.Имейте в виду, что в целом атомы не любят заряжаться.
Таким образом, если вам нужно идентифицировать и определить формальный заряд, ищите странный атом, такой как углерод с тремя связями, кислород без двух связей и т. Д. Как только вы его заметите, используйте формулу для вычисления формального заряжайте или, альтернативно, практикуйтесь, пока ваши глаза не станут естественно видеть тенденцию к образованию связей и зарядов в органических структурах.
1.
Укажите любые официальные сборы в приведенных ниже структурах:
Проверьте свои ответы
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединяясь к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению проблем, викторин с несколькими вариантами ответов, головоломок, и мощного набора из Краткое руководство по органической химии 1 и 2 .
Solution
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединяясь к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению проблем, викторин, головоломок, и мощному набору из Краткое руководство по органической химии 1 и 2 .
Ковалентные связи
Каждая из трех линий представляет собой общую пару электронов в ковалентной связи. Когда линии используются для представления связывающих пар электронов, структуру часто называют структурной формулой . Некоторые учебники для простоты опускают несвязывающие электроны.
Поскольку атом водорода имеет свою единственную 1 s орбиталь, завершенную только двумя электронами, молекула хлористого водорода нарисована, как показано на рисунке 7.
Рисунок 7.Молекула хлористого водорода.
Атомы водорода и хлора отдают по одному электрону ковалентной связи каждый. В молекуле водород завершил свою валентную оболочку двумя электронами, а хлор имеет полную оболочку с восемью валентными электронами.
В некоторых молекулах связанные атомы имеют более двух общих электронов, как в этилене (C 2 H 4 ), где два атома углерода имеют четыре общих электрона. (См. Рисунок 8.)
Рис. 8. Двойная связь между двумя атомами углерода.
Обратите внимание, что каждый углерод получает восемь электронов за счет этого распределения. Поскольку каждая общая пара представляет собой простую ковалентную связь, две общие пары называются двойной связью . Структура на правой стороне рисунка 8 показывает эту двойную связь четырех общих электронов двумя линиями, а левая часть рисунка
показывает двойную связь в виде двух пар точек.
Есть даже тройные связи шести общих электронов, как в молекуле азота. В N 2 каждый атом азота вносит пять валентных электронов.Из 10 электронов, показанных на рисунке 9, четыре не связывают, а шесть составляют тройную связь, удерживающую атомы азота вместе.
Рис. 9. Тройная связь между двумя атомами азота.
- Посмотрите на периодическую таблицу и определите количество валентных электронов алюминия и кислорода по положению столбцов этих двух элементов.
- Нарисуйте диаграмму Льюиса, представляющую электронную конфигурацию молекулы сероводорода, H 2 S.
Ковалентные соединения — Основы | chemclass-ol.org
Ковалентные связи были представлены во введении к ковалентным связям в разделе «Элементы» как разделение валентных электронов между атомами неметалла. Соединения H 2 , O 2 , N 2 , F 2 , Cl 2 , Br 2 и I 2 , обсуждаемые в этом разделе, являются ковалентными соединениями. Эти соединения будут использоваться для расширения обсуждения ковалентных соединений.
Во введении к ковалентной связи и ранее в разделе «Соединения» было сделано утверждение, что чем больше валентных электронов на валентном (внешнем) энергетическом уровне, тем выше стабильность этого атома. Наиболее стабильными атомами, встречающимися в природе, являются атомы благородных газов (Семейство 18), и, за исключением He, все они имеют 8 валентных электронов. Это приводит к «правилу октета », которое гласит, что всем атомам требуется 8 электронов на их валентном уровне энергии. Как и в случае со всеми правилами, есть исключения, и вы столкнетесь с ними.Но для большинства ковалентных соединений это правило соблюдается.
Прежде чем продолжить, необходимо познакомить вас с несколькими концепциями и инструментами.
Молекула — основная составляющая ковалентного соединения. См. Молекула, Ответы: молекула и Чудесные молекулы.
Структуры Льюиса используются, чтобы помочь визуализировать расположение атомов и валентных электронов в ковалентных соединениях.Проверьте следующие ссылки, чтобы узнать, что такое структуры Льюиса и как их использовать, Структура Льюиса, Диаграммы и структуры Льюиса, Верный способ Нарисуйте структуры Льюиса.Выберите элемент H. Covalent and Lewis Structures. Затем выберите «Простые структуры Льюиса» и следите за обсуждением.
Электроотрицательность — это расчетное значение, которое указывает на способность атома притягивать электроны к себе ковалентной связью. Атомы меньшего размера более электроотрицательны, чем атомы большего размера. Используя текущий Интернет-браузер, откройте второе окно. В Chrome, Firefox и Safari в раскрывающемся меню «Файл» есть пункт «Новое окно». Щелкните здесь, чтобы открыть новое окно.Скопируйте и вставьте следующий адрес: http://www.ptable.com/# Когда этот сайт станет доступен, щелкните вкладку «Свойства». Затем щелкните «электроотрицательность» в списке свойств, перечисленных над периодической таблицей. Обратите внимание, что наиболее электроотрицательным атомом в ковалентном соединении является фтор (F) со значением 3,98. Все остальные элементы имеют меньшие электроотрицательные значения. Откройте третье окно в своем браузере. Скопируйте и вставьте URL-адрес http://www.crystalmaker.com/support/tutorials/crystalmaker/atomicradii/index.html. Сравните размеры атомов на этом графике с электроотрицательными значениями в окне Ptable. Студент должен наблюдать и помнить электроотрицательную тенденцию в периодической таблице. Электроотрицательные значения увеличиваются при движении вправо в периоде и вверх в семье .
Форма молекулы, электронное расположение и симметрия важны для определения химических и физических свойств молекул, как будет обсуждаться ниже.
Примеры
Чтобы показать, как вышеуказанные концепции и инструменты применяются к ковалентным соединениям, мы начнем с двухатомных соединений H 2, Cl 2 O 2 и N 2 и перейдем к соединениям с другими сложные молекулы.У вас все еще должен быть открыт PTable (см. Инструкции выше), чтобы вы могли видеть количество валентных электронов.
H 2
Водород является исключением из правила октетов, потому что это гораздо меньший атом. Каждый атом водорода имеет один валентный электрон. Структура Льюиса для атома водорода
H в символе представляет ядро атома водорода, а точка представляет валентный электрон. ( Для атомов всех других элементов символ элемента представляет собой ядро и все электроны более низкого уровня энергии.Точки обозначают валентные электроны.)
Когда два атома водорода разделяют два электрона, структура Льюиса становится:
Каждая точка представляет собой валентный электрон от каждого из атомов водорода. Одна линия также используется для обозначения двух электронов, общих для двух атомов. Связь называется «одинарной связью », потому что два электрона разделяют два атома. Поскольку атомов всего два, структура молекулы водорода линейна.Два атома идентичны, поэтому электроотрицательность одинакова в каждом атоме, и электроны проводят одинаковое время вокруг каждого атома водорода. Молекулы H 2 симметричны как по расположению заряда, так и по отношению к атомам. Сообщается, что эта молекула имеет « неполярную ковалентную связь » и является «неполярной ковалентной молекулой ».
Cl 2
Атомы хлора имеют 7 валентных электронов. Структура Льюиса для атома Cl:
Символ Cl представляет собой ядро и все электроны нижнего уровня энергии.7 точек представляют 7 валентных электронов.
Когда два атома хлора разделяют два валентных электрона, структура Льюиса становится:
Два электрона разделяют два атома Cl, поэтому между атомами Cl имеется одинарная связь. Каждый хлор имеет 7 валентных электронов плюс один, который он разделяет, всего 8 валентных электронов. Таким образом, каждый атом Cl в результате совместного использования будет иметь 8 валентных электронов. Это правило октета.
Поскольку атомов всего два, структура молекулы Cl 2 является линейной.Эти два атома идентичны, поэтому электроотрицательность одинакова в каждом атоме, и электроны проводят одинаковое время вокруг каждого атома хлора. Молекулы Cl 2 симметричны как по расположению атомов, так и по заряду. Говорят, что эта молекула имеет неполярную ковалентную связь и является неполярной ковалентной молекулой.
O 2
Атомы кислорода имеют 6 валентных электронов. Структура Льюиса для атома O:
Когда два атома кислорода имеют общие валентные электроны, структура Льюиса становится:
Есть четыре электрона (2 пары), общих для двух атомов O, поэтому между атомами O существует «двойная связь » .Каждый кислород имеет 6 валентных электронов плюс те, которые он разделяет, всего 8 валентных электронов. Таким образом, каждый атом O будет иметь 8 валентных электронов в результате совместного использования. Это правило октета.
Поскольку атомов всего два, структура молекулы O 2 линейна. Эти два атома идентичны, поэтому электроотрицательность одинакова в каждом атоме, и электроны проводят одинаковое время вокруг каждого атома хлора. Молекулы O 2 симметричны как по расположению атомов, так и по заряду.Говорят, что эта молекула имеет неполярную ковалентную связь и является неполярной ковалентной молекулой.
N 2
Атомы азота имеют 5 валентных электронов. Структура Льюиса для атома N:
Когда два атома азота разделяют валентные электроны, структура Льюиса становится:
Два атома N имеют шесть электронов (3 пары), поэтому между атомами N существует «тройная связь » . Каждый азот имеет 5 валентных электронов плюс те, которые он разделяет, всего 8 валентных электронов.Таким образом, каждый атом N будет иметь 8 валентных электронов в результате совместного использования. Это правило октета.
Поскольку атомов всего два, структура молекулы N 2 является линейной. Эти два атома идентичны, поэтому электроотрицательность одинакова в каждом атоме, и электроны проводят одинаковое время вокруг каждого атома хлора. Молекулы N 2 симметричны как по расположению атомов, так и по заряду. Говорят, что эта молекула имеет неполярную ковалентную связь и является неполярной ковалентной молекулой.
Предыдущие примеры ковалентных связей показывают, как атомы могут обмениваться электронами для достижения правила октета (каждому атому требуется 8 электронов). Примеры также были использованы для представления существования одинарных связей (1 пара электронов, совместно используемых двумя атомами), двойных связей, (2 пары электронов, общих для двух атомов) и тройных связей (3 пары электронов, совместно используемых двумя атомами). между двумя атомами). Студент столкнется с каждым из вышеперечисленных в ходе этого курса.
HCl (хлористый водород)
Атом H имеет один валентный электрон, а атом Cl имеет 7 валентных электронов. Структура Льюиса для HCL:
H имеет 2 валентных электрона в результате совместного использования с Cl, а CL имеет 8 валентных электронов в результате совместного использования. Поскольку атомов всего два, структура молекулы HCl линейна. Электроотрицательность H составляет 2,20, а электроотрицательность Cl составляет 3,16. Как упоминалось выше, электроны будут проводить больше времени вокруг большего количества электроотрицательных атомов.Следовательно, электроны будут проводить больше времени вокруг атома Cl и меньше — вокруг атома H. Это приводит к несимметричному размещению заряда, при котором атом H заряжается более положительно, а атом Cl — более отрицательно. Такое разделение зарядов производит «диполь » (два полюса заряда) внутри молекулы HCl. Молекула HCl несимметрична с размещением атомов или зарядов. Утверждается, что эта молекула имеет « полярных ковалентных связей , связывающих » и представляет собой « полярные ковалентные молекулы» .Результат полярного ковалентного связывания можно наблюдать в таблице ниже, сравнивая температуры кипения. Тенденция температур кипения для H 2 , N 2 , O 2 и Cl 2 была представлена и объяснена во введении в ковалентные связи.
| СОЕДИНЕНИЕ | КОТЕЛЬНЫЙ PT (C) | МОЛЕКУЛЯРНАЯ МАССА (Г / МОЛЬ) |
| H 2 | -295 | 2 |
| N 2 | -195.8 | 28 |
| О 2 | -183 | 32 |
| HCL | -85 | 36,5 |
| О 2 | -34 | 71 |
Разница между молекулами H 2 , N 2 , O 2 , Cl 2 и HCl заключается в том, что молекулы HCl имеют постоянный диполь .Положительный конец молекул HCl будет притягиваться к отрицательным концам соседних молекул HCl. Сила этого «межмолекулярного притяжения » требует больше энергии для их разделения, что отражается в более высокой температуре кипения.
Почему Cl 2 неполярное соединение имеет более высокую температуру кипения, чем HCl полярное соединение? Разница связана с тем, что молекулы Cl 2 больше (примерно в 2 раза), чем молекулы HCl. Больший размер позволяет формировать постоянные диполи и (прокрутите до конца страницы) и небольшое притяжение между соседними молекулами.Для сравнения, O 2 и HCl ближе по размеру, но есть большая разница в точках кипения из-за диполей в молекулах HCl.
Вышеупомянутое обсуждение было сосредоточено на двухатомных молекулах, чтобы проиллюстрировать основные принципы, которые будут применяться ко всем молекулам. Теперь обсуждение будет расширено, чтобы включить соединения с более крупными молекулами.
Что такое валентность или валентность в химии?
Слова валентность и валентность имеют в химии два связанных значения.
Валентность описывает, насколько легко атом или радикал могут сочетаться с другими химическими соединениями. Это определяется на основе количества электронов, которые будут добавлены, потеряны или разделены, если он вступит в реакцию с другими атомами.
Валентность обозначается с использованием положительного или отрицательного целого числа, используемого для представления этой связывающей способности. Например, обычные валентности меди — 1 и 2.
| Номер | Элемент | Валентность |
| 1 | Водород | (-1), +1 |
| 2 | Гелий | 0 |
| 3 | Литий | +1 |
| 4 | Бериллий | +2 |
| 5 | Бор | -3, +3 |
| 6 | Углерод | (+2), +4 |
| 7 | Азот | -3, -2, -1, (+1), +2, +3, +4, +5 |
| 8 | Кислород | -2 |
| 9 | Фтор | -1, (+1) |
| 10 | Неон | 0 |
| 11 | Натрий | +1 |
| 12 | Магний | +2 |
| 13 | Алюминий | +3 |
| 14 | Кремний | -4, (+2), +4 |
| 15 | фосфор | -3, +1, +3, +5 |
| 16 | сера | -2, +2, +4, +6 |
| 17 | Хлор | -1, +1, (+2), +3, (+4), +5, +7 |
| 18 | Аргон | 0 |
| 19 | Калий | +1 |
| 20 | Кальций | +2 |
| 21 | Скандий | +3 |
| 22 | Титан | +2, +3, +4 |
| 23 | Ванадий | +2, +3, +4, +5 |
| 24 | Хром | +2, +3, +6 |
| 25 | Марганец | +2, (+3), +4, (+6), +7 |
| 26 | Утюг | +2, +3, (+4), (+6) |
| 27 | Кобальт | +2, +3, (+4) |
| 28 | Никель | (+1), +2, (+3), (+4) |
| 29 | Медь | +1, +2, (+3) |
| 30 | цинк | +2 |
| 31 | Галлий | (+2).+3 |
| 32 | Германий | -4, +2, +4 |
| 33 | Мышьяк | -3, (+2), +3, +5 |
| 34 | Селен | -2, (+2), +4, +6 |
| 35 | Бром | -1, +1, (+3), (+4), +5 |
| 36 | Криптон | 0 |
| 37 | Рубидий | +1 |
| 38 | Стронций | +2 |
| 39 | Иттрий | +3 |
| 40 | Цирконий | (+2), (+3), +4 |
| 41 | Ниобий | (+2), +3, (+4), +5 |
| 42 | молибден | (+2), +3, (+4), (+5), +6 |
| 43 | Технеций | +6 |
| 44 | Рутений | (+2), +3, +4, (+6), (+7), +8 |
| 45 | Родий | (+2), (+3), +4, (+6) |
| 46 | Палладий | +2, +4, (+6) |
| 47 | Серебро | +1, (+2), (+3) |
| 48 | Кадмий | (+1), +2 |
| 49 | Индий | (+1), (+2), +3 |
| 50 | Олово | +2, +4 |
| 51 | Сурьма | -3, +3, (+4), +5 |
| 52 | Теллур | -2, (+2), +4, +6 |
| 53 | Йод | -1, +1, (+3), (+4), +5, +7 |
| 54 | Ксенон | 0 |
| 55 | Цезий | +1 |
| 56 | Барий | +2 |
| 57 | Лантан | +3 |
| 58 | Церий | +3, +4 |
| 59 | празеодим | +3 |
| 60 | Неодим | +3, +4 |
| 61 | Прометий | +3 |
| 62 | Самарий | (+2), +3 |
| 63 | Европий | (+2), +3 |
| 64 | Гадолиний | +3 |
| 65 | Тербий | +3, +4 |
| 66 | Диспрозий | +3 |
| 67 | Гольмий | +3 |
| 68 | Эрбий | +3 |
| 69 | Тулий | (+2), +3 |
| 70 | Иттербий | (+2), +3 |
| 71 | Лютеций | +3 |
| 72 | Гафний | +4 |
| 73 | Тантал | (+3), (+4), +5 |
| 74 | Вольфрам | (+2), (+3), (+4), (+5), +6 |
| 75 | Рений | (-1), (+1), +2, (+3), +4, (+5), +6, +7 |
| 76 | Осмий | (+2), +3, +4, +6, +8 |
| 77 | Иридий | (+1), (+2), +3, +4, +6 |
| 78 | Платина | (+1), +2, (+3), +4, +6 |
| 79 | Золото | +1, (+2), +3 |
| 80 | Меркурий | +1, +2 |
| 81 | Таллий | +1, (+2), +3 |
| 82 | Свинец | +2, +4 |
| 83 | висмут | (-3), (+2), +3, (+4), (+5) |
| 84 | полоний | (-2), +2, +4, (+6) |
| 85 | Астатин | ? |
| 86 | Радон | 0 |
| 87 | Франций | ? |
| 88 | Радий | +2 |
| 89 | Актиний | +3 |
| 90 | Торий | +4 |
| 91 | Протактиний | +5 |
| 92 | Уран | (+2), +3, +4, (+5), +6 |
ковалентная связь — одинарная связь
Связь в хлоридах фосфора, PCl 3 и PCl 5
Что плохого в простом представлении PCl 3 ?
На этой диаграмме показаны только внешние (связывающие) электроны.
В этом нет ничего плохого! (Хотя он не учитывает форму молекулы должным образом.) Если бы вы собирались взглянуть на это более современно, аргумент был бы таким:
Фосфор имеет электронную структуру 1s 2 2s 2 2p 6 3s 2 3p x 1 3p y 1 3p z 1 . Если рассматривать только внешние электроны как «электроны в ящиках»:
Есть 3 неспаренных электрона, которые могут быть использованы для образования связей с 3 атомами хлора.Четыре трехуровневых орбитали гибридизуются с образованием 4 эквивалентных гибридов sp 3 , как и в случае углерода, за исключением того, что одна из этих гибридных орбиталей содержит неподеленную пару электронов.
Затем каждый из трех хлоринов образует ковалентную связь путем слияния атомной орбитали, содержащей его неспаренный электрон, с одним из неспаренных электронов фосфора, образуя 3 молекулярные орбитали.
Вы можете спросить, стоит ли все это беспокоиться! Возможно нет! Но стоит с PCl 5 .
Что плохого в простом виде PCl 5 ?
Как вы помните, изображение PCl 5 с точками и крестиками выглядит неуклюже, потому что фосфор не имеет структуры благородного газа. На этой диаграмме также показаны только внешние электроны.
В данном случае более современный взгляд улучшает ситуацию, отказываясь от каких-либо претензий на беспокойство о структурах благородных газов.
Если фосфор собирается образовать PCl 5 , он должен сначала произвести 5 неспаренных электронов.Он делает это, продвигая один из электронов на 3s-орбитали на следующую доступную орбиталь с более высокой энергией.
Какая орбиталь с более высокой энергией? Он использует одну из трехмерных орбиталей. Вы могли ожидать, что он будет использовать орбиталь 4s, потому что это орбиталь, которая заполняется до 3d, когда атомы строятся с нуля. Не так! Кроме того, когда вы в первую очередь строите атомы, 3d всегда считается орбиталью с более низкой энергией.
Это оставляет фосфор с таким расположением его электронов:
Трехуровневые электроны теперь перестраиваются (гибридизуются), чтобы дать 5 гибридных орбиталей с одинаковой энергией.Их можно было бы назвать гибридами sp 3 d, потому что они сделаны из них.
Электроны на каждой из этих орбиталей будут делить пространство с электронами пяти хлоринов, чтобы образовать пять новых молекулярных орбиталей — и, следовательно, пять ковалентных связей.
Почему фосфор образует эти две лишние связи? Он вкладывает определенное количество энергии в продвижение электрона, которое более чем окупается, когда формируются новые связи. Проще говоря, для фосфора энергетически выгодно образовывать дополнительные связи.
Преимущество такого подхода заключается в том, что он полностью игнорирует вопрос о том, есть ли у вас структура с благородным газом, и поэтому вы не беспокоитесь об этом.
(PDF) Реакции диоксида хлора с органическими соединениями
9. Wayne RP, Poulet G., Biggs P., Burrows JP, Cox
RA, Curtzen PJ, Hayman GD, Jekin ME, Bras
GL, Moortgat GK , Platt U., Schindler RN, At-
mospheres Environment 29, 2677-2881. (1995).
10. Люк Б.Т., J. Mol. Struct. (Theochem) 332, 283-
289 (1995).
11. Flesch R., Ruhl E., Hottmann K., Baumgartel
H., J. Phys. Chem. 97, 837-844 (1993).
12. Gilles M.K., Polak M.L., Lineberger W.C., J.
Chem. Phys. 96, 8012 (1992).
13. Троицкая Н.В., Мищенко К.Р., Флис И.Е., J.
Phys. Chem. СССР 33, 1577 (1959).
14. Vandrkooi N., Poole T.R., Inorg. Chem. 5, 1351-
1354 (1966).
15. Сугихара Х., Симокоши К., Ясумори И., J.
Phys. Chem. 81, 669-673 (1977).
16. Симокоши К., Сугихара Х., Ясумори И., J.
Phys. Chem. 78, 1770–1771 (1974).
17. Надолинный В.А., Макотченко В.Г., Даниленко
А.М., J.Struct.Chem. 39, 204-211 (1998).
18. Рехр А., Янсен М., Ангью. Chem. Int. Эд. Англ.
30, 1510-1512 (1991).
19. Рехр А., Янсен М., Неорг. Chem. 31, 4740-4742
(1992).
20. Миядзаки К., Танура М., Танака К., Танака
Т., J. Mol. Spectrosc. 116, 435-449 (1986).
21. Танака К., Танака Т., J. Mol. Spectrosc. 98, 425-
452 (1983).
22. Ортигосо Дж., Эскрибано Р., Буркхолдер Дж. Б.,
Ховард К. Дж., Лафферти В. Дж., J. Mol. Spectrosc.
148, 346-370 (1991).
23. Ортигосо Дж., Эскрибано Р., Буркхолдер Дж. Б., Хо-
, палата К. Дж., Лафферти В. Дж., J. Mol. Spectrosc. 156,
89-97 (1992).
24. Ортигосо Дж., Эскрибано Р., Буркхолдер Дж. Б., Хо-
, палата К. Дж., Лафферти В. Дж., J. Mol. Spectrosc. 155,
25-43 (1992).
25. Ортигосо Дж., Эскрибано Р., Буркхолдер Дж. Б., Хо-
, палата К. Дж., Лафферти В. Дж., Дж. Мол. Spectrosc. 158,
343-356 (1993).
26. Петерсон К.А., Вернер Х.Дж., J. Chem. Phys. 96,
8948-8961 (1992).
27. Петерсон К.А., Вернер Х.Дж., J. Chem. Phys. 105,
9823-9832 (1996).
28. Петерсон К.А., J. Chem. Phys. 109, 8864-8875
(1998).
29. Fangstrom T., Edvardsson D., Ericsson M., Lu-
nell S., Enkvist C., Int. J. Quant. Chem. 66, 203-
217 (1998).
30. Janoschek R., J. Mol. Struct. (Theochem) 423,
219-224 (1998).
31. Белтран А., Андрес Дж., Нури С., Сильви Б., J. Phys.
Chem. А 103, 3078-3088 (1999).
32. Вайда В., Саймон Дж. Д., Science 268, 1443-1448
(1995).
33. Hoigne J., Tratnyek P.G., Water Res. 28, 57-66
(1994).
34. Choshen E., Elits R., Rav-Acha C., Tetrahedron
Lett. 27, 5989-5992 (1986).
35. Рав-Ача К., Блиц Р., Water Res. 19, 1273-1281
(1985).
36. Рав-Ача К., Хошен Э., Environ. Sci. Technol.
21, 1069-1074 (1987).
37. Хойн Дж., Бадер Х., Вом Вассер 59, 253-267
(1982).
38. Шарма К. Б., React. Кинет.Катал. Lett. 19, 167-
173 (1982).
39. Шарма К. Б., React. Кинет. Катал. Lett. 28, 967-
975 (1983).
40. Суворкина Е.С. Кандидатская диссертация ИОЧ УНЦ
РАН, Уфа, 2002, с. 135.
41. Merenyi G., Lind J., Eriksen T.E., J. Amer.
Chem. Soc. 108, 7716-7726 (1986).
42. Козлов Ю.Н., Пурмаль А.П., Усков А.М. // Электрохимия.
J. Phys. Chem. 59, 930-932 (1985).
43. Козлов Ю.Н., Russ.J.Phys.Chem. (Англ.Пер.)
68, 218-220. (1994).
44. Alfassi Z.B., Huie R.E., Neta P., J. Phys. Chem.
90, 4156-4158 (1986).
45. Wajon J.E., Rosenblatt D.H., Burrows E.P., En-
viron. Sci. Technol. 16, 396-402 (1982).
46. Huie R.E., Neta P., J. Phys. Chem. 90, 1193-
1198 (1986).
47. Ганиев И.М., Ганиева Е.С., Кабальнова Н.Н.
Рус. Chem. Бык. 10, (2004).
48. Альфасси З. Б., Хуэ Р. Э., Нета П., Шоуте Л.C.T.,
J. Phys. Chem. 94, 8800-8805 (1990).
49. Neta P., Huie R.E., Ross A.B., J. Phys. Chem.
Арт. Данные 17, 1027-1284 (1988).
50. Ганиев И.М., Суворкина Е.С., Кабальнова Н.Н.
Рус. Chem. Бык. 52, № 5, 1123-1128 (2003).
51. Eriksen T.E., Lind J., Merenyi G., J. Chem. Soc.,
Faraday Trans. 1 77, 2137-2148 (1981).
52. Rosenblatt D.H., Hull L.A., De Luca D.C., Davis
G.T., Weglein R.C., Williams H.K.R., J. Amer.
Chem. Soc. 89, 1158-1163 (1967).
53. Халл Л.А., Дэвис Г.Т., Розенблатт Д.Х., Уилл-
iams H.K.R., Weglein R.C., J. Amer. Chem. Soc.
89, 1163-1170 (1967).
54. Голубев В.А., Козлов Ю.Н., Петров А.Н., Пурмал
А.П., Травина О.А. // Электрохимия. J. Phys. Chem. 60, 627-
628 (1986).
Eurasian ChemTech Journal 7 (2005) 1-31
И.М.Ганиев и др. 29
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.