Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / Таблица валентностей химических элементов.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Как узнать и определить валентность химического элемента по таблице Менделеева
Понятие «валентность» формировалось в химии с начала XIX века. Английский ученый Э. Франкленд обратил внимание, что все элементы могут образовывать с атомами других элементов только определенное количество связей. Он назвал это «соединительной силой». Позже немецкий ученый Ф. А. Кекуле изучал метан и пришел к выводу, что один атом углерода может присоединить в нормальных условиях только четыре атома водорода.
Английский ученый Э. Франкленд обратил внимание, что все элементы могут образовывать с атомами других элементов только определенное количество связей. Он назвал это «соединительной силой». Позже немецкий ученый Ф. А. Кекуле изучал метан и пришел к выводу, что один атом углерода может присоединить в нормальных условиях только четыре атома водорода.
Он назвал это основностью. Основность углерода равна четырем. То есть углерод может образовать четыре связи с другими элементами.
[block id=»32″]
…
Вконтакте
Google+
Мой мир
[block id=»33″]
Дальнейшее развитие понятие получило в работах Д. И. Менделеева . Дмитрий Иванович развивал учение о периодическом изменении свойств простых веществ. Соединительную силу он определял как способность элемента присоединять определенное количество атомов другого элемента.
Определение по таблице Менделеева
Таблица Менделеева позволяет с легкостью определять основность элементов. Для этого нужно уметь читать периодическую таблицу. Таблица по вертикали имеет восемь групп, а по горизонтали располагаются периоды. Если период состоит из двух рядов, то его называют большим, а если из одной — малым. Элементы по вертикали в столбцах, в группах распределены неравномерно. Валентность всегда обозначается римскими цифрами.
Для этого нужно уметь читать периодическую таблицу. Таблица по вертикали имеет восемь групп, а по горизонтали располагаются периоды. Если период состоит из двух рядов, то его называют большим, а если из одной — малым. Элементы по вертикали в столбцах, в группах распределены неравномерно. Валентность всегда обозначается римскими цифрами.
Чтобы определить валентность, нужно знать, какая она бывает. У металлов главных подгрупп она всегда постоянная, а у неметаллов и металлов побочных подгрупп может быть переменной.
Постоянная равна номеру группы. Переменная может быть высшей и низшей. Высшая переменная равна номеру группы, а низкая высчитывается по формуле: восемь минус номер группы. При определении нужно помнить:
- у водорода она равна I;
- у кислорода — II.
Если соединение имеет атом водорода или кислорода, то определить его валентность не составляет труда, особенно если перед нами гидрид или оксид.
[block id=»3″]
Формула и алгоритм
Самая меньшая валентность у тех элементов, которые расположены правее и выше в таблице. И, наоборот, если элемент ниже и левее, то она будет выше. Чтобы определить ее, необходимо следовать универсальному алгоритму:
И, наоборот, если элемент ниже и левее, то она будет выше. Чтобы определить ее, необходимо следовать универсальному алгоритму:
- Записываем формулу соединения.
- Проставляем валентность того компонента соединения, которого знаем.
- Умножаем известную величину на количество атомов элемента в соединении.
- Находим наименьшее кратное.
- Проводим проверку: умножаем значение на индекс. Должна получаться одинаковая цифра по каждому компоненту соединения.
Пример: возьмем соединение аммиака — Nh4. Нам известно, что у атома водорода валентность постоянная и равна I. Умножаем I на 3 (количество атомов) — наименьшее кратное — 3. У азота в этой формуле индекс равен единице. Отсюда вывод: 3 делим на 1 и получаем, что у азота она равна IIII.
Величину по водороду и кислороду всегда определять легко. Сложнее, когда ее необходимо определять без них. Например, соединение SiCl4. Как определить валентность элементов в этом случае? Хлор находится в 7 группе.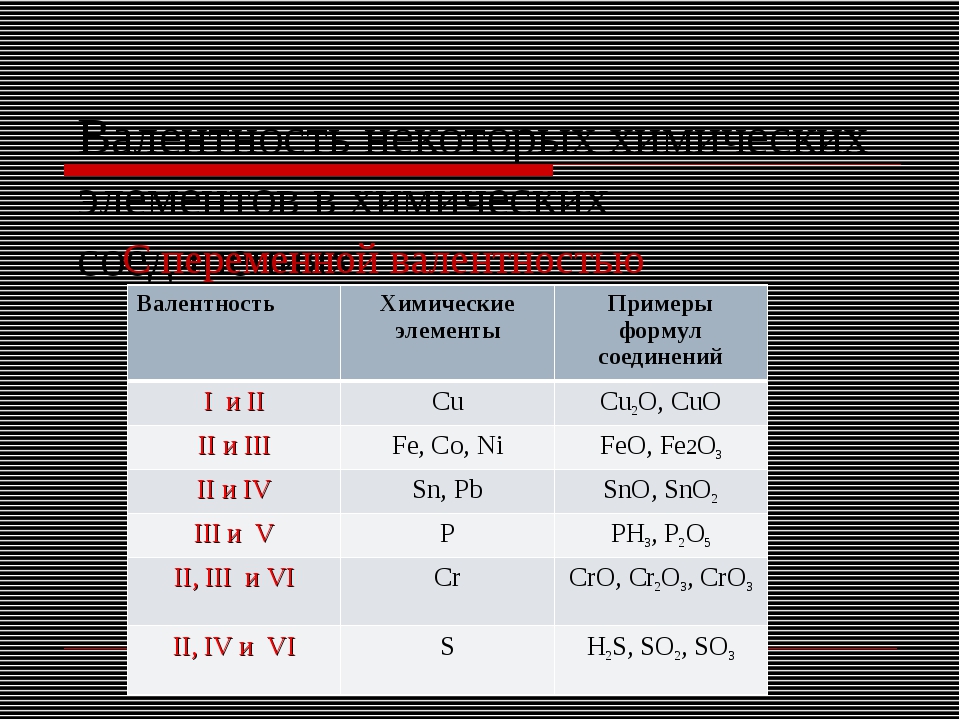 Значит, его валентность либо 7, либо 1 (восемь минус номер группы). Кремний находится в четвертой группе, значит, его потенциал для образования связей равен четырем. Становится логично, что хлор проявляет в этой ситуации наименьшую валентность и она равна I.
Значит, его валентность либо 7, либо 1 (восемь минус номер группы). Кремний находится в четвертой группе, значит, его потенциал для образования связей равен четырем. Становится логично, что хлор проявляет в этой ситуации наименьшую валентность и она равна I.
В современных учебниках химии всегда есть таблица валентности химических элементов. Это существенно облегчает задачу учащимся. Тему изучают в восьмом классе — в курсе неорганической химии.
[block id=»4″]
Современные представления
Современные представления о валентности базируются на строении атомов. Атом состоит из ядра и вращающихся на орбиталях электронах.
Само ядро состоит из протонов и нейтронов, которые определяют атомный вес. Для того чтобы вещество было стабильным, его энергетические уровни должны быть заполнены и иметь восемь электронов.
При взаимодействии элементы стремятся к стабильности и либо отдают свои неспаренные электроны, либо принимают их. Взаимодействие происходит по принципу «что легче» — отдать или принять электроны. От этого также зависит то, как изменяется валентность в таблице Менделеева. Количество неспаренных электронов на внешней энергетической орбитали равно номеру группы.
От этого также зависит то, как изменяется валентность в таблице Менделеева. Количество неспаренных электронов на внешней энергетической орбитали равно номеру группы.
В качестве примера
Щелочной металл натрий находится в первой группе периодической системы Менделеева. Это значит, что у него один неспаренный электрон на внешнем энергетическом уровне. Хлор находится в седьмой группе. Это значит, что у хлора есть семь неспаренных электронов. Для завершения энергетического уровня хлору не хватает ровно одного электрона. Натрий отдает ему свой электрон и становится стабильным в соединении. Хлор же получает дополнительный электрон и тоже становится стабильным. В итоге появляется связь и прочное соединение — NaCl — знаменитая поваренная соль. Валентность хлора и натрия в этом случае будет равна 1.
[block id=»5″]
[block id=»2″]
[block id=»10″]
Валентность химических элементов (Таблица)
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
— Валентность водорода (H) постоянна всегда 1. Отсюда в соединении h3O валентность O равна 2.
— Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
— Высшая валентность всегда равна № группы.
— Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
— У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
— У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
|
Атомный №
|
Химический элемент
|
Символ
|
Валентность химических элементов
|
Примеры соединений
|
|
1
|
Водород / Hydrogen
|
H
|
I
|
HF
|
|
2
|
Гелий / Helium
|
He
|
отсутствует
|
—
|
|
3
|
Литий / Lithium
|
Li
|
I
|
Li2O
|
|
4
|
Бериллий / Beryllium
|
Be
|
II
|
BeH2
|
|
5
|
Бор / Boron
|
B
|
III
|
BCl3
|
|
6
|
Углерод / Carbon
|
C
|
IV, II
|
CO2, CH4
|
|
7
|
Азот / Nitrogen
|
N
|
III, IV
|
NH3
|
|
8
|
Кислород / Oxygen
|
O
|
II
|
H2O, BaO
|
|
9
|
Фтор / Fluorine
|
F
|
I
|
HF
|
|
10
|
Неон / Neon
|
Ne
|
отсутствует
|
—
|
|
11
|
Натрий / Sodium
|
Na
|
I
|
Na2O
|
|
12
|
Магний / Magnesium
|
Mg
|
II
|
MgCl2
|
|
13
|
Алюминий / Aluminum
|
Al
|
III
|
Al2O3
|
|
14
|
Кремний / Silicon
|
Si
|
IV
|
SiO2, SiCl4
|
|
15
|
Фосфор / Phosphorus
|
P
|
III, V
|
PH3, P2O5
|
|
16
|
Сера / Sulfur
|
S
|
VI, IV, II
|
H2S, SO3
|
|
17
|
Хлор / Chlorine
|
Cl
|
I, III, V, VII
|
HCl, ClF3
|
|
18
|
Аргон / Argon
|
Ar
|
отсутствует
|
—
|
|
19
|
Калий / Potassium
|
K
|
I
|
KBr
|
|
20
|
Кальций / Calcium
|
Ca
|
II
|
CaH2
|
|
21
|
Скандий / Scandium
|
Sc
|
III
|
Sc2S3
|
|
22
|
Титан / Titanium
|
Ti
|
II, III, IV
|
Ti2O3, TiH4
|
|
23
|
Ванадий / Vanadium
|
V
|
II, III, IV, V
|
VF5, V2O3
|
|
24
|
Хром / Chromium
|
Cr
|
II, III, VI
|
CrCl2, CrO3
|
|
25
|
Марганец / Manganese
|
Mn
|
II, III, IV, VI, VII
|
Mn2O7, Mn2(SO4)3
|
|
26
|
Железо / Iron
|
Fe
|
II, III
|
FeSO4, FeBr3
|
|
27
|
Кобальт / Cobalt
|
Co
|
II, III
|
CoI2, Co2S3
|
|
28
|
Никель / Nickel
|
Ni
|
II, III, IV
|
NiS, Ni(CO)4
|
|
29
|
Медь / Copper
|
Сu
|
I, II
|
CuS, Cu2O
|
|
30
|
Цинк / Zinc
|
Zn
|
II
|
ZnCl2
|
|
31
|
Галлий / Gallium
|
Ga
|
III
|
Ga(OH)3
|
|
32
|
Германий / Germanium
|
Ge
|
II, IV
|
GeBr4, Ge(OH)2
|
|
33
|
Мышьяк / Arsenic
|
As
|
III, V
|
As2S5, H3AsO4
|
|
34
|
Селен / Selenium
|
Se
|
II, IV, VI,
|
H2SeO3
|
|
35
|
Бром / Bromine
|
Br
|
I, III, V, VII
|
HBrO3
|
|
36
|
Криптон / Krypton
|
Kr
|
VI, IV, II
|
KrF2, BaKrO4
|
|
37
|
Рубидий / Rubidium
|
Rb
|
I
|
RbH
|
|
38
|
Стронций / Strontium
|
Sr
|
II
|
SrSO4
|
|
39
|
Иттрий / Yttrium
|
Y
|
III
|
Y2O3
|
|
40
|
Цирконий / Zirconium
|
Zr
|
II, III, IV
|
ZrI4, ZrCl2
|
|
41
|
Ниобий / Niobium
|
Nb
|
I, II, III, IV, V
|
NbBr5
|
|
42
|
Молибден / Molybdenum
|
Mo
|
II, III, IV, V, VI
|
Mo2O5, MoF6
|
|
43
|
Технеций / Technetium
|
Tc
|
I — VII
|
Tc2S7
|
|
44
|
Рутений / Ruthenium
|
Ru
|
II — VIII
|
RuO4, RuF5, RuBr3
|
|
45
|
Родий / Rhodium
|
Rh
|
I, II, III, IV, V
|
RhS, RhF3
|
|
46
|
Палладий / Palladium
|
Pd
|
I, II, III, IV
|
Pd2S, PdS2
|
|
47
|
Серебро / Silver
|
Ag
|
I, II, III
|
AgO, AgF2, AgNO3
|
|
48
|
Кадмий / Cadmium
|
Cd
|
II
|
CdCl2
|
|
49
|
Индий / Indium
|
In
|
III
|
In2O3
|
|
50
|
Олово / Tin
|
Sn
|
II, IV
|
SnBr4, SnF2
|
|
51
|
Сурьма / Antimony
|
Sb
|
III, IV, V
|
SbF5, SbH3
|
|
52
|
Теллур / Tellurium
|
Te
|
VI, IV, II
|
TeH2, H6TeO6
|
|
53
|
Иод / Iodine
|
I
|
I, III, V, VII
|
HIO3, HI
|
|
54
|
Ксенон / Xenon
|
Xe
|
II, IV, VI, VIII
|
XeF6, XeO4, XeF2
|
|
55
|
Цезий / Cesium
|
Cs
|
I
|
CsCl
|
|
56
|
Барий / Barium
|
Ba
|
II
|
Ba(OH)2
|
|
57
|
Лантан / Lanthanum
|
La
|
III
|
LaH3
|
|
58
|
Церий / Cerium
|
Ce
|
III, IV
|
CeO2 , CeF3
|
|
59
|
Празеодим / Praseodymium
|
Pr
|
III, IV
|
PrF4, PrO2
|
|
60
|
Неодим / Neodymium
|
Nd
|
III
|
Nd2O3
|
|
61
|
Прометий / Promethium
|
Pm
|
III
|
Pm2O3
|
|
62
|
Самарий / Samarium
|
Sm
|
II, III
|
SmO
|
|
63
|
Европий / Europium
|
Eu
|
II, III
|
EuSO4
|
|
64
|
Гадолиний / Gadolinium
|
Gd
|
III
|
GdCl3
|
|
65
|
Тербий / Terbium
|
Tb
|
III, IV
|
TbF4, TbCl3
|
|
66
|
Диспрозий / Dysprosium
|
Dy
|
III
|
Dy2O3
|
|
67
|
Гольмий / Holmium
|
Ho
|
III
|
Ho2O3
|
|
68
|
Эрбий / Erbium
|
Er
|
III
|
Er2O3
|
|
69
|
Тулий / Thulium
|
Tm
|
II, III
|
Tm2O3
|
|
70
|
Иттербий / Ytterbium
|
Yb
|
II, III
|
YO
|
|
71
|
Лютеций / Lutetium
|
Lu
|
III
|
LuF3
|
|
72
|
Гафний / Hafnium
|
Hf
|
II, III, IV
|
HfBr3, HfCl4
|
|
73
|
Тантал / Tantalum
|
Ta
|
I — V
|
TaCl5, TaBr2, TaCl4
|
|
74
|
Вольфрам / Tungsten
|
W
|
II — VI
|
WBr6, Na2WO4
|
|
75
|
Рений / Rhenium
|
Re
|
I — VII
|
Re2S7, Re2O5
|
|
76
|
Осмий / Osmium
|
Os
|
II — VI, VIII
|
OsF8, OsI2, Os2O3
|
|
77
|
Иридий / Iridium
|
Ir
|
I — VI
|
IrS3, IrF4
|
|
78
|
Платина / Platinum
|
Pt
|
I, II, III, IV, V
|
Pt(SO4)3, PtBr4
|
|
79
|
Золото / Gold
|
Au
|
I, II, III
|
AuH, Au2O3, Au2Cl6
|
|
80
|
Ртуть / Mercury
|
Hg
|
II
|
HgF2, HgBr2
|
|
81
|
Талий / Thallium
|
Tl
|
I, III
|
TlCl3, TlF
|
|
82
|
Свинец / Lead
|
Pb
|
II, IV
|
PbS, PbH4
|
|
83
|
Висмут / Bismuth
|
Bi
|
III, V
|
BiF5, Bi2S3
|
|
84
|
Полоний / Polonium
|
Po
|
VI, IV, II
|
PoCl4, PoO3
|
|
85
|
Астат / Astatine
|
At
|
нет данных
| — |
|
86
|
Радон / Radon
|
Rn
|
отсутствует
| — |
|
87
|
Франций / Francium
|
Fr
|
I
| — |
|
88
|
Радий / Radium
|
Ra
|
II
|
RaBr2
|
|
89
|
Актиний / Actinium
|
Ac
|
III
|
AcCl3
|
|
90
|
Торий / Thorium
|
Th
|
II, III, IV
|
ThO2, ThF4
|
|
91
|
Проактиний / Protactinium
|
Pa
|
IV, V
|
PaCl5, PaF4
|
|
92
|
Уран / Uranium
|
U
|
III, IV
|
UF4, UO3
|
|
93
|
Нептуний
|
Np
|
III — VI
|
NpF6, NpCl4
|
|
94
|
Плутоний
|
Pu
|
II, III, IV
|
PuO2, PuF3, PuF4
|
|
95
|
Америций
|
Am
|
III — VI
|
AmF3, AmO2
|
|
96
|
Кюрий
|
Cm
|
III, IV
|
CmO2, Cm2O3
|
|
97
|
Берклий
|
Bk
|
III, IV
|
BkF3, BkO2
|
|
98
|
Калифорний
|
Cf
|
II, III, IV
|
Cf2O3
|
|
99
|
Эйнштейний
|
Es
|
II, III
|
EsF3
|
|
100
|
Фермий
|
Fm
|
II, III
|
—
|
|
101
|
Менделевий
|
Md
|
II, III
|
—
|
|
102
|
Нобелий
|
No
|
II, III
|
—
|
|
103
|
Лоуренсий
|
Lr
|
III
|
—
|
|
Номер
|
Элемент
|
Символ
|
Валентность химических элементов
|
Пример
|
Таблица валентностей химических элементов. Таблица валентности. Стандартные, высшие, низшие, редкие валентности, исключения. Максимальная валентность, минимальная валентность. Версия для печати.
Валентность химических элементов – это способность у атомов химических элементов образовывать некоторое число химических связей. Определяется числом электронов атома затраченых на образование химических связей с другим атомом. Справочно: Электронные формулы атомов химических элементов.
Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются.
Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..
|
Как определить валентность по таблице Менделеева и как она изменяется
Различные химические элементы отличаются по своей способности создавать химические связи, то есть соединяться с другими атомами. Поэтому в сложных веществах они могут находиться только в определенных соотношениях. Разберемся, как определить валентность по таблице Менделеева.
Поэтому в сложных веществах они могут находиться только в определенных соотношениях. Разберемся, как определить валентность по таблице Менделеева.
Что такое валентность?
Существует такое определение валентности: это способность атома к образованию определенного числа химических связей. В отличие от степени окисления, эта величина всегда только положительная и обозначается римскими цифрами.
В качестве единицы используется эта характеристика для водорода, которая принята равной I. Это свойство показывает, с каким числом одновалентных атомов может соединиться данный элемент. Для кислорода эта величина всегда равна II.
Знать эту характеристику необходимо, чтобы верно записывать химические формулы веществ и уравнения реакций. Знание этой величины поможет установить соотношение между числом атомов различных типов в молекуле.
Данное понятие возникло в химии в XIX веке. Начало теории, объясняющей соединение атомов в различных соотношениях, положил Франкленд, но его идеи о «связывающей силе» не были очень распространены. Решающая роль в развитии теории принадлежала Кекуле. Он называл свойство образовывать некоторое количество связей основностью. Кекуле считал, что это фундаментальное и неизменное свойство каждого вида атомов. Важные дополнения к теории сделал Бутлеров. С развитием этой теории стало возможным наглядно изображать молекулы. Это очень помогло в изучении строения различных веществ.
Решающая роль в развитии теории принадлежала Кекуле. Он называл свойство образовывать некоторое количество связей основностью. Кекуле считал, что это фундаментальное и неизменное свойство каждого вида атомов. Важные дополнения к теории сделал Бутлеров. С развитием этой теории стало возможным наглядно изображать молекулы. Это очень помогло в изучении строения различных веществ.
Чем поможет периодическая таблица?
Находить валентность можно, посмотрев на номер группы в короткопериодном варианте. Для большинства элементов, у которых эта характеристика постоянная (принимает только одно значение), она совпадает с номером группы.
Такие свойства имеют металлы главных подгрупп. Почему? Номер группы соответствует числу электронов на внешней оболочке. Эти электроны называются валентными. Именно они отвечают за возможность соединяться с другими атомами.
Группу составляют элементы с похожим устройством электронной оболочки, а сверху вниз возрастает заряд ядра. В короткопериодной форме каждая группа делится на главную и побочную подгруппы. Представители главных подгрупп — это s и p-элементы, представители побочных подгрупп имеют электроны на d и f-орбиталях.
Представители главных подгрупп — это s и p-элементы, представители побочных подгрупп имеют электроны на d и f-орбиталях.
Как определить валентность химических элементов, если она меняется? Она может совпадать с номером группы или равняться номеру группы минус восемь, а также принимать другие значения.
Важно! Чем выше и правее элемент, тем его свойство образовывать взаимосвязи меньше. Чем он более смещен вниз и влево, тем она больше.
То, как изменяется валентность в таблице Менделеева для конкретного вида атома, зависит от структуры его электронной оболочки. Сера, например, может быть двух-, четырех- и шестивалентной.
В основном (невозбужденном) состоянии у серы два неспаренных электрона находятся на подуровне 3р. В таком состоянии она может соединиться с двумя атомами водорода и образовать сероводород. Если сера перейдет в более возбужденное состояние, то один электрон перейдет на свободный 3d-подуровень, и неспаренных электронов станет 4.
Если сера перейдет в более возбужденное состояние, то один электрон перейдет на свободный 3d-подуровень, и неспаренных электронов станет 4.
Сера станет четырехвалентной. Если сообщить ей еще больше энергии, то еще один электрон перейдет с подуровня 3s на 3d. Сера перейдет в еще более возбужденное состояние и станет шестивалентной.
Постоянная и переменная
Иногда способность к образованию химических связей может меняться. Она зависит от того, в какое соединение входит элемент. Например, сера в составе h3S двухвалентна, в составе SO2 четырехвалентна, а в SO3 — шестивалентна. Наибольшее из этих значений называется высшим, а наименьшая — низшим. Высшую и низшую валентности по таблице Менделеева можно установить так: высшая совпадает с номером группы, а низшая равняется 8 минус номер группы.
Как определить валентность химических элементов и то, изменяется ли она? Нужно установить, имеем мы дело с металлом или неметаллом. Если это металл, нужно установить, относится он к главной или побочной подгруппе.
- У металлов главных подгрупп способность к образованию химических взаимосвязей постоянная.
- У металлов побочных подгрупп — переменная.
- У неметаллов — также переменная. В большинстве случаев она принимает два значения — высшее и низшее, но иногда может быть и большее число вариантов. Примеры — сера, хлор, бром, йод, хром и другие.
Это интересно! Что такое алканы: строение и химические свойства
В соединениях низшую валентность проявляет тот элемент, который находится выше и правее в периодической таблице, соответственно, высшую — тот, который левее и ниже.
Часто способность образовывать химические связи принимает больше двух значений. Тогда по таблице узнать их не получится, а нужно будет выучить. Примеры таких веществ:
- углерод,
- сера,
- хлор,
- бром.
Как определить валентность элемента в формуле соединения? Если она известна для других составляющих вещества, это несложно. Например, требуется рассчитать это свойство для хлора в NaCl. Натрий — элемент главной подгруппы первой группы, поэтому он одновалентен. Следовательно, хлор в этом веществе тоже может создать только одну связь и тоже одновалентен.
Например, требуется рассчитать это свойство для хлора в NaCl. Натрий — элемент главной подгруппы первой группы, поэтому он одновалентен. Следовательно, хлор в этом веществе тоже может создать только одну связь и тоже одновалентен.
Важно! Однако так не всегда можно узнать это свойство для всех атомов в сложном веществе. Для примера возьмем HClO4. Зная свойства водорода, можно только установить, что ClO4 — одновалентный остаток.
Как еще узнать эту величину?
Способность образовывать определенное количество связей не всегда совпадает с номером группы, и в некоторых случаях ее придется просто заучить. Здесь на помощь придет таблица валентности химических элементов, где приведены значения этой величины. В учебнике химии за 8 класс приведены значения способности соединяться с другими атомами наиболее распространенных видов атомов.
| Н, F, Li, Na, K | 1 |
| O, Mg, Ca, Ba, Sr, Zn | 2 |
| B, Al | 3 |
| C, Si | 4 |
| Cu | 1, 2 |
| Fe | 2, 3 |
| Cr | 2, 3, 6 |
| S | 2, 4, 6 |
| N | 3, 4 |
| P | 3, 5 |
| Sn, Pb | 2, 4 |
| Cl, Br, I | 1, 3, 5, 7 |
Применение
Стоит сказать, что ученые-химики в настоящее время понятие валентности по таблице Менделеева почти не используют. Вместо него для способности вещества образовывать определенное число взаимосвязей применяют понятие степени окисления, для веществ с ковалентной структурой — ковалентность, а для веществ ионного строения — заряд иона.
Вместо него для способности вещества образовывать определенное число взаимосвязей применяют понятие степени окисления, для веществ с ковалентной структурой — ковалентность, а для веществ ионного строения — заряд иона.
Однако рассматриваемое понятие применяют в методических целях. С его помощью легко объяснить, почему атомы разных видов соединяются в тех соотношениях, которые мы наблюдаем, и почему эти соотношения для разных соединений различны.
На данный момент подход, согласно которому соединение элементов в новые вещества всегда объяснялось с помощью валентности по таблице Менделеева независимо от типа связи в соединении, устарел. Сейчас мы знаем, что для ионной, ковалентной, металлической связей существуют разные механизмы объединения атомов в молекулы.
Полезное видео
Подведем итоги
По таблице Менделеева определить способность к образованию химических связей возможно не для всех элементов. Для тех, которые проявляют одну валентность по таблице Менделеева, она в большинстве случаев равна номеру группы. Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.
Для тех, которые проявляют одну валентность по таблице Менделеева, она в большинстве случаев равна номеру группы. Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.
Как узнать и определить валентность химического элемента по таблице менделеева
Время на чтение: 12 минут
Общая характеристика
Валентность представляет способность атомов создавать химические соединения, добавлять другие атомы. С давних времен известны исторические данные о молекулярной, атомной структуре веществ.
Необходимость и основные понятия
Определение в переводе характеризует силу, создание. Главное суждение введено до открытия строения атома. Природа химических соединений заключается в делении между собой пары частиц на валентные электроны.
Число обобществленных связей, которыми атом соединяется с другими элементами, называется валентностью.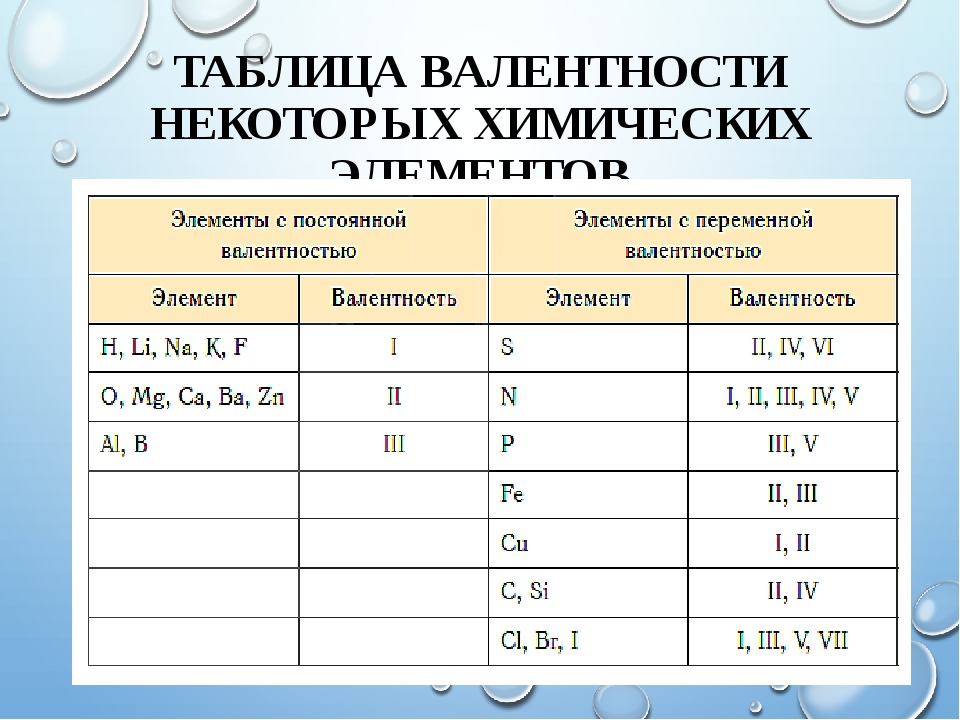 В учет не берется полярность связей, поэтому показатель не имеет знака и не равен 0. В химических сочетаниях атомные частицы находятся в числовом соотношении.
В учет не берется полярность связей, поэтому показатель не имеет знака и не равен 0. В химических сочетаниях атомные частицы находятся в числовом соотношении.
Соединения водорода H с разными микрочастицами:
- Хлороводород (HCl).
- Вода (h3O).
- Аммиак (Nh4).
- Метан (Ch5).
Атом Cl (хлора) связан с одним А. водорода, О2 (кислорода) — с двумя, азота (N)-с тремя, а углерода — с 4 атомными частицами. В молекуле углекислого газа СО2 частица Н связана с двумя атомами кислорода.
А. соединяются по-разному с другими элементами. Такая способность выражается численной характеристикой.
Обозначение валентности:
- HCl (I I).
- h3O (I II).
- HN3 (III I).
- Ch5 (IV I).
Один атом водорода соединяется только с одной частью другого элемента, соответственно, валентность принимают за 1. Объясняя «химическим» языком, атомная частица водорода обладает единицей валентности (В), он одновалентен.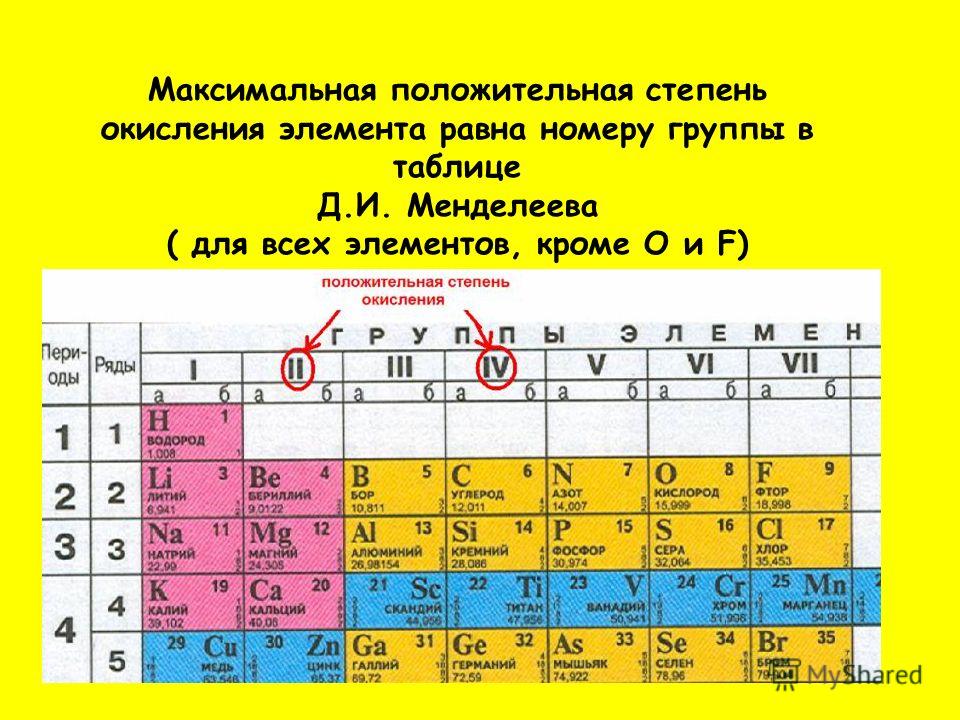
Образование химических связей атома любого элемента соответствует количеству соединившихся мелких частиц водорода. В молекуле хлороводорода валентность Cl равна 1, а в молекуле воды у атома кислорода — двум. В структурной составляющей метана В. углерода равна 4. Условно в химии обозначают единицы валентности римскими цифрами I-Х.
Историческая справка и взгляды ученых
Скудные знания о строении молекулярных и атомных частицах 19 века не позволяли объяснить причины, по которым атомы образуют связи с другими элементами. Валентность как основной принцип химии изучается до сих пор.
Ученый Э. Франкленд ввел терминологию «связь» в научные труды для характеристики взаимодействия атомов между собой. Специалист выяснил, что некоторые элементы образуют соединения с одними и теми же атомами. Азот прикрепляет три водородных частицы в молекуле аммиака.
Позже ученый выдвинул теорию о существовании конкретных чисел химической связи и назвал ее «соединительной силой». Труды Франклина стали значимым вкладом в структурную химию.
Труды Франклина стали значимым вкладом в структурную химию.
Мнения, научные работы доказаны в 1860 г. немецким деятелем Ф. Кекуле. По его мнению, углерод является из четырех основным, в самом простейшем его соединении частиц (метане) образуются связи с 4 атомами Н.
В Советском союзе информацию о строении веществ систематизировал А. Бутлеров. Последующее развитие связей получило введение периодической теории Д. Менделеева. Он подтвердил, что валентность Э. в соединениях и прочие свойства обусловлены занятым положением в периодической системе.
Главным преимуществом теории В. является возможность наглядного изображения молекулярного строения. Первые модели возникли в середине 19 века, а позже использовались структурные формулы в виде окружности с химическим знаком. Между обозначений атомов черточкой выделяется связь, а число линий соответствует В.
Основная классификация
Элементы распределяются с постоянной и переменной валентностью. Углерод соединяется с различными атомами кислорода, поэтому имеет переменную валентность.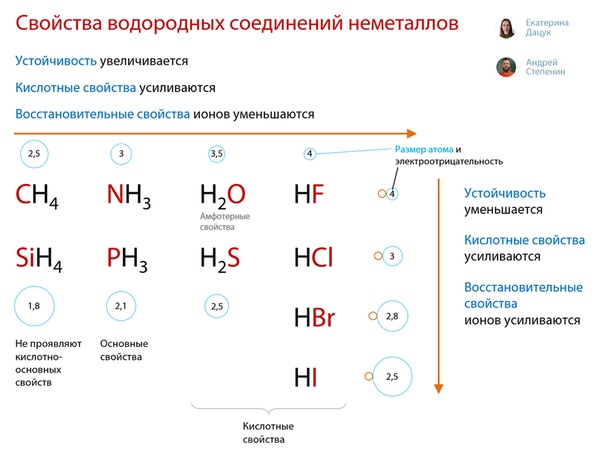 Многие элементы имеют неустойчивую величину.
Многие элементы имеют неустойчивую величину.
| Валентность | |||
| Постоянная | Переменная | ||
| Элемент | В | Элемент | В |
| H (Водород) | I | I (Йод) | I |
| Li (Литий) | S (Сера) | II, IV, VI | |
| Na (Натрий) | N (Азот) | I-V | |
| K (Калий) | F | II, III | |
| F (Фтор) | Cu | I, II | |
| Al (Алюминий), B, Р | III, V | C, Si | II, IV |
| O (Кислород), Mg (Магний), Ca (Кальций), Ba (Барий), Zn (Цинк) | II | Cl, Br, I | I, III, V, VII |
Водород образует связь не с каждым элементом, а кислородные соединения имеются почти у всех. В таких сочетаниях атомы О2 проявляют двукратную валентность.
Ковалентная связь осуществляется из-за образования общих электронных пар. Когда между 2 атомными структурами (А) существует совместная электронная пара, она называется одинарной, при наличии двух — двойной, трех — тройной.
Валентность азота N в связи Nh4 составляет III, поскольку один атом Н связан с тремя частицами N. Валентность углерода в метане (СН4), по тому же принципу будет 4 (IV).
Валентность хлора в молекуле хлороводорода равна единице, индекс не применяется. Одному атому H соответствует 1 атом Cl. Если образованная химическая связь углерода © в метане равна 4, валентность Н — всегда 1. Рядом с Н ставится индекс 4, а формула метана выглядит следующим образом: Ch5.
Постоянной одной В. остается H, K, F. Двухвалентные — кислород, магний, кальций, цинк, а трехвалентные — алюминий. Валентность брома, железа, меди, хлора или прочих элементов модифицируется, когда они формируют различные соединения.
Йод представлен в таблице 53 по счету. Присутствие одного неспаренного электрона говорит о способности проявлять низшую В., равную единице в соединениях. Зная валентность, можно легко составить формулы соединений.
Определение по формуле
Если под рукой нет таблицы Менделеева, то существует возможность установления В. элемента с помощью несложных расчетов. Для примера выбирается формула оксида марганца — Mn2O7.
элемента с помощью несложных расчетов. Для примера выбирается формула оксида марганца — Mn2O7.
Кислород двухвалентный, а для определения марганца В. кислорода умножают на число атомов газа в сочетании 2*7, получается 14. Это число делится на количество мелких атомных частиц Mn:14/2 = 7. В полученном соединении валентность составляет VII.
Индексы в молекулярных веществах отображают число А., входящих в состав. Получив формулу вещества, в котором известна В. одного элемента, можно определить В. другого. В веществе, состоящем из молекул число В. обоих элементов равно. Используется минимальное общее кратное для определения неизвестной В.
Например, в образовании формулы связи оксида железа Fe2O3 участвуют пара атомов Fe с валентностью III и три атома O с двойной валентностью. Минимальным общим кратным будет 6.
Для правильной формулировки записи оксида фосфора учитывается В кислорода (II) и фосфора (V). Наименьшее общее кратное для Р и О получается десять.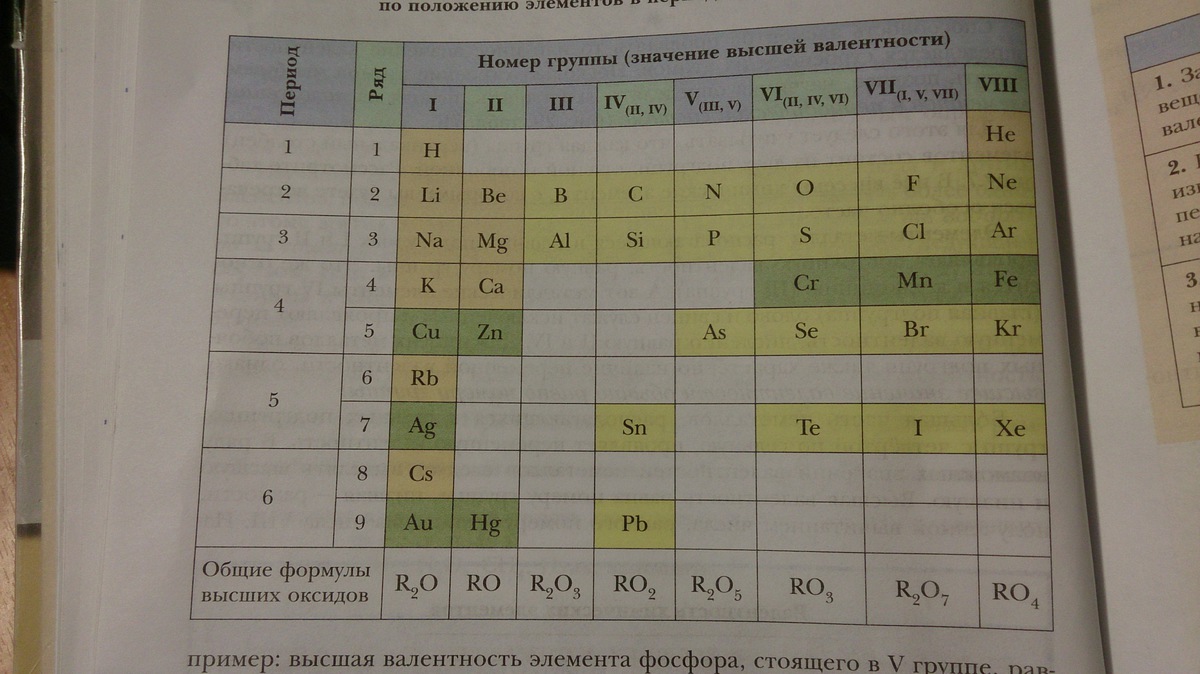 Обозначение записывается Р2О5.
Обозначение записывается Р2О5.
Понимая и зная свойства элементов, проявляющих в разных сочетаниях, можно находить валентность по внешнему параметру соединений. Оксиды меди (купрум) имеют красный (Cu2O) и черный (CuО) цвет. Гидроксиды меди будут желтыми (CuОН) и синими (Cu (ОН)2).
Чтобы составить формулу бинарных соединений элементов, достаточно определить валентность. Если требуется записать формулу кислородного соединения хлора (ClO), в котором валентность Cl равна 7, соблюдают последовательность:
- Записывают символы элементов и валентность. Это VII II ClO.
- Найти меньшее кратное валентностей двух элементов. VII*II, получается 14.
- Делят наименьшее кратное на В. каждого элемента, находят значение индексов. 14/2 = 7, 14/7 = 2.
Записывают индексы возле знаков элементов. Получается Cl2O7.
Труды Менделеева
Согласно электронной теории, В. атома определяется из числа непарных электронов (Э)., участвующих в формировании пар с Э. других атомов. Понятие В. связано с созданием закона Менделеева.
других атомов. Понятие В. связано с созданием закона Менделеева.
Теория электронов
Атомы представляют положительную основу (ядро), вокруг которой расположены отрицательно заряженные электроны. Наружная оболочка последних бывает недостроенной, а завершенная структура устойчивее, она включает восемь электронов.
Создание связи за счет общих пар электронов приводит к благоприятному состоянию атомов.
Максимальная В. — это величина Э. во внешней оболочке атома. Химические связи составляют Э., находящиеся на наружной оболочке атома. Изучив таблицу Менделеева, можно определить, что положение веществ в периодической системе и его В. взаимосвязаны.
Валентность:
- Высшая. Соответствует порядковому № группы.
- Низшая. От числа вида по табличным данным отнимают номер интересующего элемента.
- Основанием для образования соединений является прием электронов.
- Виды электронов:
- Спаренные.
 Расположены на одной орбитали.
Расположены на одной орбитали. - Неспаренные. Это 1 электрон на орбитали.
Когда атом отрицательно заряжен частицами без пары для взаимодействия, то они образуются в таком количестве, сколько имеется неспаренных электронов.
В молекулярной структуре водорода и серы h3S последнее вещество приобретает двойную валентность (-), потому что каждый атом участвует в образовании 2 электропар. Знак черточка или тире указывает на притяжение пары к более отрицательному элементу. У менее отрицательного к валентности добавляют знак плюс.
Распределение свойств
В периодической таблице указаны все 118 химических элементов (водород, литий, бор, натрий, магний, кальций, ванадий, уран и другие).
Химические и физические свойства каждого вещества похожи с предшествующим ему в таблице элементом. Закономерность проявляется у всех, кроме нескольких первых, потому что они не включают перед собой элементов, аналогичных по атомному объему.
Валентность металлов:
| Элемент | В |
| Серебро | I-III |
| Ртуть | I-II |
| Золото | I-III |
| Никель | I- IV |
| Мышьяк | -III, II, III, V |
| Свинец | II-IV |
| Кобальт | II-IV |
| Олово | II, IV |
В периодической таблице элементы классифицированы, упорядочены с учетом атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды называются периодами, а столбцы — группами. В самой первой таблице содержалось не более шестидесяти элементов, теперь продолжительность списка увеличили до 118 элементов. Систематизированы не только химические вещества, но и их свойства.
Ряды называются периодами, а столбцы — группами. В самой первой таблице содержалось не более шестидесяти элементов, теперь продолжительность списка увеличили до 118 элементов. Систематизированы не только химические вещества, но и их свойства.
Достаточно ученому-химику взглянуть на таблицу, и он сможет ответить на разные экзаменационные, научные вопросы.
Говоря о степени окисления, предполагают, что атом в веществе ионной природы имеет заряд, и если валентность нейтральная, то уровень окисления будет нулевым, положительным или отрицательным. Узнать информацию можно из таблицы Менделеева.
Для атома одного и того же Э., в зависимости от элементов, с которыми он сформирует химическое соединение, В. и стадия окисления совпадают (Н2О, СН4) и различаются (Н2О2, HNO3). Само понятие валентности ученые-химики не используют по Менделеевской таблице.
Источник: https://nauka.club/khimiya/valentnost-khimicheskikh-elementov.html
Урок 6. Валентность – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода.
В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами.
Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
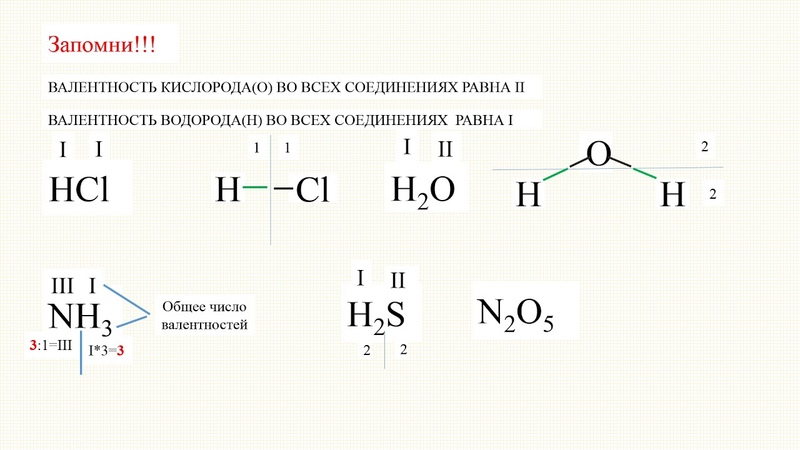
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле h3O у атома кислорода валентность равна двум.
По той же причине в молекуле Nh4 валентность атома азота равна трем, а в молекуле Ch5 валентность атома углерода равна четырем.
Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
- Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
- Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды h3O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х·1 = II·2, откуда х = IV.
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II, так как х·1 = II·1, откуда х = II:
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV, а азота — III.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 (IV·III).
- Определяем индексы каждого элемента:
- Записываем формулу соединения: Si3N4.
- В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.

- Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник: https://himi4ka.ru/arhiv-urokov/urok-6-valentnost.html
Валентность химических элементов (Таблица)
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
— Валентность водорода (H) постоянна всегда 1. Отсюда в соединении h3O валентность O равна 2.
— Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
- — Высшая валентность всегда равна № группы.
- — Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
- — У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
- — У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
| Атомный № | Химический элемент | Символ | Валентность химических элементов | Примеры соединений |
| 1 | Водород / Hydrogen | H | I | HF |
| 2 | Гелий / Helium | He | отсутствует | — |
| 3 | Литий / Lithium | Li | I | Li2O |
| 4 | Бериллий / Beryllium | Be | II | Beh3 |
| 5 | Бор / Boron | B | III | BCl3 |
| 6 | Углерод / Carbon | C | IV, II | CO2, Ch5 |
| 7 | Азот / Nitrogen | N | III, IV | Nh4 |
| 8 | Кислород / Oxygen | O | II | h3O, BaO |
| 9 | Фтор / Fluorine | F | I | HF |
| 10 | Неон / Neon | Ne | отсутствует | — |
| 11 | Натрий / Sodium | Na | I | Na2O |
| 12 | Магний / Magnesium | Mg | II | MgCl2 |
| 13 | Алюминий / Aluminum | Al | III | Al2O3 |
| 14 | Кремний / Silicon | Si | IV | SiO2, SiCl4 |
| 15 | Фосфор / Phosphorus | P | III, V | Ph4, P2O5 |
| 16 | Сера / Sulfur | S | VI, IV, II | h3S, SO3 |
| 17 | Хлор / Chlorine | Cl | I, III, V, VII | HCl, ClF3 |
| 18 | Аргон / Argon | Ar | отсутствует | — |
| 19 | Калий / Potassium | K | I | KBr |
| 20 | Кальций / Calcium | Ca | II | Cah3 |
| 21 | Скандий / Scandium | Sc | III | Sc2S3 |
| 22 | Титан / Titanium | Ti | II, III, IV | Ti2O3, Tih5 |
| 23 | Ванадий / Vanadium | V | II, III, IV, V | VF5, V2O3 |
| 24 | Хром / Chromium | Cr | II, III, VI | CrCl2, CrO3 |
| 25 | Марганец / Manganese | Mn | II, III, IV, VI, VII | Mn2O7, Mn2(SO4)3 |
| 26 | Железо / Iron | Fe | II, III | FeSO4, FeBr3 |
| 27 | Кобальт / Cobalt | Co | II, III | CoI2, Co2S3 |
| 28 | Никель / Nickel | Ni | II, III, IV | NiS, Ni(CO)4 |
| 29 | Медь / Copper | Сu | I, II | CuS, Cu2O |
| 30 | Цинк / Zinc | Zn | II | ZnCl2 |
| 31 | Галлий / Gallium | Ga | III | Ga(OH)3 |
| 32 | Германий / Germanium | Ge | II, IV | GeBr4, Ge(OH)2 |
| 33 | Мышьяк / Arsenic | As | III, V | As2S5, h4AsO4 |
| 34 | Селен / Selenium | Se | II, IV, VI, | h3SeO3 |
| 35 | Бром / Bromine | Br | I, III, V, VII | HBrO3 |
| 36 | Криптон / Krypton | Kr | VI, IV, II | KrF2, BaKrO4 |
| 37 | Рубидий / Rubidium | Rb | I | RbH |
| 38 | Стронций / Strontium | Sr | II | SrSO4 |
| 39 | Иттрий / Yttrium | Y | III | Y2O3 |
| 40 | Цирконий / Zirconium | Zr | II, III, IV | ZrI4, ZrCl2 |
| 41 | Ниобий / Niobium | Nb | I, II, III, IV, V | NbBr5 |
| 42 | Молибден / Molybdenum | Mo | II, III, IV, V, VI | Mo2O5, MoF6 |
| 43 | Технеций / Technetium | Tc | I — VII | Tc2S7 |
| 44 | Рутений / Ruthenium | Ru | II — VIII | RuO4, RuF5, RuBr3 |
| 45 | Родий / Rhodium | Rh | I, II, III, IV, V | RhS, RhF3 |
| 46 | Палладий / Palladium | Pd | I, II, III, IV | Pd2S, PdS2 |
| 47 | Серебро / Silver | Ag | I, II, III | AgO, AgF2, AgNO3 |
| 48 | Кадмий / Cadmium | Cd | II | CdCl2 |
| 49 | Индий / Indium | In | III | In2O3 |
| 50 | Олово / Tin | Sn | II, IV | SnBr4, SnF2 |
| 51 | Сурьма / Antimony | Sb | III, IV, V | SbF5, Sbh4 |
| 52 | Теллур / Tellurium | Te | VI, IV, II | Teh3, H6TeO6 |
| 53 | Иод / Iodine | I | I, III, V, VII | HIO3, HI |
| 54 | Ксенон / Xenon | Xe | II, IV, VI, VIII | XeF6, XeO4, XeF2 |
| 55 | Цезий / Cesium | Cs | I | CsCl |
| 56 | Барий / Barium | Ba | II | Ba(OH)2 |
| 57 | Лантан / Lanthanum | La | III | Lah4 |
| 58 | Церий / Cerium | Ce | III, IV | CeO2 , CeF3 |
| 59 | Празеодим / Praseodymium | Pr | III, IV | PrF4, PrO2 |
| 60 | Неодим / Neodymium | Nd | III | Nd2O3 |
| 61 | Прометий / Promethium | Pm | III | Pm2O3 |
| 62 | Самарий / Samarium | Sm | II, III | SmO |
| 63 | Европий / Europium | Eu | II, III | EuSO4 |
| 64 | Гадолиний / Gadolinium | Gd | III | GdCl3 |
| 65 | Тербий / Terbium | Tb | III, IV | TbF4, TbCl3 |
| 66 | Диспрозий / Dysprosium | Dy | III | Dy2O3 |
| 67 | Гольмий / Holmium | Ho | III | Ho2O3 |
| 68 | Эрбий / Erbium | Er | III | Er2O3 |
| 69 | Тулий / Thulium | Tm | II, III | Tm2O3 |
| 70 | Иттербий / Ytterbium | Yb | II, III | YO |
| 71 | Лютеций / Lutetium | Lu | III | LuF3 |
| 72 | Гафний / Hafnium | Hf | II, III, IV | HfBr3, HfCl4 |
| 73 | Тантал / Tantalum | Ta | I — V | TaCl5, TaBr2, TaCl4 |
| 74 | Вольфрам / Tungsten | W | II — VI | WBr6, Na2WO4 |
| 75 | Рений / Rhenium | Re | I — VII | Re2S7, Re2O5 |
| 76 | Осмий / Osmium | Os | II — VI, VIII | OsF8, OsI2, Os2O3 |
| 77 | Иридий / Iridium | Ir | I — VI | IrS3, IrF4 |
| 78 | Платина / Platinum | Pt | I, II, III, IV, V | Pt(SO4)3, PtBr4 |
| 79 | Золото / Gold | Au | I, II, III | AuH, Au2O3, Au2Cl6 |
| 80 | Ртуть / Mercury | Hg | II | HgF2, HgBr2 |
| 81 | Талий / Thallium | Tl | I, III | TlCl3, TlF |
| 82 | Свинец / Lead | Pb | II, IV | PbS, Pbh5 |
| 83 | Висмут / Bismuth | Bi | III, V | BiF5, Bi2S3 |
| 84 | Полоний / Polonium | Po | VI, IV, II | PoCl4, PoO3 |
| 85 | Астат / Astatine | At | нет данных | — |
| 86 | Радон / Radon | Rn | отсутствует | — |
| 87 | Франций / Francium | Fr | I | — |
| 88 | Радий / Radium | Ra | II | RaBr2 |
| 89 | Актиний / Actinium | Ac | III | AcCl3 |
| 90 | Торий / Thorium | Th | II, III, IV | ThO2, ThF4 |
| 91 | Проактиний / Protactinium | Pa | IV, V | PaCl5, PaF4 |
| 92 | Уран / Uranium | U | III, IV | UF4, UO3 |
| 93 | Нептуний | Np | III — VI | NpF6, NpCl4 |
| 94 | Плутоний | Pu | II, III, IV | PuO2, PuF3, PuF4 |
| 95 | Америций | Am | III — VI | AmF3, AmO2 |
| 96 | Кюрий | Cm | III, IV | CmO2, Cm2O3 |
| 97 | Берклий | Bk | III, IV | BkF3, BkO2 |
| 98 | Калифорний | Cf | II, III, IV | Cf2O3 |
| 99 | Эйнштейний | Es | II, III | EsF3 |
| 100 | Фермий | Fm | II, III | — |
| 101 | Менделевий | Md | II, III | — |
| 102 | Нобелий | No | II, III | — |
| 103 | Лоуренсий | Lr | III | — |
| Номер | Элемент | Символ | Валентность химических элементов | Пример |
Источник: https://infotables.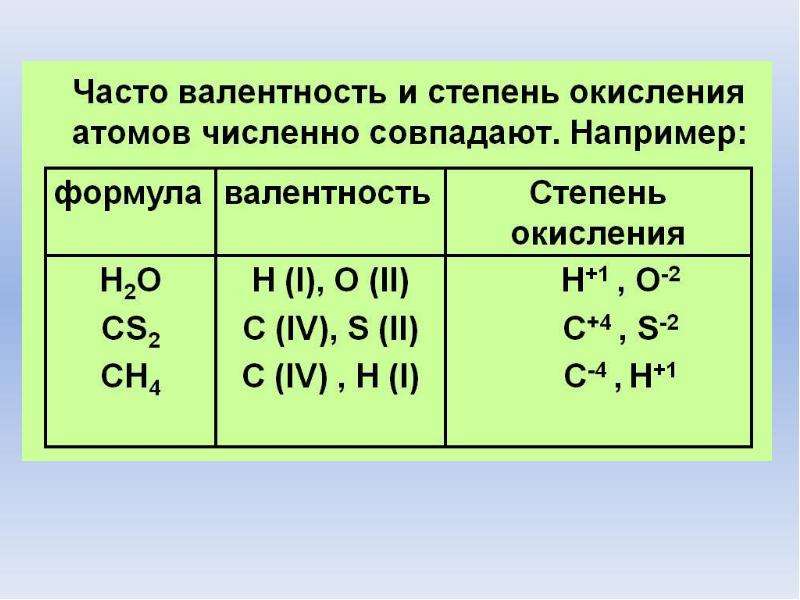 ru/khimiya/1071-valentnost-khimicheskikh-elementov
ru/khimiya/1071-valentnost-khimicheskikh-elementov
Ответы@Mail.Ru: Как определить валентность по таблице Менделеева?
есть высшая валентность это номер группы…. и низшая — это 8 — номер группы …но что касаетсятаких элементов как железо.. . они проявляют разную степень окисления и в таблице менделеева ты это не найдешь.. . это есть в справочниках по химии
Максимальная валентность по кислороду равна числу электронов на внешнем слое. В общем случае номеру группы. У Р с утра ещё была V группа, за это время что-то изменилось? Валентность по водороду равна числу электронов, которые элемент может принять на внешний слой. Равна 8- №группы.
У элементов с переменной валентностью всё сложнее. И Fe c утра был в VIII! Железо отдаёт 2 электрона с внешнего слоя, валентность 2, ст. окисления +2, ещё один «лишний» электрон с предвнешнего d слоя — валентность 3. Придётся запоминать! Только не говорите, что таблица Д.
Менделеева уже «перекроена», тогда мне придётся всё заново учить!
Валентность — свойство атомов одного химического элемента присоединять определенное число атомов другого химического элемента.
Есть элементы, которые имеют постоянную валентность:
одновалентны (I) — H,Li, Na, K, Rb, Cs, F, I
двухвалентны (II) — O, Be, Mg, Ca, Sr, Ba, Zn, Cd
трехвалентны (III) — B, Al Есть еще один способ: определять валентность можно по таблице Д. И. Менделеева.
Все элементы в таблице разделены на подгруппы а) и б) .
Активные металлы занимают только три первые группы. Металлы, которые стоят в первой а) группе имеют валентность I.
Металлы, которые стоят во второй а) группе имеют валентность II. Есть металлы с переменной валентностью, тогда ее указывают в скобках, например, оксид железа (III).
Это говорит нам о том, что железо — трехвалентно в данном соединении с кислородом.
Неметаллы имеют две валентности и более (тогда она указывается в скобках) : низшую — вычисляют по формуле (8-Ь группы) , в которой находится элемент;
высшую — равную номеру группы, в которой находится этот элемент.
Номер группы указан вверху таблицы.
Есть в-ва, валентность которых определяется по группе, а есть те в-ва ( например металлы ) , у которых валентность с ней не совпадает.
Нужно из 8 ( максимальной группы ) отнять номер группы в-ва, валентность у которого хотите найти
Все элементы в таблице разделены на подгруппы а) и б) . Активные металлы занимают только три первые группы.
Металлы, которые стоят в первой а) группе имеют валентность I.
Металлы, которые стоят во второй а) группе имеют валентность II.
Есть металлы с переменной валентностью, тогда ее указывают в скобках, например, оксид железа (III). Это говорит нам о том, что железо — трехвалентно в данном соединении с кислородом.
Неметаллы имеют две валентности и более (тогда она указывается в скобках) : низшую — вычисляют по формуле (8-Ь группы) , в которой находится элемент;
высшую — равную номеру группы, в которой находится этот элемент.
Номер группы указан вверху таблицы.
Алгоритмы составления формул по валентности и определение валентности по формуле я посылаю как прикрепленный файл. Распечатай его и пользуйся пока не научишься.
Источник: https://touch. otvet.mail.ru/question/28569283
otvet.mail.ru/question/28569283
Как определить валентность?
Согласно школьному определению валентность — это способность химического элемента образовывать то или иное количество химических связей с другими атомами.
Как известно, валентность бывает постоянной (когда химический элемент образует всегда одно и то же количество связей с другими атомами) и переменной (когда в зависимости от того или иного вещества валентность одного и того же элемента изменяется).
Определить валентность нам поможет периодическая система химических элементов Д. И. Менделеева.
Действуют такие правила:
1) Максимальная валентность химического элемента равняется номеру группы. Например, хлор находится в 7-й группе, а значит, у него максимальная валентность равна 7. Сера: она в 6-й группе, значит, у неё максимальная валентность равна 6.
2) Минимальная валентность для неметаллов равна 8 минус номер группы.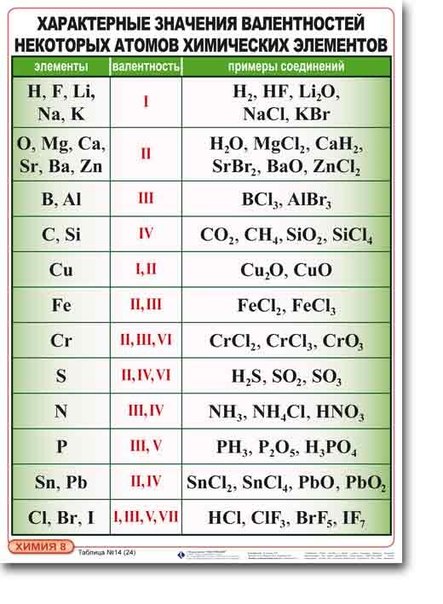 Например, минимальная валентность того же хлора равна 8 – 7, то есть 1.
Например, минимальная валентность того же хлора равна 8 – 7, то есть 1.
- Увы, из обоих правил имеются исключения.
- Например, медь находится в 1-й группе, однако максимальная валентность меди равна не 1, а 2.
- Кислород находится в 6-й группе, но у него валентность почти всегда 2, а вовсе не 6.
- Полезно помнить ещё следующие правила:
3) Все щелочные металлы (металлы I группы, главной подгруппы) всегда имеют валентность 1. Например, валентность натрия всегда равна 1, потому что это щелочной металл.
4) Все щёлочно-земельные металлы (металлы II группы, главной подгруппы) всегда имеют валентность 2. Например, валентность магния всегда равна 2, потому что это щёлочно-земельный металл.
- 5) Алюминий всегда имеет валентность 3.
- 6) Водород всегда имеет валентность 1.
- 7) Кислород практически всегда имеет валентность 2.
- 8) Углерод практически всегда имеет валентность 4.

- Следует помнить, что в разных источниках определения валентности могут отличаться.
- Более или менее точно валентность можно определить как количество общих электронных пар, посредством которых данный атом связан с другими.
Согласно такому определению, валентность азота в HNO3 равна 4, а не 5. Пятивалентным азот быть не может, потому что в таком случае вокруг атома азота кружилось бы 10 электронов. А такого не может быть, потому что максимум электронов составляет 8.
Источник: http://www.bolshoyvopros.ru/questions/505034-kak-opredelit-valentnost.html
Как определить валентность по периодической таблице Менделеева: что это такое, изучение свойств химических элементов
Атомы химических элементов могут образовывать различное число связей. Эта способность имеет специальное название – валентность.
Давайте разберемся, как определить валентность по таблице Менделеева, узнаем, в чем заключается ее отличие от степени окисления, увидим закономерности, характерные для водорода, углерода, фосфора, цинка, научимся находить валентность химических элементов.
Основные сведения
Валентность – это возможность атомов различных химических элементов образовывать связи между собой. Другими словами можно сказать, что это способность атома присоединить к себе определенное количество других атомов.
Важно! Это не всегда постоянное число для одного и того же элемента. В разных соединениях элемент может обладать различными значениями.
Определение по таблице Д.И. Менделеева
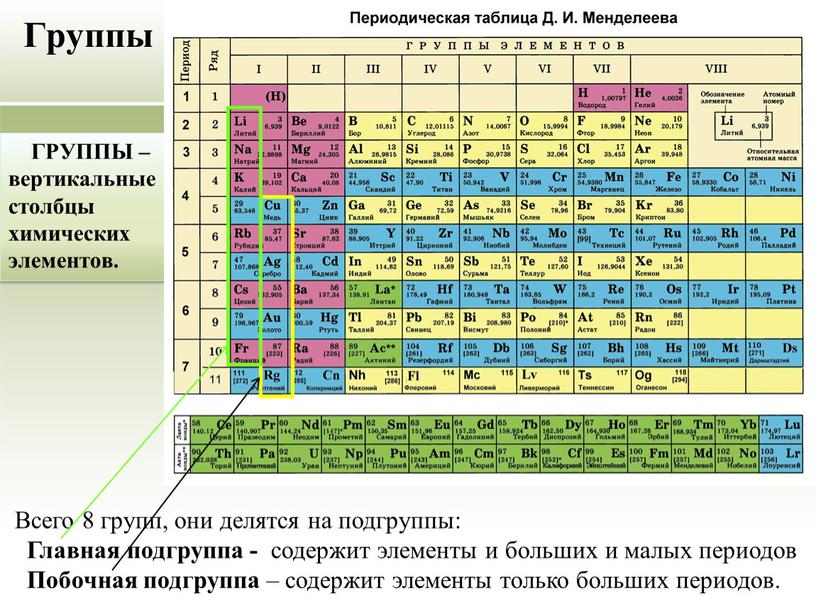
Для определения этой способности атома по таблице Менделеева необходимо знать, что такое группы и подгруппы периодической таблицы.
Это вертикальные столбцы, которые делят все элементы по определенному признаку. В зависимости от признака, выделяют подразделения элементов.
Этими столбцами элементы делятся на тяжелые и легкие элементы, а также подгруппы — галогены, инертные газы и тому подобное.
Итак, для определения способности элемента образовывать связи нужно руководствоваться двумя правилами:
- Высшая валентность элемента равна номеру его группы.
- Низшая валентность находится как разница между числом 8 и номером группы, в которой расположен данный элемент.
Например, фосфор проявляет высшую валентность V – P2O5 и низшую (8-5)=3– PF3.
Стоит также отметить несколько основных характеристик и особенностей при определении этого показателя:
- Валентность водорода всегда I – h3O, HNO3, h4PO4.
- Валентность кислорода всегда равна II – CO2, SO3.
- У металлов, которые расположены в главной подгруппе, этот показатель всегда равен номеру группы – Al2O3, NaOH, KH.
- Для неметаллов чаще всего проявляются только две валентности – высшая и низшая.
Также существуют элементы, у которых может быть 3 или 4 разных значений этого показателя. К ним относятся хлор, бор, йод, хром, сера и другие. Например, хлор обладает валентностью I, III, V, VII – HCl, ClF3,ClF5,HClO4 соответственно.
Определение по формуле
Для определения по формуле можно воспользоваться несколькими правилами:
- Если известна валентность (V) одного из элементов в двойном соединении: допустим, есть соединение углерода и кислорода СО2, при этом мы знаем, что валентность кислорода всегда равна II, тогда можем воспользоваться таким правилом: произведение числа атомов на его V одного элемента должно равняться произведению числа атомов другого элемента на его V.
 Таким образом, валентность углерода можно найти так – 2×2 (в молекуле 2 атома кислорода с V= 2), то есть валентность углерода равняется 4. Рассмотрим еще несколько примеров: P2O5 – тут валентность фосфора = (5*2)/2 = 5. HCl – валентность хлора будет равна I, так как в этой молекуле 1 атом водорода, и V= 1.
Таким образом, валентность углерода можно найти так – 2×2 (в молекуле 2 атома кислорода с V= 2), то есть валентность углерода равняется 4. Рассмотрим еще несколько примеров: P2O5 – тут валентность фосфора = (5*2)/2 = 5. HCl – валентность хлора будет равна I, так как в этой молекуле 1 атом водорода, и V= 1. - Если известна валентность нескольких элементов, которые составляют группу: в молекуле гидроксида натрия NaOH валентность кислорода равняется II, а валентность водорода – I, таким образом группа -OH обладает одной свободной валентностью, так как кислород присоединил только один атом водорода и еще одна связь свободна. К ней и присоединится натрий. Можно сделать вывод, что натрий – одновалентный элемент.
Разница между степенью окисления и валентностью
Очень важно понимать принципиальную разницу между этими понятиями. Степень окисления – это условный электрический заряд, которым обладает ядро атома, в то время как валентность – это количество связей, которые может установить ядро элемента.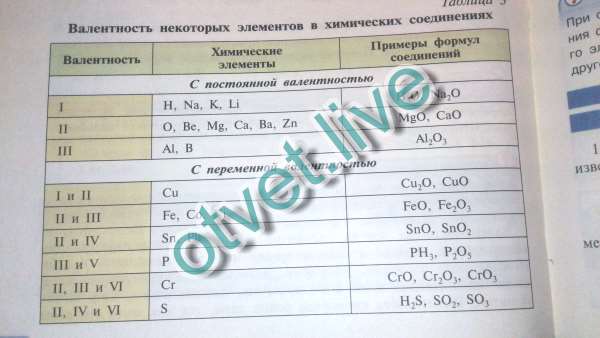
Рассмотрим подробнее, что такое степень окисления. Согласно современной теории о строении атома, ядро элемента состоит из положительно заряженных протонов и нейтронов без заряда, а вокруг него находятся электроны с отрицательным зарядом, которые уравновешивают заряд ядра и делают элемент электрически нейтральным.
В случае, если атом устанавливает связь с другим элементом, он отдает или принимает электроны, то есть выходит из состоянии баланса и начинает обладать электрическим зарядом. При этом если атом отдает электрон, он становится положительно заряженным, а если принимает – отрицательным.
Внимание! В соединении хлора и водорода HCl водород отдает один электрон и приобретает заряд +1, а хлор принимает электрон и становится отрицательным -1. В сложных соединениях, HNO3 и h3SO4, степени окисления будут такими – H+1N+5O3 -2 и h3 +1S +6O4 -2.
Сравнивая два этих определения, можно сделать вывод, что валентность и степень окисления часто совпадают: валентность водорода +1 и валентность I, степень окисления кислорода -2 и V II, но очень важно помнить, что это правило выполняется не всегда!
В органическом соединении углерода под названием формальдегид и формулой HCOH у углерода степень окисления 0, но он обладает V, равной 4.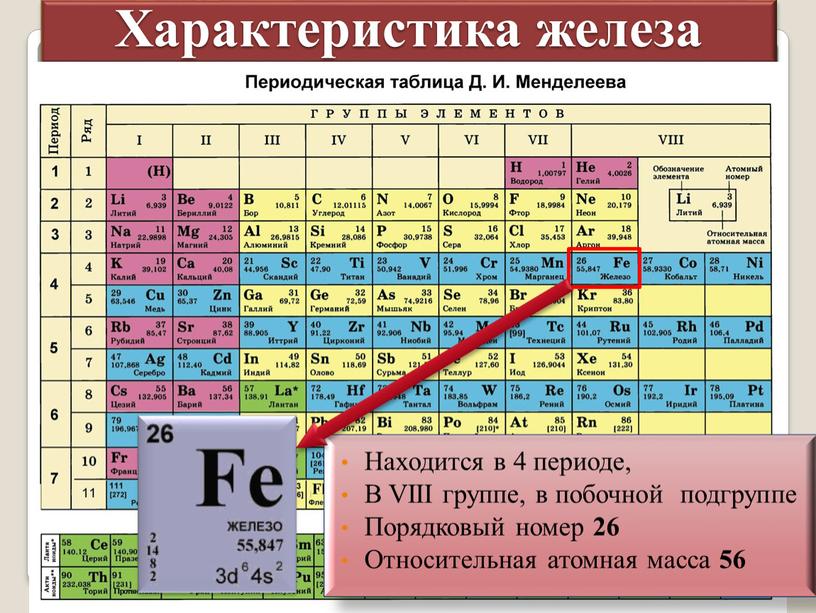 В перекиси водорода h3O2 у кислорода степень окисления +1, но V остается равной 2. Поэтому не следует отождествлять два этих понятия, так как в ряде случаев это может привести к ошибке.
В перекиси водорода h3O2 у кислорода степень окисления +1, но V остается равной 2. Поэтому не следует отождествлять два этих понятия, так как в ряде случаев это может привести к ошибке.
Валентности распространенных элементов
Водород
Один из самых распространенных элементов во вселенной, встречается во многих соединениях и всегда обладает V=1. Это связано со строением его внешней электронной орбитали, на которой у водорода находится 1 электрон.
На первом уровне может находиться не более двух электронов одновременно, таким образом, водород может либо отдать свой электрон и образовать связь (электронная оболочка останется пустой), либо принять 1 электрон, также образовав новую связь (электронная оболочка полностью заполнится).
Пример: h3O – 2 атома водорода с V=1 связаны с двухвалентным кислородом; HCl – одновалентные хлор и водород; HCN – синильная кислота, где водород также проявляет V, равную 1.
Углерод
Углерод может обладать либо валентностью II, либо IV. Связано это со строением внешнего электронного уровня, на котором находится 2 электрона, в случае если он их отдаст, его V будет II.
То есть 2 электрона установили 2 новые связи, например, соединение CO – угарный газ, где и кислород, и водород двухвалентные.
Однако бывают ситуации, когда один электрон с первого уровня переходит на второй, тогда у углерода образуется 4 свободных электрона, которые могут образовывать связи: СО2, НСООН, Н2СО3.
Фосфор
Данный элемент может обладать валентностью III и V.
Как и в предыдущих случаях, связанно это со строением внешнего электронного уровня, на котором у него 3 электрона, то есть возможность образовать 3 связи, но, как и углерод, у него возможен переход 1 электрона с s-орбитали на d-орбиталь, тогда неспаренных электронов станет 5, а значит, и валентность тоже будет равна V. Например: РН3, Р2О5, Н3РО4.
Цинк
Как элемент главной подгруппы и металл, цинк может обладать только валентностью, которая равна номеру его группы, то есть 2. Во всех своих соединениях валентность цинка равна II и не зависит от типа элемента и вида связи с ним. Пример: ZnCl2, ZnO, Znh3, ZnSO4.
Во всех своих соединениях валентность цинка равна II и не зависит от типа элемента и вида связи с ним. Пример: ZnCl2, ZnO, Znh3, ZnSO4.
Определение валентности химических элементов
Изучение валентности по периодической таблице Менделеева
Вывод
Теперь вы знаете, что такое валентность, чем она отличается от степени окисления, и легко определите валентность элементов по формулам или таблице Менделеева.
Это интересно! Основной закон Гесса и следствия из него
Источник: https://uchim.guru/himiya/kak-opredelit-valentnost-po-tablitse-mendeleeva.html
Таблица валентностей химических элементов
Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / Таблица валентностей химических элементов.
Таблица валентностей химических элементов. Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов. Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В скобках обозначены более редкие валентности. Химические элементы с единственной валентностью — одну и имеют. Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов. Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В скобках обозначены более редкие валентности. Химические элементы с единственной валентностью — одну и имеют.
|
Источник: https://tehtab.ru/guide/guidechemistry/valencytable/
Улучшенная версия таблицы Менделеева
Как легко определять свойства элементов и их соединений
Не так уж часто удается написать заметку о том, что не просто войдет в школьные учебники будущего, а станет одной из базовых картинок-иллюстраций. Химики из Сколковского института науки и технологий Артем Оганов и Захед Алахъяри придумали и рассчитали, как расположить химические элементы в порядке постепенного изменения их химических свойств. Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, «Коту» рассказал профессор Сколтеха Артем Оганов.
Химики из Сколковского института науки и технологий Артем Оганов и Захед Алахъяри придумали и рассчитали, как расположить химические элементы в порядке постепенного изменения их химических свойств. Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, «Коту» рассказал профессор Сколтеха Артем Оганов.
Артем Оганов — кристаллограф-теоретик, создатель ряда новых материалов, а главное, методов, которые позволяют открывать новые материалы. Решил считавшуюся нерешаемой задачу предсказания кристаллической структуры вещества на основе его химического состава. Создал программу USPEX, способную предсказывать устойчивые химические соединения по набору исходных элементов. Один из самых цитируемых в мире ученых.
Я хорошо помню, как мне пришло в голову решение этой задачи. Мы с семьей садились в самолет. У меня четверо детей, и все они расположились у меня на голове и прочих частях тела и к тому же продолжали непрерывно двигаться. Опытные родители знают, что сопротивляться этому бессмысленно, а беспокоиться неразумно. Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
У меня четверо детей, и все они расположились у меня на голове и прочих частях тела и к тому же продолжали непрерывно двигаться. Опытные родители знают, что сопротивляться этому бессмысленно, а беспокоиться неразумно. Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
Эта проблема волновала меня последние 15 лет. В 1984 году британский физик Дэвид Петтифор опубликовал работу, в которой ввел понятие менделеевских чисел, — с их помощью он сгруппировал элементы в порядке изменения их химических свойств. В таблице Менделеева свойства элементов меняются скачками. Так, после самого химически активного неметалла фтора идет инертный неон, а сразу за ним — активнейший металл натрий. Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
Петтифор предложил решение — выстроил элементы в некоторой последовательности, приписав им некие числа Менделеева. Но как приписал, не объяснил. И тем более не объяснил, какой у них физический смысл. Эти числа не расчет, а произвол, хотя и основанный на наблюдениях за свойствами бинарных соединений — веществ, состоящих из двух разных атомов. Скажем, если NaCl и KCl похожи, то и натрий с калием должны стоять рядом. Все это время ученые модифицировали и улучшали менделеевские числа, но что это такое, так никто и не объяснил.
У химических элементов есть разные характеристики, которые влияют на их свойства. Прежде всего размер атома (его радиус), валентность, поляризуемость*, электроотрицательность**. Но валентность — параметр непостоянный, у разных элементов могут быть разные валентности, а мы неоднократно открывали химические соединения, которые с точки зрения привычных представлений о валентности не могли бы существовать. Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
*Поляризуемость — способность атома или молекулы становиться электрически полярными во внешнем электромагнитном поле. Поляризуемость показывает, насколько легко может возникнуть заряженная частица (ион) или новая химическая связь.
**Электроотрицательность — способность атома оттягивать электроны других атомов в химических соединениях. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (F, O, N, Cl), низкая — у активных металлов (Li, Na, K).
Получается, что для определения фундаментальных свойств атомов можно использовать только атомный радиус и электроотрицательность. И если по оси Х — радиус, а по оси Y — электроотрицательность, мы получаем плоскость, на которой сильно вытянутым облаком располагаются элементы. Внутри этого облака, воспользовавшись несложным математическим приемом, можно провести линию, вдоль которой элементы встанут в порядке максимально плавного изменения свойств.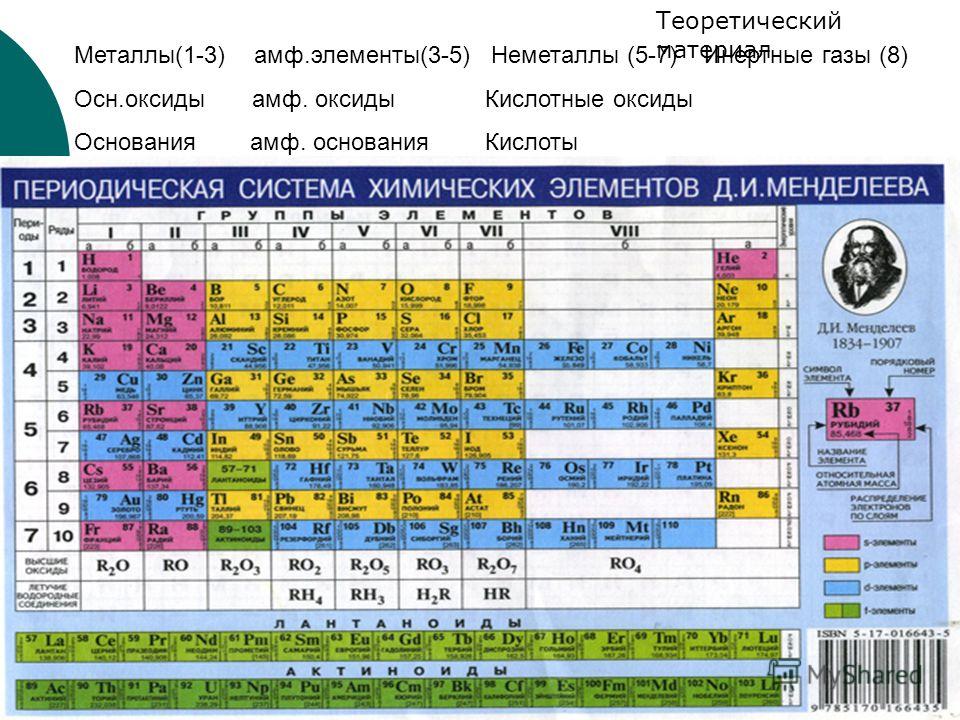
Так мы открыли физический и химический смысл менделеевских чисел: это наилучшее представление всех химических свойств атома одним числом. Но мы предложили не только объяснение, но и улучшенную версию чисел Менделеева, в которой нет места субъективности — только расчеты на основе фундаментальных характеристик атомов. Мы назвали это «Универсальной последовательностью элементов», по-английски Universal Sequence Of Elements, сокращенно USE. И действительно, наша последовательность удобна в применении: она предсказывает свойства химических соединений лучше, чем петтифоровские менделеевские числа и их позднейшие модификации.
Если расположить элементы на осях, то на плоскости будут бинарные соединения — молекулы и кристаллы, состоящие из двух типов атомов. Мы обнаружили, что на этом поле — его можно назвать химическим пространством — возникают области соединений с близкими свойствами, например твердостью кристаллов, магнетизмом, энергией связи. Известно, например, что алмаз, состоящий только из углерода, — самый твердый из кристаллов.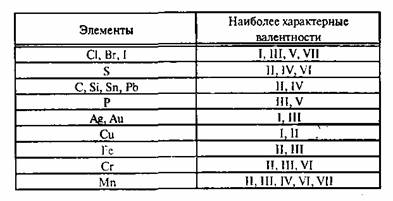 А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
Улучшенные менделеевские числа помогут находить новые соединения с полезными свойствами и смогут прояснить некоторые вопросы, связанные с привычной таблицей Менделеева. Например, уже сейчас можно ставить точку в споре, где должен находиться водород: над литием или над фтором. Согласно менделеевским числам, водород ближе к галогенам, чем к щелочным металлам.
Ссылка: Zahed Allahyari and Artem R. Oganov, Nonempirical Definition of the Mendeleev Numbers: Organizing the Chemical Space: J. Phys. Chem. C 2020, 124, 43, 23867-23878.
| НОМЕР | СИМВОЛ | ЭЛЕМЕНТ | СОСТОЯНИЕ ОКИСЛЕНИЯ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | He | Гелий | 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | Li | Литий | 1 , -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | B | Бор | 3 , 2, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | C | Углерод | 4 , 3, — 2, 1, 2, -4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | N | Азот | 5 , 4, 3, 2, 1, 0, -1, -2, -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8 | O | Кислород | 2, 1, 0, -1, -2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 | F | Фтор | 0, -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10 | 4 Neon | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11 | Na | Натрий | 1 , -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 | Mg | Магний | 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 , 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 14 | Si | Кремний | 4 , 3, 2, 1, -1, -2, -4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 15 | P | Фосфор | 5 , 4, 3 , 2, 1, 0, -1, -2, -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16 | S | Сера | 6 , 5, 4, 3 , 2, 1, 0, -1, -2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17 | Класс | Хлор | 6, 5, 4, 3, 2, 1, 0, -1 , -2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 18 | Ar | Аргон | 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19 | K | Калий | 1 , -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 20 | Ca | Кальций | 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 21 | Sc | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 22 | Ti | Титан | 4 , 3, 2, 0, -1, -2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 23 | V | Ванадий | 5, 4, 3 , 2, 1, 0, -1, -2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 24 | Cr | Хром | 6 , 5, 4, 3 , 2 , 1, 0, -1, -2, -3 , -4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 25 | Mn | Марганец | 7 , 6, 5, 4 , 3, 9 0005 2 , 1, 0, -1, -2, -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 26 | Fe | Железо | 6, 5, 4, 3 , 2 , 1, 0, -1, -2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 27 | Co | Кобальт | 5, 4, 3 , 2 , 1, 0, -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 28 | Ni | Никель | 6, 4, 3, 2 , 1, 0, -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 29 | Cu | Медь | 4, 3, 2 , 1 , 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 30 | Zn | Цинк | Цинк | 2 , 1, 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 31 | Ga | Галлий | 3 , 2, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 32 | Ge | Германий | , 20005, 2000 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 33 | As | Мышьяк | 5 , 3 , 2, -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 34 | S e | Селен | 6, 4 , 2, 1, -2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 35 | Br | Бром | 7, 5, 4, 3, 1, 0, -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 36 | Kr | Krypton | 2, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 37 | Rb | Рубидий | 1 , -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 39 | Y | Иттрий | 3 , 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 40 | Zr | Цирконий | 4 , 3, 2 | 41 | Nb | Ниобий | 5 , 4, 3, 2, 1, 0, -1, -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 42 | Mo | Молибден | 6 , 5, , 3, 2, 1, 0, -1, -2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 43 | Tc | Технеций | 7 , 6, 5, 4 , 3, 2, 1, 0, -1, -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 44 | Ru | Рутений | 8, 7, 6 , 5, 4 , 3 , 2, 1, 0, -2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 45 | Rh | Родий | 6, 5, 4, 3 , 2, 1, 0, -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 46 | Pd | Палладий | 4 , 2 , 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 47 | Ag | Серебро | 3, 2, 000 20, 0 | Cd | Кадмий | 2 , 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 49 | In | Индий | 3 , 2, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 50 | Sn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 51 | Сб | Сурьма | 5, 3 , — 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 52 | Te | Теллур | 6, 5, 4 , 2, 1, -2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 53 | I | Йод | 7, 5 , 3, 3, 3, , 0, -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 54 | Xe | Ксенон | 8, 6, 4, 3, 2, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 55 | Cs | Цезий | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 56 | Ba | Барий | 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 57 | La | Лантан | 3 , 2 | 58007 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 59 | Pr | Празеодим | 4, 3 , 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 60 | Nd | Неодим | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| П м | Прометий | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 62 | Sm | Самарий | 3 , 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 63 | Eu | Gd | Гадолиний | 3 , 2, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 65 | Tb | Тербий | 4, 3 , 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 67 | Ho | Гольмий | 3 , 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 68 | Er | Эрбий | 3 | 00 | 3 , 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 70 | Yb | Иттербий | 3 , 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 71 | Лютеций | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 72 | Hf | Гафний | 4 , 3, 2, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 73 | , 3, 2, 1, -1, -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 74 | W | Вольфрам | 6 , 5, 4 , 3, 2, 1, 0, -1, -2, — 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 75 | Re | Рений | 7, 6, 5 , 4 , 3 , 2, 1, 0, -1, -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 76 | Os | Осмий | 8, 7, 6, 5, 4 , 3, 2, 1, 0, -2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 77 | Ir | Иридий | 6, 5, 4 , 3 , 2, 1, 0, -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 78 | Pt | Платина | 6, 5, 4 , 2 , 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 79 | Au 900 07 | Золото | 7, 5, 3 , 2, 1, 0, -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 80 | Hg | Mercury | 2 , 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 81 | Tl | Таллий | 3 , 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 82 | Pb | Свинец | 4, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 83 | Bi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 84 | Po | Полоний | 6, 4 , 2, -2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 85 | At | Астатин | 7, 5, 3, 1, — 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 86 | Rn | Радон | 2, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 87 | Fr | Франций | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 89 | Ac | Актиний | 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 90 | Th | Торий | 4 , 3, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 , 4, 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 92 | U | Уран | 6 , 5, 4, 3, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 93 | Np | Np | , 6, 5, 4, 3, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 94 | Pu | Плутоний | 7 , 6, 5, 4 , 3, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 95 | Am | Америций | 7, 6, 5, 4, 3 , 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 96 | Cm | Curium | 6 , 5 , 4, 3 , 2 | 97 Bk | Berkelium 9000 7 | 4, 3 , 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 98 | Cf | Калифорний | 5 , 4, 3 , 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 99 | Es |
| 0 | 0 Einsteinium 3 , 2 | |||||
| 100 | Fm | Фермий | 4 , 3 , 2 | |||
| 101 | Md | Менделевий | ||||
| 102 | Нет | Нобелиум | 3, 2 | |||
| 103 | Lr | Lawrencium | 3 , 2 3 | 00 | 00 | 00 |
| 105 | Db | Дубний | 5 , 4 | |||
| 106 | Sg | Seaborgium | 6 , 5 , 4 | |||
| 107 | Bh | Bohrium | 7 , 6| 0, , , | | ||
| 108 | Hs | Калий | 8 , 7 , 4 , 3 , 2 | |||
| 109 | ||||||
| 110 | Ds | Дармштадтиум | 6 , 5 , | |||
| 111 | Rg | Roentgenium | 3 , -1 | |||
| 112 | Cn | Copernicium | ||||
| 113 | Nh | Nihonium | 1 | |||
| 114 | Fl | Flerovium | 3 , 1 | |||
| 116 | Lv | Livermorium | 4 , 2 | |||
| 117 | 00 | Tsine000 | Og | Оганессон | 8 , 6 , 4 , 2 |
Таблица химического состава элементов
Вы можете предположить, что валентности элементов — количество электронов, с которыми атом будет связываться или образовывать — это те, которые можно определить, глядя на группы (столбцы) периодической таблицы.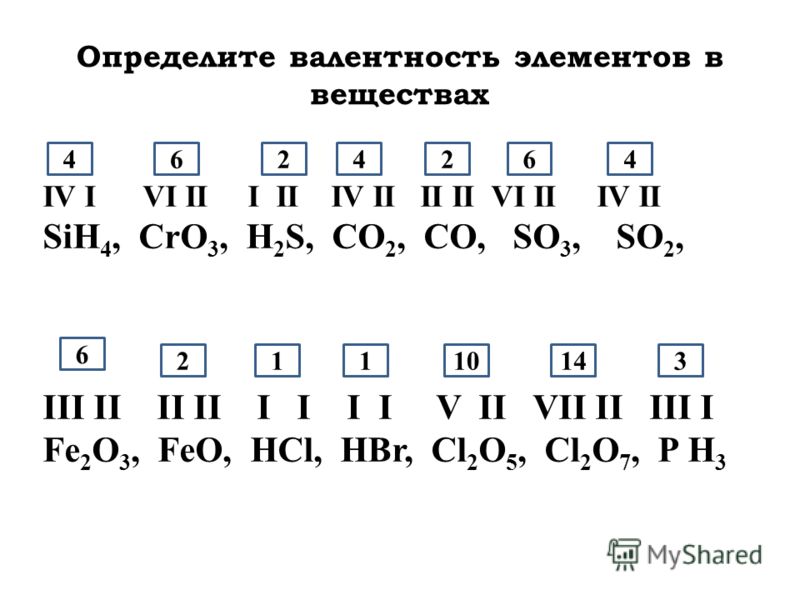 Хотя это наиболее распространенные валентности, реальное поведение электронов менее простое.
Хотя это наиболее распространенные валентности, реальное поведение электронов менее простое.
Вот таблица валентностей элементов. Помните, что электронное облако элемента станет более стабильным, если заполнить, опустошить или наполовину заполнить оболочку. Кроме того, оболочки не складываются аккуратно одна на другую, поэтому не всегда предполагайте, что валентность элемента определяется количеством электронов в его внешней оболочке.
| Номер | Элемент | Валентность |
| 1 | Водород | (-1), +1 |
| 2 | Гелий | 0 |
| 3 | Литий | +1 |
| 4 | Бериллий | +2 |
| 5 | Бор | -3, +3 |
| 6 | Углерод | (+2), +4 |
| 7 | Азот | -3, -2, -1, (+1), +2, +3, +4, +5 |
| 8 | Кислород | -2 |
| 9 | Фтор | -1, (+1) |
| 10 | Неон | 0 |
| 11 | Натрий | +1 |
| 12 | Магний | +2 |
| 13 | Алюминий | +3 |
| 14 | Кремний | -4, (+2), +4 |
| 15 | Фосфор | -3, +1, +3, +5 |
| 16 | Сера | -2, +2, +4, +6 |
| 17 | Хлор | -1, +1, (+2), +3, (+4), +5, +7 |
| 18 | Аргон | 0 |
| 19 | Калий | +1 |
| 20 | Кальций | +2 |
| 21 | Скандий | +3 |
| 22 | Титан | +2, +3, +4 |
| 23 | Ванадий | +2, +3, +4, +5 |
| 24 | Хром | +2, +3, +6 |
| 25 | Марганец | +2, (+3), +4, (+6), +7 |
| 26 | Утюг | +2, +3, (+4), (+6) |
| 27 | Кобальт | +2, +3, (+4) |
| 28 | Никель | (+1), +2, (+3), (+4) |
| 29 | Медь | +1, +2, (+3) |
| 30 | Цинк | +2 |
| 31 | Галлий | (+2). +3 +3 |
| 32 | Германий | -4, +2, +4 |
| 33 | Мышьяк | -3, (+2), +3, +5 |
| 34 | Селен | -2, (+2), +4, +6 |
| 35 | Бром | -1, +1, (+3), (+4), +5 |
| 36 | Криптон | 0 |
| 37 | Рубидий | +1 |
| 38 | Стронций | +2 |
| 39 | Иттрий | +3 |
| 40 | Цирконий | (+2), (+3), +4 |
| 41 | Ниобий | (+2), +3, (+4), +5 |
| 42 | Молибден | (+2), +3, (+4), (+5), +6 |
| 43 | Технеций | +6 |
| 44 | Рутений | (+2), +3, +4, (+6), (+7), +8 |
| 45 | Родий | (+2), (+3), +4, (+6) |
| 46 | Палладий | +2, +4, (+6) |
| 47 | Серебро | +1, (+2), (+3) |
| 48 | Кадмий | (+1), +2 |
| 49 | Индий | (+1), (+2), +3 |
| 50 | Олово | +2, +4 |
| 51 | Сурьма | -3, +3, (+4), +5 |
| 52 | Теллур | -2, (+2), +4, +6 |
| 53 | Йод | -1, +1, (+3), (+4), +5, +7 |
| 54 | Ксенон | 0 |
| 55 | Цезий | +1 |
| 56 | Барий | +2 |
| 57 | Лантан | +3 |
| 58 | Церий | +3, +4 |
| 59 | Празеодим | +3 |
| 60 | Неодим | +3, +4 |
| 61 | Прометий | +3 |
| 62 | Самарий | (+2), +3 |
| 63 | Европий | (+2), +3 |
| 64 | Гадолиний | +3 |
| 65 | Тербий | +3, +4 |
| 66 | Диспрозий | +3 |
| 67 | Гольмий | +3 |
| 68 | Эрбий | +3 |
| 69 | Тулий | (+2), +3 |
| 70 | Иттербий | (+2), +3 |
| 71 | Лютеций | +3 |
| 72 | Гафний | +4 |
| 73 | Тантал | (+3), (+4), +5 |
| 74 | Вольфрам | (+2), (+3), (+4), (+5), +6 |
| 75 | Рений | (-1), (+1), +2, (+3), +4, (+5), +6, +7 |
| 76 | Осмий | (+2), +3, +4, +6, +8 |
| 77 | Иридий | (+1), (+2), +3, +4, +6 |
| 78 | Платина | (+1), +2, (+3), +4, +6 |
| 79 | Золото | +1, (+2), +3 |
| 80 | Меркурий | +1, +2 |
| 81 | Таллий | +1, (+2), +3 |
| 82 | Свинец | +2, +4 |
| 83 | Висмут | (-3), (+2), +3, (+4), (+5) |
| 84 | Полоний | (-2), +2, +4, (+6) |
| 85 | Астатин | ? |
| 86 | Радон | 0 |
| 87 | Франций | ? |
| 88 | Радий | +2 |
| 89 | Актиний | +3 |
| 90 | торий | +4 |
| 91 | Протактиний | +5 |
| 92 | Уран | (+2), +3, +4, (+5), +6 |
Источники
- Коричневый, И.
 Дэйвид. «Химическая связь в неорганической химии: модель валентности связи», 2-е изд. Международный союз кристаллографии. Oxford: Oxford Science Publications, 2016.
Дэйвид. «Химическая связь в неорганической химии: модель валентности связи», 2-е изд. Международный союз кристаллографии. Oxford: Oxford Science Publications, 2016. - Ланге, Норберт А. «Справочник Ланге по химии», 8-е изд. Справочник издательства, 1952 г.
- О’Дуайер, М.Ф., Дж. Э. Кент и Р. Д. Браун. «Валентность». Нью-Йорк: Springer-Verlag, 1978.
- Смарт, Лесли Э. и Элейн А. Мур. «Химия твердого тела. Введение», 4-е издание.Бока-Ратон: CRC Press, 2016.
1.3: Валентные электроны и открытые валентности
Валентный электрон — это электрон, который связан с атомом и может участвовать в образовании химической связи; в одинарной ковалентной связи оба атома в связи вносят один валентный электрон для образования общей пары. Присутствие валентных электронов может определять химические свойства элемента и то, может ли он связываться с другими элементами: для элемента основной группы валентный электрон может находиться только во внешней электронной оболочке. 6 \)) химически инертен. Атом с одним или двумя валентными электронами больше, чем закрытая оболочка, очень реактивен, потому что лишние валентные электроны легко удаляются с образованием положительного иона. Атом с одним или двумя валентными электронами меньше, чем закрытая оболочка, также является высоко реактивным из-за тенденции либо получать недостающие валентные электроны (тем самым образуя отрицательный ион), либо делить валентные электроны (тем самым образуя ковалентную связь).
6 \)) химически инертен. Атом с одним или двумя валентными электронами больше, чем закрытая оболочка, очень реактивен, потому что лишние валентные электроны легко удаляются с образованием положительного иона. Атом с одним или двумя валентными электронами меньше, чем закрытая оболочка, также является высоко реактивным из-за тенденции либо получать недостающие валентные электроны (тем самым образуя отрицательный ион), либо делить валентные электроны (тем самым образуя ковалентную связь).
Подобно электрону во внутренней оболочке, валентный электрон обладает способностью поглощать или выделять энергию в виде фотона.Увеличение энергии может заставить электрон переместиться (прыгнуть) на внешнюю оболочку; это известно как атомное возбуждение. Или электрон может даже вырваться из валентной оболочки связанного с ним атома; это ионизация с образованием положительного иона. Когда электрон теряет энергию (тем самым вызывая излучение фотона), он может перемещаться во внутреннюю оболочку, которая не полностью занята.
Число валентных электронов
Число валентных электронов элемента можно определить по группе периодической таблицы (вертикальный столбец), в которой этот элемент отнесен к категории.За исключением групп 3–12 (переходные металлы), цифра единиц номера группы указывает, сколько валентных электронов связано с нейтральным атомом элемента, указанного в этом конкретном столбце.
Периодическая таблица химических элементов
| Группа периодической таблицы | Валентные электроны |
|---|---|
| Группа 1 (I) (щелочные металлы) | 1 |
| Группа 2 (II) (щелочноземельные металлы) | 2 |
| Группы 3-12 (переходные металлы) | 2 * (Оболочка 4s завершена и больше не может удерживать электроны) |
| Группа 13 (III) (группа бора) | 3 |
| Группа 14 (IV) (углеродная группа) | 4 |
| Группа 15 (V) (пниктогены) | 5 |
| Группа 16 (VI) (халькогены) | 6 |
| Группа 17 (VII) (галогены) | 7 |
| Группа 18 (VIII или 0) (благородные газы) | 8 ** |
* Общий метод подсчета валентных электронов обычно не подходит для переходных металлов. Вместо этого используется модифицированный метод счета d-электронов. ** За исключением гелия, у которого всего два валентных электрона.
Вместо этого используется модифицированный метод счета d-электронов. ** За исключением гелия, у которого всего два валентных электрона.
Концепция открытой валентности («валентность»)
Валентность (или валентность ) элемента является мерой его объединяющей способности с другими атомами, когда он образует химические соединения или молекулы. Концепция валентности была разработана во второй половине 19 века и успешно объяснила молекулярную структуру многих органических соединений.Поиски основных причин валентности привели к современным теориям химической связи, включая структуры Льюиса (1916), теорию валентных связей (1927), молекулярные орбитали (1928), теорию отталкивания пар электронов валентных оболочек (1958) и все продвинутые методы квантовой химии.
Объединяющая способность или сродство атома элемента определялась числом атомов водорода, с которыми он соединялся. В метане углерод имеет валентность 4; в аммиаке азот имеет валентность 3; в воде кислород имеет валентность два; а в хлористом водороде хлор имеет валентность 1. Хлор, поскольку он имеет валентность, равную единице, может быть заменен водородом, поэтому фосфор имеет валентность 5 в пентахлориде фосфора, PCl 5 . Диаграммы валентности соединения представляют собой взаимосвязь элементов, линии между двумя элементами, иногда называемые связями, представляют насыщенную валентность для каждого элемента. [1] Примеры: —
Хлор, поскольку он имеет валентность, равную единице, может быть заменен водородом, поэтому фосфор имеет валентность 5 в пентахлориде фосфора, PCl 5 . Диаграммы валентности соединения представляют собой взаимосвязь элементов, линии между двумя элементами, иногда называемые связями, представляют насыщенную валентность для каждого элемента. [1] Примеры: —
Валентность описывает только связность, она не описывает геометрию молекулярных соединений или то, что сейчас известно как ионные соединения или гигантские ковалентные структуры.Линия между атомами не представляет собой пару электронов, как на диаграммах Льюиса.
[PDF] Периодическая таблица, валентность и формула
1 Периодическая таблица, валентность и формула Происхождение периодической таблицы Мендельев в 1869 г. предположил, что существует связь …
Периодическая таблица, валентность и формула Происхождение периодической таблицы
Мендельёв в 1869 году предположил, что существует связь между химическими свойствами элементов и их атомными массами. Он заметил закономерность, когда элементы располагались горизонтальными рядами, а химически похожие элементы располагались в вертикальных столбцах. Зная, что в то время его познания в химии и элементах были ограничены, он решил оставить пробелы в своей таблице, где элементы должны существовать, даже если они не были известны в то время, он также правильно предсказал свойства этих недостающих элементов. Х. Г. Мозли (1887 — 1915) внес свой вклад в периодическую таблицу элементов, расположив элементы в соответствии с их атомным номером, а не массовым числом.Для этого Мозли работал с рентгеновскими лучами.
Он заметил закономерность, когда элементы располагались горизонтальными рядами, а химически похожие элементы располагались в вертикальных столбцах. Зная, что в то время его познания в химии и элементах были ограничены, он решил оставить пробелы в своей таблице, где элементы должны существовать, даже если они не были известны в то время, он также правильно предсказал свойства этих недостающих элементов. Х. Г. Мозли (1887 — 1915) внес свой вклад в периодическую таблицу элементов, расположив элементы в соответствии с их атомным номером, а не массовым числом.Для этого Мозли работал с рентгеновскими лучами.
Периодическая таблица
Периодическая таблица представляет собой классификацию всех элементов на основе атомных номеров. Современная таблица состоит из горизонтальных периодов и вертикальных групп, которые содержат элементы, расположенные в следующем порядке: • Порядок возрастания атомного номера • Относительно электронной структуры их атомов • Относительно их химических свойств Периоды: — Новый период начинается, когда новый электрон попадает в новую оболочку. Есть семь периодов, пронумерованных от 1 до 7 со следующими свойствами: 1. Все элементы одного периода имеют одинаковое количество оболочек. 2. В периоде у каждого элемента на один протон больше, чем у предыдущего элемента. 3. Со временем химические свойства элементов становятся менее металлическими и более неметаллическими. Кевин Смолл www.cxctutor.org или www.cxctutor.com
Есть семь периодов, пронумерованных от 1 до 7 со следующими свойствами: 1. Все элементы одного периода имеют одинаковое количество оболочек. 2. В периоде у каждого элемента на один протон больше, чем у предыдущего элемента. 3. Со временем химические свойства элементов становятся менее металлическими и более неметаллическими. Кевин Смолл www.cxctutor.org или www.cxctutor.com
Группы: — Это вертикальные столбцы элементов, они представляют собой 8 групп, пронумерованных I-‐ VIII.1. Каждый элемент в группе имеет одинаковое количество электронов на внешней оболочке. Для элемента в группе I-‐ VIII этот номер называется номером группы. 2. При спуске по группе каждый элемент имеет на одну оболочку больше, чем предыдущий элемент. 3. Элементы одной группы имеют схожие химические свойства. 4. Повышается активность металлов, снижающихся по группе. 5. Активность неметаллов возрастает по группе. В периодической таблице элементы делятся на металлы, неметаллы и полуметаллы (металлоиды).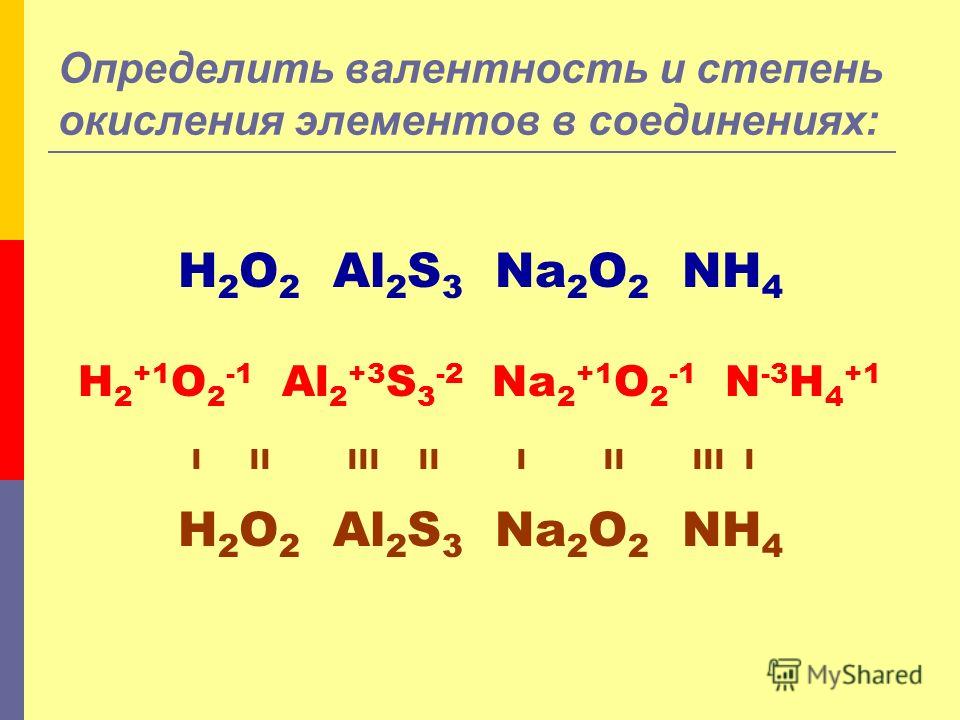 Есть две группы, которые включают только металлы. Это I и II группа. Есть две группы, которые содержат металлы, за исключением бора. К металлоидам относятся: Si группа B, группа Ge IV как группа V Te, группа Po VI Al группа III Кевин Смолл www.cxctutor.org или www.cxctutor.com
Есть две группы, которые включают только металлы. Это I и II группа. Есть две группы, которые содержат металлы, за исключением бора. К металлоидам относятся: Si группа B, группа Ge IV как группа V Te, группа Po VI Al группа III Кевин Смолл www.cxctutor.org или www.cxctutor.com
Кевин Смолл www.cxctutor.org или www. cxctutor.com
Валентность элементов Валентность — это количество электронов, которое атом должен потерять, получить или разделить для достижения стабильной электронной структуры.Формула Например, 1 Формула воды (h3O) говорит нам, что у нас 2 атома водорода на 1 атом кислорода. Например. 2 Формула углекислого газа (CO2) говорит нам, что у нас есть 2 атома кислорода и 1 атом углерода. Химическая формула соединения показывает соотношение атомов каждого элемента по массе. Например, сульфат аммония — (Nh5) 2SO4: Азот — 2 Водород — 8 Сера — 1 Кислород — 4 Формула нитрата меди записывается как: Cu (NO3) 2, а не как CuN2O6 Это потому, что соединение является нитратом и имеет свойства нитрата. Нитратная группа распознается как NO3. Вот список некоторых общих названий групп: 1. 2. 3. 4. 5. 6. 7. 8.
Нитратная группа распознается как NO3. Вот список некоторых общих названий групп: 1. 2. 3. 4. 5. 6. 7. 8.
SO4 — сульфат, например. K2SO4 CO3 — карбонат, например Na2CO3 Cl — хлорид, например NaCl OH — гидроксид, например KOH O — оксид, например Al2O3 S — сульфид, например ZnS NO3 — нитрат, например Cu (NO3) 2 HCO3 — гидрокарбонат, например NaHCO3
Кевин Смолл www.cxctutor.org или www.cxctutor.com
Составление формулы соединений Чтобы написать простую химическую формулу, вам необходимо знать: 1.Символ или формула элементов и групп. 2. Валентности элементов или групп. (Валентность является мерой объединяющей способности) Элемент (Металлы) Натрий Калий Серебро Золото Барий Кальций Цинк Медь Железо Свинец Магний Алюминий
Символ Na K Ag Au Ba Ca Zn Cu Fe Pb Mg Al
Валентность 1 1 1 1 и 3 2 2 2 2 и 1 2 и 3 2 2 3
Элемент (неметаллы) Бромид водорода Йодид Кислород Сера Азот Фосфор углерод
Символ H Cl Br I O S N P C
Валентность 1 1 1 1 2 2, 4 и 6 3 и 5 3 и 5 4
Группа Гидроксид аммония Нитрат Сульфат Карбонат Водород Карбонат Фосфат
Символ Nh5 OH NO3 SO4 CO3 HCO3 PO4
Валентность 1 1 1 2 2 1 3
Kevin Small www.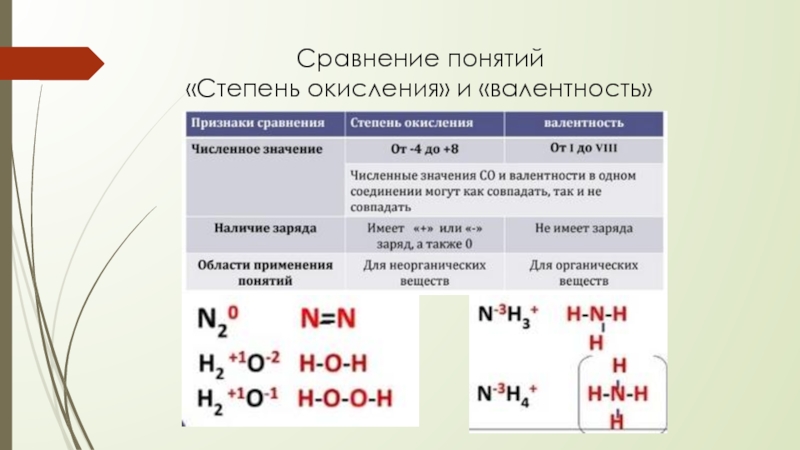 cxctutor.org или www.cxctutor.com
cxctutor.org или www.cxctutor.com
Кевин Смолл www.cxctutor.org или www.cxctutor.com
Кевин Смолл www.cxctutor.org или www.cxctutor.com
Как рассчитать валентность | Sciencing
Обновлено 10 февраля 2020 г.
Tracy McConnell
Рецензировано: Lana Bandoim, B.S.
Валентность — это мера способности атома связываться с другими атомами.Чем выше количество валентных электронов, тем более реакционноспособен атом или молекула.
Сколько электронов на каждой орбитали?
Электроны первыми займут наиболее устойчивое положение. Внутренняя орбиталь (K) вмещает до 2 электронов. Следующая орбиталь (L) содержит до 8 электронов. Следующая орбиталь (M) также содержит до 8 электронов.
Есть суборбиталей s, p, d и f , которые находятся в пределах орбиталей K, L, M, N.
Присутствие 8 электронов на L-орбитали обеспечивает стабильность на основе полной орбитали. Имея 2 на суборбитальных s и по 2 на каждой из 3 p суборбиталей, это делает L-орбиталь завершенной. Это относится и к орбитали М. Это называется правилом октетов .
Имея 2 на суборбитальных s и по 2 на каждой из 3 p суборбиталей, это делает L-орбиталь завершенной. Это относится и к орбитали М. Это называется правилом октетов .
Найдите число валентности
Воспользуйтесь периодической таблицей, чтобы найти атомный номер. В первом примере возьмем углерод. Атомный номер 6, что означает 6 протонов и 6 электронов.
На внутренней орбитали электронов 2 электрона, поэтому на следующей орбитали 4 (6 — 2 = 4).
Внешняя орбиталь с 4 электронами, движущимися по-разному, вращая ядро, может создать 4 одинарные связи.
Можно сказать, что валентность углерода равна 4.
Группы периодической таблицы
В периодической таблице элементы располагаются в определенном порядке в зависимости от их поведения. Элементы с одинаковым количеством валентных электронов обладают одинаковыми свойствами. Группы названы по элементу в верхней части столбца периодической таблицы.
Группы названы по элементу в верхней части столбца периодической таблицы.
Литиевое семейство Group 1A имеет 1 валентный электрон.Атомы в этом столбце периодической таблицы имеют тенденцию к терять 1 электрон, и это связывает его с атомом, который предпочитает принимать 1 электрон.
Элементы в группе Бериллий имеют 2 валентных электрона, а элементы в группе кислорода — 6. В соответствии с структурой элементов, желающих иметь полную оболочку из электронов, элементы кислородной группы любят получать 2 электрона.
Семейство гелия, также называемое благородными газами, не реагирует, потому что у них нет отверстий во внешней электронной оболочке.
Валентность таких элементов, как железо, принадлежащих к семейству металлов, более сложна и может иметь разные валентности в зависимости от сил со стороны других атомов вокруг него. Некоторые могут иметь валентность +2 при одних обстоятельствах и +3 при других. Одна из причин этой разницы в том, что в более крупных молекулах орбитали дальше от ядра, а это означает, что сила, удерживающая электрон с атомом, слабее. Другая причина в том, что орбитали иногда близки друг к другу или перекрываются.
Другая причина в том, что орбитали иногда близки друг к другу или перекрываются.
Валентность бора (B)
Внутренняя орбиталь является ближайшей к центру атома бора и содержит 2 электрона.
Следующая орбиталь содержит 3 электрона, разделенных на подоболочки s и p. 2 электрона в сек. и 1 электрон в сек. Это крайние 3, так что это реактивные электроны. Каждый будет связываться с другими атомами, разделяя электрон.
Валентность бора равна 3.
Предсказание поведения электронов
Электроны заполняют атомные орбитали определенным образом.Принцип aufbau гласит, что электроны присутствуют на атомных орбиталях, начиная с электронов с самой низкой энергией, за которыми следуют электроны с последовательно большей энергией.
Орбитальная 1_s_ заполняется перед 2_s, заполняется перед 2_p и так далее.
Валентность важно знать, потому что она позволяет предсказать, будет ли атом с большей вероятностью пожертвовать электронов или примет их , и это позволяет узнать, как атом будет взаимодействовать с другими атомами.
Диаграмма валентности
Знаете ли вы формулу соли или воды? Ага! Формула соли — NaCl, вода — h3O. Это был простой вопрос, не правда ли? Но задумывались ли вы, в чем причина этой конкретной формулы? Как они получены? Что ж, в этой статье мы собираемся обсудить ответ на эти вопросы, который называется «Валентность». Валентность играет жизненно важную роль в определении формулы соединений.
Что означает термин «валентность»?
Валентность — это объединяющая способность элемента.Это всегда целое число. У него нет знака плюс или минус. Электроны, присутствующие во внешней оболочке атома, известны как «валентные электроны». Мы можем сказать, что валентность — это количество электронов, которое элемент может потерять или получить для достижения стабильности. Валентность используется для написания химической формулы соединения. Это означает, что по валентности мы можем знать, как атомы элемента будут соединяться с атомами другого элемента.
У него нет знака плюс или минус. Электроны, присутствующие во внешней оболочке атома, известны как «валентные электроны». Мы можем сказать, что валентность — это количество электронов, которое элемент может потерять или получить для достижения стабильности. Валентность используется для написания химической формулы соединения. Это означает, что по валентности мы можем знать, как атомы элемента будут соединяться с атомами другого элемента.
Давайте разберемся с валентностью на следующих примерах —
1. Валентность меди — Медь является переходным элементом.Большинство переходных элементов имеют переменную валентность. Медь имеет две валентности 1 и 2. Если медь показывает валентность 1 или Cu (I), то она называется медью, а когда она показывает валентность 2 или Cu (II), то она известна как медь.
2. Валентность азота — Атомный номер азота равен 7. Его электронная конфигурация — 2, 5. Итак, ясно, что азот имеет 5 электронов в своей внешней оболочке. Для завершения своего октета азоту нужно еще 3 электрона. Завершив свой октет, он достигнет стабильности.Таким образом, валентность азота равна 3.
Для завершения своего октета азоту нужно еще 3 электрона. Завершив свой октет, он достигнет стабильности.Таким образом, валентность азота равна 3.
3. Валентность натрия — Атомный номер натрия равен 11. Его электронная конфигурация составляет 2,8,1. Итак, ясно, что натрий должен потерять один электрон, чтобы достичь стабильности, заполнив свой октет. Таким образом, его валентность составляет 1.
4. Валентность фтора — атомное число фтора равно 9. Его электронная конфигурация составляет 2,7. Ему нужен один электрон для выполнения своего октета и достижения стабильности. Итак, его валентность 1.
5. Валентность лития — атомный номер лития 3.Его электронная конфигурация — 2,1. Таким образом, он должен потерять один электрон, чтобы достичь стабильности и получить электронную конфигурацию, как благородный газ гелий. Таким образом, его валентность равна 1.
6. Валентность гелия — атомный номер гелия равен 2. Его внешняя оболочка уже выполнена. Итак, гелий является очень стабильным элементом и не реагирует легко с другими элементами. Он также известен как инертный газ или благородный газ. Таким образом, валентность гелия равна нулю.
Итак, гелий является очень стабильным элементом и не реагирует легко с другими элементами. Он также известен как инертный газ или благородный газ. Таким образом, валентность гелия равна нулю.
7. Валентность никеля — Никель — переходный элемент.Итак, он показывает переменные валентности. Его атомный номер 28. Он имеет две электронные конфигурации [Ar] 3d84s2 или [Ar] 3d9 4s1. Он показывает в основном валентности 2, 3 и 4.
8. Валентность фосфора — атомный номер фосфора 15. Его электронная конфигурация 2,8,5. Таким образом, ему нужно 3 электрона, чтобы выполнить свою внешнюю оболочку и достичь стабильности. Таким образом, его валентность составляет 3.
9. Валентность скандия — атомный номер скандия равен 21. Это также переходный элемент, но он не имеет переменных валентностей.Его электронная конфигурация — [Ar] 3d1 4s2. Итак, его валентность составляет 3.
10. Валентность ванадия — атомный номер ванадия равен 23. Это также переходный элемент, который имеет переменные значения. Его электронная конфигурация — [Ar] 3d3 4s2. Он показывает валентности 2, 3, 4 и 5 (в основном 5 и 4).
Его электронная конфигурация — [Ar] 3d3 4s2. Он показывает валентности 2, 3, 4 и 5 (в основном 5 и 4).
Диаграмма валентности элементов (первые тридцать)
Элемент | Атомный номер | Валентность | ||||||||||||||||||||||||||||||||||
00 1 Водород 6 | ||||||||||||||||||||||||||||||||||||
Гелий | 2 | 0 | ||||||||||||||||||||||||||||||||||
литий | 3 | 1 | 7 | |||||||||||||||||||||||||||||||||
Бор | 5 | 3 | ||||||||||||||||||||||||||||||||||
Углерод | 6 | 4 27 | ||||||||||||||||||||||||||||||||||
Кислород | 8 | 2 | ||||||||||||||||||||||||||||||||||
Фтор | 9 | 1 | ||||||||||||||||||||||||||||||||||
Неон | ||||||||||||||||||||||||||||||||||||
Натрий | 11 | 1 | ||||||||||||||||||||||||||||||||||
Магний | 12 | 2 | ||||||||||||||||||||||||||||||||||
Алюминий | ||||||||||||||||||||||||||||||||||||
Кремний | 14 | 4 | ||||||||||||||||||||||||||||||||||
Фосфор | 15 | 3 | ||||||||||||||||||||||||||||||||||
0 | ||||||||||||||||||||||||||||||||||||
9262 Сера Сера | ||||||||||||||||||||||||||||||||||||
Хлор 9 0007 | 17 | 1 | ||||||||||||||||||||||||||||||||||
Аргон | 18 | 0 | ||||||||||||||||||||||||||||||||||
Калий | 7 | 7
|

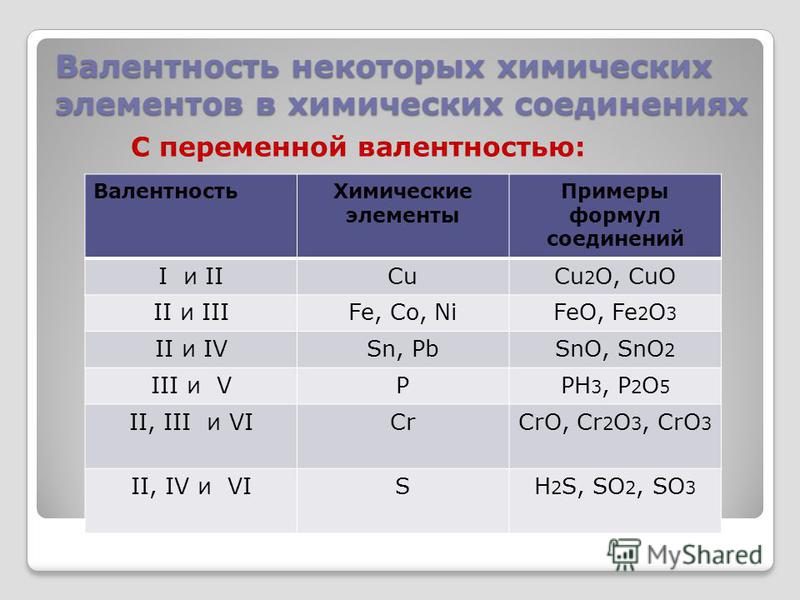
 +3
+3
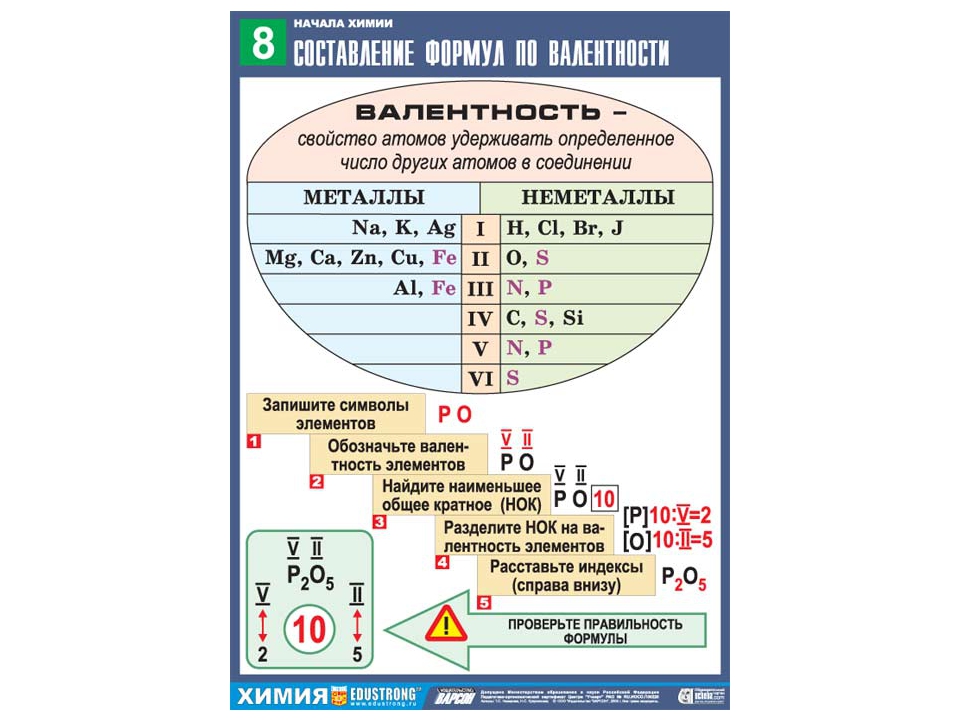 Растворимость. Смеси.
Растворимость. Смеси.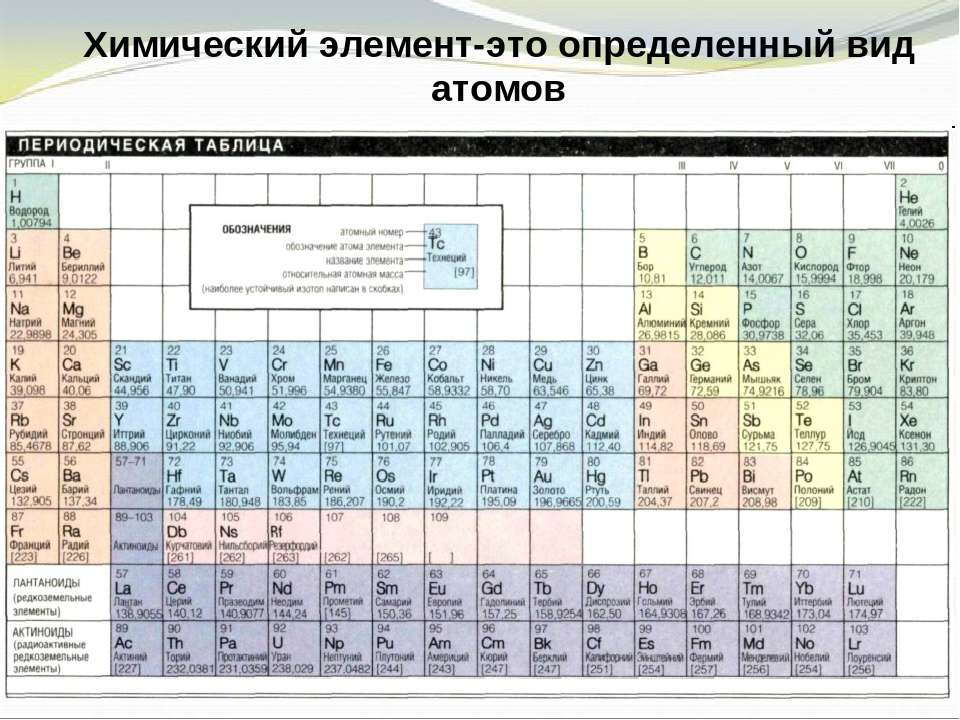 Максимальная и минимальная валентность.
Максимальная и минимальная валентность. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов.
Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов.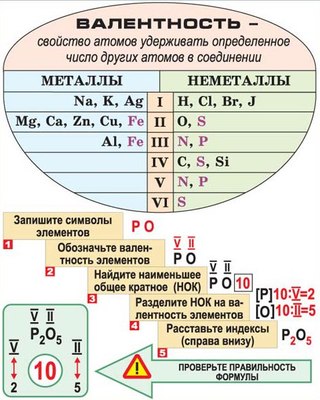





 +3
+3
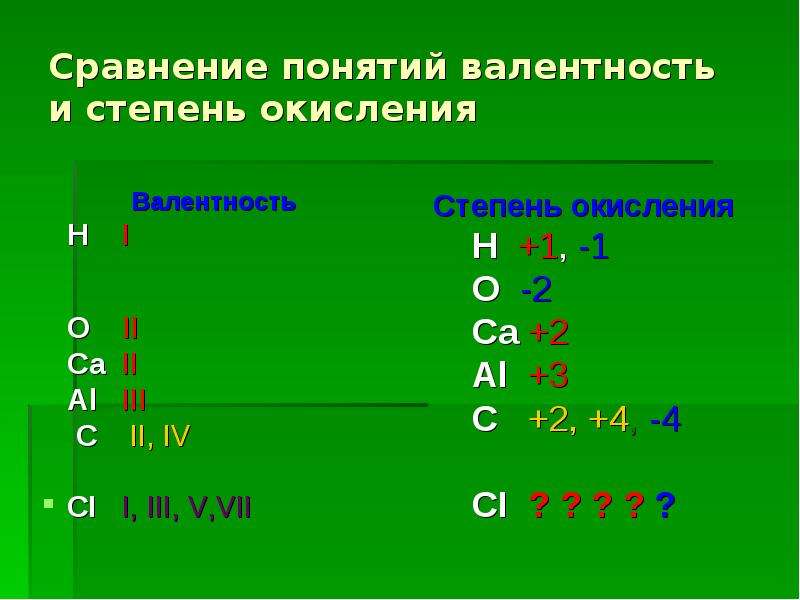 Энтальпии. Энтропии. Энергии Гиббса…
Энтальпии. Энтропии. Энергии Гиббса… Например —
Например —