Содержание
Валентность родия
Валентность родия.
Валентность родия:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.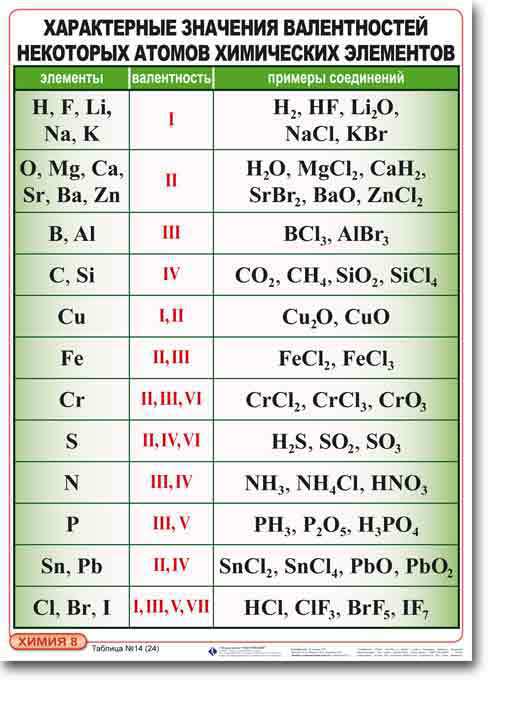
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность родия равна II, III, IV, V, VI. Родий проявляет переменную валентность.
| Валентность родия в соединениях | |
| II | RhO |
| III | Rh2(SO4)3, RhBr3, Rh2O3 |
| IV | Rh(OH)4, RhF4,RhO2 |
| V | RhF5, Sr3LiRhO6 |
| VI | RhP2, RhF6 |
Все свойства атома родия
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Коэффициент востребованности
50
Родий шести валентный — Справочник химика 21
Согласно этой теории, катализ происходит только при структурном и энергетическом соответствии катализируемых молекул данному катализатору. Теорией Баландина было предсказано, что реакции каталитического гидрирования бензола и дегидрирования циклогексана могут идти только на переходных металлах, имеющих гранецентрированную кубическую структуру или гексагональную структуру и притом атомные радиусы строго определенных размеров. При этих условиях шестичленные циклы образуют на октаэдрических гранях кристаллов металла шесть связей М— — С — С, валентный угол которых близок тетраэдрическому углу. Данным условиям удовлетворяют палладий, платина, иридий, родий, осмий и все они являются активными катализаторами гидрирования бензола и дегидрирования циклогексана. В то же время металлы, обладающие объемноцентрированной структурой, например тантал, вольфрам, даже при почти таких же размерах их атомных радиусов, как у платиновых металлов, а также металлы, имеющие такую же кристаллическую структуру, как платина, но иные размеры атомных радиусов, в частности серебро, золото, или не относящиеся к переходным элементам — медь, цинк,—все эти металлы не проявляют каталитической активности в вышеуказанных реакциях. Таким образом, структура поверхностных соединений бензола и циклогексана с платиновыми металлами была описана и доказана. Мало того, было, в сущности, установлено, что в условиях катализа подобные соединения легко и притом в точности воспроизводятся. Иначе катализ был бы невозможен. [c.59]
Данным условиям удовлетворяют палладий, платина, иридий, родий, осмий и все они являются активными катализаторами гидрирования бензола и дегидрирования циклогексана. В то же время металлы, обладающие объемноцентрированной структурой, например тантал, вольфрам, даже при почти таких же размерах их атомных радиусов, как у платиновых металлов, а также металлы, имеющие такую же кристаллическую структуру, как платина, но иные размеры атомных радиусов, в частности серебро, золото, или не относящиеся к переходным элементам — медь, цинк,—все эти металлы не проявляют каталитической активности в вышеуказанных реакциях. Таким образом, структура поверхностных соединений бензола и циклогексана с платиновыми металлами была описана и доказана. Мало того, было, в сущности, установлено, что в условиях катализа подобные соединения легко и притом в точности воспроизводятся. Иначе катализ был бы невозможен. [c.59]
Все три рассмотренных типа связи — ковалентная, ионная и донорно-акцепторная — являются двухэлектронными, в них атомы связаны при помощи пары электронов. Помимо химических соединений, в которых атомы связаны двухэлектронными связями, известны вполне устойчивые соединения, у которых на одну связь приходится меньше, чем по два электрона — так называемые соединения с дефицитными структурами. Примером такого рода соединений являются бороводороды. Так, н молекуле В2Н0 шесть валентных электронов двух атомов В и шесть валентных электронов шести атомов Н обеспечивают соединение 8 атомов, т. е. образование по крайней мере 7 связей. [c.13]
Помимо химических соединений, в которых атомы связаны двухэлектронными связями, известны вполне устойчивые соединения, у которых на одну связь приходится меньше, чем по два электрона — так называемые соединения с дефицитными структурами. Примером такого рода соединений являются бороводороды. Так, н молекуле В2Н0 шесть валентных электронов двух атомов В и шесть валентных электронов шести атомов Н обеспечивают соединение 8 атомов, т. е. образование по крайней мере 7 связей. [c.13]
Велер и Эвальд [12] считают, что нет достаточных оснований для утверждения существования RhOg. Однако Грубе и сотр. [15] при исследовании продуктов анодного окисления перхлората родия получали синие растворы, содержащие смесь соединений родия с валентностью, близкой к шести. [c.48]
Высшая положительная валентность элементов обычно отвечает номеру группы, причем в высших оксидах и гидроксидах кислотный характер растет слева направо по периодам, а основной — ослабевает. У фтора вообще не обнаружена положительная валентность в соединениях он всегда одновалентен. Положительная валентность кислорода проявляется только в соединениях с фтором и равна двум. Железо, кобальт и никель проявляют высшую валентность соответственно шесть, четыре и три, палладий — четыре, родий, иридий и платина — шесть, бром и астат — пять. У некоторых благородных газов высшая положительная валентность достигает восьми (ХеРв). У элементов подгруппы меди в образовании валентных связей могут участвовать с1-злектроны предпоследнего уровня, поэтому их высшая положительная валентность оказывается больше номера группы — бывает +1, +2, +3. Эти элементы являются неполными аналогами элементов главной подгруппы I группы и вместе с тем продолжают развитие свойств элементов семейства железа и платиновых металлов, к которым они вплотную примыкают в системе элементов. [c.79]
У фтора вообще не обнаружена положительная валентность в соединениях он всегда одновалентен. Положительная валентность кислорода проявляется только в соединениях с фтором и равна двум. Железо, кобальт и никель проявляют высшую валентность соответственно шесть, четыре и три, палладий — четыре, родий, иридий и платина — шесть, бром и астат — пять. У некоторых благородных газов высшая положительная валентность достигает восьми (ХеРв). У элементов подгруппы меди в образовании валентных связей могут участвовать с1-злектроны предпоследнего уровня, поэтому их высшая положительная валентность оказывается больше номера группы — бывает +1, +2, +3. Эти элементы являются неполными аналогами элементов главной подгруппы I группы и вместе с тем продолжают развитие свойств элементов семейства железа и платиновых металлов, к которым они вплотную примыкают в системе элементов. [c.79]
Попытки систематизации элементов на основе поиска арифметических закономерностей в изменениях атомных масс предпринимались с первой половины XIX века. Одна из наиболее успешных попыток такого рода принадлежит немецкому химику Л. Мейеру. В 1864 г. он опубликовал таблицу, в которой 44 элемента были расположены в порядке возрастания их атомных масс в шести столбцах в соответствии с их высшей валентностью по водороду. Таким образом были выделены шесть вертикальных групп — углерода, азота, кислорода, фтора, в которых валентность по водороду равна 4, 3, 2 и 1 соответственно, и группы лития и бериллия — с валентностью 1 и 2. Мейер также искал и арифметические отношения между атомными массами элементов, в таблице он привел разности между атомными массами стоящих друг под другом элементов и обратил внимание на то, что их значения более или менее постоянны в горизонтальных строках таблицы. В группах Мейера элементы-аналоги были расположены довольно удачно, но встречались и явные промахи, например, марганец, железо, рутений и платина оказались в одной группе элементов с валентностью по водороду четыре. Некоторые элементы, в частности водород и бор, в таблицу вообще не вошли.
Одна из наиболее успешных попыток такого рода принадлежит немецкому химику Л. Мейеру. В 1864 г. он опубликовал таблицу, в которой 44 элемента были расположены в порядке возрастания их атомных масс в шести столбцах в соответствии с их высшей валентностью по водороду. Таким образом были выделены шесть вертикальных групп — углерода, азота, кислорода, фтора, в которых валентность по водороду равна 4, 3, 2 и 1 соответственно, и группы лития и бериллия — с валентностью 1 и 2. Мейер также искал и арифметические отношения между атомными массами элементов, в таблице он привел разности между атомными массами стоящих друг под другом элементов и обратил внимание на то, что их значения более или менее постоянны в горизонтальных строках таблицы. В группах Мейера элементы-аналоги были расположены довольно удачно, но встречались и явные промахи, например, марганец, железо, рутений и платина оказались в одной группе элементов с валентностью по водороду четыре. Некоторые элементы, в частности водород и бор, в таблицу вообще не вошли. [c.224]
[c.224]
Резонансная стабилизация. — Расстояние между центрами соседних атомов углерода в бензольном кольце, как было определено рентгеноструктурным методом и подтверждено электронографически, равно 1,40А, т. е. имеет промежуточное значение между длиной связи С—С в парафинах (1,54A) и длиной связи С = С (1,ЗЗА). В то же время длина связи Салиф,—Саром. между углеродом алкильного заместителя н атомом угле рода в щикле соответствует длине связи в парафинах (1,54А). Кроме того, все шесть связей в кольце идентичны. Эквивалентность всех шести связей может быть объяснена лишь формулами Армстронга — Байера или Тиле или теорией осцилляции, выдвинутой Кекуле. Однако электронная теория валентности дает возможность сделать четкий выбор из этих альтернатив. Общепринятая концепция о том, что ковалентная связь представляет собой обобщенную электронную пару, позволяет описать в установленных терминах ординарные и двойные связи в формуле Кекуле, но не дает возможности описать современными понятиями взаимно насыщенные центрические связи или парциальные валентности. Таким образом, ни формула Армстронга — Байера, ии формула Тиле не имеют физического смысла, в то время как формула Кекуле может быть непосредственно интерпретирована с позиций электронных представлений атомы углерода попеременно связаны одной или двумя парами обобщенных электронов. [c.128]
Таким образом, ни формула Армстронга — Байера, ии формула Тиле не имеют физического смысла, в то время как формула Кекуле может быть непосредственно интерпретирована с позиций электронных представлений атомы углерода попеременно связаны одной или двумя парами обобщенных электронов. [c.128]
Определив из графика область концентраций, где можно ожидать излом на кривой, снимают еще несколько кинетических кривых при концентрациях, лежащих в пределах этой области. Зависимость длительности первой стадии коагуляции от концентрации электролита изображают в виде кривых t = /(С) или =/(lg ). Подобного рода кривые представлены на рис. 14. Находят на них точку излома. Концентрация электролита, соответствующая этой точке, есть ПБК. То же самое проделывают для электролитов с другой валентностью коагулирующего иона. Далее устанавливают соотношение ПБК под влиянием ионов различной валентности и сравнивают его с известным правилом Шульце— Гарди. Как известно, это соотношение является следствием современной физической теории устойчивости лиофобных коллоидов и формулируется как правило обратной пропорциональности коагулирующих концентраций электролитов шестой степени их валентности [c. 87]
87]
Большое значение имеют исследования структуры поверхности катализаторов. Согласно теории А. А. Баландина катализ происходит только при структурном и энергетическом соответствии реагирующих молекул данному катализатору (1929 г.). А. А. Баландин предсказал, что реакции каталитического гидрирования бензола и дегидрирования циклогексана могут идти только на переходных металлах, имеющих гранецентрированную кубическую структуру или гексагональную структуру и притом атомные радиусы строго определенных размеров. Шестичленные циклы образуют на октаэдрических гранях кристаллов металла шесть связей, валентный угол которых близок к тетраэдрическому углу. Этими условиями обладают п-алладий, платина, иридий, родий, осмий. Предсказание А. А. Баландина полностью подтвердилось. Другие металлы, имеющие такой же атомный радиус, но иную структуру или такую же структуру, но другой атомный радиус, не проявили каталитической активности в упомянутых реакциях. [c.54]
На внешних электронных слоях у атомов металлов VHI группы имеется не более двух электронов, предпоследние слои — не заполнены (за исключением атомов палладия). В химических реакциях атомы этих элементов только отдают валентные электроны и в соединениях являются положительно валентными. В с оих наиболее устойчивых соединениях железо, кобальт и никель обычно бывают двух- и трехвалентными, родий и иридий — трехвалентными, осмий и рутений — шести- и даже восьмивалентными, платина — четырехг и двухвалентной, палладий — двухвалентным. [c.441]
В химических реакциях атомы этих элементов только отдают валентные электроны и в соединениях являются положительно валентными. В с оих наиболее устойчивых соединениях железо, кобальт и никель обычно бывают двух- и трехвалентными, родий и иридий — трехвалентными, осмий и рутений — шести- и даже восьмивалентными, платина — четырехг и двухвалентной, палладий — двухвалентным. [c.441]
Схема IV отвечает центрической формуле-, в ней нет валентностей углерода, насыщаюгцихся попарно, но есть валентности, направленные к центру шестиугольника, составляющие как бы род системы е шестью центростремительными силами, в результате чего образуется устойчивая циклическая система бензола. Центрическая формула была предложена Армстронгом [c.291]
Относительно характеристичным из шести колебаний СНОа-группы является валентное антисимметричное колебание. В этом колебании связь С—N практически не участвует, что и обусловливает его большую характеристичность по сравнению с другими колебаниями. При переходе от нитрометана к более сложным нитросоедИнениям изменения частот группы СНОг могут быть обусловлены как нехарактеристичностью колебаний, так и измене- ниями электронного и пространственного строения соединений. Поэтому следует осторожно подходить к различного рода корреляциям, связывающим изменения частот с изменениями электронных параметров молекул, и в каждом конкретном случае тщательно анализировать, чем же вызваны наблюдаемые сдвиги.частот. [c.340]
При переходе от нитрометана к более сложным нитросоедИнениям изменения частот группы СНОг могут быть обусловлены как нехарактеристичностью колебаний, так и измене- ниями электронного и пространственного строения соединений. Поэтому следует осторожно подходить к различного рода корреляциям, связывающим изменения частот с изменениями электронных параметров молекул, и в каждом конкретном случае тщательно анализировать, чем же вызваны наблюдаемые сдвиги.частот. [c.340]
Изучать электрохимическую адсорбцию кислорода практически сложнее, чем водорода, поскольку а) могут образовываться многослойные окисные пленки б) частицы О могут хемосорбироваться либо на поверхности раздела таких пленок с объемными свойствами , либо на самом металле, как это имеет место, например, в случае платины (вероятно, уникальном) и, возможно, родия в) эффекты барьерного слоя [125] могут искажать кривую спада потенциала г) могут наблюдаться изменения валентного состояния в поверхностном окисле или адсорбированном слое [8, 27, 151], что ошибочно может интерпретироваться как изменение степени покрытия частицами более низкой валентности д) в результате поверхностного окисления может изменяться величина истинной поверхности е) при измерении нестационарных анодных и катодных кривых заряжения могут получаться как завышенные, так и заниженные результаты [8, 125].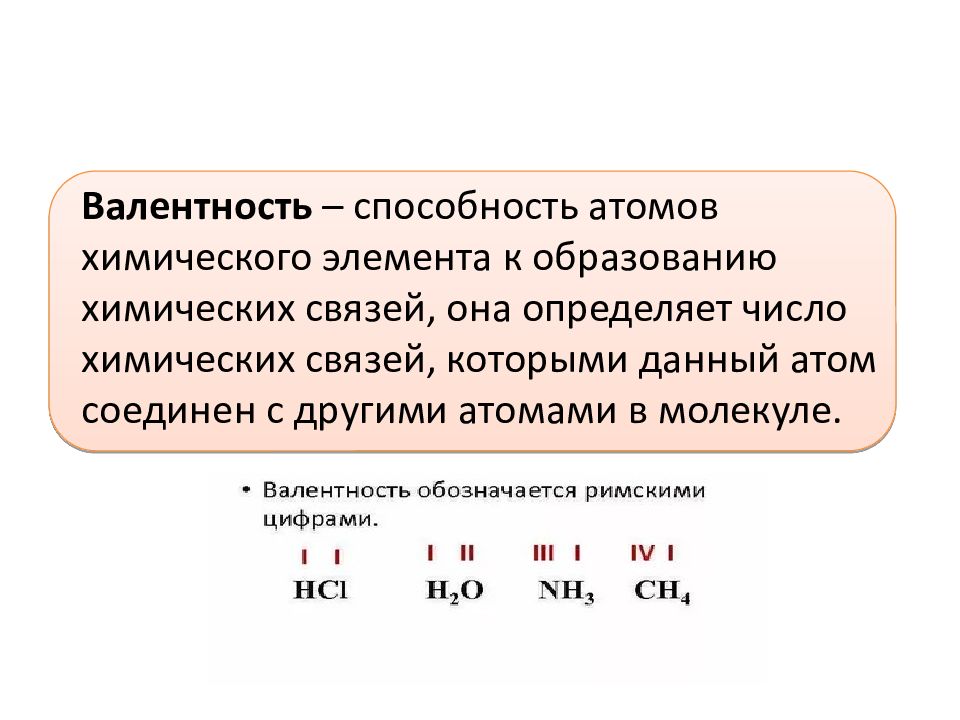 Несмотря на эти осложнения, ряд важных исследований был выполнен на благородных металлах VIII группы и золоте, а также на окисно-никелевом электроде, где на границе раздела полупроводникового объемного окисла, представляющего собой твердый раствор Ni (II) — Ni (III) — Ni (IV), наблюдается хемосорбция промежуточных частиц, содержащих О. Некоторые из наиболее ранних работ по адсорбции кислорода были выполнены Батлером с сотр. [152], которые нашли, что кривые заряжения для платины имеют линейную форму, но их наклоны (емкости) зависят от предшествующей обработки электрода и от начального потенциала измерения анодной кривой заряжения. Емкость в начальной линейной области заряжения — около 400 мкф на 1 см истинной поверхности и приблизительно постоянна в интервале потенциалов порядка 0,4 е однако если провести повторное заряжение электрода от потенциала вблизи -f l,Oei H и затем спять катодную кривую заряжения до этого потенциала, то величина емкости уменьшится приблизительно в шесть раз это свидетельствует о том, что в предшествующем цикле восстановление прошло не до конца и процесс является необратимым.
Несмотря на эти осложнения, ряд важных исследований был выполнен на благородных металлах VIII группы и золоте, а также на окисно-никелевом электроде, где на границе раздела полупроводникового объемного окисла, представляющего собой твердый раствор Ni (II) — Ni (III) — Ni (IV), наблюдается хемосорбция промежуточных частиц, содержащих О. Некоторые из наиболее ранних работ по адсорбции кислорода были выполнены Батлером с сотр. [152], которые нашли, что кривые заряжения для платины имеют линейную форму, но их наклоны (емкости) зависят от предшествующей обработки электрода и от начального потенциала измерения анодной кривой заряжения. Емкость в начальной линейной области заряжения — около 400 мкф на 1 см истинной поверхности и приблизительно постоянна в интервале потенциалов порядка 0,4 е однако если провести повторное заряжение электрода от потенциала вблизи -f l,Oei H и затем спять катодную кривую заряжения до этого потенциала, то величина емкости уменьшится приблизительно в шесть раз это свидетельствует о том, что в предшествующем цикле восстановление прошло не до конца и процесс является необратимым. В этом нет ничего необычного между катодными и анодными кривыми заряжения в большинстве случаев, в том числе при адсорбции водорода, наблюдается гистерезис подобные эффекты Феттер и Берндт [153] наблюдали во всем интервале pH от О до 12. [c.479]
Я думаю, что эту стереоспецифичность можно было бы объяснить образованием металлических комплексов хелатного типа, в которых металл обладает четырьмя или шестью координационными связями, расходуемыми частично на связь с оптически активным белком, частично — на связь с молекулой субстрата. Известно, что оптически активные координационные соединения таких металлов, как. кобальт, обладают чрезвычайно высоким молекулярным вращением, а потому различие в способности d- и /-форм субстрата давать хелатные соединения может быть весьма велико. Как было отмечено д-ром Чебиреком (см. статью 33), подобного рода хелатные соединения могут содержать металлы как постоянной (например. Mg, Zn), так и переменной валентности. Доказано, что ионы металлов обоих типов играют в биологических системах роль микроэлементов. [c.422]
[c.422]
Тяжелые аналоги железа — рутений и осмий — имеют электронные конфигурации и . Они проявляют валентности от 2-Ь до 8+, однако наиболее прочны соединения, где они четырехвалентны. Если в металлическом состоянии свободными становятся 4 -электрона, то их ионы могут иметь оболочки , V или . Сферическая симметрия -оболочек или псевдосфероидальпая симметрия оболочек обусловливает плотную гексагональную структуру этих металлов, сохраняющуюся до температуры плавления. Аналоги кобальта — родий и иридий —имеют конфигурации V и соответственно. Эти поливалентные металлы образуют наиболее устойчивые соединения в трехвалентном состоянии. Ионы КЬ и 1г с шестью электронами, занимающими — и -уровни (конфигурации , ), имеют сферическую симметрию. Это может быть причиной существования плотных кубических упаковок ионов этих металлов. Аналоги никеля — палладий и платина — в свободном состоянии имеют конфигурации и . В соединениях они проявляют валентности 2+, 3+ и 4+, причем ионы Ме отвечают весьма стабильным соединениям. Можно полагать, что в металлическом состоянии от их атомов отщепляется по два электрона и образуются ионы и с конфигурациями или , [c.227]
Можно полагать, что в металлическом состоянии от их атомов отщепляется по два электрона и образуются ионы и с конфигурациями или , [c.227]
На рис. 99 представлено изменение валентных состояний металлов больших периодов в зависимости от их атомного номера. Указаны валентности каждого металла в различных химических соединениях, причем валентности, соответствующие наиболее прочным соединениям, даны зачерненными значками. От I до VI групп высшей валентностью, отвечающей наиболее прочной химической связи, оказывается валентность, соответствующая номеру группы. Только у хрома наряду с шестивалентными соединениями сравнительно прочными оказываются и трехвалентные. В VII группе наибольшая прочность соединений соответствует двухвалентному марганцу, который бывает и одновалентным, однако технеций и рений дают более стабильные четырех-, шести- и семивалентные соединения. В VIII группе у железа, кобальта и никеля наибольшая прочность связи соответствует двух- и трехвалептным соединениям, а у рутения и осмия — четырехвалентным. У родия и иридия наиболее прочны трехвалентные соединения, у никеля, палладия и платины — двухвалентные, а у металлов I группы — меди, серебра и золота — устойчивы одновалентные соединения. Итак, обычные химические валентности у элементов 4-го, 5-го и б-го периодов нарастают от 1+ для калия, рубидия и цезия до 6-(-для хрома, молибдена и вольфрама, а затем падают до 1+ У меди, серебра и золота. Принимая, что эти валентности определяют число электронов, отделяющихся от атомов соответствующих элементов при образовании [c.229]
У родия и иридия наиболее прочны трехвалентные соединения, у никеля, палладия и платины — двухвалентные, а у металлов I группы — меди, серебра и золота — устойчивы одновалентные соединения. Итак, обычные химические валентности у элементов 4-го, 5-го и б-го периодов нарастают от 1+ для калия, рубидия и цезия до 6-(-для хрома, молибдена и вольфрама, а затем падают до 1+ У меди, серебра и золота. Принимая, что эти валентности определяют число электронов, отделяющихся от атомов соответствующих элементов при образовании [c.229]
Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / Таблица валентностей химических элементов.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Валентные возможности атомов химических элементов
Понятие валентность происходит от латинского слова «valentia» и было известно еще в середине XIX века. Первое «пространное» упоминание валентности было
Первое «пространное» упоминание валентности было
еще в работах Дж. Дальтона, который утверждал, что все вещества состоят из атомов, соединенных между собой в определенных пропорциях. Затем, Франкланд ввел
само понятие валентности, которое нашло дальнейшее развитие в трудах Кекуле, который говорил о взаимосвязи валентности и химической связи, А.М. Бутлерова,
который в своей теории строения органических соединений связывал валентность с реакционной способностью того или иного химического соединения и Д.И.
Менделеева (в Периодической системе химических элементов высшая валентность элемента определяется номером группы).
Основное состояние атома (состояние с минимальной энергией) характеризуется электронной конфигурацией атома, которая соответствует положению элемента в
Периодической системе. Возбужденное состояние – это новое энергетическое состояние атома, с новым распределением электронов в пределах валентного уровня.
Графические электронные формулы
Электронные конфигурации электронов в атоме можно изобразить не только в виде электронных формул, но и с помощью электронно-графических формул
(энергетических, квантовых ячеек). Каждая ячейка обозначает орбиталь, стрелка – электрон, направление стрелки (вверх или вниз) показывает спин электрона,
свободная клетка – свободная орбиталь, которую может занимать электрон при возбуждении. Если в ячейке 2 электрона, такие электроны называются спаренными,
если электрон 1 – неспаренный. Например:
6C 1s22s22p2
Орбитали заполняют следующим образом: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. Поскольку
на 2p подуровне три орбитали с одинаковой энергией, то каждый из двух электронов занял по одной орбитали. Одна орбиталь осталась свободной.
Определение валентности элемента по электронно-графическим формулам
Валентность элемента можно определить по электронно-графическим формулам электронных конфигураций электронов в атоме. Рассмотрим два атома – азота и
Рассмотрим два атома – азота и
фосфора.
7N 1s22s22p3
Т.к. валентность элемента определяется числом неспаренных электронов, следовательно, валентность азота равна III. Поскольку у атома азота нет свободных
орбиталей, для этого элемента невозможно возбужденное состояние. Однако III, не максимальная валентность азота, максимальная валентность азота V и
определяется номером группы. Поэтому, следует запомнить, что с помощью электронно-графических формул не всегда можно определить высшую валентность, а также
все валентности, характерные для этого элемента.
15P 1s22s22p63s23p3
В основном состоянии атом фосфора имеет 3 неспаренных электрона, следовательно, валентность фосфора равна III. Однако, в атоме фосфора имеются свободные
d-орбитали, поэтому электроны, находящиеся на 2s – подуровне способны распариваться и занимать вакантные орбитали d-подуровня, т. е. переходить в
е. переходить в
возбужденное состояние.
Теперь атом фосфора имеет 5 неспаренных электронов, следовательно для фосфора характерна и валентность, равная V.
Элементы, имеющие несколько значений валентности
Элементы IVA – VIIA групп могут иметь несколько значений валентности, причем, как правило, валентность изменяется ступенчато на 2 единицы. Такое явление
обусловлено тем, что в образовании химической связи электроны участвуют попарно.
В отличие от элементов главных подгрупп, элементы В-подгрупп, в большинстве соединений не проявляют высшую валентность, равную номеру группы, например,
медь и золото. В целом, переходные элементы проявляют большое разнообразие химических свойств, которое объясняется большим набором валентностей.
Рассмотрим электронно-графические формулы элементов и установим, в связи с чем элементы имеют разные валентности (рис.1).
Задания:
определите валентные возможности атомов As и Cl в основном и возбужденном состояниях.
Ответы:
33As 1s22s22p63s23p63d104s24p3
Основное состояние. Валентность равна III.
Возбужденное состояние. Валентность равна V.
17Cl 1s22s22p63s23p5
Основное состояние. Валентность равна I.
Возбужденное состояние 1. Валентность равна III.
Возбужденное состояние 2. Валентность равна IV.
Возбужденное состояние 3. Валентность равна VII.
Способ извлечения осколочного родия из азотнокислых водных растворов
Изобретение относится к способу извлечения осколочного родия из азотно-кислотных водных растворов, включающему снижение кислотности раствора, экстракцию с использованием несмешивающихся с водой растворов органических экстрагентов в инертных разбавителях путем контактирования двух несмешивающихся фаз, разделение расслоившихся фаз и последующую реэкстракцию родия из органического раствора в водный раствор.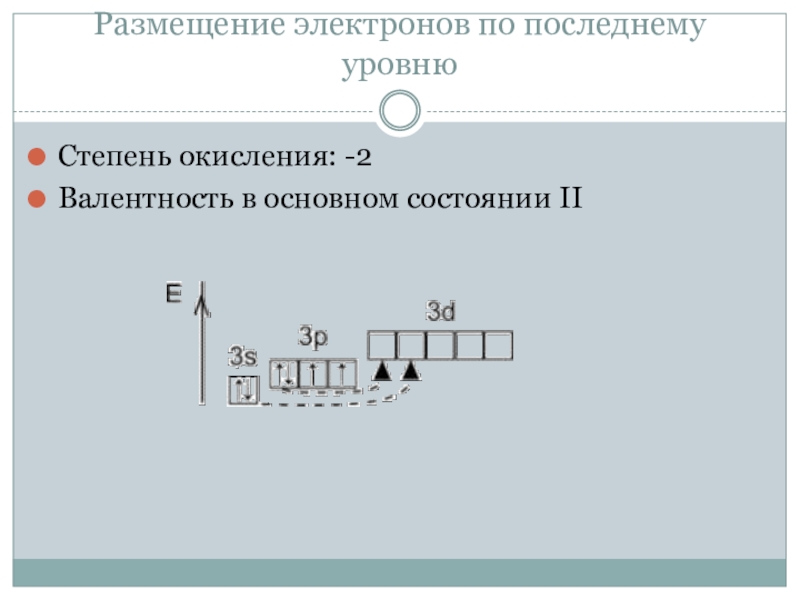 Сущность: перед экстракцией азотнокислотный водный раствор обрабатывают окислителем для перевода родия в четырехвалентное состояние, при этом азотнокислотный водный раствор обрабатывают с использованием в качестве окислителя висмутата натрия. 1 з.п. ф-лы, 1 табл.
Сущность: перед экстракцией азотнокислотный водный раствор обрабатывают окислителем для перевода родия в четырехвалентное состояние, при этом азотнокислотный водный раствор обрабатывают с использованием в качестве окислителя висмутата натрия. 1 з.п. ф-лы, 1 табл.
Изобретение относится к гидрометаллургической (экстракционной) технологии извлечения родия из смеси металлов в водном растворе, в частности, извлечению родия из азотнокислых растворов от растворения вторичного родийсодержащего сырья, в частности, из высокоактивных растворов смеси продуктов деления отработавшего ядерного топлива АЭС, содержащих осколочный родий (смесь стабильных и радиоактивных изотопов) наряду с не менее чем 20 элементами — продуктами деления актиноидов (в том числе и платиноидами рутением и палладием) и продуктами коррозии аппаратуры из нержавеющей стали. Этот источник родия (до 1 кг родия на каждую тонну отработавшего топлива АЭС) рассматривается как серьезный потенциальный резерв родия для передовой техники и технологии из-за ограниченности добычи природного родия и нарастающего потребления его в мире.
Основная форма существования радиородия в азотнокислотных растворах это моно- или димеризованные гидратированные катионы [Rh(H2O)6]3+ или [Rh(OH)2(H2O)4]3+ Известны способы извлечения родия из жидких радиоактивных растворов — электролизом на платиновом (М. Одзава и др. «Разработка бессолевого Пурекс-процесса». Труды Межд. конф. по регенерации отработавшего ядерного топлива и обращению с отходами, РИКОД-91, Синдай, Япония, апрель 1991 г. т. 2, с. 729 734) или на углеволокнистом электродах (Л. В. Арсеенков и др. «Продукты деления палладий и родий: состояние в растворах, поведение при регенерации топлива АЭС, поиск путей селективного извлечения». Атомная энергия, т. 76, вып. 5. 1992, с. 462 473), чем, однако, достигается как далеко неколичественное, так и неселективное извлечение родия; к тому же растворить осажденный на электроде металлический (или гидратооксидный) родий — для последующего его аффинажа можно только в кипящей серной кислоте; процесс осаждения идет только после предварительного электрохимического восстановления трехвалентного железа. Известен также способ экстракционного извлечения радиородия с использованием аминных экстрагентов (третичных и четвертичных алкиламинов) после перевода родия (III) в форму гексанитритного [Rh(NO2)6]3- или роданидного [Rh(CNS)x] +3-x(x>3) комплексов трехвалентного родия, снижения кислотности раствора, введения большого избытка нитрит-(NaNO2) или роданид-ионов (KCNS) в систему (Б.Горски и др. «Экстракция осколочного родия из растворов азотной кислоты. I. Экстракция анионных нитритных комплексов родия. II. Об экстракции осколочного родия из азотнокислотных растворов. К вопросу об экстракции роданидных комплексов родия (III) аминами». Журнал (ГДР) «Isotopenpraexis», 1988 т. 24, номер 5, с. 200 207. Прототип). В рассматриваемом прототипе для извлечения осколочного родия из азотнокислых водных сред применена экстракция несмешивающимся с водой органическим жидким экстрагентом (раствором три-н-октиламина в инертных (ароматических) разбавителях (толуол, ксилол)).
Известен также способ экстракционного извлечения радиородия с использованием аминных экстрагентов (третичных и четвертичных алкиламинов) после перевода родия (III) в форму гексанитритного [Rh(NO2)6]3- или роданидного [Rh(CNS)x] +3-x(x>3) комплексов трехвалентного родия, снижения кислотности раствора, введения большого избытка нитрит-(NaNO2) или роданид-ионов (KCNS) в систему (Б.Горски и др. «Экстракция осколочного родия из растворов азотной кислоты. I. Экстракция анионных нитритных комплексов родия. II. Об экстракции осколочного родия из азотнокислотных растворов. К вопросу об экстракции роданидных комплексов родия (III) аминами». Журнал (ГДР) «Isotopenpraexis», 1988 т. 24, номер 5, с. 200 207. Прототип). В рассматриваемом прототипе для извлечения осколочного родия из азотнокислых водных сред применена экстракция несмешивающимся с водой органическим жидким экстрагентом (раствором три-н-октиламина в инертных (ароматических) разбавителях (толуол, ксилол)). Однако из-за известной кинетической инертности лигандного обмена в основной координационной сфере катиона аква(гидроксо)родия (III) практически неудачными были попытки экстракционного извлечения родия из умеренно кислых нитратных водных сред такими экстрагентами, как диалкилсульфиды, диалкилсульфоксиды, третичные и четвертичные алкиламины, нейтральные алкилфосфаты, диалкилнафталинсульфокислоты; при этом небольшие коэффициенты распределения родия между органической и водной фазами (D) достигались или после многочасового контактирования фаз, или в результате использования высоких концентраций высаливателей, что должно приводить соответственно как к радиолитическому разложению органических экстрагента и разбавителя, так и к возрастанию объемов радиоактивных солевых отходов (В.Ф. Борбат, Р.С. Чекушин, «Экстракция благородных металлов сульфидами и сульфоксидами». М. Наука, 1989, с. 82 и далее; К.П. Луничкина и др. «Об экстракции родия (III) из нитратных растворов». Радиохимия, т. 16, 1974, вып.
Однако из-за известной кинетической инертности лигандного обмена в основной координационной сфере катиона аква(гидроксо)родия (III) практически неудачными были попытки экстракционного извлечения родия из умеренно кислых нитратных водных сред такими экстрагентами, как диалкилсульфиды, диалкилсульфоксиды, третичные и четвертичные алкиламины, нейтральные алкилфосфаты, диалкилнафталинсульфокислоты; при этом небольшие коэффициенты распределения родия между органической и водной фазами (D) достигались или после многочасового контактирования фаз, или в результате использования высоких концентраций высаливателей, что должно приводить соответственно как к радиолитическому разложению органических экстрагента и разбавителя, так и к возрастанию объемов радиоактивных солевых отходов (В.Ф. Борбат, Р.С. Чекушин, «Экстракция благородных металлов сульфидами и сульфоксидами». М. Наука, 1989, с. 82 и далее; К.П. Луничкина и др. «Об экстракции родия (III) из нитратных растворов». Радиохимия, т. 16, 1974, вып. 2, с. 268 269). В рассматриваемом прототипе удовлетворительное извлечение родия в органический экстрагент (величина D выше 10) достигается только в результате: резкого снижения кислотности исходного водного раствора до 0,25 М азотной кислоты, использования для «буферирования» (стабилизации величины рН) ацетатов или карбонатов натрия (нелетучих катионов), введения высоких концентраций нитрита натрия или роданида калия, использования экстрагента третичного амина -в виде соли с азотистой (не азотной!) кислотой, проведения процесса контактирования фаз в течение не менее 15 мин. Задачей настоящего изобретения является разработка такого способа, который позволит: повысить извлечение осколочного родия из азотнокислотной среды, снизить засоление водного раствора, повысить кислотность перерабатываемого раствора при извлечении родия,
2, с. 268 269). В рассматриваемом прототипе удовлетворительное извлечение родия в органический экстрагент (величина D выше 10) достигается только в результате: резкого снижения кислотности исходного водного раствора до 0,25 М азотной кислоты, использования для «буферирования» (стабилизации величины рН) ацетатов или карбонатов натрия (нелетучих катионов), введения высоких концентраций нитрита натрия или роданида калия, использования экстрагента третичного амина -в виде соли с азотистой (не азотной!) кислотой, проведения процесса контактирования фаз в течение не менее 15 мин. Задачей настоящего изобретения является разработка такого способа, который позволит: повысить извлечение осколочного родия из азотнокислотной среды, снизить засоление водного раствора, повысить кислотность перерабатываемого раствора при извлечении родия,
снизить время контактирования фаз,
снизить радиационно-химическую деструкцию экстрагента. Решение этой задачи обеспечивается тем, что в способе экстракционного извлечения осколочного родия из азотнокислотных водных растворов путем: снижения кислотности, стабилизации родия в заданной химической форме, контактирования водного раствора с раствором органических азот-, фосфор-, серосодержащих экстрагентов в инертных разбавителях, разделения проконтактированных фаз реэкстракцией родия водным раствором подходящего реагента (кислота, комплексообразователь, восстановитель) азотнокислый водный раствор предварительно обрабатывают сильным окислителем, например, висмутатом натрия NaBiO3, гипериодной кислотой HJO4 и др. Исследование патентной и научно-технической литературы показало, что заявляемый способ для решения задачи извлечения родия из нитратных водных сред (переводом родия в четырехвалентное состояние) неизвестен ни в аналитической практике анализа платиноидов, ни в практике благороднометалльной технологии, ни в практике извлечения осколочного родия, что технические решения, обладающие такой же совокупностью существенных признаков, что и предложенный способ, отсутствуют. Таким образом, можно сделать вывод, что заявленный способ отвечает требованиям критерия «новизна». Достичь высокого извлечения осколочного родия из азотнокислой среды можно в результате окисления родия (III) до родия (IV), при этом четырехвалентный родий может быть практически количественно и быстро проэкстрагирован органическими экстрагентами из азотнокислотной среды, он в этой среде достаточно устойчив для обеспечения реализации условий процесса его экстракции (кратковременное контактирование с экстрагентом), он может быть получен в водном умеренно кислом азотнокислотном растворе с использованием, например, висмутата натрия.
Исследование патентной и научно-технической литературы показало, что заявляемый способ для решения задачи извлечения родия из нитратных водных сред (переводом родия в четырехвалентное состояние) неизвестен ни в аналитической практике анализа платиноидов, ни в практике благороднометалльной технологии, ни в практике извлечения осколочного родия, что технические решения, обладающие такой же совокупностью существенных признаков, что и предложенный способ, отсутствуют. Таким образом, можно сделать вывод, что заявленный способ отвечает требованиям критерия «новизна». Достичь высокого извлечения осколочного родия из азотнокислой среды можно в результате окисления родия (III) до родия (IV), при этом четырехвалентный родий может быть практически количественно и быстро проэкстрагирован органическими экстрагентами из азотнокислотной среды, он в этой среде достаточно устойчив для обеспечения реализации условий процесса его экстракции (кратковременное контактирование с экстрагентом), он может быть получен в водном умеренно кислом азотнокислотном растворе с использованием, например, висмутата натрия. Пример осуществления способа. Раствор нитрата родия (III) (1,6 1,8 ммоль/л) в 0,5 М азотной кислоте обрабатывают порошкообразным висмутатом натрия (50 г/л) в течение 10 15 мин при 20oС. Свежеприготовленный водный раствор с окисленным до Rh(IV) родием контактирует около 10 мин при комнатной температуре и 1:1 соотношении объемов обеих несмешивающихся фаз с предварительно окисленными (обработанными тем же окислителем) растворами органических экстрагентов в инертных разбавителях (предельные или ароматические жидкофазные растворители). Экстракция родия происходит без образования иных фаз и стойких эмульсий ( см. таблицу, из которой видно, что экстракция родия возрастает в ряду экстрагентов: ТБФ3) водных растворов смеси продуктов деления актиноидов и продуктов коррозии аппаратуры. Реэкстракцию родия осуществляют в крепкую азотную кислоту (3-8М) или в водный раствор с восстановителями, способными быстро восстановить родий (IV) до неэкстрагируемого этими экстрагентами родия (III) например, аскорбиновая кислота, азотистая кислота, пероксид водорода, двухвалентное железо и т.
Пример осуществления способа. Раствор нитрата родия (III) (1,6 1,8 ммоль/л) в 0,5 М азотной кислоте обрабатывают порошкообразным висмутатом натрия (50 г/л) в течение 10 15 мин при 20oС. Свежеприготовленный водный раствор с окисленным до Rh(IV) родием контактирует около 10 мин при комнатной температуре и 1:1 соотношении объемов обеих несмешивающихся фаз с предварительно окисленными (обработанными тем же окислителем) растворами органических экстрагентов в инертных разбавителях (предельные или ароматические жидкофазные растворители). Экстракция родия происходит без образования иных фаз и стойких эмульсий ( см. таблицу, из которой видно, что экстракция родия возрастает в ряду экстрагентов: ТБФ3) водных растворов смеси продуктов деления актиноидов и продуктов коррозии аппаратуры. Реэкстракцию родия осуществляют в крепкую азотную кислоту (3-8М) или в водный раствор с восстановителями, способными быстро восстановить родий (IV) до неэкстрагируемого этими экстрагентами родия (III) например, аскорбиновая кислота, азотистая кислота, пероксид водорода, двухвалентное железо и т.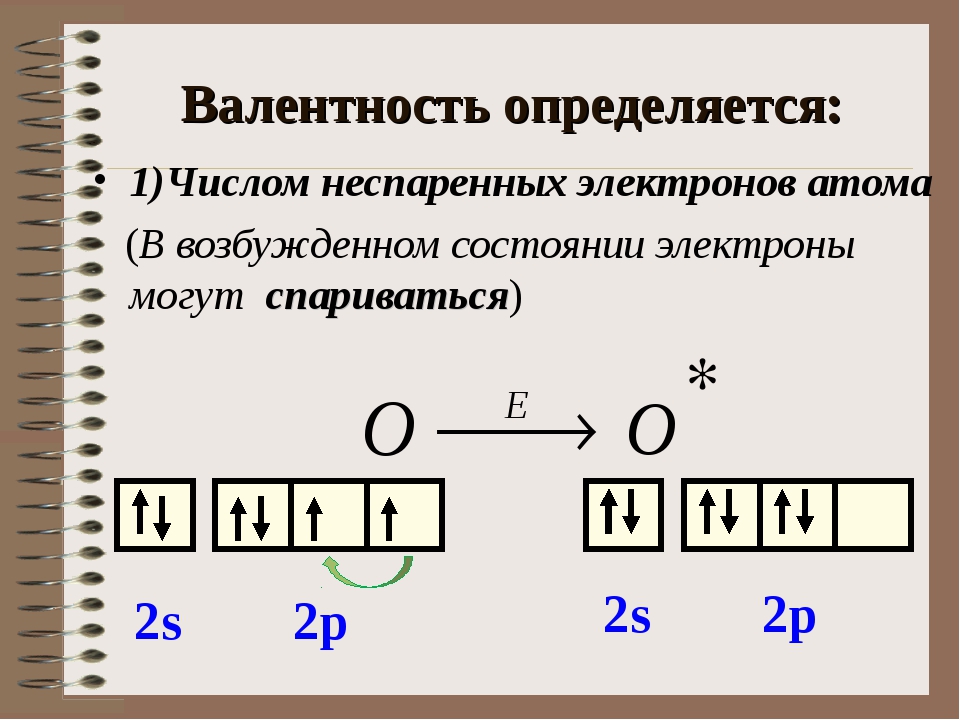 п. На описанной выше операции экстракции-реэкстракции родия реализуется высокая очистка родия как от продуктов деления (включая технеций и рутений), так и от продуктов коррозии нержавеющих (хромоникелевых) или циркониевых сплавов материалов аппаратуры и оболочек тепловыделяющих элементов АЭС. Дополнительная очистка родия от этих элементов может быть достигнута или при многоступенчатом процессе экстракции и промывки экстракта, или при предварительной экстракции (так называемой «форэкстракции») хорошо экстрагирующихся примесей в тот же экстрагент из водного раствора с родием перед его последующим окислением и извлечением тем же экстрагентом. При осуществлении заявленного способа может быть получен новый технический результат, состоящий в:
п. На описанной выше операции экстракции-реэкстракции родия реализуется высокая очистка родия как от продуктов деления (включая технеций и рутений), так и от продуктов коррозии нержавеющих (хромоникелевых) или циркониевых сплавов материалов аппаратуры и оболочек тепловыделяющих элементов АЭС. Дополнительная очистка родия от этих элементов может быть достигнута или при многоступенчатом процессе экстракции и промывки экстракта, или при предварительной экстракции (так называемой «форэкстракции») хорошо экстрагирующихся примесей в тот же экстрагент из водного раствора с родием перед его последующим окислением и извлечением тем же экстрагентом. При осуществлении заявленного способа может быть получен новый технический результат, состоящий в:
более экономичном осуществлении процесса извлечения осколочного родия из водных высокорадиоактивных азотнокислотных сред, содержащих не менее 20 металлов-элементов (включая и сильно гидролизующиеся катионы типа четырехвалентных плутония, титана, циркония, церия), что исключает опасность нарушения гомогенности водного раствора с родием до или после акта экстракции),
более высоком (выше 80%) извлечении родия (при одинаковом времени контакта фаз, что и в прототипе) или в результате более короткого контактирования (для получения одинаковой с прототипом величины извлечения родия за счет перевода его в валентное состояние IV)
в меньшем засолении подлежащих обязательному последующему дорогостоящему отверждению высокорадиоактивных водных отходов после возможного извлечения из них ряда ценных (палладий, родий) или крайне токсичных и опасных для вечного захоронения компонентов (америций, нептуний, кюрий и технеций),
в снижении опасности радиационно-химической деструкции экстрагента (снижение поглощенной дозы радиации и исключение атаки со стороны сильно нитрующего органические растворители агента, каковым является азотистая кислота, используемая в прототипе),
в снижении опасности коррозии аппаратуры из нержавеющей стали под действием серной кислоты (образующейся из-за деструкции роданида калия при взаимодействии его с сильными кислотами),
в повышении селективности извлечения родия за счет перевода его в валентность «+4».
Формула изобретения
1 1. Способ извлечения осколочного родия из азотно-кислотных водных растворов, включающий снижение кислотности раствора, экстракцию с использованием несмешивающихся с водой растворов органических экстрагентов в инертных разбавителях путем контактирования двух несмешивающихся фаз, разделение расслоившихся фаз и последующую реэкстракцию родия из органического раствора в водный раствор, отличающийся тем, что перед экстракцией азотнокислотный водный раствор обрабатывают окислителем для перевода родия в четырехвалентное состояние.2 2. Способ по п.1, отличающийся тем, что азотнокислотный водный раствор обрабатывают с использованием в качестве окислителя висмутата натрия.
РИСУНКИ
Рисунок 1
Электроосаждение палладия (Л. И. Каданер)
из «Гальванотехника справочник »
Платина — металл серовато-белого цвета, атомная масса 195,1, валентность 2,4. Плотность платины 21,45, температура плавления 1770 °С.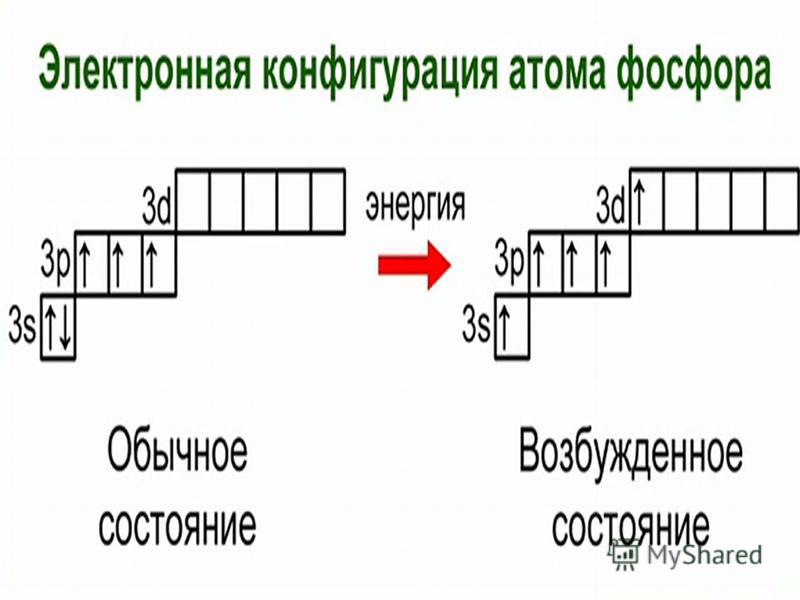 Платина хорошо поддается механической обработке. Твердость платины около 0,4 ГПа, а платиновых покрытий — до б ГПа. Удельное электросопротивление платины 0,11 X X 10 мкОм-м.
[c.287]
Платина хорошо поддается механической обработке. Твердость платины около 0,4 ГПа, а платиновых покрытий — до б ГПа. Удельное электросопротивление платины 0,11 X X 10 мкОм-м.
[c.287]
Платина не окисляется при нагреве до 1100 °С, обладает высокой химической стойкостью, нерастворима в щелочах и минеральных кислотах, растворима лишь в царской водке. Стандартный электродный потенциал платины по отношению к ее двухвалентным ионам +1,28 В.
[c.287]
В жестких условиях эксплуатации платина не должна сопрягаться с углеродистой сталью, цинком, кадмием, магнием, оксидированным и неоксидированным алюминием из-за значительной коррозии в сопряжениях.
[c.287]
В остальных случаях выбор толщины покрытий определяется агрессивностью среды и может достигать даже 200 мкм.
[c.287]
Применение платиновых покрытий в технике ограничивается высокой стоимостью и дефицитностью платины.
[c. 287]
287]
Заменой платиновых покрытий при изготовлении металлических зеркал и отражателей могут служить покрытия палладием, родием и рутением.
[c.287]
Для электроосаждения платины используют кислые и щелочные электролиты (табл. 5.51).
[c.287]
Применяются также сульфатный и хлоридный электролиты для осаждения платины.
[c.287]
Приготовление электролитов. Хлорплатинат аммония или натрия готовят следующим образом металлическую платину растворяют в царской водке, а образующийся хлорид платины, кристаллизующийся в форме желтых кристаллов, нейтрализуют аммиаком или щелочью.
[c.288]
Фосфатный электролит готовят растворением хлорплатината аммония и гидрофосфата натрия в воде. Электролит требует предварительной проработки током до 20 А.ч/л. Корректируют электролит хлор платинатом аммония.
[c.288]
Диаминонитрит платины готовят смешиванием растворов хлорида платины и нитрита натрия или калия в соотношении 1 10 при нагреве до 40—50 °С. К полученному раствору добавляют расчетное количество аммиака и нитрита натрия или ортофосфорной кислоты при кипячении.
[c.288]
К полученному раствору добавляют расчетное количество аммиака и нитрита натрия или ортофосфорной кислоты при кипячении.
[c.288]
Щелочной электролит платинирования готовят введением нитрита натрия, а затем 5 %-ного раствора аммиака в кипящий раствор платинохлористоводородной кислоты.
[c.288]
Удаление некачественных платиновых покрытий производят анодным растворением их в электролите платинирования при использовании серебряных или графитовых катодов.
[c.288]
Электролитические покрытия родием получили сравнительно широкое техническое применение, несмотря на высокую стоимость этого металла, в связи с высокой коррозионной стойкостью, высоким длительно сохраняюш,имся коэффициентом отражения света, низким контактным сопротивлением, высокой электропроводностью, значительной твердостью, износостойкостью и красивым внешним видом. Атомная масса родия 102,9, валентность 1 и 3. Плотность родия 12,4, температура плавления 1960 °С. [c.289]
[c.289]
Твердость металлургического отожженного родия составляет 1,0 ГПа. твердость электролитического родия 7,5—9,5 ГПа, что связано с поглощением водорода в процессе электроосаждения и деформацией кристаллической решетки.
[c.289]
Значительная твердость родиевых покрытий сочетается с высокими внутренними напряжениями, составляющими 0,8—2,0 ГПа. Коэффициент отражения родия несколько меньше, чем серебра (76—81 % в интервале длин световых волн 500—800 км). Однако в отличие от серебра родий длительно сохраняет неизменным коэффициент отражения, что определило применение родиевых покрытий для защиты поверхности серебряных зеркал и отражателей от потускнения. Удельное электросопротивление родня 0,043 Ом-мм.
[c.289]
Родий обладает высокой стойкостью по отношению к сероводороду и сернистым соединениям, он устойчив по отношению ко всем щелочам, минеральным и органическим кислотам, к царской водке.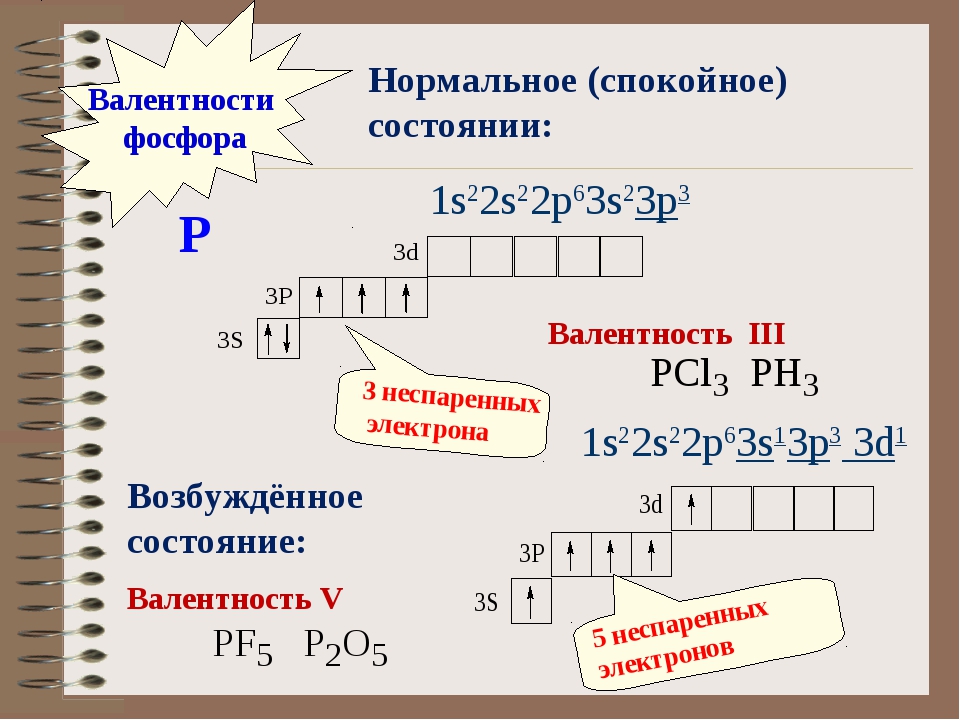 Только в высокораздробленном состоянии (в виде родиевой черни) он сравнительно легко растворяется в царской водке, в растворах серной и соляной кислот.
[c.289]
Только в высокораздробленном состоянии (в виде родиевой черни) он сравнительно легко растворяется в царской водке, в растворах серной и соляной кислот.
[c.289]
Родиевые покрытия длительное время сохраняют неизменной высокую проводимость в контактах. В сочетании с большой твердостью и износостойкостью это определило применение родия для покрытия прецизионных токопроводящих, скользящих и трущихся контактов радиотехнической и электронной аппаратуры, требующей безотказной работы в сложных условиях.
[c.289]
Вернуться к основной статье
химический элемент Родий Rhodium — «Химическая продукция»
Что такое
Родий, rhodium, характеристики, свойства
Родий — это химический элемент Rh (химический символ — Rh; лат. Rhodium) — элемент девятой группы (в старой системе — побочной подгруппы восьмой группы) пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер — 45. Простое вещество родий — твёрдый переходный металл серебристо-белого цвета. Благородный металл платиновой группы.
И. Менделеева, атомный номер — 45. Простое вещество родий — твёрдый переходный металл серебристо-белого цвета. Благородный металл платиновой группы.
Происхождение названия
От др.-греч. ῥόδον — роза, типичные соединения родия (III) имеют глубокий тёмно-красный цвет. Его можно увидеть, растворив металл в царской водке.
Родий класс химических элементов
Элемент Rh — относится к группе, классу хим элементов (…)
Элемент Rh свойство химического элемента Родий Rhodium
Основные характеристики и свойства элемента Rh…, его параметры.
формула химического элемента Родия Rhodium
Химическая формула Родийа:
Атомы Родий Rhodium химических элементов
Атомы Rhodium хим. элемента
Rhodium Родий ядро строение
Строение ядра химического элемента Rhodium — Rh,
История открытия Родий Rhodium
Открытие элемента Rhodium — Открыт в Англии в 1803 году Уильямом Гайдом Волластоном в ходе работ с самородной платиной.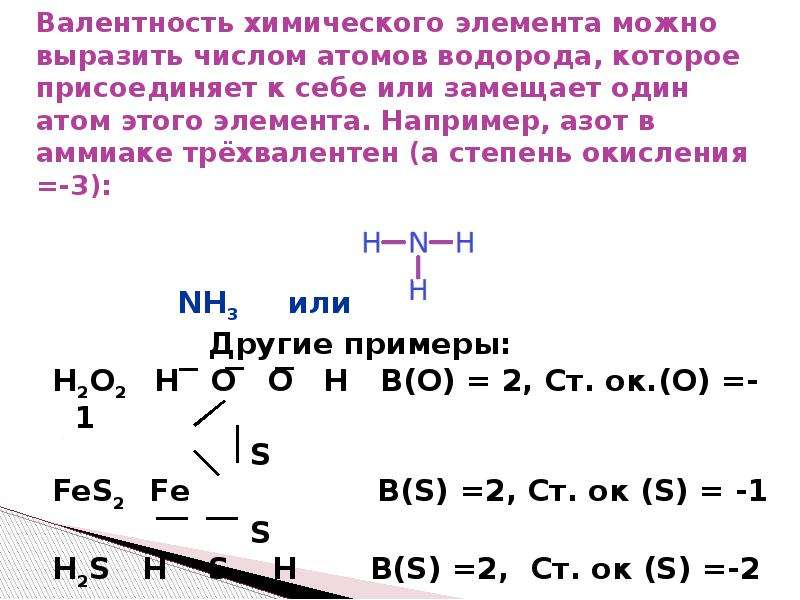 Подробнее историю открытия см. в статье палладий.
Подробнее историю открытия см. в статье палладий.
Родий Rhodium происхождение названия
Откуда произошло название Rhodium …
Распространённость Родий Rhodium
Как любой хим. элемент имеет свою распространенность в природе, Rh …
Получение Родий Rhodium
Rhodium — получение элемента
Физические свойства Родий Rhodium
Основные свойства Rhodium
Изотопы Rhodium Родий
Наличие и определение изотопов Rhodium
Rh свойства изотопов Родий Rhodium
…
Химические свойства Родий Rhodium
Определение химических свойств Rhodium
Меры предосторожности Родий Rhodium
Внимание! Внимательно ознакомьтесь с мерами безопасности при работе с Rhodium
Содержание в природе
Родий очень редкий и рассеянный элемент. В природе встречается только изотоп 103 Rh. Среднее содержание родия в земной коре 1⋅10 −7 % по массе, в каменных метеоритах 4,8⋅10 −5 %. Содержание родия повышено в ультраосновных изверженных породах . Собственных минералов не имеет. Содержится в некоторых золотых песках Южной Америки. Содержится в никелевых и платиновых рудах в виде простого соединения. До 43 % родия приходится на мексиканские золотые месторождения. Также содержится в изоморфной примеси минералов группы осмистого иридия (до 3,3 %), в медноникелевых рудах. Редкая разновидность осмистого иридия — родиевый невьянскит — самый богатый родием минерал (до 11,3 %).
Собственных минералов не имеет. Содержится в некоторых золотых песках Южной Америки. Содержится в никелевых и платиновых рудах в виде простого соединения. До 43 % родия приходится на мексиканские золотые месторождения. Также содержится в изоморфной примеси минералов группы осмистого иридия (до 3,3 %), в медноникелевых рудах. Редкая разновидность осмистого иридия — родиевый невьянскит — самый богатый родием минерал (до 11,3 %).
Месторождения
Ежегодно в мире добывается менее 30 тонн родия. Месторождения родия находятся на территории ЮАР , Канады, Колумбии, РФ
Получение
Родий извлекают из самородной платин. Сырую самородную платину помещают в фарфоровые котлы, после чего обрабатывают царской водкой при нагревании в течение суток. Родий, почти вся платина, палладий, неблагородные металлы (железо, медь и другие), частично рутений и иридий переходят в раствор, а в осадке остаётся осмистый иридий, кварц, хромистый железняк и другие примеси. Оставшийся раствор упаривают, в осадке остаётся до 6 % родия, присутствуют также палладий, рутений, иридий, платина (всю её с помощью NH 4 Cl отделить не удаётся) и неблагородные металлы. Этот осадок растворяют в воде и ещё раз тем же способом отделяют платину. Раствор, в котором остались родий, рутений и палладий, направляют на очистку и разделение.
Этот осадок растворяют в воде и ещё раз тем же способом отделяют платину. Раствор, в котором остались родий, рутений и палладий, направляют на очистку и разделение.
Родий извлекают разными способами. Известен способ, предложенный советским учёным В. В. Лебединским в 1932 г. Вначале на раствор действуют нитритом натрия NaNO 2 . Таким образом осаждают и отделяют от раствора гидроокиси неблагородных металлов. Родий сохраняется в растворе в форме Na 3 [Rh(NO 2 )6 ]. После этого действием NH 4 Cl на раствор на холоде выделяют родий в виде малорастворимого комплекса (NH 4 )2 Na[Rh(NO 2 )6 ]. Однако при этом вместе с родием в осадок переходит и иридий. Другие платиновые металлы — рутений, палладий и остатки платины — остаются в растворе.
На осадок действуют разбавленным едким натром, что позволяет растворить его. Из полученного раствора действием аммиака и NH 4 Cl снова осаждают родий. Осаждение происходит за счёт образования малорастворимого комплексного соединения [Rh(NH 3 )3 (NO 2 )3 ]. Отделенный осадок тщательно промывают раствором хлористого аммония. После этого осадок обрабатывают соляной кислотой, нагревая его в ней в течение нескольких часов. Протекает реакция:
Осаждение происходит за счёт образования малорастворимого комплексного соединения [Rh(NH 3 )3 (NO 2 )3 ]. Отделенный осадок тщательно промывают раствором хлористого аммония. После этого осадок обрабатывают соляной кислотой, нагревая его в ней в течение нескольких часов. Протекает реакция:
2[Rh(NH 3 )3 (NO 2 )3 ] + 6HCl → 2[Rh(NH 3 )3 Cl 3 ] +3NO 2 + 3NO + 3H 2 O
с образованием триаминтрихлорида родия ярко-жёлтого цвета. Осадок тщательно промывают водой, переводя в состояние, пригодное для выделения металлического родия. Прокаливание полученного соединения проводят в течение нескольких часов при 800—900 °C. Итогом процесса является порошкообразный продукт смеси родия с его окислами. Порошок охлаждают, промывают разбавленной царской водкой с целью удаления оставшегося незначительного количества неблагородных примесей, после чего при высокой температуре восстанавливают до металла в среде водорода.
Физические свойства
Родиевая фольга и проволока
Родий — твёрдый металл серебристо-серого цвета. Имеет высокий коэффициент отражения электромагнитных лучей видимой части спектра , поэтому широко используется для изготовления «поверхностных» зеркал .
Изотопы родия
Природный родий состоит из изотопа 103 Rh. Наиболее долгоживущие изотопы
| Изотоп | Период полураспада |
|---|---|
| 101 Rh | 3,3 года |
| 102 Rh | 207 дней |
| 102m Rh | 2,9 года |
| 99 Rh | 16,1 дней |
Химические свойства
Родий — благородный металл , по химической стойкости в большинстве коррозионных сред превосходит платину . Металлический родий растворяется в царской водке при кипячении , в расплаве КНSО 4 , в концентрированной серной кислоте при нагревании, а также электрохимически , анодно — в смеси перекиси водорода и серной кислоты.
Родий характеризуется высокой химической устойчивостью. С неметаллами он взаимодействует только при температуре красного каления . Мелко измельчённый родий медленно окисляется только при температуре выше 600 °C:
При нагревании родий медленно взаимодействует с концентрированной серной кислотой , раствором гипохлорита натрия и бромоводорода.
При спекании реагирует с расплавами гидросульфата калия KHSO 4 , пероксида натрия Na 2 O2 и пероксида бария BaO 2 :
В присутствии хлоридов щелочных металлов , когда есть возможность образовывать комплексы [RhX 6 ]3− , родий взаимодействует с хлором , например:
При действии на водные растворы солей и комплексов родия (III) щелочами образуется осадок гидроксида родия Rh(OH) 3 :
Гидроксид и оксид родия (III) проявляют основные свойства и взаимодействуют с кислотами с образованием комплексов Rh (III):
Высшую степень окисления +6 родий проявляет в гексафториде RhF 6 , который образуется при прямом сжигании родия во фторе . Соединение неустойчиво. В отсутствие паров воды гексафторид окисляет свободный хлор:
Соединение неустойчиво. В отсутствие паров воды гексафторид окисляет свободный хлор:
В низших степенях окисления +1 и +2 родий образует комплексные соединения .
Применение родия
Катализаторы
- Родий применяется в катализаторах (до 81 % всего производства), в том числе в каталитических фильтрах-нейтрализаторах выхлопных газов автомобилей
- Применяется как катализатор в различных реакциях, например, при получении уксусной кислоты из метилового спирта .
- Сплав родия с платиной — очень эффективный катализатор для производства азотной кислоты окислением аммиака воздухом, и до сих пор его применению нет альтернативы.
Конструкционный материал
- при производстве стекла (сплав платина -родий — фильеры для стеклонитей, для жидкокристаллических экранов). В связи с ростом производства жидкокристаллических устройств потребление родия быстро растёт (в 2005 в производстве стекла было использовано 1,55 тонны родия, в 2003 — 0,81 тонны).

- Металлический родий используется для производства зеркал, подвергающихся сильному нагреву (калению) для мощных лазерных систем (например, фтороводородных лазеров ), а также для производства дифракционных решёток к приборам для анализа вещества (спектрометры).
- Тигли из платино-родиевых сплавов используются в лабораторных исследованиях и для выращивания некоторых драгоценных камней и электрооптических кристаллов.
Термопары
- Термопары платина-родий и др., для очень эффективного и долговечного измерения высоких (до 2200 °C) температур нашли широкое применение сплавы родия с иридием (например, ИР 40\\60).
Материал контактных пар
Благодаря высокой стойкости к электроэрозии родий и его сплавы применяются в качестве материала для контактов ( герконы , разъёмы , скользящие контакты ).
Ювелирное дело
Используются гальванические электролиты родирования (преимущественно сульфатные , сульфаматные и фосфатные ) для получения износостойких и коррозионноустойчивых покрытий.
Холодный белый блеск родия хорошо сочетается с бриллиантами , фианитами и др. вставками. Также родий добавляют в качестве легирующей, укрепляющей добавки в платину и палладий. Родием также покрывают изделия из серебра , что предотвращает их потемнение. Нанесение на ювелирное изделие родиевого покрытия уменьшает износ и увеличивает твёрдость изделия, защищая от царапин, и придаёт яркий блеск.
В 2009 году частный монетный двор США впервые в мире выпустил монету из чистого родия. Из-за крайне высокой температуры плавления данного металла американским монетным двором был разработан особый процесс производства монет из родия. Монеты из родия были выпущены не как платёжное средство, а в качестве объекта инвестирования средств
В 2014 году Национальный банк Руанды впервые в мире выпустил монету из чистого родия, как платёжное средство. Монета была выпущена достоинством 10 руандийских франков .
Ядерные реакторы
Родиевые детекторы применяются в реакторах для измерения нейтронного потока.
Биологическая роль и физиологическое воздействие
Родий не играет биологической роли.
Соединения родия довольно редко встречаются в повседневной жизни и их воздействие на человеческий организм до конца не изучено. Несмотря на это, они являются высокотоксичными и канцерогенными веществами . LD 50 хлорида родия для крыс — 12,6 мг/кг. Соли родия способны сильно окрашивать человеческую кожу.
Стоимость Родий Rhodium
Рыночная стоимость Rh, цена Родий Rhodium В феврале 2006 цены на родий достигли рекордного значения 3500 долл. за тройскую унцию . В январе 2008 года цены на родий установили новый рекорд — 7000 долл. за унцию. После пика в 10100 долл. за унцию цена на родий упала до 900 долл на конец ноября 2008 в связи с кризисом в автомобилестроении. 19 ноября 2009 года цена металла поднялась до 2600 долларов за унцию.
Реакторный родий 130—180 грамм на тонну осколков деления ядерного топлива урана, плутония, тория
В связи с очень высокими ценами на чистый родий и при значительном спросе и малом объёме добываемого родия встаёт актуальная задача для решения острого дефицита родия, выделение его стабильного изотопа из осколков деления ядерного топлива (урана, плутония, тория), где он накапливается в значительных количествах (до 130—180 граммов на тонну осколков), и учитывая развитую атомную энергетику в крупнейших индустриальных странах, объём добычи реакторного родия в несколько раз превысит его добычу из руд.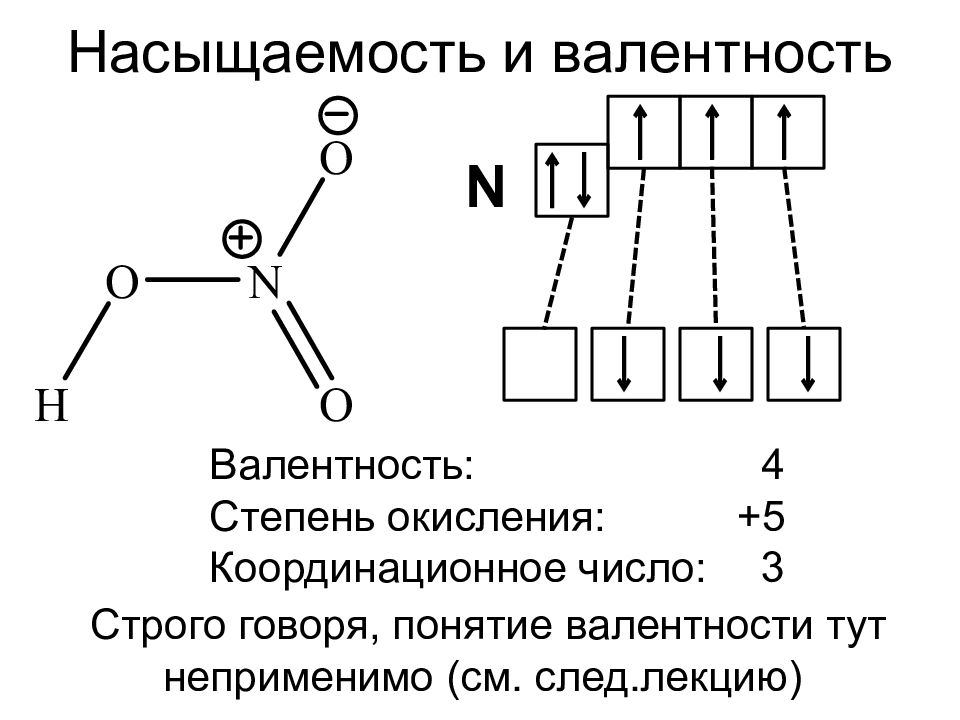
Необходимы исследования также и по вопросу режимов работы реакторов, при которых количество родия в процентном отношении к массе осколков будет выше, и таким образом атомная промышленность может стать основным поставщиком родия на мировой рынок.
По состоянию на сентябрь 2015 года средняя цена на родий составляет 756,67 долл. за унцию
Примечания
Список примечаний и ссылок на различные материалы про хим. элемент Rh
валентных электронов родия | Валентность родия (Rh) Точечная диаграмма
Узнайте о валентных электронах родия здесь и расширите свои знания об элементах. Статья поможет вам систематически изучить этот элемент. Родий — химический элемент в химии. Он имеет атомный номер 45 и символ Rh.
Сколько валентных электронов у родия?
Он известен как очень редкий химический элемент из-за его минимальной доступности в природе.Итак, он относится к категории переходных металлов в периодической таблице. Родий имеет физическую структуру белого твердого и химически инертного металла. Он отмечен как благородный металл платиновой группы.
Родий имеет физическую структуру белого твердого и химически инертного металла. Он отмечен как благородный металл платиновой группы.
Родий добывается из никелевых и платиновых руд. Вот почему он относится к категории платиновой группы в периодической таблице. Как мы знаем, родий имеет очень незначительную свободную форму, что делает его очень дорогостоящим элементом. Таким образом, это один из самых ценных химических элементов.
В основном родий используется в качестве катализатора в автомобильном механизме. Он работает как трехкомпонентный каталитический нейтрализатор в автомобилях. Другие применения родия включают в себя украшения. Его можно использовать для позолоты белого золота, чтобы сделать его блестящим и прибыльным.
Точечная диаграмма валентных электронов родия
Мы предоставляем точечную диаграмму валентных электронов родия. Итак, вы можете использовать эту диаграмму, чтобы узнать фактическое количество валентных электронов.
Подобным образом диаграмма помогает понять взаимодействие валентных электронов. Вы также можете узнать характер связи валентных электронов после взаимодействия.
Валентность родия
Родий имеет валентность 3 и 21 валентный электрон во внешней оболочке. Следовательно, валентность можно назвать объединяющей способностью родия. Итак, валентность полезна для правильного анализа химических элементов. Вы можете дополнительно проверить валентность родия в периодической таблице.
Rh Информация об элементе родий: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
История родия
Элемент родий был открыт Уильямом Хайдом Волластоном в год.
1803 г. в Соединенном Королевстве
.
Родий
получил свое название от греческого rhodos, что означает «цвет розы».
Присутствие родия: изобилие в природе и вокруг нас
В таблице ниже показано содержание родия во Вселенной, Солнце, метеоритах,
Земная кора, океаны и человеческое тело.
Кристаллическая структура родия
Твердотельная структура родия — гранецентрированная кубическая.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в
три
пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки
края
Константы решетки ( a , b и c )
| а | б | c |
|---|---|---|
| 380.34 | 380,34 | 380,34 м. |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений (
x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства родия
Атомы родия имеют 45 электронов и
структура электронной оболочки [2, 8, 18, 16, 1] с символом атомного члена (квантовые числа) 4 F 9/2 .
Оболочечная структура родия — количество электронов на энергию
уровень
| n | с | с. | г | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 6 | 10 | |
| 4 | N | 2 | 6 | 8 | |
| 5 | O | 1 |
Основное состояние Электронная конфигурация родия — нейтраль
Атом родия
Электронная конфигурация нейтрального атома родия в основном состоянии
[Kr] 4d8 5s1. Часть конфигурации родия, которая эквивалентна благородному газу
Часть конфигурации родия, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается [Kr]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 4d8 5s1, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального родия
Полная электронная конфигурация в основном состоянии атома родия, полная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d10 4с2 4п6 4д8 5с1
Атомная структура родия
Атомный радиус родия 173 пм, а его ковалентный радиус 135 пм.
Атомный спектр родия
Химические свойства родия:
Энергии ионизации родия и сродство к электрону
Электронное сродство родия 109,7 кДж / моль.
Энергия ионизации родия
Энергии ионизации родия
см. В таблице ниже.
| Число энергии ионизации | Энтальпия — кДж / моль |
|---|---|
| 1 | 719.7 |
| 2 | 1740 |
| 3 | 2997 |
Физические свойства родия
Физические свойства родия
см. В таблице ниже.
| Плотность | 12,45 г / см3 |
| Молярный объем | 8.26550200803 см3 |
Эластичные свойства
Твердость родия — Испытания для измерения твердости элемента
Электрические свойства родия
Родий — проводник электричества. Ссылаться на
Ссылаться на
Таблица
ниже электрические свойства родия
Теплопроводные свойства родия
Магнитные свойства родия
Оптические свойства родия
Акустические свойства родия
Термические свойства родия — энтальпии и
термодинамика
Термические свойства родия
см. В таблице ниже.
Энтальпия родия
Изотопы родия — Ядерные свойства родия
Изотопы родия.Встречающийся в природе родий имеет
1 стабильный изотоп —
103Rh.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 89Rh | ||||
| 90Rh | ||||
| 91Rh | ||||
| 92Rh | ||||
| 93Rh | ||||
| 94Rh | ||||
| 95Rh | ||||
| 96Rh | ||||
| 97Rh | ||||
| 98Rh | ||||
| 99Rh | ||||
| 100Rh | ||||
| 101Rh | ||||
| 102Rh | ||||
| 103Rh | 100% | Стабильный | N / A | |
| 104Rh | ||||
| 105Rh | ||||
| 106Rh | ||||
| 107Rh | ||||
| 108Rh | ||||
| 109Rh | ||||
| 110Rh | ||||
| 111Rh | ||||
| 112Rh | ||||
| 113Rh | ||||
| 114Rh | ||||
| 115Rh | ||||
| 116Rh | ||||
| 117Rh | ||||
| 118Rh | ||||
| 119Rh | ||||
| 120Rh | ||||
| 121Rh | ||||
| 122Rh |
Нормативно-правовое регулирование и здравоохранение — Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
WebElements Периодическая таблица »Родий» Свойства свободных атомов
Атомы родия имеют 45 электронов, а структура оболочки равна 2. 8.18.16.1.
8.18.16.1.
Электронная конфигурация основного состояния газообразного нейтрального родия в основном состоянии равна [ Kr ]. 4d 8 5s 1 и условное обозначение равно 4 F 9/2 .
Схематическая электронная конфигурация родия.
Оболочечная структура Косселя родия.
Атомный спектр
Изображение атомного спектра родия.
Энергии ионизации и сродство к электрону
Электронное сродство родия 109,7 кДж / моль ‑1 . Энергии ионизации родия приведены ниже.
Энергии ионизации родия.
Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды «Клементи-Раймонди», Z eff . Перейдите по гиперссылкам для получения более подробной информации и графиков в различных форматах.
| 1с | 44. 08 08 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 33,15 | 2 пол | 40,94 | ||||
| 3с | 28,44 | 3 пол. | 28,15 | 3д | 30,41 | ||
| 4с | 18,58 | 4 пол. | 17,14 | 4д | 13,44 | 4f | (нет данных) |
| 5с | 6,64 | 5п | (нет данных) | 5д | (нет данных) | ||
| 6с | (нет данных) | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди и В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальная | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 23220 [1] |
| L I | 2s | 3412 [1] |
| L II | 2p 1/2 | 3146 [1] |
| L III | 2p 3/2 | 3004 [1] |
| M I | 3s | 628.1 [3] |
| M II | 3p 1/2 | 521,3 [3] |
| M III | 3p 3/2 | 496,5 [3] |
| M IV | 3d 3/2 | 311,9 [3] |
| M V | 3d 5/2 | 307,2 [3] |
| N I | 4s | 81,4 [2, значения взяты из ссылки 1] |
| N II | 4p 1/2 | 50.5 [3] |
| N III | 4p 3/2 | 47,3 [3] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электронов. Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev.Мод. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- D.R. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, «Энергии связи на уровне ядра в металлах», J.Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
Атом родия — обзор
4.4.7.2 Глобулярные кластерные комплексы родия с межузельными атомами родия
Существует семейство слабо связанных шаровых кластеров, все из которых содержат один или несколько межузельных атомов родия, окруженных оболочкой из поверхностных атомов родия. Эти кластерные комплексы содержат только CO и гидридные лиганды, и все они являются анионами. Обширное описание аспектов синтеза, структур, текучести и реакционной способности большинства членов этого семейства появилось в COMC-I . 253,331 В таблице 4 представлен обзор структур, мотив твердотельной плотной упаковки, аппроксимированный скелетом Rh n , и количество валентных электронов кластера для каждого кластера в этом семействе.
Таблица 4. Средние и крупные кластерные комплексы родия, содержащие межузельные атомы родия.
| Комплекс | CVE a | Твердотельная структура | Мотив плотной упаковки |
|---|---|---|---|
| Rh 13 H 5 — n (CO) 24 ] n — ( n = 2–4) | 170 | Антикубоктаэдр (моно, дигидридные комплексы) | ч.c.p. |
| (14 n s b + 2) | 3: 7: 3 наслоение | ||
| Rh 14 (CO) 26 ] 2− | 180 | Центрированный куб с пятиугольниками | bcc |
| Rh 14 (CO) 25 ] 4- (250 ) | (12 n s + 24) | 3: 7: 4 наслоение | |
| Rh 14 H (CO) 25 ] 3- | |||
| Rh 15 (CO) 27 ] 3- ( 251 ) | 192 (12 n s + 24) | искаженный центрированный антикубоктаэдр с закрывающим атомом родия двумя квадратными гранями | h.c.p – b.c.c. |
| Rh 15 (CO) 30 ] 2− / 3− ( 257 ) | 179/198 | Центрированный куб с шестигранной головкой | b.c.c. |
| (12 n s + 2 ( n s + 1)) | 4: 7: 4 наслоение | ||
| Rh 17 (CO) 30 ] 3− ( 256 ) | 216 | Rh 13 антикубоктаэдр с квадратными гранями, покрытыми родием | h.c.p. |
| (12 n s + 24) | 6: 7: 4 слоев | ||
| Rh 22 (CO) 37 ] 4- ( 255 ) | 276 | Rh 13 антикубооктаэдр с родиевым колпачком на всех квадратных гранях и треугольником из трех дополнительных атомов родия наверху | hcp |
| (12 n s + 24) | 3: 6: 7: 6 слоев | ||
| Rh 22 H x (CO) 35 ] 5 — ( 252 ) | два искаженных объемно-центрированных куба с общей квадратной гранью, шесть родиевых крышек с квадратными гранями + два дополнительных атома родия | b.cc | |
| Rh 22 H x + 1 (CO) 35 ] 4- ( 253 ) |
Для получение высокоядерных комплексов шаровидных скоплений. Стратегия высокого давления, разработанная Vidal et al. 331 использует легкодоступный мононуклеарный комплекс Rh (CO) 2 acac ( 249 ) в качестве источника родия.Когда ( 249 ) подвергается воздействию давления от 10 до 15 атм COH 2 (1: 1) при 150 ° C в тетраглиме и двух эквивалентах основания, такого как N, -метилморфолин, либо [Rh 14 (CO) 25 ] 4- (250 ) 332 или [Rh 15 (CO) 27 ] 3- ( 251 ) 33203 может быть выделен с высоким выходом (схема 35). Гидриды Rh 22 334 [Rh 22 H x (CO) 35 ] 5– ( 252 ) и [Rh 22 H x 1 (CO) 35 ] 4- ( 253 ) также получали из этого исходного материала.
Схема 35.
Второй метод синтеза кластеров с высокой ядерностью использует Rh 4 (CO) 12 ( 161 ) в качестве источника родия. Атмосферное давление N 2 или CO используется со спиртовыми растворителями в присутствии основания. Количество основания является функцией желаемого соотношения Rh: OH —. Например, комплексы [Rh 14 (CO) 26 ] 2- ( 254 ), [Rh 22 (CO) 37 ] 4- ( 255 ) и [Rh 17 (CO) 30 ] 3- ( 256 ) 335 получают из ( 161 ) кипячением с обратным холодильником в Pr i OH с NaOH (Rh: OH — = 1: 5.5) на 5 ч. Хотя этот метод не всегда селективен, этот метод, разработанный Чини и соавторами 336 , позволил получить не только множество кластеров родия шаровидного типа, но также и самое большое количество известных кластерных комплексов, содержащих родий, кобальт и иридий. . 189,253
Третий метод кластерного синтеза включает направленное расщепление или добавление моно- или полиядерного фрагмента к одному кластеру с образованием нового (схема 36 и уравнения (73) — (76)).Растущее знание структур этих кластерных комплексов позволило идентифицировать конкретные фрагменты, которые должны быть подвержены расщеплению нуклеофильными реагентами, а также электрофильные родийсодержащие фрагменты, которые будут добавляться к подходящим кластерам. Появилось несколько исследований реакций фрагментации, 337 идентичностей продуктов фрагментации, 331 и влияния различных катионов, оснований и растворителей на стабильность высокоядерных кластеров родия. 338
Схема 36.
Присутствие межузельного атома металла в кластере меняет формализм полиэдрического счета электронов, применяемый к этим кластерам. Валентные орбитали межузельных атомов не включены в скелетную связь внешнего многогранника атомов металла. Кластерные комплексы Rh 13 (таблица 4) все состоят из центрированного антикубоктаэдра из 12 внешних атомов родия, в котором каждый металл четырехсвязен. Таким образом, применяется правило счета 14 n s + 2 ( n s = поверхностные атомы), которое учитывает их 170 CVE.Теоретический анализ 328,329,339,340 кластерных комплексов Rh 14 и выше является более сложным, но для этих случаев были разработаны аналогичные правила подсчета.
Слоистость атома металла, наблюдаемая в структурах подсемейств кластеров из 13, 14 и 15 атомов, перечисленных в таблице 4, может рассматриваться как прогрессия от гексагональной плотной упаковки (ГПУ) к объемно центрированной кубической (ОЦК) плотной упаковке. упаковка. Металлический каркас [Rh 13 H 5 — n (CO) 24 ] n — , [Rh 14 (CO) 25 ] 4- (250 ), [Rh 15 (CO) 27 ] 3- ( 251 ) и [Rh 15 (CO) 30 ] 3- ( 257 ) иллюстрируют эту последовательность (Схема 37). 341 Гидридные комплексы Rh 13 все соответствуют центрированной антикубоктаэдрической структуре, в которой ГКП 3: 7: 3. наслоение очевидно. Структура ( 257 ) представляет собой полный переход к компоновке насадки b.c.c. Расположение атомов металла ( 250 ) и ( 251 ) представляет собой переходные структуры между ГЦП. и b.c.c. упаковка. Структура (250 ) является неполной b.c.c. упаковка атомов родия, которая при формальном добавлении одной группы «Rh (CO) 5 » дала бы полное b.c.c. расположение наблюдается в ( 257 ). Структура атома металла ( 251 ) может рассматриваться как сплавление ГЦП. и упаковка b.c.c. Слоистость атомов металла 6: 7: 4, наблюдаемая в [Rh 17 (CO) 30 ] 3- ( 256 ), снова возвращается к ГКП. и может считаться промежуточным звеном между ГПУ. расположение в гидридах Rh 13 (3: 7: 3, aba наслоение) и наслоение 6: 7: 6: 3 ( abac ), наблюдаемое в [Rh 22 (CO) 37 ] 4− ( 255 ).В то время как ( 255 ) представляет собой плавленый Г.С. (кубическая плотноупакованная) расположение атомов родия, гидридные комплексы Rh 22 ( 252 ) и ( 253 ) представляют собой b.c.c.-to-c.c.p. договоренности.
Схема 37.
ЯМР-исследования в растворе 342 на семействах гидридных кластеров Rh 13 и Rh 14 показали, что как гидридные, так и CO-лиганды в этих комплексах являются флуксирующими при комнатной температуре, но не их скелеты атомов металла.Гидридный лиганд в [Rh 14 H (CO) 25 ] 3- является флюсионным даже при низкой температуре (-90 ° C), тогда как лиганд в ди- и тригидридных кластерных комплексах Rh 13 не является . Основываясь на косвенных доказательствах структуры твердого тела, считается, что гидридные лиганды находятся в квадратных пирамидальных камерах внутри этих комплексов. Значения ЯМР родия-103, указанные для межузельных атомов металла в этих комплексах, согласуются со значениями, указанными для других комплексов, которые всегда имеют значительно более высокие частоты, чем поверхностные атомы родия. 342
Изучена кинетическая и термодинамическая кислотность гидридных лигандов в [Rh 13 H 3 (CO) 24 ] 2- ( 258 ). 343 Значения p K a для депротонирования первого и второго гидридов внедрения в ( 258 ) составляют 11 и 16,5 в ацетонитриле. Ранее для более мелких полиядерных комплексов было показано, что в комплексах, в которых отщепление мостикового гидридного лиганда (депротонирование) дает делокализованные анионы, наблюдаются большие кинетические барьеры из-за структурных изменений, сопровождающих делокализацию нового отрицательного заряда на комплексе.Тригидрид Rh 13 также следует этой схеме, поскольку депротонирование ( 258 ) на семь порядков медленнее, чем депротонирование H 2 Fe (CO) 4 , которое имеет ap K a аналогично ( 258 ).
Что такое валентность или валентность в химии?
Слова валентность и валентность имеют в химии два связанных значения.
Валентность описывает, насколько легко атом или радикал могут соединяться с другими химическими соединениями.Это определяется на основе количества электронов, которые будут добавлены, потеряны или разделены, если он вступит в реакцию с другими атомами.
Валентность обозначается с использованием положительного или отрицательного целого числа, используемого для представления этой связывающей способности. Например, обычные валентности меди — 1 и 2.
| Номер | Элемент | Валентность |
| 1 | Водород | (-1), +1 |
| 2 | Гелий | 0 |
| 3 | Литий | +1 |
| 4 | Бериллий | +2 |
| 5 | Бор | -3, +3 |
| 6 | Карбон | (+2), +4 |
| 7 | Азот | -3, -2, -1, (+1), +2, +3, +4, +5 |
| 8 | Кислород | -2 |
| 9 | Фтор | -1, (+1) |
| 10 | Неон | 0 |
| 11 | Натрий | +1 |
| 12 | Магний | +2 |
| 13 | Алюминий | +3 |
| 14 | Кремний | -4, (+2), +4 |
| 15 | Фосфор | -3, +1, +3, +5 |
| 16 | Сера | -2, +2, +4, +6 |
| 17 | Хлор | -1, +1, (+2), +3, (+4), +5, +7 |
| 18 | Аргон | 0 |
| 19 | Калий | +1 |
| 20 | Кальций | +2 |
| 21 | Скандий | +3 |
| 22 | Титан | +2, +3, +4 |
| 23 | Ванадий | +2, +3, +4, +5 |
| 24 | Хром | +2, +3, +6 |
| 25 | Марганец | +2, (+3), +4, (+6), +7 |
| 26 | Утюг | +2, +3, (+4), (+6) |
| 27 | Кобальт | +2, +3, (+4) |
| 28 | Никель | (+1), +2, (+3), (+4) |
| 29 | Медь | +1, +2, (+3) |
| 30 | Цинк | +2 |
| 31 | Галлий | (+2).+3 |
| 32 | Германий | -4, +2, +4 |
| 33 | Мышьяк | -3, (+2), +3, +5 |
| 34 | Селен | -2, (+2), +4, +6 |
| 35 | Бром | -1, +1, (+3), (+4), +5 |
| 36 | Криптон | 0 |
| 37 | Рубидий | +1 |
| 38 | Стронций | +2 |
| 39 | Иттрий | +3 |
| 40 | Цирконий | (+2), (+3), +4 |
| 41 | Ниобий | (+2), +3, (+4), +5 |
| 42 | Молибден | (+2), +3, (+4), (+5), +6 |
| 43 | Технеций | +6 |
| 44 | Рутений | (+2), +3, +4, (+6), (+7), +8 |
| 45 | Родий | (+2), (+3), +4, (+6) |
| 46 | Палладий | +2, +4, (+6) |
| 47 | Серебро | +1, (+2), (+3) |
| 48 | Кадмий | (+1), +2 |
| 49 | Индий | (+1), (+2), +3 |
| 50 | Олово | +2, +4 |
| 51 | Сурьма | -3, +3, (+4), +5 |
| 52 | Теллур | -2, (+2), +4, +6 |
| 53 | Йод | -1, +1, (+3), (+4), +5, +7 |
| 54 | Ксенон | 0 |
| 55 | Цезий | +1 |
| 56 | Барий | +2 |
| 57 | Лантан | +3 |
| 58 | Церий | +3, +4 |
| 59 | Празеодим | +3 |
| 60 | Неодим | +3, +4 |
| 61 | Прометий | +3 |
| 62 | Самарий | (+2), +3 |
| 63 | Европий | (+2), +3 |
| 64 | Гадолиний | +3 |
| 65 | Тербий | +3, +4 |
| 66 | Диспрозий | +3 |
| 67 | Гольмий | +3 |
| 68 | Эрбий | +3 |
| 69 | Тулий | (+2), +3 |
| 70 | Иттербий | (+2), +3 |
| 71 | Лютеций | +3 |
| 72 | Гафний | +4 |
| 73 | Тантал | (+3), (+4), +5 |
| 74 | Вольфрам | (+2), (+3), (+4), (+5), +6 |
| 75 | Рений | (-1), (+1), +2, (+3), +4, (+5), +6, +7 |
| 76 | Осмий | (+2), +3, +4, +6, +8 |
| 77 | Иридий | (+1), (+2), +3, +4, +6 |
| 78 | Платина | (+1), +2, (+3), +4, +6 |
| 79 | Золото | +1, (+2), +3 |
| 80 | Меркурий | +1, +2 |
| 81 | Таллий | +1, (+2), +3 |
| 82 | Свинец | +2, +4 |
| 83 | Висмут | (-3), (+2), +3, (+4), (+5) |
| 84 | Полоний | (-2), +2, +4, (+6) |
| 85 | Астатин | ? |
| 86 | Радон | 0 |
| 87 | Франций | ? |
| 88 | Радий | +2 |
| 89 | Актиний | +3 |
| 90 | Торий | +4 |
| 91 | Протактиний | +5 |
| 92 | Уран | (+2), +3, +4, (+5), +6 |
Фактов о родии, Символ, Открытие, Свойства, Использование
Что такое родий
Родий (произношение RO-dee-em [2] ), представленный химическим символом Rh [1] , представляет собой драгоценный, высокоотражающий, коррозионно-стойкий металл [1, 5] , принадлежащий к семейству платин. [3] . Встречающийся в природе родий имеет единственный стабильный изотоп с массовым числом 103 [1, 3] . Он реагирует с кислородом при очень высоких температурах и галогенами, но инертен по отношению к воде и кислотам [12] .
Родиевый символ
Где это находится
Редчайший из всех нерадиоактивных металлов в несвязанном виде можно найти в природе в речных песках Северной и Южной Америки. Он также присутствует в сульфидных медно-никелевых рудах Онтарио, Канада. В промышленных масштабах его получают как побочный продукт рафинирования никеля и меди [1] .
Украшения с родиевым покрытием
Изображение предоставлено: Calla Gold
История
Происхождение его названия: Название металла происходит от греческого слова rhodon, означающего розовый цвет, цвет его солей [1, 5] .
Кто это открыл: Английский физик и химик Уильям Хайд Волластон [1, 5] .
Когда был открыт родий: Год его открытия 1803 [1] .
Родиевые монеты
Как это было обнаружено
Элемент был открыт в результате сотрудничества Волластона и английского химика Смитсона Теннанта в рамках коммерческого предприятия по синтезу чистой платины для продажи. Первый шаг заключался в растворении обычной платины в царской водке (растворе азотной и соляной кислот). Он не растворился полностью и оставил после себя черный осадок, который позже был разделен Теннантом на осмий и иридий.Волластон взял раствор, содержащий растворенную платину, и отделил от него платину и палладий осаждением. Затем ему оставили красный раствор, из которого он получил кристаллы розово-красного цвета. Он обнаружил, что это хлорид родия натрия, который в конечном итоге был использован для получения образца самого металла [1] .
Родиевая цепь
Идентификация родия | |||
| Атомный номер | 45 [1] | ||
| Номер CAS | 7440-16-6 [1] | ||
| Позиция в таблице Менделеева | Группа | Период | Блок |
| 9 [1] | 5 [1] | d [1] | |
Расположение родия в Периодической таблице
Свойства и характеристики родия
Общая недвижимость | ||
| Атомная масса | 102.906 атомных единиц массы [1] | |
| Атомный вес | 102,906 [1] | |
| Молярная масса | 102, | 0 ± 0,000020 г / моль [19] |
Физические свойства | ||
| Цвет / внешний вид | Серебристо-белый [1] | |
| Люстра | Металлик [3] | |
| Точка плавления / замерзания | 1963 0 C, 3565 0 F [1] | |
| Температура кипения | 3695 0 C, 6683 0 F [1] | |
| Плотность | 12.4 г см -3 [1] | |
| Состояние вещества при комнатной температуре (нормальная фаза) | Цельный [1] | |
| Твердость | 6 (шкала Мооса) [16] | |
| Электропроводность | Хорошо [1] | |
Магнитные свойства | ||
| Магнитный заказ | Парамагнитный [15] | |
| Магнитная восприимчивость | +102/10 −6 см 3 / моль -1 [15] | |
Химические свойства | ||
| Воспламеняемость | Есть [10] | |
| Степени окисления | +3 [2] | |
Атомные данные родия (элемент 45)
| Валентные электроны | 1 [3] | ||||||
| Квантовые числа | |||||||
| — н. | 4 [11] | ||||||
| – | 2 [11] | ||||||
| — м ℓ | 0 [11] | ||||||
| — м с | -½ [11] | ||||||
| Электронная конфигурация (конфигурация благородного газа) | [Kr] 4d 8 5s 1 [1] | ||||||
| Кристаллическая структура | куб.см (плотно упакованный куб) [14] | ||||||
| Постоянная решетки | 380.34, 380.34, 380.34 pm [18] | ||||||
| Атомная структура | |||||||
| — Количество электронов | 45 [3] | ||||||
| — Количество нейтронов | 58 [3] | ||||||
| — Число протонов | 45 [3] | ||||||
| Уровни энергии [3] | |||||||
| — Первый уровень энергии | 2 | ||||||
| — Второй энергетический уровень | 8 | ||||||
| — Третий энергетический уровень | 18 | ||||||
| — Четвертый уровень энергии | 16 | ||||||
| — Пятый энергетический уровень | 1 | ||||||
| Радиус атома | |||||||
| — Атомный радиус | 2.10 Å [1] | ||||||
| — Ковалентный радиус | 1,34 Å [1] | ||||||
| Ионный заряд | +3 [13] | ||||||
| K энергия связи оболочки | 23,22 кэВ [17] | ||||||
| Энергия ионизации (кДжмоль -1 ) [1] | 1-й | 2-я | 3-й | 4-я | 5-й | 6-я | 7-й |
| 719.675 | 1744,45 | 2996,83 | – | – | – | – | |
Родиевая электронная конфигурация (модель Бора)
Используется родий
- Его основное применение — каталитические нейтрализаторы автомобилей, где он восстанавливает оксиды азота в выхлопных газах [1] .
- Используется в качестве катализатора в химической промышленности для получения азотной кислоты, уксусной кислоты и в реакциях гидрирования [1] .В некоторых случаях его легируют платиной в виде сетки, г. при производстве азотной кислоты по процессу Габера [9] .
- Родиевое гальваническое покрытие, также известное как родиевое окунание или родиевое покрытие [7] , на ювелирных изделиях (стерлинговое серебро, белое / желтое золото, латунь) защищает их поверхности от царапин и потускнения, является гипоаллергенным [7] и придает им белый, светоотражающий [4] . Тем не менее, глубокая металлическая отделка украшений с черным родиевым покрытием также популярна. [6] .
- Используется для покрытия оптических волокон и оптических зеркал [1] , а также находит применение в проводах термопар (наряду с платиной).
Родиевый слиток
Это опасно
Родий при использовании в промышленных целях может представлять опасность для здоровья, поскольку его соединения токсичны и канцерогены. Следовательно, с ним нужно обращаться осторожно. То же самое и с родиевой пылью, поскольку она легко воспламеняется. Однако носить украшения с родиевым покрытием безопасно, поскольку это предотвращает раздражение кожи [8] .
Родий
Интересные факты
- Ежегодное производство металла в мире составляет всего около 30 тонн в год [1] .
Кольцо с черным родием
Родий (Rh Element) Цена
Хотя его цена колеблется, чистый родий обычно стоит около 13 000 долларов за 100 грамм, в то время как родий оптом стоит 7 000 долларов за каждые 100 грамм. Редкость металла делает его таким дорогим [3] .
Список литературы
- http: // www.rsc.org/periodic-table/element/45/rhodium
- https://education.jlab.org/itselemental/ele045.html
- https://www.chemicool.com/elements/rhodium.html
- https://www.sarraf.com/pages/rhodium-plating.html
- https://www.livescience.com/36988-rhodium.html
- https://www.reuters.com/article/us-platinum-week-jewellery/jewelers-back-to-black-with-rhodium-ruthenium-idUSKBN0O51UG20150521
- http://www.jewelrywise.com/jewelry-101/make-it-last/rhodium-plating
- https: // здраво.ru / rhodium-dangerous-health-used-jewelry-8745645.html
- https://www.alfa.com/ru/catalog/012217/
- http://www.elementsdatabase.com/Rhodium-Rh-45-element/
- http://chemistry-reference.com/q_elements.asp?Symbol=Rh&language=en
- https://www.webelements.com/rhodium/chemistry.html
- http://www.sciencegeek.net/Chemistry/chempdfs/CommonIons.pdf
- https://www.webelements.com/rhodium/crystal_structure.html
- https: // web.archive.org/web/20110303222309/http://www-d0.fnal.gov/hardware/cal/lvps_info/engineering/elementmagn.pdf
- http://www.jewelrynotes.com/the-mohs-scale-of-hardness-for-metals-why-it-is-important/
- http://www.sprawls.org/resources/MAMMO/module.htm
- http://periodictable.com/Properties/A/LatticeConstants.html
- https://www.webqc.org/molecular-weight-of-rhodium.html
Наблюдение таутомерного перехода валентности с большой амплитудой, связанного с тепловыми колебаниями, в проводящем одномерном родий-диоксоленовом комплексе
.2021, 10 февраля; 27 (9): 3074-3084.
DOI: 10.1002 / chem.202004217.
Epub 2021 7 января.
Принадлежности
Расширять
Принадлежности
- 1 Химический факультет Научного университета Окаяма, 1-1 Ridai-cho, Kita-ku, Okayama, 700-0005, Япония.
- 2 Департамент материаловедения, Высшая школа материаловедения, Университет Хиого, 3-2-1 Коото, Камигори-тё, Ако-гун, Хиого, 678-1297, Япония.
- 3 Департамент материаловедения, Высшая школа инженерных наук, Университет Осаки, 1-3 Мачиканэяма, Тойонака, Осака, 560-8531, Япония.
- 4 Исследовательский центр тепловых и энтропийных наук, Высшая школа наук, Университет Осаки, 1-1 Мачиканэяма, Тойонака, Осака, 560-0043, Япония.
- 5 Химический факультет Высшей школы естественных наук Университета Осаки, 1-1 Мачиканэяма, Тойонака, Осака, 560-0043, Япония.
- 6 Научно-исследовательский институт естественных наук, Научный университет Окаямы, 1-1 Ридай-тё, Кита-ку, Окаяма, 700-0005, Япония.
Элемент в буфере обмена
Минору Мицуми и др.Химия.
.
Показать детали
Показать варианты
Показать варианты
Формат
АннотацияPubMedPMID
.2021, 10 февраля; 27 (9): 3074-3084.
DOI: 10.1002 / chem.202004217.
Epub 2021 7 января.
Принадлежности
- 1 Химический факультет Научного университета Окаяма, 1-1 Ridai-cho, Kita-ku, Okayama, 700-0005, Япония.
- 2 Департамент материаловедения, Высшая школа материаловедения, Университет Хиого, 3-2-1 Коото, Камигори-тё, Ако-гун, Хиого, 678-1297, Япония.
- 3 Департамент материаловедения, Высшая школа инженерных наук, Университет Осаки, 1-3 Мачиканэяма, Тойонака, Осака, 560-8531, Япония.
- 4 Исследовательский центр тепловых и энтропийных наук, Высшая школа наук, Университет Осаки, 1-1 Мачиканэяма, Тойонака, Осака, 560-0043, Япония.
- 5 Химический факультет Высшей школы естественных наук Университета Осаки, 1-1 Мачиканэяма, Тойонака, Осака, 560-0043, Япония.
- 6 Научно-исследовательский институт естественных наук, Научный университет Окаямы, 1-1 Ридай-тё, Кита-ку, Окаяма, 700-0005, Япония.
Элемент в буфере обмена
Полнотекстовые ссылки
Опции CiteDisplay
Показать варианты
Формат
АннотацияPubMedPMID
Абстрактный
Исследование динамических молекулярных кристаллов — увлекательная тема для материаловедов из-за их фундаментальной науки и потенциального применения в молекулярных устройствах.Здесь сообщается об одномерном (1D) родий-диоксоленовом комплексе, который проявляет резкие изменения свойств при фазовом переходе. Рентгеновская фотоэлектронная спектроскопия (XPS) показала, что фаза при комнатной температуре (RT) находится в состоянии смешанной валентности, и, следовательно, резкие изменения происходят из состояния смешанной валентности, возникающего в фазе RT. Другой примечательной особенностью является то, что среднеквадратичные смещения атомов родия вдоль одномерной цепочки резко увеличиваются в фазе RT, что указывает на колебание большой амплитуды связей Rh-Rh.На основе этих результатов был предложен возможный механизм возникновения состояния смешанной валентности в RT-фазе, основанный на тепловом переносе электронов с одномерной d-полосы на семихинонатную π * -орбиталь в сочетании с колебанием большой амплитуды Rh -Rh облигации.
Ключевые слова:
проводящие материалы; вибрация большой амплитуды; смешанно-валентные соединения; валентная таутомерия; вибронные взаимодействия.
© 2020 Wiley-VCH GmbH.
Похожие статьи
Бистабильная многофункциональность и переключаемая сильная ферромагнитно-антиферромагнитная связь в одномерном родиевом (I) -семихинонатном комплексе.
Мицуми М., Нишитани Т., Ямасаки С., Шимада Н., Комацу Ю., Торими К., Китагава Ю., Окумура М., Миядзаки Ю., Горска Н., Инаба А., Канда А., Ханасаки Н.Мицуми М. и др.
J Am Chem Soc. 2014 14 мая; 136 (19): 7026-37. DOI: 10.1021 / ja5017014. Epub 2014 2 мая.
J Am Chem Soc. 2014 г.PMID: 24749985
Многофункциональный одномерный родий (I) -семихинонатный комплекс: влияние заместителей на кристаллические структуры и твердотельные свойства.
Мицуми М., Отаке С., Какуно Ю., Комацу Ю., Одзава Ю., Торими К., Ясуда Н., Адзума Н., Миядзаки Ю.Мицуми М. и др.
Inorg Chem. 2014 3 ноября; 53 (21): 11710-20. DOI: 10.1021 / ic5019532. Epub 2014 21 октября.
Inorg Chem. 2014 г.PMID: 25330817
Валентный таутомерный переход комплекса бис (о-диоксолен) кобальта в твердом состоянии и растворе.
Гуда А.А., Чегерев М, Стариков А.Г., Власенко В.Г., Золотухин А.А., Бубнов М.П., Черкасов В.К., Шаповалов В.В., Русалев Ю.В., Терещенко А.А., Тригуб А.Л., Чернышев А.В., Солдатов А.В.Гуда А.А. и др.
J Phys Condens Matter. 2021 г. 3 мая; 33 (21). DOI: 10.1088 / 1361-648X / abe650.
J Phys Condens Matter. 2021 г.PMID: 33588394
Валентно-таутомерное взаимодействие в комплексе бис (диоксолен) кобальта с иминопиридином, функционализированным фрагментом ТЕМПО. Фазовый переход в сочетании с разрушением монокристалла.
Золотухин А.А., Бубнов М.П., Арапова А.В., Фукин Г.К., Румянцев Р.В., Богомяков А.С., Князев А.В., Черкасов В.К.Золотухин А.А. и др.
Inorg Chem. 2017 г. 18 декабря; 56 (24): 14751-14754. DOI: 10.1021 / acs.inorgchem.7b02597. Epub 2017 29 ноя.
Inorg Chem. 2017 г.PMID: 2
22
Реальная и гипотетическая промежуточная валентность Ag II / Ag III и Ag II / Ag I Фторидные системы как потенциальные сверхпроводники.
Грохала В., Хоффманн Р.Grochala W, et al.
Angew Chem Int Ed Engl. 2001 3 августа; 40 (15): 2742-2781. DOI: 10.1002 / 1521-3773 (20010803) 40: 153.0.CO; 2-X.
Angew Chem Int Ed Engl. 2001 г.PMID: 29711991
Рассмотрение.
Рекомендации
Никто
Z.S. Yao, Z. Tang, J. Tao, Chem. Commun. 2020, 56, 2071–2086;
Ю.-С. Мэн, Т. Лю, акк. Chem. Res. 2019, 52, 1369–1379;
Х. Феррандо-Сориа, Х. Вальехо, М. Кастеллано, Х. Мартинес-Лилло, Э. Пардо, Х. Кано, И. Кастро, Ф. Льорет, Р. Руис-Гарсия, М. Джульве, Coord. Chem. Ред.2017, 339, 17-103;
О. Сато, Нат. Chem. 2016, 8, 644-656;
Показать все 101 упоминание
LinkOut — дополнительные ресурсы
Источники полных текстов
Источники другой литературы
Материалы исследований
Разное
.


 +3
+3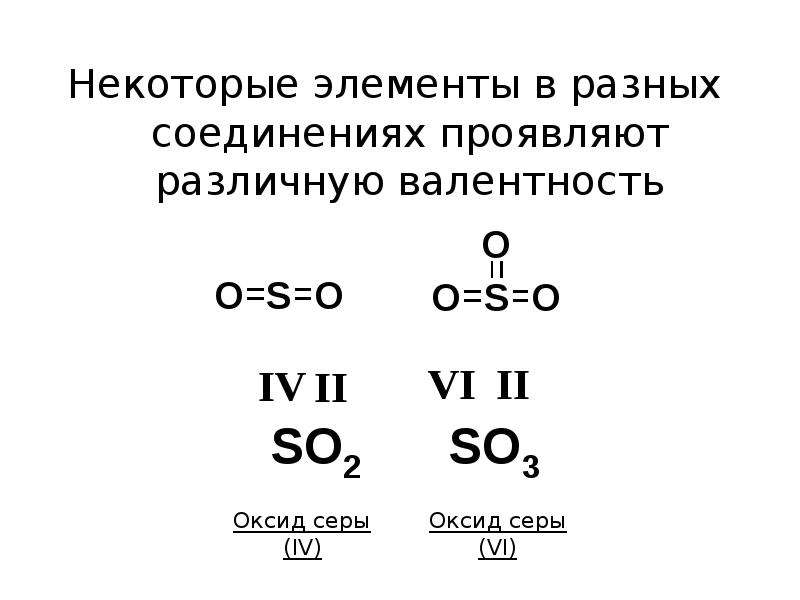
 Растворимость. Смеси.
Растворимость. Смеси.