Содержание
Кислоти — Дистанційне вивчення хімії
Опанувавши матеріал, ви зможете:
• розрізняти фізичні властивості кислот;
• визначати зміну забарвлення індикаторів у кислому середовищі;
• характеризувати хімічні властивості кислот;
• наводити приклади рівнянь реакцій, що характеризують хімічні властивості кислот;
• прогнозувати перебіг реакцій взаємодії кислот з металами;
• досліджувати хімічні властивості кислот.
Кислоти — це складні речовини, які складаються з атомів Гідрогену, здатних заміщуватися на атоми метали, та кислотних залишків.
Назви кислотних залишків відповідають назвам кислот, якщо забрати закінчення -на.
Назви кислот та кислотних залишків
Виконайте інтерактивну вправу Тренажер «Назви кислот»
Кислоти класифікують за: вмістом атомів Гідрогену (одноосновні, двоосновні. триосновні)та за вмістом Оксигену (оксигеновмісні й безоксигенові).
Фізичні властивості кислот.
За агрегатним станом:
Всі кислоти добре розчиняються у воді, крім H2SiO3
Деякі з них, як-от хлоридна, сульфатна, нітратна, є токсичними й небезпечними для життя і функціонування живих організмів.
 Вони роз’їдають органічні речовини, спричиняють опіки.
Вони роз’їдають органічні речовини, спричиняють опіки.
Під час роботи з кислотами необхідно дотримуватися правил техніки безпеки!
| Хлоридна кислота | HCl | Хлоридна кислота це водний розчин гідроген хлориду. Прозора рідина, іцо на повітрі «димить». У концентрованому розчині цієї кислоти масова частка гідроген хлориду становить 36 40 %. Важча за воду. Має характерний різкий запах. Вдихання парів концентрованої хлоридної кислоти викликає подразнення й опіки дихальних шляхів. Під час роботи з хлоридною кислотою потрібно дотримуватися правил техніки безпеки. У лабораторії хлоридну кислоту добувають розчиненням гідроген хлориду у воді. Гідроген хлорид (хлороводень — традиційна назва) добувають шляхом взаємодії натрій хлориду (NaCI) з концентрованою сульфатною кислотою за нагрівання. |
| Сульфатна кислота | H2SO4 | Сульфатна кислота безбарвна рідина, нелетка, в’язка. Густина 1,84 г/см3. Під час розчинення у воді сильно розігрівається, аж до закипання розчину, що. Густина 1,84 г/см3. Під час розчинення у воді сильно розігрівається, аж до закипання розчину, що.V свою чергу, спричиняє його розбризгу-ваппя. Щоб уникнути цього, потрібно кислоту вливати у воду, а не навпаки. Характерною властивістю концентрованої сульфатної кислоти є здатність легко вбирати вологу (гігроскопічність). Цю властивість часто застосовують у промисловості для осушення газів. |
| Нітратна кислота | HNO3 | Нітратна кислота безбарвна рідина з різким, задушливим запахом, летка. Концентрована має жовте забарвлення, якого набуває за рахунок розчинення в ній нітроген(IV) оксиду. Масова частка кислоти в концентрованому розчині досягає 98 %. Руйнує білок. За потрапляння па шкіру спричиняє пожовтіння, опіки. |
| Ортофосфатна кислота | H3PO4 | Ортофосфатна кислота безбарвна, тверда, кристалічна речовина. Добре розчинна у воді, важча за воду. За темперетури вище 40 0C перетворюється па в’язку безбарвну рідину. На відміну від інших кислот не отруйна. На відміну від інших кислот не отруйна. |
Хімічні властивості кислот
1. Зміна забарвлення індикаторів.
Віртуальний лабораторний дослід 2. ДІЯ РОЗЧИНІВ КИСЛОТ НА ІНДИКАТОРИ
Досліджуємо, як діють кислоти па індикатори. Зверніть увагу, чи всі індикатори можна використовувати для виявлення кислот у розчинах.
Відео YouTube
Фенолфталеїн не змінює забарвлення в кислому середовищі. Усі інші індикатори (лакмус, метиловий оранжевий, універсальний індикаторний напір) набувають червоного забарвлення різних відтінків.
2. Взаємодія кислот з металами.
Спільною властивістю кислот є їх взаємодія з металами. Якщо до порошку магнію долити хлоридної кислоти, відбувається характерне «закипання» суміші через інтенсивне виділення газу водню, що витіснився магнієм з кислоти.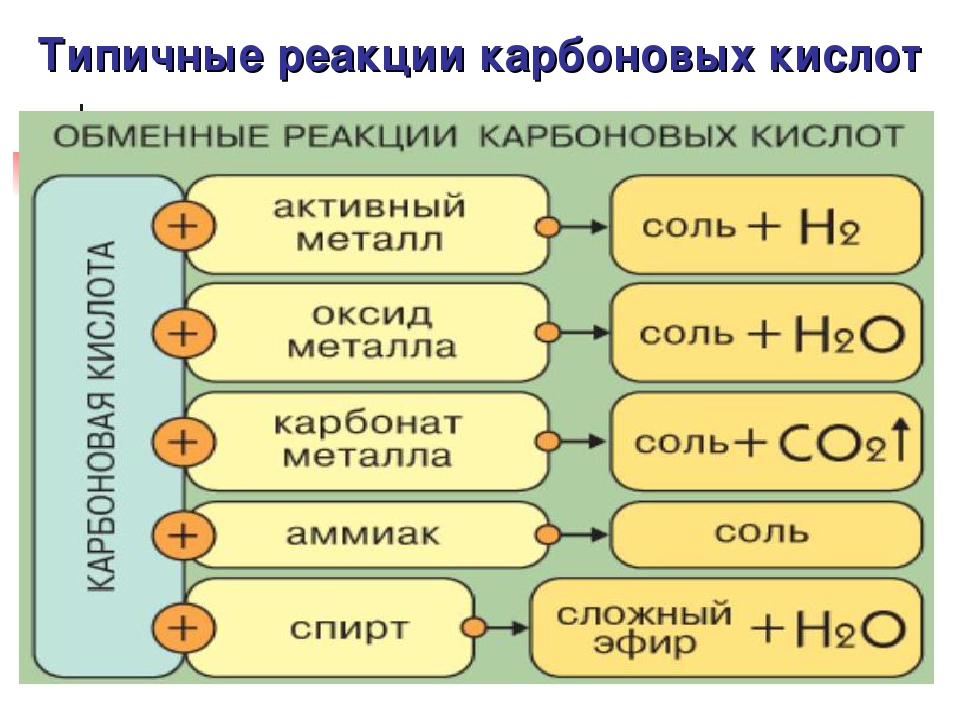 Рівняння реакції:
Рівняння реакції:
Аналогічно виділення водню спостерігається, якщо до гранул цинку долити розчину сульфатної кислоти (рис. 69):
- Реакції заміщення — це реакції, що відбуваються між простою і складною речовинами, унаслідок чого атоми простої речовини заміщають атоми в складній.
Віртуальний лабораторний дослід З. ВЗАЄМОДІЯ ХЛОРИДНОЇ КИСЛОТИ З МЕТАЛАМИ
Досліджуємо, як взаємодіє хлоридна кислота з металами.
Відео YouTube
Це дослідження показує, що хімічна активність металів є неоднаковою. Одні метали проявляють більшу, інші меншу активність під час хімічних перетворень.
На основі експериментальних досліджень російський учений М. Бекетов розмістив метали у внтискувальиий ряд металів.
Виявлено, що метали, розташовані в ряді до водню, мають здатність витискувати його з кислот, утворюючи просту речовину водень (виняток нітратна кислота). П’ять металів, які розміщені після водню, з розчинами кислот не реагують. Кожний наступний метал у ряді є менш хімічно активний, ніж попередній. Самі ж метали заміщають атоми Гідрогену в кислоті. Такий тин реакцій називають реакціями заміщення.
П’ять металів, які розміщені після водню, з розчинами кислот не реагують. Кожний наступний метал у ряді є менш хімічно активний, ніж попередній. Самі ж метали заміщають атоми Гідрогену в кислоті. Такий тин реакцій називають реакціями заміщення.
Реакції заміщення це реакції, що відбуваються між простою та складною речовинами, унаслідок чого атоми простої речовини заміщають атоми в складній.
Окрім водню, під час реакції утворюється сіль відповідного металу.
3. Взаємодія кислот з основними оксидами.
Відеодемонстрація
Відео YouTube
Як приклади таких хімічних перетворень можна навести рівняння реакцій:
Реакції обміну — це реакції між двома складними речовинами, під час яких вони обмінюються складовими частинами.
4. Взаємодія кислот з основами
Взаємодія кислот з основами
Кислоти взаємодіють з основами, при цьому утворюється сіль та вода.
Взаємодія кислот з оновами з утворенням солі та води називається реакцією нейтралізації.
Реакція нейтралізації належить до реакції обміну.
Відео YouTube
NaOH+HCl=NaCl+H20
Відео YouTube
Cu(OH)2+ H2SO4 = CuSO4+ H2O
Приклади реакцій нейтралізації:
Са(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)2 +6H2O
5. Взаємодія кислот з солями
Взаємодія кислот з солями
Кислотам властиво взаємодіяти з розчинами солей. Реакції між ними відбуваються за умови, якщо спостерігається:
а) випадання осаду;
б) виділення газу;
в) одним із продуктів реакції є вода.
Розглянемо приклад цієї реакції за допомогою відеодемонстраційного досліду.
Відео YouTube
CaCO3 + 2HCl = CaCl2 + H2O +CO2
При взаємодії солей із кислотами більш сильні кислоти витісняють менш сильні кислоти із розчинів їх солей. Витискувальний ряд кислот зображено на рисунку.
Наприклад,
K2S + 2HCl = 2KCl + H2S
Na2SO3 + H2SO4 = Na2SO4 +H2O + SO2
Виконай інтерактивну вправу Витискувальний ряд кислот
ПІДСУМОВУЄМО ВИВЧEНE
- Кислоти за нормальних умов є рідинами або твердими речовинами.
 Важчі за воду, безбарвні. Добре розчиняються у воді. Водні розчини — кислі на смак, роз’їдають органічні речовини.
Важчі за воду, безбарвні. Добре розчиняються у воді. Водні розчини — кислі на смак, роз’їдають органічні речовини. - Кислоти змінюють забарвлення індикаторів: лакмусу — на червоний, метилового оранжевого — на рожевий, універсальний індикаторний папір — на червоний.
- Кислоти (за винятком нітратної) взаємодіють з металами, що у витискувальному ряді розташовані до водню. Продуктами реакцій є сіль відповідного металу та водень.
- Реакції заміщення — це реакції, що відбуваються між простою і складною речовинами, унаслідок чого атоми простої речовини заміщають атоми в складній.
- Кислоти взаємодіють з оснбвними оксидами з утворенням солі та води.
- Реакції обміну — це реакції між двома складними речовинами, під час яких вони обмінюються складовими частинами.
- Кислоти взаємодіють з основами, в результаті реакції утворюється сіль та вода.
- Реакція нейтралізації — це взаємодія кислот з оновами з утворенням солі та води.
- Кислоти взаємодіють з солями за умови, якщо спостерігається: а) випадання осаду; б) виділення газу; в) одним із продуктів реакції є вода.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
Кислоти
Кислоти
Це матеріал з підручника Хімія 8 клас Савчин
Хімічні властивості кислот — урок. Хімія, 9 клас.
Кислоти мають наступні хімічні властивості:
змінюють колір індикаторів;
реагують з металами;
реагують з основними і амфотерними оксидами;
реагують з основами і амфотерними гідроксидами;
реагують з солями;
деякі кислоти легко розкладаються.
Кислоти мають цілу низку загальних хімічних властивостей.
1. Дія кислот на індикатори
Водні розчини кислот змінюють забарвлення індикаторів.
У кислому середовищі фіолетовий лакмус, метилоранж і універсальний індикатор стають червоними.
Забарвлення деяких індикаторів в різних середовищах
2. Взаємодія кислот з металами
Взаємодія кислот з металами
Кислоти взаємодіють з металами, що стоять в ряду активності металів лівіше водню. В результаті реакції утворюється сіль і виділяється водень.
Можна сказати, що метали, розташовані в ряду активності лівіше, витісняють атоми Гідрогену з кислот.
Наприклад, при взаємодії цинку з сульфатною кислотою утворюється цинк сульфат і виділяється водень:
Zn+h3SO4=ZnSO4+h3↑.
Зверни увагу!
Нітратна кислота і концентрована сульфатна кислота з металами взаємодіє інакше (сіль утворюється, але водень при цьому не виділяється).
3. Взаємодія кислот з основними і амфотерними оксидами
Кислоти реагують з основними і амфотерними оксидами. У результаті реакції утворюється сіль і вода.
Наприклад, при взаємодії основного кальцій оксиду з нітратною кислотою утворюється сіль кальцій нітрат, а при взаємодії амфотерного алюміній оксиду з сульфатною кислотою утворюється сіль алюміній сульфат:
CaO+2HNO3=Ca(NO3)2+h3O;Al2O3+3h3SO4=Al2(SO4)3+3h3O.
4. Взаємодія кислот з основами і з амфотерними гідроксидами
Кислоти реагують з основами і з амфотерними гідроксидами, утворюючи сіль і воду.
Так само, як і в попередньому прикладі, при взаємодії натрій гідроксиду і алюміній гідроксиду з кислотами утворюються відповідні солі:
NaOH+HNO3=NaNO3+h3O;Al(OH)3+3HCl=AlCl3+3h3O.
Реакції між кислотами і основами називають реакціями нейтралізації.
5. Взаємодія кислот з солями
Реакції між кислотами і солями можливі, якщо в результаті утворюється практично нерозчинна у воді речовина (випадає осад) або утворюється летка речовина (газ).
- Кислоти реагують з розчинами солей, якщо в результаті реакції один з продуктів випадає в осад.
Наприклад, при взаємодії розчину сульфатної кислоти з розчином кальцій хлориду в осад випадає кальцій сульфат, а при взаємодії розчину калій силікату з розчином нітратної кислоти в осад випадає силікатна кислота:
h3SO4+CaCl2=CaSO4↓+2HCl;K2SiO3+2HNO3=h3SiO3↓+2KNO3.
- Продукт реакції при звичайних умовах, або при нагріванні випаровується.
Наприклад, при дії хлоридної кислоти на ферум(\(II\)) сульфід виділяється газ гідроген сульфід:
FeS+2HCl=FeCl2+h3S↑.
Якщо кислота, яка вступає в реакцію, є сильнішою, за ту кислоту, що утворюється.
Наприклад, хлоридна кислота може витіснити карбонатну з її солі:
2HCl+CaCO3→CaCl2+h3O+CO2↑⏟h3CO3
Для того, щоб винести судження про можливість протікання реакції, можна скористатися витискувальним рядом кислот:
HNO3h3SO4HClh3SO3h3CO3h3Sh3SiO3→h4PO4
У цьому ряду кислота, що знаходиться лівіше, може витіснити з солі кислоту, що знаходиться правіше.
6. Розклад оксигеновмісних кислот
При розкладанні кислот утворюється кислотний оксид і вода. Карбонатна кислота розкладається при звичайних умовах, а сульфітна і силікатна кислоти — при невеликому нагріванні:
Карбонатна кислота розкладається при звичайних умовах, а сульфітна і силікатна кислоти — при невеликому нагріванні:
h3CO3⇄h3O+CO2↑;h3SO3⇌toh3O+SO2↑;h3SiO3⟶toh3O+SiO2.
Хімічні властивості кислот — урок. Хімія, 8 клас.
Кислоти мають цілу низку загальних хімічних властивостей.
1. Дія кислот на індикатори
Водні розчини кислот змінюють забарвлення індикаторів.
У кислому середовищі фіолетовий лакмус, метилоранж і універсальний індикатор стають червоними.
Забарвлення деяких індикаторів в різних середовищах
2. Взаємодія кислот з металами
Кислоти взаємодіють з металами, що стоять в ряду активності металів лівіше водню. В результаті реакції утворюється сіль і виділяється водень.
Можна сказати, що метали, розташовані в ряду активності лівіше, витісняють атоми Гідрогену з кислот.
Наприклад, при взаємодії магнію з хлоридною кислотою утворюється магній хлорид і виділяється водень:
Mg+2HCl=MgCl2+h3↑.
Зверни увагу!
Нітратна кислота і концентрована сульфатна кислота з металами взаємодіє інакше (сіль утворюється, але водень при цьому не виділяється).
3. Взаємодія кислот з основними і амфотерними оксидами
Кислоти реагують з основними і амфотерними оксидами. У результаті реакції утворюється сіль і вода.
Наприклад, при взаємодії основного калій оксиду з нітратною кислотою утворюється сіль калій нітрат, а при взаємодії амфотерного алюміній оксиду з хлоридною кислотою утворюється сіль алюміній хлорид:
K2O+2HNO3=2KNO3+h3O;Al2O3+6HCl=2AlCl3+3h3O.
4. Взаємодія кислот з основами і з амфотерними гідроксидами
Кислоти реагують з основами і з амфотерними гідроксидами, утворюючи сіль і воду.
Так само, як і в попередньому прикладі, при взаємодії калій гідроксиду і алюміній гідроксиду з кислотами утворюються відповідні солі:
KOH+HNO3→KNO3+h3O;Al(OH)3+3HCl→AlCl3+3h3O.
Реакції між кислотами і основами називають реакціями нейтралізації.
5. Взаємодія кислот з солями
Реакції між кислотами і солями можливі, якщо в результаті утворюється практично нерозчинна у воді речовина (випадає осад) або утворюється летка речовина (газ).
- Кислоти реагують з розчинами солей, якщо в результаті реакції один з продуктів випадає в осад.
Наприклад, при взаємодії розчину сульфатної кислоти з розчином барій хлориду в осад випадає барій сульфат, а при взаємодії розчину натрій силікату з розчином нітратної кислоти в осад випадає силікатна кислота:
h3SO4+BaCl2=BaSO4↓+2HCl;Na2SiO3+2HNO3=h3SiO3↓+2NaNO3.
- Продукт реакції при звичайних умовах, або при нагріванні випаровується.
Наприклад, при дії концентрованої сульфатної кислоти на кристалічний натрій хлорид, утворюється газоподібний гідроген хлорид, а при дії хлоридної кислоти на ферум(\(II\)) сульфід виділяється газ гідроген сульфід:
NaCl(т.р.)+h3SO4(конц.)=Na2SO4+2HCl↑;FeS+2HCl=FeCl2+h3S↑.
Примітка. Скорочення (т.р.) Означає «тверда речовина», а (конц.) — «концентрований розчин».
Якщо кислота, яка вступає в реакцію, є сильнішою, за ту кислоту, що утворюється.
Наприклад, хлоридна кислота може витіснити карбонатну з її солі:
2HCl+CaCO3→CaCl2+h3O+CO2↑⏟h3CO3
Для того, щоб винести судження про можливість протікання реакції, можна скористатися витискувальним рядом кислот:
HNO3h3SO4HClh3SO3h3CO3h3Sh3SiO3→h4PO4
У цьому ряду кислота, що знаходиться лівіше, може витіснити з солі кислоту, що знаходиться правіше.
6. Розклад оксигеновмісних кислот
При розкладанні кислот утворюється кислотний оксид і вода. Карбонатна кислота розкладається при звичайних умовах, а сульфітна і силікатна кислоти — при невеликому нагріванні:
h3CO3⇄h3O+CO2↑;h3SO3⇌toh3O+SO2↑;h3SiO3⟶toh3O+SiO2.
Таким чином, можна зробити висновок, що кислоти:
змінюють колір індикаторів;
реагують з металами;
реагують з основними і амфотерними оксидами;
реагують з основами і амфотерними гідроксидами;
реагують з солями;
деякі кислоти легко розкладаються.
Матеріал з теми « Карбонові кислоти» Група 12
Дата: 24.03.2020 18:10
Кількість переглядів: 19813
Матеріал з теми « Карбонові кислоти»
Група 12 24. 03.2020
03.2020
Урок 28,29, 30: Карбонові кислоти.
Карбонові кислоти, на відміну від альдегідів, дуже поширені в природі органічні сполуки. Вони входять до складу рослинних і тваринних організмів. Мурашина, лимонна, щавлева, янтарна, яблучна кислоти є у вільному стані, водночас залишки їхніх молекул містять у своєму складі жири, естери й інші сполуки. До таких кислот належать етанова (оцтова), бутанова (масляна), гексадеканова (пальмітинова), октадеканова (стеаринова) та ін.
Класифікують карбонові кислоти за кількістю в їхньому складі характеристичних (функціональних) груп атомів -СООН. Якщо кислота містить у своєму складі одну характеристичну (функціональну) групу, її називають одноосновною, дві — двоосновною, більше — багатоосновною.
Залежно від природи вуглеводневого ланцюга розрізняють гомологічні ряди кислот: насичені одноосновні карбонові кислоти та ненасичені: алкенові, алкінові, ароматичні (рис. 32).
32).
Схема класифікації карбонових кислот
Склад і будова молекул насичених одноосновних кислот. Ознайомившись зі схемою класифікації кислот, можна зробити висновок: до насичених одноосновних карбонових кислот належать такі, що у своєму складі містять одну характеристичну (функціональну) карбоксильну групу -СООН і насичений вуглеводневий ланцюг. Їхню будову розглядають як похідні алканів, у молекулах яких один атом Гідрогену заміщений на карбоксильну групу
Насичені одноосновні карбонові кислоти утворюють гомологічний ряд, вісім представників якого наведено в табл. 10.
Таблиця 10
Гомологічний ряд одноосновних карбонових кислот та їхні фізичні властивості
|
Молекулярна формула
|
Назва кислоти
|
Температура, °С
|
Агрегатний стан
| ||
|
систематична
|
тривіальна
|
Тпл
|
Т кіп
| ||
|
Н-СООН
|
Метанова
|
Мурашина
|
8
|
101
|
Рідини з різким запахом, добре розчинні у воді.
|
|
СН3-СООН
|
Етанова
|
Оцтова
|
17
|
118
| |
|
С2Н5-СООН
|
Пропанова
|
Пропіонова
|
-21
|
141
|
Оліїсті речовини, менш розчинні у воді, з неприємним запахом.
|
|
С3Н7-СООН
|
Бутанова
|
Масляна
|
-7,9
|
164
| |
|
С4Н9-СООН
|
Пентанова
|
Валеріанова
|
-35
|
185
| |
|
С5Н11-СООН
|
Гексанова
|
Капронова
|
-3,4
|
205
| |
Продовження табл.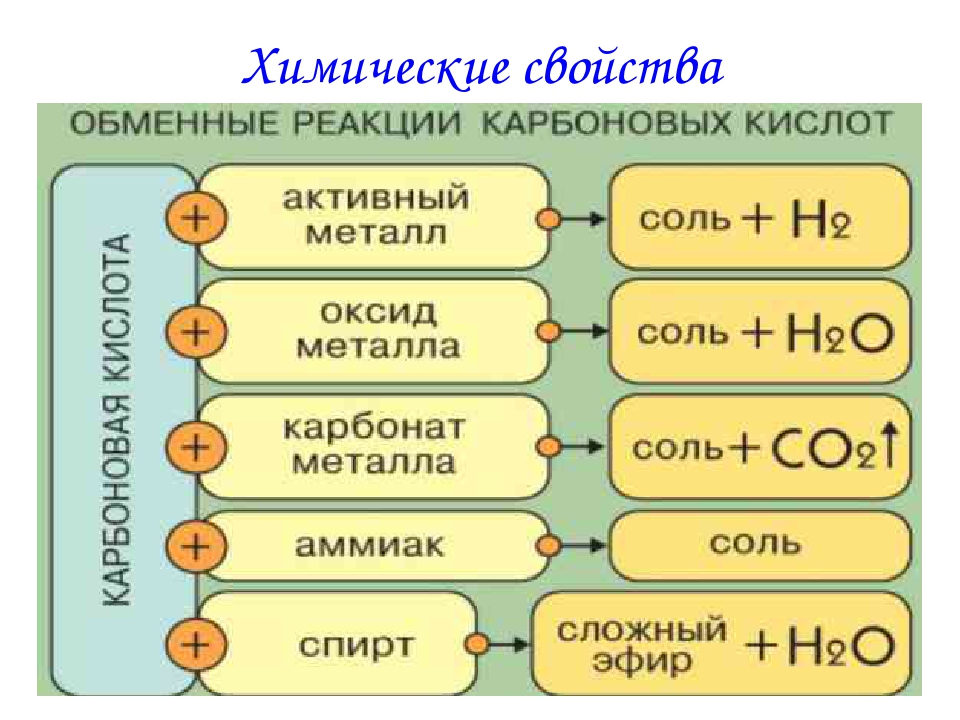
Номенклатура насичених одноосновних кислот. Утворення назв гомологів за систематичною номенклатурою наведено в таблиці
Одноосновним карбоновим кислотам властива структурна ізомерія карбонового ланцюга. Напишемо структурні формули пентанової кислоти та її ізомерів:
Хімічні властивості етанової кислоти. На хімічні властивості етанової кислоти впливає будова її характеристичної (функціональної) групи.
Вам уже відомо, що характеристична група молекули етанової кислоти складається з двох груп: гідроксильної -ОН і карбонільної >С=О. Атом Оксигену, що міститься в складі карбонільної групи, відтягує на себе електронну густину хімічного зв’язку, унаслідок чого зв’язок між атомами Оксигену й Гідрогену в гідроксильній групі послаблюється. Зміщення електронної густини, яке можна зобразити так:
визначає кислотні властивості цієї речовини.
Для того щоб переконатися, що різкої межі між неорганічними та органічними речовинами немає, звернемося до таблиці і порівняємо хімічні властивості насичених одноосновних карбонових кислот (на прикладі етанової) і неорганічних (хлоридної, сульфатної) кислот.
Порівняльна характеристика хімічних властивостей етанової та неорганічних кислот
Добування етанової кислоти. Вам уже відомо, що внаслідок часткового окиснення альдегідів утворюються карбонові кислоти
Пригадайте реакції часткового окиснення альдегідів. Напишіть рівняння реакцій.
Окиснення етанолу. Етанову кислоту добувають окисненням етанолу за наявності каталізатора. Рівняння реакції:
Окиснення етаналю. Оскільки з реакцією часткового окиснення етаналю ви вже ознайомилися , то зазначимо, що окисниками можуть бути й калій перманганат, калій дихромат та інші сильні окисники. Рівняння реакції:
Економічно вигідний промисловий спосіб добування етанової кислоти — це окиснення алканів повітрям за наявності каталізаторів.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Карбонові кислоти класифікують за кількістю характеристичних (функціональних) груп і за насиченістю вуглеводневого ланцюга.
• До насичених одноосновних карбонових кислот належать такі, що містять у своєму складі одну характеристичну (функціональну) карбоксильну групу й насичений вуглеводневий ланцюг.
• Будову насичених одноосновних карбонових кислот розглядають як похідні алканів, у молекулах яких один атом Гідрогену заміщений на карбоксильну групу -СООН. Загальна формула CnH2n+1COOH або R-COOH.
• Назви насичених одноосновних карбонових кислот утворюють за алгоритмом: алкан + ова + кислота. Наприклад: етан + ова + кислота → етанова кислота.
Наприклад: етан + ова + кислота → етанова кислота.
• Наявність карбоксильної групи в складі молекули карбонових кислот визначає їхні фізичні й хімічні властивості.
• Хімічні властивості карбонових кислот подібні до властивостей неорганічних кислот, крім взаємодії зі спиртами, унаслідок якої утворюються естери карбонових кислот.
• Реакції між карбоновими кислотами та спиртами з утворенням естерів називають реакціями естерифікації.
• Добувають насичені одноосновні карбонові кислоти окисненням спиртів (за наявності каталізатора) та альдегідів.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Поясніть, за якими ознаками класифікують карбонові кислоти.
- 2. Охарактеризуйте склад і будову насичених одноосновних карбонових кислот.
- 3. Дайте назви структурним ізомерам насичених одноосновних карбонових кислот за систематичною номенклатурою:
- 4.
 Порівняйте хімічні властивості сульфатної та етанової кислот, використовуючи конкретні приклади.
Порівняйте хімічні властивості сульфатної та етанової кислот, використовуючи конкретні приклади. - 5. Складіть структурні формули кислот за їхніми назвами: а) 2,2-диметилбутанова кислота; б) 2-метил-3-хлоропентанова кислота; в) 2-етил-3-метилпентанова кислота.
- 6. Складіть рівняння реакцій між речовинами:
а) С2Н5-СООН + Mg → … ;
б) С3Н7-СООН + KOH → … ;
в) С2Н5-СООН + K2CO3 → … ;
г) СН3-СООН + OH-C2H5 → … ;
ґ) СН3-СНО + Ag2O → … ;
д) СН3-СНО + Cu(OH)2 → … ;
е) СН3-СН2-ОН + О2 → … ;
є) С3Н7-СНО + О2 → … .
- 7.
 Дано речовини: етанол, натрій гідроксид, калій карбонат, кальцій оксид, купрум(ІІ) гідроксид, водень. Установіть, з якими з них реагуватимуть етанова й сульфатна кислоти. Напишіть молекулярні та, де можливо, йонні рівняння хімічних реакцій.
Дано речовини: етанол, натрій гідроксид, калій карбонат, кальцій оксид, купрум(ІІ) гідроксид, водень. Установіть, з якими з них реагуватимуть етанова й сульфатна кислоти. Напишіть молекулярні та, де можливо, йонні рівняння хімічних реакцій. - 8. Складіть рівняння хімічних реакцій за схемою. Назвіть речовини, позначені літерами А, Б і В.
Виконання завдання ля самоконтролю відправляйте мені на електронну адресу: [email protected]
Консультації на Viber : 0509569860
Бажаю успіху!
« повернутися
4.6. Хімічні властивості кислот та способи їх добування – Хімія – шкільний курс
Схема 5
Ряд активності кислот
| HClO4, HNO3, HI, HBr, HCl, H2SO4, | H2SO3, H3PO4, HF, HNO2, | H2CO3, H2S, H2SiO3 |
сильні | середні | слабкі |
1. Кислоти змінюють колір індикаторів.
Кислоти змінюють колір індикаторів.
2. Кислоти взаємодіючи з металами, утворюють сіль і водень. Виняток – нітратна кислота (HNO3) і концентрована сульфатна кислоти. При взаємодії їх навіть з активними металами водень не виділяється.
2HCl (хлоридна кислота) + Zn = ZnCl2(цинк хлорид) + H2 – реакція заміщення
3. Кислоти вступають в реакції обміну з оснóвними оксидами, утворюючи сіль і воду.
4. Кислоти взаємодіють з основами, утворюючи сіль і воду. Це реакція обміну по типу і реакція нейтралізації по суті.
Реакцією нейтралізації називають реакцію між кислотою і основою, в результаті якої утворюється сіль і вода.
5. Кислоти взаємодіють з деякими солями. Відповідно до ряду активності кислот кожна попередня кислота витісняє наступну кислоту з її солі: утворюється нова сіль і нова кислота. Сіль не повинна бути важкорозчинна, а кислота сильніша за ту, яку добувають.
6. Деякі кислоти розкладаються на кислотний оксид і воду:
За нормальних умов | H2CO3 = CO2 + H2O; |
Під час нагрівання | H2SiO3 = H2O + SiO2; |
Під час сильного нагрівання | H2SіO3= H2O + SіO2 |
Лабораторний дослід 6.
Дія водних розчинів кислот на індикатори
У три пробірки налийте по 1-2 мл розчину хлоридної кислоти. В одну пробірку добавте 1-2 краплі лакмусу, в другу – розчин фенолфталеїну, а в третю – розчин метилоранжу. Що спостерігаєте? Як змінюється забарвлення індикаторів?Яким індикатором не можна виявити кислоту?
Лабораторний дослід 7.
Взаємодія хлоридної кислоти з металами
Візьміть три пробірки. У першу пробірку помістіть 2-3 кусочки цинку, у другу – трошки порошка магнію, а у третю – 2-3 кусочки мідної дротини. До кожної пробірки долийте 2-3 мл хлоридної кислоти. Чи усі метали взаємодіють із кислотою? Порівняйте активність металів. Складіть рівняння реакцій.
Завдання для самоконтролю
■ 386. Виберіть окремо формули кислот і оксидів, назвіть їх:
а)N2O5, H2S, ZnO, H2SO3, KNO3, H2SiO3; б)H2SO4, CuO, HI, SO3, H3PO4, NaCl.
387. Запишіть хімічними рівняннями реакції нейтралізації: а) цинк гідроксиду фосфатною кислотою; б) калій гідроксиду плавиковою кислотою; в) натрій гідроксиду хлоридною кислотою; г) калій гідроксиду сульфідною кислотою.
388. Дано метали: Fe, Ca, Ag, Cu. Які із цих металів взаємодіятимуть із сульфідною кислотою? Напишіть рівняння реакцій.
389. Напишіть рівняння реакцій у тих випадках, де вони можливі. Назвіть солі, що утворюються в результаті реакцій:
| а) ZnO + HCl → … | б) MgO + H3PO4 → … |
| в) KOH + HCl → … | г) NaOH + H2CO3 → … |
| д) Cu + H2SO4 → … | е) Na2SO4 + H2SO4 → … |
390. Напишіть можливі рівняння реакцій між сульфатною кислотою і речовинами: BaO, Na2O, Cu, Ca(OH)2, O2, Na2SO3, H2O, Zn.
391. Закінчіть рівняння реакцій за такими схемами:
| ? + H3PO4 → Na3PO4 + ?; | H2SO4 + ? → CuSO4 + ?; |
| HCl + ? → CuCl2 + ?; | ? + H2S → ZnS + H2O; |
| Mg + ? → MgSO3 + ?; | ? + ? → Al2(SO4)3 + H2O; |
| MgO + ? → MgSO4; | ? + ? → K2CO3. |
▲● 392. Накресліть у зошиті наведену нижче таблицю і у відповідних графах напишіть хімічні формули відомих вам кислот, підкресліть кислотні залишки й зазначте їхню валентність:
Кислоти | ||||
Одноосновні | Двохосновні | Трьохосновні | Оксигеновмісні | Безоксигенові |
|
|
|
|
|
393. Назвіть оксиди і напишіть їх формули, що відповідають таким кислотам: H3PO4, HNO3, H2SiO3, H2SO3, H2SO4.
●● 394. Які з наведених нижче речовин, реагують із хлоридною кислотою: а) Cu, CuO, Cu(OH)2; б) Mg, MgO, Mg(OH)2? Напишіть можливі рівняння реакцій.
395. Вкажіть групу речовин, у якій усі сполуки взаємодіють із хлоридною кислотою: а) H2O, H2, BaO; б) Zn, H2O, BaSO4; в) Fe, MgO, Na2S. Напишіть рівняння реакцій.
396. Вкажіть, які пари речовин взаємодіють між собою: а) H2O і SO3; б) HCl і ZnO; в) HNO3 і SiO2. Напишіть рівняння реакцій.
●●● 397. Напишіть рівняння реакцій нейтралізації, в результаті яких утворюються солі: Li3PO4, SrSO4, AgNO3, RbH2PO4, AlOHCl2.
398. Напишіть рівняння реакцій добування відомими вам способами: а) барій сульфату; б) цинк хлориду.
399. Напишіть по два рівняння реакцій, які характеризують хімічні властивості сульфатної кислоти. Зазначте, до якого типу реакцій вони належать.
400. З якими з названих нижче оксидів, взаємодіє хлоридна кислота: а) алюміній оксид, нітроген(IV) оксид, магній оксид; б) карбон(II) оксид, кальцій оксид, ферум(III) оксид? Напишіть рівняння реакцій.
●●●● 401. Здійсніть перетворення, визначте типи реакцій: а) KClO3 → O2 → ZnO → ZnCl2; б) Al → Al2O3 → AlCl3 → Al2(SO4)3; в) H2O → O2 → CO2 → H2CO3.
Властивості та використання кислот — Хімія. 8 клас. Попель
Хімія. 8 клас. Попель
Матеріал параграфа допоможе вам:
- з’ясувати фізичні властивості кислот;
- засвоїти хімічні властивості кислот;
- прогнозувати можливість реакції кислоти з металом;
- дізнатися про сфери використання кислот.
Фізичні властивості кислот. Усі кислоти мають молекулярну будову. Оскільки молекули притягуються одна до одної слабко (на відміну від протилежно заряджених йонів в основному оксиді чи основі), то кислоти мають низькі температури плавлення і майже всі за звичайних умов є рідинами. Вони розчиняються у воді (крім кислоти H2SiO3), у багатьох випадках — необмежено, тобто змішуються з водою в будь-яких співвідношеннях з утворенням розчинів. Під час розчинення деяких кислот виділяється значна кількість теплоти (мал. 56).
Мал. 56. Розчинення сульфатної кислоти у воді
Вам відомо, що безоксигенові кислоти є водними розчинами газів — сполук неметалічних елементів VI і VII груп із Гідрогеном (наприклад, H2S, НСl). Ці гази виділяються зі своїх розчинів навіть за звичайних умов.
Леткою, тобто такою, що переходить у газуватий стан за помірного нагрівання, є нітратна кислота HNO3, а також кілька інших. Леткі кислоти мають запах.
Ортофосфатна кислота Н3РО4, ортоборатна (борна) Н3ВО3, метасилікатна H2SiO3 — тверді речовини. Вони, а також сульфатна кислота H2SO4 є нелеткими.
Карбонатна і сульфітна кислоти існують лише у водному розчині. Відповідні оксиди взаємодіють із водою неповною мірою, а кислоти, що утворюються, частково розкладаються на оксиди і воду:
СО2 + Н2О ⇄ Н2СО3;
SO2 + Н2О ⇄ H2SO3.
Більшість кислот — токсичні речовини. Вони спричиняють серйозні отруєння, опіки шкіри. Тому працювати з кислотами, як і з лугами, потрібно обережно, дотримуючись правил безпеки. При потраплянні розчину кислоти на руку слід змити його водою, обробити шкіру розбавленим розчином харчової соди (для знешкодження залишків кислоти) і знову промити водою.
Хімічні властивості кислот. Здатність кислот реагувати з іншими речовинами значною мірою залежить від їх активності, стійкості, леткості, розчинності у воді. На це звертатимемо увагу, розглядаючи хімічні властивості кислот.
Кислоти виявляють різну хімічну активність. Дуже активні кислоти називають сильними, а малоактивні — слабкими. Є ще й кілька кислот середньої сили. Приклади сполук кожної групи (див. також форзац II):
Дія на індикатори. Кислоти у водних розчинах змінюють забарвлення індикаторів (мал. 57), але не всіх і не так, як луги.
Мал. 57. Забарвлення індикаторів У воді (а) та розчині кислоти (б)
ЛАБОРАТОРНИЙ ДОСЛІД № 4
Дія водних розчинів кислот на індикатори
У три пробірки налийте по 1—2 мл розчину сульфатної кислоти. У будь-якій пробірці змочіть скляну паличку розчином кислоти й доторкніться нею до універсального індикаторного папірця. Як змінюється колір індикатора?
В одну пробірку з розчином кислоти добавте 1—2 краплі розчину лакмусу, у другу — стільки ж розчину фенолфталеїну, а в третю — метилоранжу. Що спостерігаєте? Яким індикатором не можна виявити кислоту?
Реакції з металами. Усі безоксигенові кислоти, сульфатна кислота (у розбавленому розчині) та деякі інші реагують із металами з виділенням водню й утворенням солей (мал. 58):
Мал. 58. Реакція хлоридної кислоти з алюмінієвою монетою (2 коп. випуску 1992 р.)
Під час таких реакцій атоми металічного елемента, які містяться в простій речовині, заміщують атоми Гідрогену у складній речовині.
Реакцію між простою і складною речовинами, у результаті якої утворюються нові проста і складна речовини, називають реакцією заміщення.
Микола Миколайович Бекетов (1827—1911)
Видатний російський і український хімік, академік Петербурзької академії наук. Дослідив реакції солей у водних розчинах із металами і воднем. Запропонував витискувальний ряд, або ряд активності металів (1865). Розробив та описав один із методів добування металів — металотермію. Сприяв становленню фізичної хімії — однієї з найважливіших хімічних наук. Працював професором у Харківському університеті (1855—1887), уперше читав курс лекцій із фізичної хімії як самостійної наукової дисципліни. Був президентом Російського фізико-хімічного товариства.
Зі щойно вказаними кислотами взаємодіють не всі метали. Передбачити можливість реакції між металом і кислотою можна за допомогою ряду активності металів. Його склав вітчизняний хімік Μ. М. Бекетов на підставі вивчення реакцій металів із кислотами і солями. Наводимо цей ряд у сучасному вигляді (див. також форзац II):
Формула неметалу водню поділяє ряд на дві частини. Метали, розміщені в його лівій частині, взаємодіють із хлоридною і розбавленою сульфатною кислотами з виділенням водню, а розміщені праворуч — не реагують із ними (мал. 59):
Ag + НСl ↛
Cu + H2SO4(розб.) ↛
Мал. 59. Відношення металів до розбавленого розчину сульфатної кислоти
ЛАБОРАТОРНИЙ ДОСЛІД № 5
Взаємодія хлоридної кислоти з металами
Візьміть дві пробірки. В одну пробірку помістіть залізний цвях, в іншу — трохи порошку чи стружки магнію. Дослідіть відношення кожного металу до розбавленої хлоридної кислоти.
Який метал активніше реагує з кислотою? Чи узгоджуються результати досліду із розміщенням заліза і магнію в ряду активності металів?
Складіть хімічні рівняння. Зважте на те, що Ферум у продукті реакції має ступінь окиснення +2.
Під час взаємодії нітратної кислоти, а також концентрованого розчину сульфатної кислоти1 з металами замість водню утворюються інші речовини (мал. 60). Такі реакції розглядатимемо в 9 класі.
1 Концентрований розчин містить значно більше кислоти, ніж води.
Мал. 60. Реакція міді з нітратною кислотою
Реакції з основними оксидами та основами. Характерною властивістю всіх кислот є здатність взаємодіяти зі сполуками протилежного типу — основними оксидами й основами. Продукти кожної реакції — сіль і вода:
Li2O + 2HCl = 2LiCl + H2O;
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O.
Про такі хімічні перетворення йшлося в попередніх параграфах.
Реакції із солями. Взаємодія кислоти із сіллю є реакцією обміну. Назвемо випадки, коли ці реакції відбуваються (мал. 61).
Мал. 61. Реакції кислот із солями
- Продукт реакції — сіль або кислота — є нерозчинним у воді (це з’ясовуємо за таблицею розчинності):
ВаСl2 + H2SO4 = BaSO4↓ + 2НСl;
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3↓.
- Кислота-продукт є леткою чи походить від газуватої сполуки або розкладається з утворенням газу:
(Скорочення «тв.» означає «тверда речовина», а «конц.» — «концентрований розчин».)
- Кислота, що вступає в реакцію, є сильною, а кислота, яка утворюється, — слабкою. Прикладами можуть слугувати три останні реакції.
Термічний розклад оксигеновмісних кислот. Оксигеновмісні кислоти під час нагрівання, а карбонатна і сульфітна — за звичайних умов, розкладаються з утворенням відповідних кислотних оксидів і води:
Одним із продуктів розкладу сульфатної кислоти при помірному нагріванні є сульфур(VІ) оксид, який при сильному нагріванні також розкладається:
Реакція термічного розкладу нітратної кислоти має певну особливість. Ця сполука розкладається на три речовини — нітроген(ІV) оксид, кисень і воду (оксид Ν2Ο5, який відповідає нітратній кислоті, надто нестійкий):
Викладений матеріал підсумовує схема 8.
Схема 8
Хімічні властивості кислот
Використання кислот. Найчастіше застосовують сульфатну, хлоридну, нітратну й ортофосфатну кислоти (табл. 10). Їх добувають на хімічних заводах у великій кількості.
Розчин сульфатної кислоти заливають в акумулятори автомобілів, а розчин борної кислоти застосовують як дезінфікуючий засіб. У побуті використовують і органічні кислоти: оцтову кислоту СН3СООН (оцет — її розбавлений водний розчин), лимонну кислоту (консервант), аскорбінову кислоту (вітамін С).
Таблиця 10
Використання кислот
Кислота | Галузь використання |
H2SO4 | Виробництво інших кислот, солей, добрив, барвників, ліків, очищення нафтопродуктів |
HCl | Виробництво солей, фарб, ліків |
HNO3 | Виробництво добрив, вибухових речовин, барвників |
H3PO4 | Виробництво добрив, мийних засобів |
ВИСНОВКИ
Кислоти — молекулярні речовини, розчинні у воді. Вони змінюють забарвлення індикаторів, але не так, як луги.
Безоксигенові кислоти і розбавлена сульфатна кислота взаємодіють із більшістю металів з виділенням водню й утворенням солей. Такі реакції називають реакціями заміщення. Можливість їх перебігу визначають за допомогою ряду активності металів.
Кислоти реагують з основними оксидами й основами з утворенням солей і води, а також із солями (продукти реакції — інші кислота і сіль). Оксигеновмісні кислоти розкладаються при нагріванні.
Кислоти широко використовують у різних сферах.
- 234. Назвіть характерні фізичні властивості кислот. Чим вони зумовлені?
- 235. Чи можна розрізнити за допомогою лакмусу, фенолфталеїну, універсального індикатора розчини кислоти і лугу? Якщо так, то як саме?
- 236. Допишіть схеми реакцій і складіть хімічні рівняння:
a) Mg + НВr →
ВаО + HNO3 →
NaOH + H2S →
б) Lі2О + H2SO4 →
Fe(OH)2 + HNO3 →
K2SiO3 + Н3РО4 →
- 237. Замість крапок напишіть формули кислот-реагентів, продуктів реакцій і перетворіть схеми на хімічні рівняння:
a) Fe + … → FeCl2 + …;
Lі2О + … → Lі3РО4 + …;
KOH + … → ΚΝO3 + …;
б) Al + … → Al2(SO4)3 + …;
Cr(OH)2 + … → CrSO4 + …;
AgNO3 + … → AgI↓ + … .
- 238. Напишіть рівняння реакцій (якщо вони відбуваються) між розбавленою сульфатною кислотою і такими речовинами:
а) цинк;
б) срібло;
в) карбон(ІV) оксид;
г) фторидна кислота;
ґ) барій гідроксид;
д) плюмбум(ІІ) нітрат.
- 239. Для кожного перетворення напишіть по два хімічних рівняння:
а) НСl → СаСl2;
б) H2S → K2S;
в) Н3РО4 → Ва3(РО4)2.
- 240. Щоб здійснити реакцію між натрій хлоридом і сульфатною кислотою, до твердої солі додають чисту кислоту і нагрівають цю суміш. Поясніть, чому не використовують розчини сполук і для чого необхідне нагрівання.
- 241. За матеріалами з інтернету підготуйте повідомлення про використання фторидної (плавикової) кислоти.
- 242. Яка маса сульфатної кислоти потрібна для нейтралізації 8 г натрій гідроксиду?
- 243. У результаті реакції достатньої кількості хлоридної кислоти із 10 г суміші порошків срібла і цинку виділилося 0,7 л водню (н. у.). Обчисліть масову частку срібла в суміші.
- 244. Під час розкладу нітратної кислоти виділилося 11,2 л суміші газів (н. у.). Визначте масу кислоти, що розклалася.
ДОМАШНІЙ ЕКСПЕРИМЕНТ
Дія на сік буряка лимонного соку, розчину харчової соди, мильного розчину
Сік столового буряка містить забарвлену речовину, що є індикатором. Пропонуємо виконати з ним такий експеримент.
Приготуйте столову ложку соку столового буряка, а також невеликі кількості водних розчинів харчової соди і господарчого мила.
Налийте в чотири полімерні стаканчики по 20—30 мл води і однакові порції соку буряка. Вміст посудин перемішайте.
Додайте в один стаканчик 1/2 чайної ложки лимонного соку, у другий — чайну ложку розчину харчової соди, у третій — стільки ж мильного розчину. Вміст четвертого стаканчика слугуватиме для порівняння забарвлень.
Що спостерігаєте? У яких розчинах виявлено луг, кислоту?
Результати експерименту запишіть у зошит.
Зробіть коротке повідомлення про ваше дослідження на уроці хімії.
Результати тестування – сайт ЗНО.Освіта.UA
12345678910111213141516171819202122232425262728293031323334353637383940414243444546474849505152
Дата цього тесту: 12.06.2019.
Ваш тестовий бал: 19 з 80 можливих.
Ваш бал ДПА: 4 з 12 можливих.
* Номери запитань, які враховуються в оцінку ДПА, виділені жирним.
Ваш рейтинговий бал: 110 з 200 можливих.
Витрачено часу: 1 год. 8 хв. з 150 запропонованих.
Завдання 1 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 2 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 3 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 4 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 5 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 6 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 7 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 8 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 9 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 10 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 11 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 12 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 13 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 14 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 15 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 16 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 17 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 18 з 52
Відповіді:
Завдання пропущено
Читати коментар
Завдання 19 з 52
Відповіді:
Кількість балів: 0
Читати коментар
Завдання 20 з 52
Відповіді:
Кількість балів: 1
Читати коментар
Завдання 21 з 52
Відповіді:
Кількість балів: 1
Читати коментар
Завдання 22 з 52
Відповіді:
Кількість балів: 0
Читати коментар
Завдання 23 з 52
Відповіді:
Кількість балів: 1
Читати коментар
Завдання 24 з 52
Відповіді:
Кількість балів: 1
Читати коментар
Завдання 25 з 52
Відповіді:
Кількість балів: 0
Читати коментар
Завдання 26 з 52
Відповіді:
Кількість балів: 0
Читати коментар
Завдання 27 з 52
Відповіді:
Кількість балів: 1
Читати коментар
Завдання 28 з 52
Відповіді:
Кількість балів: 1
Читати коментар
Завдання 29 з 52
Відповіді:
Кількість балів: 0
Читати коментар
Завдання 30 з 52
Відповіді:
Кількість балів: 1
Читати коментар
Завдання 31 з 52
Відповіді:
Кількість балів: 0
Читати коментар
Завдання 32 з 52
Відповіді:
Кількість балів: 0
Читати коментар
Завдання 33 з 52
Відповіді:
Кількість балів: 0
Читати коментар
Завдання 34 з 52
Відповіді:
Кількість балів: 0
Читати коментар
Завдання 35 з 52
Відповіді:
Кількість балів: 0
Читати коментар
Завдання 36 з 52
Відповіді:
Кількість балів: 0
Читати коментар
Завдання 37 з 52
Правильна відповідь:
Кількість балів: 0
Читати коментар
Завдання 38 з 52
Правильна відповідь:
Кількість балів: 2
Читати коментар
Завдання 39 з 52
Правильна відповідь:
Кількість балів: 1
Читати коментар
Завдання 40 з 52
Правильна відповідь:
Кількість балів: 1
Читати коментар
Завдання 41 з 52
Правильна відповідь:
Кількість балів: 2
Читати коментар
Завдання 42 з 52
Правильна відповідь:
Кількість балів: 4
Читати коментар
Завдання 43 з 52
Завдання пропущено
Правильна відповідь: 210
Кількість балів:
Читати коментар
Завдання 44 з 52
Відповідь: 84
Правильна відповідь: 31
Кількість балів: 0
Читати коментар
Завдання 45 з 52
Відповідь: 60
Правильна відповідь: 60
Кількість балів: 2
Читати коментар
Завдання 46 з 52
Відповідь: 4
Правильна відповідь: 10
Кількість балів: 0
Читати коментар
Завдання 47 з 52
Відповідь: 180
Правильна відповідь: 40
Кількість балів: 0
Читати коментар
Завдання 48 з 52
Завдання пропущено
Правильна відповідь: 12
Кількість балів:
Читати коментар
Завдання 49 з 52
Завдання пропущено
Правильна відповідь: 15
Кількість балів:
Читати коментар
Завдання 50 з 52
Відповідь: 4
Правильна відповідь: 96
Кількість балів: 0
Читати коментар
Завдання 51 з 52
Відповідь: 6
Правильна відповідь: 5
Кількість балів: 0
Читати коментар
Завдання 52 з 52
Відповідь: 84
Правильна відповідь: 90
Кількість балів: 0
Читати коментар
кислотно-основная реакция | Определение, примеры, формулы и факты
Кислотно-основная реакция , тип химического процесса, типичным примером которого является обмен одного или нескольких ионов водорода, H + , между частицами, которые могут быть нейтральными (молекулы, такие как вода , H 2 O; или уксусная кислота, CH 3 CO 2 H) или электрически заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH —; или карбонат, CO 3 2−).Он также включает аналогичное поведение молекул и ионов, которые являются кислыми, но не отдают ионы водорода (хлорид алюминия, AlCl 3 и ион серебра AG + ).
сульфат натрия
Сульфат натрия, также называемый глауберовской солью, является, как и другие соли, продуктом кислотно-щелочной реакции.
Martin Walker
Популярные вопросы
Что такое кислоты и основания?
Кислоты — это вещества, содержащие один или несколько атомов водорода, которые в растворе выделяются в виде положительно заряженных ионов водорода.Кислота в водном растворе имеет кислый вкус, меняет цвет голубой лакмусовой бумаги на красный, вступает в реакцию с некоторыми металлами (например, с железом) с выделением водорода, реагирует с основаниями с образованием солей и способствует определенным химическим реакциям (кислотный катализ). Основания — вещества, которые имеют горький вкус и меняют цвет красной лакмусовой бумаги на синий. Основания реагируют с кислотами с образованием солей и способствуют определенным химическим реакциям (щелочной катализ).
Как измеряются кислоты и основания?
Кислотам и основаниям присваивается значение от 0 до 14, значение pH, в зависимости от их относительной силы.Чистая вода, которая является нейтральной, имеет pH 7. Раствор с pH менее 7 считается кислым, а раствор с pH более 7 считается щелочным или щелочным. Сильные кислоты имеют более высокую концентрацию ионов водорода, и им присваиваются значения, близкие к 0. И наоборот, сильные основания имеют более высокие концентрации гидроксид-ионов, и им присваиваются значения, близкие к 14. Более слабые кислоты и основания ближе к значению pH 7, чем их более сильные собратья.
Что происходит во время кислотно-щелочной реакции?
Кислотно-основная реакция — это тип химической реакции, которая включает обмен одним или несколькими ионами водорода, H + , между частицами, которые могут быть нейтральными (молекулы, такие как вода, H 2 O) или электрически заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH —; или карбонат, CO 3 2−).Он также включает аналогичные процессы, которые происходят в молекулах и ионах, которые являются кислотными, но не отдают ионы водорода.
Как кислоты и основания нейтрализуют друг друга (или нейтрализуют)?
Различные реакции дают разные результаты. Реакции между сильными кислотами и сильными основаниями более полно разлагаются на ионы водорода (протоны, положительно заряженные ионы) и анионы (отрицательно заряженные ионы) в воде. Для слабой кислоты и слабого основания нейтрализация более подходящим образом включает прямой перенос протонов от кислоты к основанию.Если один из реагентов присутствует в большом избытке, реакция может привести к образованию соли (или ее раствора), которая может быть кислой, основной или нейтральной в зависимости от силы кислот и оснований, взаимодействующих друг с другом.
Кислоты — это химические соединения, которые в водном растворе проявляют резкий вкус, разъедающее действие на металлы и способность окрашивать некоторые синие растительные красители в красный цвет. Основания — это химические соединения, которые в растворе становятся мыльными на ощупь и окрашивают красные растительные красители в синий цвет. При смешивании кислоты и основания нейтрализуют друг друга и образуют соли, вещества с солоноватым вкусом, не обладающие характерными свойствами ни кислот, ни оснований.
Идея о том, что одни вещества являются кислотами, а другие — основаниями, почти так же стара, как и химия, а термины кислота , основание и соль встречаются очень рано в трудах средневековых алхимиков. Кислоты, вероятно, были первыми из них, которые были обнаружены, по-видимому, из-за их кислого вкуса. Английское слово acid , французское acide , немецкое Säure и русское kislota происходит от слов, означающих кислый (лат. Русский кислый ).К другим свойствам, которые в свое время связывали кислоты, относились их растворяющее или коррозионное действие; их действие на растительные красители; и вспенивание, возникающее при нанесении их на мел (образование пузырьков углекислого газа). Основания (или щелочи) характеризовались в основном своей способностью нейтрализовать кислоты и образовывать соли, причем последние довольно слабо характеризовались как кристаллические вещества, растворимые в воде и имеющие соленый вкус.
Несмотря на их неточный характер, эти идеи служили для корреляции значительного диапазона качественных наблюдений, и многие из самых обычных химических материалов, с которыми сталкивались ранние химики, можно было классифицировать как кислоты (соляная, серная, азотная и угольная кислоты), основания (сода, поташ, известь, нашатырный спирт) или соли (поваренная соль, нашатырный спирт, селитра, квасцы, бура).Отсутствие какой-либо очевидной физической основы для рассматриваемого явления затрудняло количественный прогресс в понимании кислотно-основного поведения, но способность фиксированного количества кислоты нейтрализовать фиксированное количество основания была одним из первых примеров химической эквивалентности. : идея о том, что определенная мера одного вещества в некотором химическом смысле равна разному количеству второго вещества. Кроме того, довольно рано было обнаружено, что одна кислота может быть вытеснена из соли другой кислотой, и это позволило расположить кислоты в приблизительном порядке силы.Также вскоре стало ясно, что многие из этих смещений могут происходить в любом направлении в соответствии с экспериментальными условиями. Это явление свидетельствует о том, что кислотно-основные реакции обратимы, то есть продукты реакции могут взаимодействовать с регенерированием исходного материала. Он также ввел концепцию равновесия в кислотно-щелочную химию: эта концепция гласит, что обратимые химические реакции достигают точки баланса или равновесия, при которой исходные материалы и продукты регенерируются каждой из двух реакций так же быстро, как и они. потребляются другим.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Помимо теоретического интереса, кислоты и основания играют большую роль в промышленной химии и в повседневной жизни. Серная кислота и гидроксид натрия входят в число продуктов, производимых в наибольших количествах химической промышленностью, и большой процент химических процессов включает кислоты или основания в качестве реагентов или катализаторов. Почти каждый биологический химический процесс тесно связан с кислотно-щелочным равновесием в клетке или в организме в целом, и кислотность или щелочность почвы и воды имеют большое значение для растений или животных, живущих в них.И идеи, и терминология кислотно-щелочной химии проникли в повседневную жизнь, и термин соль особенно распространен.
кислотно-основная реакция | Определение, примеры, формулы и факты
Кислотно-основная реакция , тип химического процесса, типичным примером которого является обмен одного или нескольких ионов водорода, H + , между частицами, которые могут быть нейтральными (молекулы, такие как вода , H 2 O; или уксусная кислота, CH 3 CO 2 H) или электрически заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH —; или карбонат, CO 3 2−).Он также включает аналогичное поведение молекул и ионов, которые являются кислыми, но не отдают ионы водорода (хлорид алюминия, AlCl 3 и ион серебра AG + ).
сульфат натрия
Сульфат натрия, также называемый глауберовской солью, является, как и другие соли, продуктом кислотно-щелочной реакции.
Martin Walker
Популярные вопросы
Что такое кислоты и основания?
Кислоты — это вещества, содержащие один или несколько атомов водорода, которые в растворе выделяются в виде положительно заряженных ионов водорода.Кислота в водном растворе имеет кислый вкус, меняет цвет голубой лакмусовой бумаги на красный, вступает в реакцию с некоторыми металлами (например, с железом) с выделением водорода, реагирует с основаниями с образованием солей и способствует определенным химическим реакциям (кислотный катализ). Основания — вещества, которые имеют горький вкус и меняют цвет красной лакмусовой бумаги на синий. Основания реагируют с кислотами с образованием солей и способствуют определенным химическим реакциям (щелочной катализ).
Как измеряются кислоты и основания?
Кислотам и основаниям присваивается значение от 0 до 14, значение pH, в зависимости от их относительной силы.Чистая вода, которая является нейтральной, имеет pH 7. Раствор с pH менее 7 считается кислым, а раствор с pH более 7 считается щелочным или щелочным. Сильные кислоты имеют более высокую концентрацию ионов водорода, и им присваиваются значения, близкие к 0. И наоборот, сильные основания имеют более высокие концентрации гидроксид-ионов, и им присваиваются значения, близкие к 14. Более слабые кислоты и основания ближе к значению pH 7, чем их более сильные собратья.
Что происходит во время кислотно-щелочной реакции?
Кислотно-основная реакция — это тип химической реакции, которая включает обмен одним или несколькими ионами водорода, H + , между частицами, которые могут быть нейтральными (молекулы, такие как вода, H 2 O) или электрически заряженные (ионы, такие как аммоний, NH 4 + ; гидроксид, OH —; или карбонат, CO 3 2−).Он также включает аналогичные процессы, которые происходят в молекулах и ионах, которые являются кислотными, но не отдают ионы водорода.
Как кислоты и основания нейтрализуют друг друга (или нейтрализуют)?
Различные реакции дают разные результаты. Реакции между сильными кислотами и сильными основаниями более полно разлагаются на ионы водорода (протоны, положительно заряженные ионы) и анионы (отрицательно заряженные ионы) в воде. Для слабой кислоты и слабого основания нейтрализация более подходящим образом включает прямой перенос протонов от кислоты к основанию.Если один из реагентов присутствует в большом избытке, реакция может привести к образованию соли (или ее раствора), которая может быть кислой, основной или нейтральной в зависимости от силы кислот и оснований, взаимодействующих друг с другом.
Кислоты — это химические соединения, которые в водном растворе проявляют резкий вкус, разъедающее действие на металлы и способность окрашивать некоторые синие растительные красители в красный цвет. Основания — это химические соединения, которые в растворе становятся мыльными на ощупь и окрашивают красные растительные красители в синий цвет. При смешивании кислоты и основания нейтрализуют друг друга и образуют соли, вещества с солоноватым вкусом, не обладающие характерными свойствами ни кислот, ни оснований.
Идея о том, что одни вещества являются кислотами, а другие — основаниями, почти так же стара, как и химия, а термины кислота , основание и соль встречаются очень рано в трудах средневековых алхимиков. Кислоты, вероятно, были первыми из них, которые были обнаружены, по-видимому, из-за их кислого вкуса. Английское слово acid , французское acide , немецкое Säure и русское kislota происходит от слов, означающих кислый (лат. Русский кислый ).К другим свойствам, которые в свое время связывали кислоты, относились их растворяющее или коррозионное действие; их действие на растительные красители; и вспенивание, возникающее при нанесении их на мел (образование пузырьков углекислого газа). Основания (или щелочи) характеризовались в основном своей способностью нейтрализовать кислоты и образовывать соли, причем последние довольно слабо характеризовались как кристаллические вещества, растворимые в воде и имеющие соленый вкус.
Несмотря на их неточный характер, эти идеи служили для корреляции значительного диапазона качественных наблюдений, и многие из самых обычных химических материалов, с которыми сталкивались ранние химики, можно было классифицировать как кислоты (соляная, серная, азотная и угольная кислоты), основания (сода, поташ, известь, нашатырный спирт) или соли (поваренная соль, нашатырный спирт, селитра, квасцы, бура).Отсутствие какой-либо очевидной физической основы для рассматриваемого явления затрудняло количественный прогресс в понимании кислотно-основного поведения, но способность фиксированного количества кислоты нейтрализовать фиксированное количество основания была одним из первых примеров химической эквивалентности. : идея о том, что определенная мера одного вещества в некотором химическом смысле равна разному количеству второго вещества. Кроме того, довольно рано было обнаружено, что одна кислота может быть вытеснена из соли другой кислотой, и это позволило расположить кислоты в приблизительном порядке силы.Также вскоре стало ясно, что многие из этих смещений могут происходить в любом направлении в соответствии с экспериментальными условиями. Это явление свидетельствует о том, что кислотно-основные реакции обратимы, то есть продукты реакции могут взаимодействовать с регенерированием исходного материала. Он также ввел концепцию равновесия в кислотно-щелочную химию: эта концепция гласит, что обратимые химические реакции достигают точки баланса или равновесия, при которой исходные материалы и продукты регенерируются каждой из двух реакций так же быстро, как и они. потребляются другим.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Помимо теоретического интереса, кислоты и основания играют большую роль в промышленной химии и в повседневной жизни. Серная кислота и гидроксид натрия входят в число продуктов, производимых в наибольших количествах химической промышленностью, и большой процент химических процессов включает кислоты или основания в качестве реагентов или катализаторов. Почти каждый биологический химический процесс тесно связан с кислотно-щелочным равновесием в клетке или в организме в целом, и кислотность или щелочность почвы и воды имеют большое значение для растений или животных, живущих в них.И идеи, и терминология кислотно-щелочной химии проникли в повседневную жизнь, и термин соль особенно распространен.
Реакции с кислотами — Получение солей — GCSE Chemistry (Single Science) Revision — WJEC
Кислоты и химически активные металлы
Кислоты будут реагировать с химически активными металлами, такими как магний и цинк, с образованием соли и водорода.
кислота + металл → соль + водород
соляная кислота + цинк → хлорид цинка + водород
2HCl + Zn → ZnCl 2 + H 2
Водород вызывает образование пузырьков во время реакции и может быть обнаружен с помощью горящая шина, издающая скрипучий хлопок.
Как правило, чем более активен металл, тем быстрее реакция. На это указывает большее количество пузырьков, выделяемых в секунду из металлов с более высокой реакционной способностью, как показано на этой диаграмме.
Диаграмма показывает, что алюминий является наиболее реактивным из четырех металлов, за ним следует цинк, затем железо и, наконец, медь.
Также обратите внимание, что реакция металлов с кислотами экзотермична (т.е. выделяется тепловая энергия).
Кислоты и гидроксиды металлов (щелочи)
Когда кислоты реагируют с гидроксидами металлов (обычно называемыми щелочами), образуются соль и вода.
кислота + гидроксид металла → соль + вода
азотная кислота + гидроксид лития → нитрат лития + вода
HNO 3 + LiOH → LiNO 3 + H 2 O
[только для высшего уровня]
Обратите внимание, что реакция между гидроксидом металла и кислотой может быть представлена ионным уравнением между ионами водорода и ионами гидроксида с образованием молекул воды.
H + (вод.) + OH — (вод.) → H 2 O (l)
Также обратите внимание, что реакция гидроксидов металлов с кислотами является экзотермической (т.е. выделяется тепловая энергия).
Кислоты и основания
Когда кислоты реагируют с основанием, образуются соль и вода.
кислота + основание → соль + вода
азотная кислота + оксид магния → нитрат магния + вода
2HNO 3 + MgO → Mg (NO 3 ) 2 + H 2 O
Также обратите внимание что реакция оксидов металлов с кислотами экзотермична (т. е. выделяется тепловая энергия).
Кислоты и карбонаты металлов
Когда кислоты вступают в реакцию с карбонатами, такими как карбонат кальция (содержится в меле, известняке и мраморе), образуются соль, вода и углекислый газ.
кислота + карбонат металла → соль + вода + диоксид углерода
серная кислота + карбонат железа (II) → сульфат железа (II) + вода + диоксид углерода
H 2 SO 4 + FeCO 3 → FeSO 4 + H 2 O + CO 2
Двуокись углерода вызывает образование пузырьков во время реакции, что наблюдается как шипение. Его можно обнаружить, пропустив газ через известковую воду, которая станет мутной.
Также реакция карбонатов металлов с кислотами экзотермична (т.е. выделяется тепловая энергия).
Реакцию этого типа можно использовать для проверки неизвестных растворов на кислотность. Просто добавьте в раствор раствор карбоната натрия, и если выделяется углекислый газ, раствор будет кислым.
Этот тип реакции также может быть использован для проверки неизвестных растворов на наличие карбонатных (CO 3 — ) ионов. Просто добавьте кислоту в раствор, и если выделяются пузырьки углекислого газа, раствор содержит ионы карбоната.
Типы реакций — осадки и кислота / основание
Типы реакций — осадки и кислота / основание
Типы реакций
Нижеследующее содержание является сутью лекции 13.В этой лекции мы рассмотрим реакции осаждения и кислотно-основные реакции.
Растворимость и осаждение
Продолжая обсуждение того, что заставляет реакцию протекать к продукту, мы теперь вернемся к образованию твердого вещества. В реакции, в которой один из продуктов практически не имеет растворимости (способности растворяться) в воде, образуется твердое вещество. Это твердое вещество называется осадком. Это связано с тем, что так же, как дождь падает с неба, твердое вещество, которое образуется, выпадает из раствора и собирается на дне контейнера, в котором оно находится.
Уловка для понимания реакции осаждения заключается в знании того, какие соединения, образующиеся, не растворимы. К сожалению, единственный способ узнать это — запомнить некоторые правила растворимости:
В приведенной выше таблице представлены несколько правил, которые вы должны запомнить. Обратите внимание, что из большинства правил есть исключения. Вам также нужно будет знать это.
Написание уравнения реакции осаждения:
Типичные вопросы, касающиеся реакции осаждения, потребуют идентификации чистого ионного уравнения, которое мы рассмотрели ранее, или будут простым вопросом, в котором вам нужно завершить реакцию и определить, будет ли она производить продукт или нет.Другими словами, он будет образовывать какие-либо соединения, которые стимулируют реакцию в прямом направлении.
Вот пример:
Какие продукты для следующей реакции?
AgNO 3 (водн.) + KI (водн.) →?
Чтобы ответить на вопрос, вы должны понять, что это реакция Метатезиса. Это причудливое слово для обозначения «обмена партнерами» в качестве реакции.
Лучший способ завершить этот процесс и правильно спрогнозировать продукты — это разделить каждый из реагентов на их ионы:
Ag + + NO 3 — + K + + I — →
Теперь поменяйте местами положительные ионы и сделайте так, чтобы новые соединения уравновешивали заряды, чтобы соединение было нейтральным.
Ag + + NO 3 — + K + + I — → AgI (s) + KNO 3 (водный)
Идентификация AgI как твердого вещества происходит из исключений из правил для галогенидов, указанных в таблице выше.
Чистое ионное уравнение для этой реакции будет включать только те ионы, которые образуют твердое тело, поэтому:
Ag + (водн.) + I — (водн.) → AgI (s)
Чтобы отработать эти реакции, вам нужно сначала потратить некоторое время на работу с правилами, а затем использовать приведенные ниже вопросы, чтобы проверить себя.
Практические проблемы и ответы
А теперь перейдем ко второй части этой лекции о реакциях ….
Кислоты и основания
Как мы видели, когда мы работали над номенклатурой, кислоты можно идентифицировать по тому, как их формула записана с ионизируемыми атомами водорода в передней части молекулы: H Cl, H 2 SO 4 и т. Д. Кислота определяется ее способностью отдавать этот водород (также называемый протоном), когда он находится в водном растворе.С другой стороны, основания обычно распознаются по присутствию гидроксид-иона в их формуле: Na OH , Ba ( OH ) 2 и т. Д. Мы определяем основание по его способности поглощать протоны из раствора.
Определение кислоты = молекула или другой объект, который может отдавать протон или принимать пару электронов в реакциях.
Основное определение = химическое соединение, которое отдает электроны или гидроксид-ионы или принимает протоны в реакциях.
Итак, теперь, когда мы знаем, что они собой представляют, что нам с ними делать? Что ж, всякий раз, когда кислота и гидроксидное основание взаимодействуют вместе, они всегда производят одни и те же два типа продуктов: соль и воду.
Пример: HCl (вод.) + NaOH (вод.) → NaCl (вод.) + H 2 O (л)
NaCl — это соль этой реакции, а вода вам уже знакома. Если мы посмотрим на чистое ионное уравнение для этой реакции, оно показывает, что движущей силой реакции является производство воды:
H + (водн.) + OH — (водн.) → H 2 O (л)
Когда вы взаимодействуете с кислотой и основанием, этот процесс называется нейтрализацией.Это связано с тем, что продукты реакции не вносят никаких протонов или гидроксид-ионов в раствор, кроме нормальной диссоциации воды в воде, которая является очень небольшой величиной (константа диссоциации Kw = 1.0x 10 -14 ). Концентрация H + , основанная на этой диссоциации, составляет 1,0 x 10 -7 M, и когда мы берем pH этого значения (-log (1,0 x 10 -7 )), он равен 7, что определяется как нейтральный pH.
А пока мы сконцентрируемся на реакциях сильных кислот и оснований.В таблице ниже указаны сильные кислоты и основания, которые вам необходимо знать. Все остальные кислоты и основания будут считаться слабыми для целей этого курса.
Вот некоторые практические задачи для реакций кислот и оснований:
Рабочий лист и ключ
Как называется кислотно-основная реакция?
Обновлено 26 марта 2020 г.
Розанн Козловски
Проверено: Lana Bandoim, B.S.
Прием антацидов от кислотного рефлюкса, изжоги или несварения желудка помогает облегчить жжение и боль.Антацид, содержащий такое основание, как карбонат кальция или гидроксид магния, снимает боль, нейтрализуя желудочную кислоту. Реакция между кислотой и основанием называется нейтрализацией.
Определение и примеры кислоты и основания
Кислота представляет собой химическое соединение, которое отдает ионы водорода H + в водном растворе; он теряет протон. Основание создает ионы гидроксида ОН- в водном растворе; он получает протон.
Кислотно-основная реакция дает воду и соль.В указанной выше реакции образуется соль хлорида натрия. Обратите внимание, что солевой продукт реакции нейтрализации имеет более широкое значение, чем поваренная соль, хлорид натрия. Он относится к соединению, в котором две части связаны друг с другом посредством ионной связи.
Помимо антацидов, при оказании первой помощи используются и другие примеры реакций нейтрализации. И кислоты, и щелочи могут вызвать ожоги, и если раствор попадет на кожу, можно применить противоположное, чтобы нейтрализовать эффект. Например, основная пищевая сода (NaHCO 3 ) может использоваться для кислотных ожогов, а кислотный уксус (CH 3 COOH) может лечить щелочь.
Уравнения кислотно-основных реакций
Общее уравнение для кислотно-основной реакции:
кислота + основание = соль + вода
Химическое уравнение реакции соляной кислоты и гидроксида натрия:
HCl (водн.) + NaOH (водн.) → NaCl (водн.) + H 2 O ( l )
Ионное уравнение указанной выше реакции:
H + ( водн.) + Cl — (водн.) + Na + (водн.) + OH — (водн.) → Na + (водн.) + Cl — ( aq) + H 2 O ( l )
Обратите внимание, что ионы хлора и натрия находятся по обе стороны уравнения, а чистое ионное уравнение выглядит следующим образом:
H + (водн.) + OH — (водн.) → H 2 O ( l )
Все реакции между сильным основанием и сильной кислотой нейтрализуются по этому уравнению.Обратите внимание, что эта реакция соответствует определениям кислот и оснований; присутствие H + и OH — в водном растворе. Кислота теряет ион H + , и он переходит в основание.
Реакция кислоты и основания равной величины приведет к pH, равному 7, нейтральному раствору. Если сильная кислота, такая как соляная кислота, и сильное основание, например гидроксид натрия, вступают в реакцию, получится нейтральный раствор.
Реакция нейтрализации и ее эквиваленты
В реакции нейтрализации эквивалентные количества кислоты и основания объединяются с образованием эквивалентных количеств соли и воды.Эквивалент — это реакционная способность химического вещества.
В кислотах эквивалентной единицей является количество ионов водорода (H + ), предусмотренных для реакции. В соляной кислоте, HCl, эквивалент равен 1, а в серной кислоте, H 2 SO 4 , он равен 2.
В основаниях эквивалентно числу гидроксид-ионов (OH — ) обеспечил реакцию. В гидроксиде натрия NaOH эквивалент равен единице, а в гидроксиде бария Ba (OH) 2 — двум.
Один эквивалент кислоты реагирует с одним эквивалентом основания. Кислота HCl и основание NaOH, оба в одном эквиваленте, обладают одинаковой реакционной способностью. Если H 2 SO 4 , с двумя эквивалентами, реагирует с NaOH, с одним эквивалентом, потребуется вдвое больше NaOH, чтобы прореагировать с серной кислотой.
Реакции нейтрализации: титрование
В химической лаборатории кислотно-основные реакции обычно завершаются посредством процесса, называемого титрованием.Раствор известной концентрации осторожно добавляют к раствору неизвестной концентрации.
Индикатор, например фенолфталеин, добавлен в неизвестной концентрации. Когда раствор меняет цвет (например, бесцветный на розовый), точка титрования или нейтрализации была достигнута, и можно рассчитать неизвестную концентрацию.
Обратимые и необратимые кислотно-основные реакции в органической химии
Обратимые и необратимые кислотно-основные реакции
В прошлый раз мы узнали о pKa и о том, что это самое близкое к универсальному измерению силы всех видов разные кислоты и основания.Я также сослался на сообщение о том, как использовать таблицу pKa (ключевой урок: более сильная кислота плюс более сильное основание дает более слабую кислоту и более слабое основание).
Как далеко мы можем это продвинуть? Рассмотрим три наглядных примера.
Содержание
- Необратимая кислотно-основная реакция: сильная кислота (HCl) плюс сильное основание (NaOH) дает воду
- Легко обратимая кислотно-основная реакция: метанол (pKa 15,2) с водой (pKa 14 )
- В какой момент кислотно-основная реакция становится необратимой для практических целей?
- Применение: При конденсации Клайзена исходный сложный эфир менее кислый, чем CH 3 OH примерно на 10 pK a единиц
1.Необратимая кислотно-основная реакция: сильная кислота (HCl) плюс сильное основание (NaOH), дающая воду
На одном из крайних значений у нас есть один моль действительно сильной кислоты — скажем, соляная добавка (HCl), pKa –8. И к нему мы добавляем (медленно!) Раствор воды, содержащий один моль гидроксида натрия (сопряженное основание воды, pKa 15,7).
HCl и NaOH реагируют с образованием воды и NaCl. Насколько благоприятна эта реакция? Мы можем сделать приблизительную оценку. PKa HCl составляет -8.Гидроксид натрия является сопряженным основанием h3O (pKa 15,7). Это разница примерно в 24 единицы pKa — и поскольку каждая единица pKa представляет собой один порядок величины, эта реакция является благоприятной с константой равновесия примерно 10 в степени 24.
Для всех целей и задач реакция с равновесием постоянная эта огромная необратима.
Это означает, что HCl и NaOH полностью расходуются, когда они взаимодействуют вместе, давая только h3O и NaCl.
2.Легко обратимая кислотно-основная реакция: метанол (pKa 15,2) с водой (pKa 14)
А как насчет другой крайности: реакция метанола (pKa 15,2) с гидроксидом натрия (сопряженное основание воды, pKa 14)?
Ни одна из сторон кислотно-щелочной реакции не является предпочтительной. Здесь мы имеем дело с очень небольшой разницей в pKa — всего 0,5 единицы pKa. Таким образом, константа равновесия здесь будет только около 10 в степени 0,5 -> 3,16 в сторону получения более слабой кислоты (воды) и более слабого основания (Ch4O (-).
В состоянии равновесия мы ожидаем получить смесь примерно 75% Ch4O (-) [более слабое основание] и 25% HO (-) [более сильное основание].
Другими словами, оба вида присутствуют в растворе.
3. В какой момент кислотно-основная реакция становится необратимой для практических целей?
Итак, как далеко мы можем это растянуть? Между этими двумя крайностями, в какой момент реакция становится необратимой для практических целей?
На этот счет нет жесткого правила. Но для практических целей хорошее эмпирическое правило составляет около 10 единиц пКа.
То есть, если разница в pKas между кислотой и основанием (фактически, — сопряженная кислота основания ) составляет около 10 единиц pKa или меньше, полезно рассмотреть их кислотно-щелочную реакцию на быть в равновесии.
Подумайте, что это значит — соотношение одна молекула к 10 миллиардам может иметь значение в реакции!
Один из 10 миллиардов может показаться не таким уж большим.Но если учесть, что моль содержит 10 молекул в степени 23, и каждая из них сталкивается миллионы раз в секунду, шансы на самом деле не так плохи, как кажется. Эти реакции могут произойти. Если бы ваш единственный шанс купить частный самолет был связан с выигрышем в лотерею Powerball, но вы могли заполнять сотни тысяч заявок в секунду, каждую секунду, вы были бы у дилера G5 к следующему вторнику.
Вот пример, который вы увидите в организации 2. Конденсация Клайзена начинается с депротонирования сложного эфира (pKa ~ 24) ионом алкоксида (основание конъюгата спирта, pKa ~ 15).Примерно 10 в степени 9 не способствует, поскольку мы переходим от более слабого основания (алкоксида) к более сильному (депротонированный сложный эфир, он же енолят сложного эфира).
Несмотря на то, что в равновесии присутствует лишь небольшое количество депротонированного сложного эфира, этого может быть достаточно, чтобы реакция прошла! Вы можете поверить мне на слово — что это практическое правило применимо — и оставить все как есть. Или, если вы предпочитаете на практике применить эту концепцию, я закончу на этом.
4. Применение: в конденсации Клайзена исходный эфир менее кислый, чем CH 3 OH примерно на 10 pK a единиц
Одно применение этой концепции можно найти в конденсации сложных эфиров Клайзена. Конденсация Клайзена включает добавление депротонированного сложного эфира («енолят») к другому эквиваленту сложного эфира посредством реакции присоединения-элиминирования (более подробно здесь и здесь).
Первой стадией является депротонирование сложного эфира алкоксид-ионом [в данном случае CH 3 O (-)], как упомянуто выше.Этот енолят может затем атаковать второй эквивалент сложного эфира, который затем удаляет эквивалент иона алкоксида. Эта реакция также потенциально обратима. Однако протоны нового продукта — «бета-кетоэфира» — значительно более кислые, чем протоны исходного сложного эфира, и кислотно-основная реакция между ним (pK a 12) и алкоксидом (pK a 15) весьма благоприятно.
Равновесие в конечном итоге благоприятствует конечному продукту, поскольку сопряженное основание бета-кетоэфира (pK a 12) значительно слабее, чем метанол (pKa ~ 15).
Другими словами, даже если первый шаг крайне неблагоприятен, это компенсируется тем, что существует очень хорошая «движущая сила» для последующей реакции.
Следующее сообщение: Кислотно-основные реакции происходят быстро
Введение в кислотно-основные реакции в пищевых продуктах
Сок красной капусты меняет цвет, когда вы добавляете немного сока лайма или ложку пищевой соды. Благодаря разрыхлителю торт красиво поднимается в духовке. Вы можете «приготовить» рыбу, добавив сок лимона и лайма, получается севиче.
Что общего у всех этих примеров?
Все они являются примерами кислотно-основных реакций. Эти типы реакций — лишь одна из многих химических реакций, происходящих с едой (другой — потемнение бананов). У всех кислотно-основных реакций много общего, хотя их эффект (изменение цвета, дрожжевой пирог или «приготовленная» рыба) может сильно отличаться. В этом посте мы обсудим научные основы этих типов реакций.
Когда пищевая кислота является кислой?
Кислые продукты довольно распространены.Лимонно-лаймовый сок, уксус, йогурт и пахта — все это кислые продукты. Если вы выпьете что-нибудь из этого, вы почувствуете кислинку.
Противоположность кислой пище (или напитку) — щелочная. Хороший пример — пищевая сода. Пища, которая не является ни кислой, ни щелочной, называется нейтральной.
Химики очень хорошо определяют, является ли что-то кислым или щелочным. Чтобы определить, что это за еда, вы пользуетесь шкалой pH. Шкала от 0 до 14. Любая пища со значением pH 7 нейтральна.Пища с pH ниже 7 является кислой, а с pH выше 7 — щелочной.
Чем дальше от нейтрального значения 7, тем более кислая (или щелочная) пища. Например, лимонный сок имеет значение pH 2–3, а йогурт — около 4–4,5. Таким образом, лимонный сок более кислый, чем йогурт.
Определение значения pH
Вы можете измерить pH продукта питания с помощью pH-метра или специальной полоски для измерения pH. Если вы используете pH-метр, вы можете получить конкретное значение для измеряемого продукта, например.грамм. 2.3. Однако, поскольку продукты питания от природы весьма разнообразны, между схожими продуктами может быть довольно много различий. Один лимон может иметь значение pH 2,1, а другой — 2,4. Вот почему вы часто видите диапазоны для определенных продуктов.
Примеры значений pH в пищевых продуктах
Продукты питания имеют широкий спектр значений pH, хотя большинство из них либо около 7 (таким образом, нейтрально), либо ниже семи. Поскольку пищевые продукты, особенно свежие продукты, такие как фрукты, овощи и мясо, не очень постоянны по своим свойствам, точное значение pH будет отличаться для каждого продукта.На показатель pH влияет множество факторов, в том числе спелость продукта. В приведенном ниже списке приведены некоторые общие рекомендации (источник).
- Яблоки: 3,3 — 4,0
- Авокадо: 6,2 — 6,6
- Баклажаны: 4,5 — 5,3
- Фруктовый джем: 3,5 — 4,5
- Мед: 3 , 9
- Уксус: 2,0 — 3,4
Какой показатель pH используется в пищевой науке?
Значение pH влияет на вкус вашей еды, но также может иметь большое значение для срока хранения ваших продуктов, как долго они остаются безопасными.Пища может испортиться и испортиться из-за роста нежелательных микроорганизмов. Однако многие микроорганизмы перестают расти, когда значение pH падает ниже определенного значения. Таким образом, достаточно понизить уровень pH, чтобы еда дольше оставалась безопасной.
Помимо срока годности, значение pH можно использовать для мониторинга пищевых процессов. Например, приготовление йогурта в основном заключается в снижении уровня pH молока. Из-за более низкого значения pH молоко загустеет. Производители будут знать, при каком значении pH процесс завершается.Таким образом, измеряя это значение, они могут отслеживать процесс, не осматривая и не пробуя продукт.
Йогурт — это пример кислой пищи.
Что такое значение pH?
Так что же делает эти продукты щелочными или кислыми? В то время как сахар делает что-то сладкое, а соль делает что-то соленым, протоны делают что-то кислым.
Протоны
Протоны — это одиночные атомы водорода (H), которые пропускают свой электрон. В результате они заряжены положительно.Химики записывают протоны как: H + .
Протоны играют роль во многих реакциях в организме человека и в большинстве живых организмов в этом отношении. Так откуда они?
Один из способов — через естественные кислые молекулы (например, лимонная кислота). Они довольно легко передают один из своих протонов. Когда они это делают, концентрация протонов увеличивается. Если концентрация протонов увеличивается, значение pH пищи снижается. Больше протонов — больше кислотности.Это соотношение можно выразить следующей формулой:
Как видно из этих формул, существует баланс между протонами (H + ) и гидроксид-ионами (OH — ). Они противоположны друг другу. Больше протонов означает более низкое значение pH, тогда как большее количество гидроксид-ионов приводит к более высокому значению pH (или более низкому значению pOH). Чаще всего встречаются только значения pH, значение pOH практически не используется. Эта взаимосвязь лежит в основе кислотно-основных реакций и берет свое начало в молекуле воды.
Вода и кислотность
Вода сама по себе нейтральна, но может расщепляться как на протон, так и на гидроксид-ион.
Вместо одиночного протона образуется ион гидроксония (H 3 O + ). Это произойдет в присутствии воды, поэтому во многих случаях вы можете использовать их взаимозаменяемые. (Если вы не знакомы с записью химических реакций, сначала прочтите основы химических реакций.)
В нейтральной среде существует равное количество протонов (H + ) и гидроксид-ионов (OH — ).Это равновесие нарушается только в том случае, если пища кислая или щелочная. Кислотные или щелочные молекулы могут увеличивать содержание протонов или гидроксидов.
Когда кислота (AH в примере ниже) присутствует в воде, она снижает значение pH, высвобождая протон:
С другой стороны, когда присутствует щелочное вещество, оно образует гидроксид-ион, в результате чего влага становится более щелочной.
Кислотно-основные реакции
Это значение pH является сильным индикатором типов химических реакций, которые могут произойти.В кислой среде могут происходить разные типы реакций, в отличие от щелочных.
Общим для всех кислотно-основных реакций является обмен протонами. Кислота выделяет протон (увеличивая концентрацию протонов, тем самым понижая pH). С другой стороны, щелочное вещество будет иметь тенденцию принимать протон.
Давайте еще раз посмотрим на реакции, которые мы видели ранее. Посмотрите, как обмениваются эти протоны.
Равновесные реакции
Одна вещь, которую вы могли бы заметить в этих реакциях, — это двойные стрелки на обеих.Эти двойные стрелки указывают на то, что это равновесная реакция. Другими словами, реакция может происходить слева направо и справа налево. Это не означает, что это происходит в одинаковой степени в обоих направлениях.
Очень сильные кислоты отдают (почти) все свои протоны. Это, соответственно, сильные кислоты. Однако в большинстве случаев только определенный процент кислот отдает свои протоны. Это слабые кислоты. То же самое касается их щелочных аналогов, оснований.
Сколько кислоты отдаст протон, можно выразить с помощью константы равновесия. Для приведенного выше уравнения кислоты (AH) оно выглядит так:
[] обозначает концентрацию. Поскольку концентрация воды практически постоянна, это часто не учитывается. Кислота, которая отдает почти все свои протоны, будет иметь очень низкую концентрацию AH и высокую концентрацию A — . В результате значение K a будет большим.Чем больше значение K a , тем сильнее кислота.
Важно знать, что эта константа равновесия изменяется с температурой. Таким образом, кислота может более или менее легко выделять протоны при разных температурах.
Для щелочного вещества уравнение равновесия очень похоже:
Применение кислотно-основных реакций
На практике вы не будете часто обсуждать значения K a и K b . Однако вы будете видеть их эффекты повсюду вокруг себя.Например, пищевая сода является примером щелочного пищевого ингредиента. Сравнение этих химических реакций с этими основными формулами покажет много общего.
То же самое и с краснокочанной капустой. Цвет краснокочанной капусты меняется в зависимости от pH окружающей жидкости. Это вызвано кислотно-щелочной реакцией с молекулами, придающими краснокочанной капусте ее цвет!
Конечно, кислота — это не только химические реакции. Это также очень важно для вкуса и баланса блюда.Некоторым блюдам просто нужна кислота (например, лимонный сок), чтобы они хорошо подействовали. Самин Носрат прекрасно объясняет эту сторону кислоты в своей книге: соль, жир, кислота, тепло.
Список литературы
Университет Клемсона, Значения pH обычных пищевых продуктов и ингредиентов, ссылка; источник значений pH продуктов, упомянутых в этой статье
.

