Содержание
формулировка Ж. Пруста и современная — урок. Химия, 8–9 класс.
Пример:
углекислый газ может быть получен в результате сгорания угля, метана или при разложении известняка. Но в любом случае в порции углекислого газа число атомов кислорода будет в два раза больше числа атомов углерода, а массовые доли углерода и кислорода всегда равны \(27,29\) % и \(72,71\) %.
Развитие химии внесло дополнения в закон постоянства состава. Оказалось, что этот закон строго выполняется только для веществ молекулярного строения. Так, в любой молекуле углекислого газа содержится один атом углерода и два атома кислорода, и состав этого вещества изменяться не может.
Молекула углекислого газа
Молекулярное строение имеют все газообразные и жидкие вещества, а также твёрдые вещества с низкими температурами плавления. Постоянный состав имеют: вода, сернистый газ, сероводород, метан, аммиак, кислоты, спирт, сахар, глюкоза и т. д.
д.
Количественный состав веществ немолекулярного строения может несколько изменяться в зависимости от способа получения.
Поваренная соль состоит из атомов натрия и хлора, расположенных в определённом порядке. Этот порядок может нарушаться, поэтому состав разных образцов соли несколько отличается. В поваренной соли, полученной разными способами, на \(1\) атом натрия может приходиться от \(0,99\) до \(1,01\) атомов хлора. Однако условно для простоты обычно указывают округлённые целые числа.
Кристалл поваренной соли
Немолекулярное строение имеют и другие соединения (питьевая сода, мел, оксиды металлов, их соли), песок и некоторые другие вещества. Для этих веществ закон постоянства состава выполняется только приблизительно.
Современная формулировка закона постоянства состава:
Всякое чистое вещество молекулярного строения независимо от места нахождения и способа получения имеет постоянный качественный и количественный состав.
Из закона постоянства состава следует, что при образовании сложного вещества химические элементы соединяются в определённых численных и массовых соотношениях.
Закон постоянства состава веществ
Данный урок посвящен изучению закона постоянства состава вещества. Из материалов урока вы узнаете, кто открыл этот закон.
I. Открытие закона постоянства состава вещества
К основным законам химии относится закон постоянства состава:
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г.
Он писал: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
Чтобы получить сульфид железа (II) FeS, мы смешиваем железо и серу в соотношении 7:4.
Посмотрите видео-эксперимент.
Если смешать их в другой пропорции, например 10:4, то химическая реакция произойдет, но 3 г железа в реакцию не вступит. Почему наблюдается такая закономерность? Известно, что в сульфиде железа (II) на каждый один атом железа приходится один атом серы. Следовательно, для реакции нужно брать вещества в таких массовых соотношениях, чтобы сохранялось соотношение атомов железа и серы (1:1). Поскольку численные значения атомных масс Fe, S и их относительных атомных масс Ar (Fe), Ar (S)совпадают, можно записать: Ar (Fe) : Ar (S) = 56:32 = 7:4.
Отношение 7:4 сохраняется постоянно, в каких бы единицах массы ни выражать массу веществ (г, кг, т, а.е.м.). Большинство химических веществ обладает постоянным составом.
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава.
Вещества, имеющие переменный состав существуют, их назвали в честь Бертолле – бертоллидами.
Бертоллиды — соединения переменного состава, не подчиняющиеся законам постоянных и кратных отношений. Бертоллиды являются нестехиометрическими бинарными соединениями переменного состава, который зависит от способа получения. Многочисленные случаи образования бертоллидов открыты в металлических системах, а также среди оксидов, сульфидов, карбидов, гидридов и др. Например, оксид ванадия(II) может иметь в зависимости от условий получения, состав от V0,9 до V1,3.
По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые — бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н2О, НCl, ССl4, СO2. Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Cостав соединений молекулярной структуры, т.е. состоящих из молекул, — является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
II. Решение задач
На основе закона постоянства состава можно производить различные расчёты.
Задача №1
В каких массовых отношениях соединяются химические элементы в серной кислоте, химическая формула которой H2SO4?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32, Ar(O)=16.
Определим массовые отношения этих элементов в формуле H2SO4
m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2 : 32 : 64 = 1 : 16 : 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г — Н, 16 г — S и 32 г — О.
Задача №2
Водород соединяется с серой в массовых отношениях 1 : 16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода.
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32.
Обозначим количество атомов водорода в формуле — х, а серы — у: НхSу
m(H) : m(S) = хAr(H) : уAr(S)= х1 : у32 = (2*1) : (1*32) = 2 : 32 = 1 : 16
Следовательно, формула сероводорода Н2S
Задача №3
Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и кислорода соответственно равны 2:1:2?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(Cu)=64, Ar(S)=32, Ar(O)=16.
Обозначим количество атомов меди в формуле — х, серы — у, а кислорода — z: CuxSyOz
m(Cu) : m(S) : m(O) = хAr(Cu) : уAr(S) : zAr(O) = x64 : y32 : z16 = (1*64) : (1*32) : (4*16) = 64:32:64 = 2:1:2
III. Контрольные задачи
№1. Применяя сведения об относительных атомных массах химических элементов, вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H2CO3.
№2. Определите массу кислорода, реагирующего без остатка с 3 г водорода, если водород и кислород в данном случае соединяются соответственно в соотношении 1 : 8?
№3. Углерод и кислород в углекислом газе соединяются в массовых отношениях 3 : 8.
Выведите химическую формулу углекислого газа
№4. Определите массу водорода, реагирующего без остатка с 48 г кислорода, если водород и кислород в данном случае соединяются в соотношеннии 1:8.
ЦОРы
Видео:“Реакция соединения серы с железом”
Закон постоянства состава — Справочник химика 21
Эквивалент. Закон эквивалентов. Из закона постоянства состава следует, что элементы соединяются друг с другом в стро.го определенных количественных соотношениях. Поэтому в химию были введены понятия эквивалента и эквивалентной массы (слово эквивалентный в переводе означает равноценный ). [c.31]
Закон эквивалентов. Из закона постоянства состава следует, что элементы соединяются друг с другом в стро.го определенных количественных соотношениях. Поэтому в химию были введены понятия эквивалента и эквивалентной массы (слово эквивалентный в переводе означает равноценный ). [c.31]
Наряду с соединениями, для которых справедливы законы постоянства состава и кратных отношений, существуют соединения переменного состава — многие твердые оксиды, сульфиды, нитриды, карбиды и пр. [c.260]
Стехиометрия — умение о составе веществ, основанное па законах постоянства состава, эквивалентов и кратных отношений (законы стехиометрии), [c.152]
Более того, Пруст установил, что постоянство соотношений компонентов наблюдается и в ряде других соединений. Он сформулировал общее правило, согласно которому все соединения содержат элементы в строго определенных пропорциях (а не в любых сочетаниях) вне зависимости от условий получения этих соединений. Это правило называется законом постоянства состава, или иногда законом Пруста. (Пруст также показал, что Бертолле, пытаясь доказать, что состав определенных соединений меняется в зависимости от метода их получения, пришел к ошибочным выводам из-за неточности анализов и использования недостаточно чистых исходных соединений.) [c.54]
Это правило называется законом постоянства состава, или иногда законом Пруста. (Пруст также показал, что Бертолле, пытаясь доказать, что состав определенных соединений меняется в зависимости от метода их получения, пришел к ошибочным выводам из-за неточности анализов и использования недостаточно чистых исходных соединений.) [c.54]
Закон постоянства состава. Следующим шагом в развитии химии явилось установление положения о постоянстве состава вещества [c.14]
ВИДНО, что Пруст прав. Закон постоянства состава был уточнен и стал краеугольным камнем химии . [c.55]
Другими словами, если признать атомное строение материи, то из этого положения закон постоянства состава вытекает как естественное следствие. Более того, поскольку справедливость закона постоянства состава — неоспоримый факт, то, следовательно, атомы действительно являются неделимыми частицами. [c.55]
В честь Дальтона, широко применявшего молекулярно-атомную теорию к химическим явлениям, и Бертолле, впервые высказавшего предположение о существовании соединений, не подчиняющихся законам постоянства состава и кратных отношений. [c.261]
[c.261]
И тем не менее с момента открытия закона Пруста существовали серьезные сомнения в его справедливости. В конце концов, почему закон постоянства состава всегда должен быть справедлив Почему какое-то соединение всегда должно содержать 4 части л и 1 часть у, и почему оно не может содержать, например, 4,1 или 3,9 части х и 1 часть у Если допустить, что материя является сплошной (а не дискретной), то понять это трудно. Почему элементы не могут смешиваться в несколько иных пропорциях [c.55]
Выводы Канниццаро были последним звеном в цепи логических рассуждений, которая вела свое начало от Пруста и его закона постоянства состава. Спор был окончен, настало время расчетов. Ученые могли находить точную атомную массу любого элемента, входящего в соединения, плотность паров которых удавалось измерить. Зная атомные массы элементов, можно было вычислять процентный состав новых соединений, что давало возможность однозначно устанавливать их химические формулы. На этой основе было введено понятие моля, которое мы уже сформулировали в гл. 1. Моль определялся как количество вещества в граммах, численно равное его молекулярной массе в шкале Канниццаро (которой мы пользуемся и сегодня разумеется, к нашему времени точность ее стала значительно выше). Отсюда ясно, что моль любого вещества должен содержать одинаковое число молекул. Хотя значение этого числа сначала было неизвестным, ему присвоили название числа Авогадро N в знак запоздалой признательности ученому, внесшему столь большой вклад в развитие химии. [c.289]
На этой основе было введено понятие моля, которое мы уже сформулировали в гл. 1. Моль определялся как количество вещества в граммах, численно равное его молекулярной массе в шкале Канниццаро (которой мы пользуемся и сегодня разумеется, к нашему времени точность ее стала значительно выше). Отсюда ясно, что моль любого вещества должен содержать одинаковое число молекул. Хотя значение этого числа сначала было неизвестным, ему присвоили название числа Авогадро N в знак запоздалой признательности ученому, внесшему столь большой вклад в развитие химии. [c.289]
В отличие от закона сохранения массы, справедливость которого полностью подтверждена открытиями, сделанными после его установления, законы постоянства состава и кратных отношений оказались не столь всеобщими. В связи с открытием изотопов ( 35) выяснилось, что соотношение между массами элементов, входящих в состав данного вещества, постоянно лишь при условии постоянства изотопного состава этих элементов. При изменении изотопного состава элемента меняется и массовый состав соединения. Например, тяжелая вода 72) содержит около 2Ь% (масс.) водорода, а обычная вода лишь 11%. [c.24]
Например, тяжелая вода 72) содержит около 2Ь% (масс.) водорода, а обычная вода лишь 11%. [c.24]
В действительности состав некоторых соединений может колебаться в определенных пределах, но это особые случаи. Состав тех простых соединений, которыми занимались химики до 1800 г,, строго соответствует требованиям закона постоянства состава. [c.55]
Это утверждение получило название закона постоянства состава Пруста. Спор между Бертолле и Прустом принес большую пользу, потому что многие химики отправились в свои лаборатории доказывать идеи, приверженцами которых они были, а результатом явилось быстрое накопление большого объема знаний о составе химических соединений. Конечно, прав оказался Пруст и все же существуют твердые кристаллические вещества, в которых из-за наличия дефектов кристаллической структуры подлинное отношение атомов не совпадает с предсказываемым идеальной химической формулой. Например, состав сульфида железа может варьировать от Fe, (S до FeS,, в зависимости от способа получения образца. [c.275]
[c.275]
Закон постоянства состава. Закон кратных отношений 23 [c.23]
Закон постоянства состава формулируется таким образом [c.14]
Имеет ли соединение постоянный состав Закон постоянства состава. Эквивалентные отношения и соединительные веса. [c.267]
Д. Дальтон (1776—1844 гг.) в дальнейшем, используя открытый им закон кратных отношений, закон эквивалентов и закон постоянства состава, создал новую версию атомистической теории, основанную на количественных соотношениях, возникающих при взаимодействии между химическими элементами. [c.15]
Клод Бертолле (1748-1822). Французский химик, противник закона постоянства состава соединений. [c.66]
Примечание значения х У1 у — чрезвычайно а-лы, знаки равенства в некоторых случаях поставлены условно. Предложите, как следует дополнить закон постоянства состава или дайте новую его формулировку. [c.18]
[c.18]
В заключение еще раз отметим, что сформулированный Прустом закон постоянства состава Пропорции, в которых два элемента соединяются при образовании определенного химического вида, не способны к непрерывным изменениям — действителен лишь для молекул, состоящих из небольшого числа атомов и настолько мало взаимодействующих между собой, что этим можно пренебречь. Любое кристаллическое вещество, не имеющее молекулярного строения, в большей или меньшей степени должно иметь переменный состав. Причина этого лежит в энергетических закономерностях—проявлении энтропийного фактора (см. с. 124). Полное структурное упорядочение может реализоваться лишь при абсолютном нуле, О К. [c.107]
Закон постоянства состава. Из представлений, лежащих в основе современной химии, вторым по значимости после принципа сохранения массы и энергии является закон постоянства состава химических соединений. [c.13]
I видимому, Л. Больцман. Тем не менее, большинство моделей этих систем детерминистские по своей сути. Другой недостаток, препятствующий моделированию сложных систем — стремление к описанию их на уровне взаимодействия элементарных частей системы. В сложных системах процессы являются стохастическими. Детерминированность таких систем кажущаяся. Квантовая теория изменила представления об атомах и молекулах. Одно из крупнейших достижений физики и химии XX века — теория гибридизации Л. Полинга, обычно понимается довольно узко как образование сложных электронных оболочек, хотя истинный смысл этой теории в том, что реальный атом в молекуле и изолированный атом таблицы Менделеева — разные вещества. То же относится к молекулам молекула в почве, лаборатории и организме — разные объекты. Состояние вещества зависит от среды. Природные геохимические и биогеохимические системы — почвы, нефти, водные биоценозы состоят из бесконечного числа компонентов. В природе нет и не может быть абсолютно чистого вещества. Понятие чистого вещества противоречит понятию памяти сред.
Больцман. Тем не менее, большинство моделей этих систем детерминистские по своей сути. Другой недостаток, препятствующий моделированию сложных систем — стремление к описанию их на уровне взаимодействия элементарных частей системы. В сложных системах процессы являются стохастическими. Детерминированность таких систем кажущаяся. Квантовая теория изменила представления об атомах и молекулах. Одно из крупнейших достижений физики и химии XX века — теория гибридизации Л. Полинга, обычно понимается довольно узко как образование сложных электронных оболочек, хотя истинный смысл этой теории в том, что реальный атом в молекуле и изолированный атом таблицы Менделеева — разные вещества. То же относится к молекулам молекула в почве, лаборатории и организме — разные объекты. Состояние вещества зависит от среды. Природные геохимические и биогеохимические системы — почвы, нефти, водные биоценозы состоят из бесконечного числа компонентов. В природе нет и не может быть абсолютно чистого вещества. Понятие чистого вещества противоречит понятию памяти сред. В дальнейшем будет показано непостоянство закона постоянства состава. Кроме того, для таких систем характерны законы квантовой. логики. В конечном счете, это приводит к замыканию макромира таких систем [c.22]
В дальнейшем будет показано непостоянство закона постоянства состава. Кроме того, для таких систем характерны законы квантовой. логики. В конечном счете, это приводит к замыканию макромира таких систем [c.22]
Как и закон постоянства состава, закон кратных отношений предусматривает постоянство атомной массы любого химического элемента, что возможно только при условии постоянства его изотопного состава. [c.14]
Доказательство постоянства состава для самых разнообразных химических соединений уже являлось само по себе свидетельством в пользу дискретности строения материи. Применение же закона постоянства состава для анализа любого из указанных рядов показывает, что существование двух (или нескольких) соединений, образующихся при взаимодействии любой пары химических элементов, возможно лишь в том случае, когда состав соединений будет отличаться один от другого на целые атомы. Естественно, что эти различия в составе химических соединений ряда, впрочем, как и сами основные законы химии, справедливы лишь при условии, что материя действительно состоит из мельчайших неделимых частиц. [c.16]
[c.16]
В начале XIX в. Ж- Пруст в длительном споре с К- Бертолле отстаивал мысль, что вещество независимо от способов получения обладает одним и тем же составом. Это утверждение было сформулировано в закон постоянства состава. Исходя из данных о составе вещества выводилась его химическая формула с постоянным количественным соотношением элементов ( Oj, HjO, СН4). Поэтому соединения постоянного состава были названы стехиометрическими соединениями (стехиометрия от греческого stoi heian — основание, элемент и metreo — мерю). Закон постоянства состава и стехио-метричность соединений долгое время считались незыблемыми. Однако в начале XX в. И. С. Курнаков на основании своих исследований пришел к выводу о существовании нестехиометрических соединений, т. е. характеризующихся переменным составом. Н. С. Курнаков отмечал, что было бы ошибкой считать соединения переменного состава… чем-то редким и исключительным . Соединения постоянного состава Н. С. Курнаков назвал дальтонидами в честь Д. Дальтона, широко применявшего атомно-молекулярную теорию к химическим явлениям. Нестехиометрические соединения были названы в честь К. Бертолле бертоллидами. [c.105]
Дальтона, широко применявшего атомно-молекулярную теорию к химическим явлениям. Нестехиометрические соединения были названы в честь К. Бертолле бертоллидами. [c.105]
И наконец, использование закона постоянства состава и закона кратных отношений позволило Д. Дальтону установить значения относительных атомных масс элементов, принимая за единичную — массу атома водорода. [c.16]
Азеотропные смеси не являются химическими соединениями. Это подтверждается тем, что состав азеотропной смеси зависит от давления, а следовательно, не соблюдается обязательный для каждого химического соединения закон постоянства состава. Так, например, смесь этиловый спирт — вода при давлении 101,3 кПа образует азеотроп, содержащий 88,4 мол.% спирта. При понижении давления концентрация спирта в азеотропе увеличивается, а при абсолютном давлении ниже 12 кПа азеотропная смесь вовсе не образуется. [c.17]
Структура книги построена следующим образом первая часть, методологическая, написана сравнительно популяр(ю и посвящается критике атомизма, закона постоянства состава, представлению о энтропии, как мере хаоса, разрушающей ро.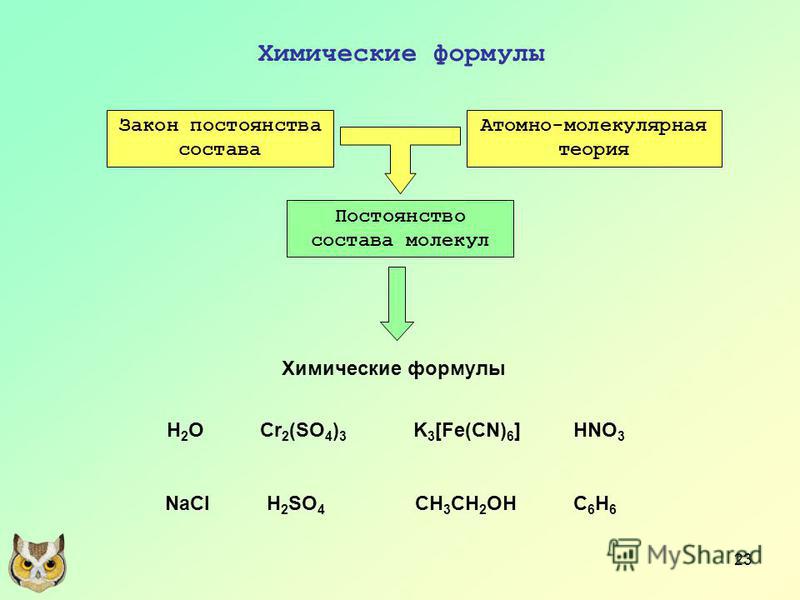 чп энтропии и ряду других догм естествознания. Вторая часть 6 [c.6]
чп энтропии и ряду других догм естествознания. Вторая часть 6 [c.6]
Природа опирается на законы развития многокомпонентных систем -веществ, завязанных в единое целое. Для систем — веществ не выполняются точно законы сохранения вещества, законы постоянства состава. [c.39]
Различные образцы одного и того же вещества, представляю-щег.о собой химическое соединение, содержат в своем составе одни и те же элементы и всегда в одинаковых пропорциях. При этом каким бы способом мы ни получали данное соединение, оно всегда имеет один и тот же состав. Таков смысл известного закона постоянства состава. [c.12]
Предложен системный подход к веществу, согласно которому все вещество в природе заключено не в молекулярные, а в многокомпонентные стохастические системы (МСС) с случайным распределением состава. Для вещества, как многокомпонентной системы, не выполним закон постоянства состава. Он справедлив с некоторой точностью только для основного, доминирующего в этой системе, компонента. [c.65]
[c.65]
Атомизм, сыгравший выдающуюся роль в прошлом, сейчас не способствует познанию и созданию единой картины Мира и приводит к утрате единства и целостности окружающей действительности и Человеческой личности. Атомизм теряет смысл при переходе от индивидуальных веществ к большим системам веществ, где необходимо учитывать значение примесей. К основным компонентам добавляются их спутники — примеси. Поэтому любое вещество -система. Предлагается системный подход к исследованию сложного вещества в отличии от классического подхода, учитывающего только индивидуальные основные компоненты, вещество рассматривается как единая стохастическая многокомпонентная система. Природа опирается на законы развития многокомпонентных систем — веществ, завязанных в единое целое. Для систем- веществ не выполняются законы постоянства состава. [c.105]
Таким образом, любое реальное химически чистое вещество содержит в своей системе один доминирующий (основной) компонент и разные компоненты — спутники. Закон постоянства состава выполним только для основного вещества. При системном подходе к веществу с учетом всех даже очень малых количеств компонентов закон постоянства состава не выполняется, суммы компонентов лишь приближенно равны целому. Отсюда следует невыполнимость закона действующих масс для системы в целом. [c.9]
Закон постоянства состава выполним только для основного вещества. При системном подходе к веществу с учетом всех даже очень малых количеств компонентов закон постоянства состава не выполняется, суммы компонентов лишь приближенно равны целому. Отсюда следует невыполнимость закона действующих масс для системы в целом. [c.9]
В результате установ. .еиия закона сохранения массы с конца ХУИ1 века в хи.мии прочно утвердились количественные методы исследования. Был изучен количественный состав многих веществ. При этом был установлен закон постоянства состава [c.23]
Еще в прошлом веке стехиометрические законы (законы постоянства состава, кратных отношений, эквивалентов), установленные для молекулярных соединений (газообразных и парообразных), завоевали в теоретической химии настолько прочные позиции, что отклонения от них для веществ любой структуры казались невозможными. Поэтому первые факты получения соединений непостоянного состава, соединений с нарушением стехиометрических соотношений пытались объяснить недостаточной очисткой препаратов. [c.199]
[c.199]
Поворотный этап в истории развития химической атомистики связан с именем шведского химика Иёнса Якоба Берцелиуса. Он вслед за Дальтоном внес особенно большой вклад в создание атомистической теории. Примерно о 1807 г. Берцелиус вплотную занялся определением точного элементного состава различных соединений. Проведя не одну сотню анализов, он представил столько доказательств, подтверждавших закон постоянства состава, что химики были вынуждены признать справедливость этого закона, а следовательно, и принять атомистическую теорию, которая непосредственно вытекала из закона постоянства состава. [c.61]
Расчеты технологических процссеов, в результате кото[)ы> происходит химическое изменение веш,ества, основаны на сто хиометрпческих законах законе постоянства состава и законе к р а т н (л х отношений, которые выра кают собой взаимное отношение атомов и молекул при их химическом взаимодействии друг с другом. [c.30]
Законы постоянства состава и кратных отношений вытекают из атомно-мо-леиулприого учения. Вещества с молекулярной структурой состоят из одинако-вмх молекул. Поэтому естественно, что состав таких веществ постоянен. При образовании из двух элементов нескольких соединений атомы этих элементов соединяются друг с другом в молекулы различного, но определенного состава. Например, молекула оксида углерода(И) построена из одного атома углерода и одного атома кислорода, а в состав молекулы диоксида углерода входит один атсм углерода и два атома кислорода. Ясно, что масса кислорода, приходящаяся па одну и ту же массу углерода, во втором из этих соедипепнй в 2 раза больше, чем в первом. [c.24]
Вещества с молекулярной структурой состоят из одинако-вмх молекул. Поэтому естественно, что состав таких веществ постоянен. При образовании из двух элементов нескольких соединений атомы этих элементов соединяются друг с другом в молекулы различного, но определенного состава. Например, молекула оксида углерода(И) построена из одного атома углерода и одного атома кислорода, а в состав молекулы диоксида углерода входит один атсм углерода и два атома кислорода. Ясно, что масса кислорода, приходящаяся па одну и ту же массу углерода, во втором из этих соедипепнй в 2 раза больше, чем в первом. [c.24]
В некоторых учебниках закон постоянства состава фО рмулируется так Состав химического со- [c.17]
И еще один пример. Наряду с соединениями постоянного состава (характеризующимися целочисленными стехио-метрическими коэффициентами), для которых справедливы законы постоянства состава и кратных отношений, существуют соединения переменного состава (многие оксиды, сульфиды, карбиды, нитриды и т. д.). Так, карбид циркония имеет состав не 2гС (в соответствии с местом элементов-партнеров в периодической системе элементов), а 2гС1—х, где X в границах области непрерывного изменения состава меняется в широких пределах, К подобным выводам можно прийти не только на основании изучения структуры, но и в результате термохимических исследований, так как в соответствии с непрерывным изменением состава будет непрерывно меняться и теплота образования таких солей. [c.29]
д.). Так, карбид циркония имеет состав не 2гС (в соответствии с местом элементов-партнеров в периодической системе элементов), а 2гС1—х, где X в границах области непрерывного изменения состава меняется в широких пределах, К подобным выводам можно прийти не только на основании изучения структуры, но и в результате термохимических исследований, так как в соответствии с непрерывным изменением состава будет непрерывно меняться и теплота образования таких солей. [c.29]
Необходимо заметить, что закон постоянства состава выполняется при условии, что образующие химическое соединение элементы мононзотопны (см. гл. I, 2) илн же имеют строго постоянный изотопный состав. Это естественно, поскольку закон постоян- TB.il состава предусматривает постоянство атомной массы любого химического элемента, что возможно только при условии строгой определенности его изотопного состава. [c.14]
Выше указывалось, что установление закона сохранения массы и закона постоянства состава позволило приписать атомам химических элементов строго определенную массу. Значения масс атомов, выраженные в обычно используемых единицах массы (абсолютная атомная масса rrijJ, очень малы, поэтому применять их в повседневной практике крайне неудобно. Например, масса атома углерода равна [c.17]
Значения масс атомов, выраженные в обычно используемых единицах массы (абсолютная атомная масса rrijJ, очень малы, поэтому применять их в повседневной практике крайне неудобно. Например, масса атома углерода равна [c.17]
Среди неорганических веществ почти 95% не имеют молекулярного строения и, следовательно, являются нестехиометрическими соединениями. Часто отклонения от стехиометрического состава так невелики, что при химическом анализе их установить не удается. (Этим и объясняется тот факт, что закон постоянства состава считали справедливым на протяжении столь долгого аремени.) Однако исследование свойств веществ, например электрической проводимости, окраски, магнитных и др., свидетельствует о наличии переменного состава. [c.107]
Таким образом, при системном подходе к веществу закон постоянства состава не выполняется, суммы компонентов лищь приближенно равны сумме частей. [c.45]
Химия (1986) — [
c. 12
12
]
Неорганическая химия (1987) — [
c.0
]
Химия для поступающих в вузы 1985 (1985) — [
c.21
]
Химия для поступающих в вузы 1993 (1993) — [
c.22
]
Основы общей химии (1988) — [
c.15
]
Пособие по химии для поступающих в вузы 1972 (1972) — [
c.19
]
Общая химия в формулах, определениях, схемах (1996) — [
c.10
]
Общая химия в формулах, определениях, схемах (0) — [
c.10
]
Общая химия в формулах, определениях, схемах (1985) — [
c.10
]
Общая химия в формулах, определениях, схемах (0) — [
c.10
]
Физика и химия в переработке нефти (1955) — [
c.143
]
Введение в молекулярную теорию растворов (1959) — [
c.19
,
c.23
]
Курс химии Часть 1 (1972) — [
c.21
]
Минеральные кислоты и основания часть 1 (1932) — [
c.68
]
Общая химия и неорганическая химия издание 5 (1952) — [
c.23
]
Курс общей химии (1964) — [
c.8
,
c.9
]
Очерк общей истории химии (1969) — [
c.437
]
Неорганическая химия (1979) — [
c.20
]
Неорганическая химия Издание 2 (1976) — [
c.15
,
c.17
]
Аналитическая химия (1975) — [
c.263
]
Химия (1985) — [
c.18
]
Строение неорганических веществ (1948) — [
c.198
,
c.649
]
Неорганическая химия (1978) — [
c.13
]
Неорганическая химия (1950) — [
c.10
]
Химия (1975) — [
c.10
]
Общая химия Издание 4 (1965) — [
c.10
]
Химия (1982) — [
c.10
]
Основы химической термодинамики и кинетики химических реакций (1981) — [
c.41
]
Введение в физическую химию и кристаллохимию полупроводников Издание 2 (1973) — [
c.11
,
c.46
,
c.118
,
c.450
,
c.465
]
Теоретические основы общей химии (1978) — [
c.8
]
Неорганическая химия (1994) — [
c.505
]
Химия Издание 2 (1988) — [
c.20
]
Введение в молекулярную теорию растворов (1956) — [
c.19
,
c.23
]
Общая химия Изд2 (2000) — [
c.14
]
Метод физико-химического анализа в неорганическом синтезе (1975) — [
c.45
]
Структуры неорганических веществ (1950) — [
c.19
]
Закон постоянства состава вещества химия формулировка. Закон постоянства состава вещества. Законы сохранения в химии. Химия и химическая технология
Пьер Кюри в 1895г. показал, что парамагнитная восприимчивость сильно зависит от температуры и для многих веществ обратно пропорциональна абсолютной температуре. Уравнение, выражающее эту зависимость,
называют законом Кюри, а входящую в него величину называют мольной константой Кюри
; D выражает диамагнитный вклад (он обычно отрицателен).
Первый член этого уравнения можно рассчитать на основе принципа Больцмана при допущении, что данное вещество содержит постоянные магнитные дипольные моменты, способные ориентироваться в магнитном поле. Такой теоретический расчет был выполнен французским ученым Полем Ланжевеном в 1905г. Он вывел уравнение
величина дипольного магнитного момента в расчете на один атом или молекулу.
Это уравнение позволяет рассчитать значения магнитных моментов по экспериментальной магнитной восприимчивости парамагнитных веществ, измеренной в некотором интервале температур. На основании полученных значений можно определить число не спаренных электронов в молекулах веществ.
Закон постоянства состава был впервые сформулирован французским ученым Ж. Прустом в 1808г.
Современная формулировка закона такова:
Закон постоянства состава вещества вытекает из атомно-молекулярного учения. Вещества с молекулярной структурой состоят из одинаковых молекул, потому и состав таких веществ постоянен. При образовании из двух элементов нескольких соединений атомы этих элементов соединяются друг с другом в молекулы различного, но определенного состава. Например, азот с кислородом образует шесть соединений.
В начале ХХ века выяснилось, что соединения переменного состава встречаются не только среди соединений металлов друг с другом, но и среди других твердых тел, например оксидов, сульфидов, нитридов, карбидов и других неорганических веществ, имеющих кристаллическую структуру.
Для многих соединений переменного состава установлены пределы, в которых может изменяться их состав. Например, оксид урана (IV) имеет состав UO2.5 до UO3, оксид ванадия (II) — от VO0.9 до VO1.3
Таким образом, в формулировку закона постоянства состава вносится уточнение:
М. В. Ломоносов впервые сформулировал закон сохранения массы вещества в 1748г., а экспериментально подтвердил его на примере обжига металлов в запаянных сосудах в 1756г. Современная формулировка закона такова:
Независимо от Ломоносова это закон был установлен в 1789г. французским химиком Лавуазье, который показал, что при химических реакциях сохраняется не только общая масса веществ, но и масса каждого из элементов, входящих в состав взаимодействующих веществ.
Закон сохранения массы веществ М. В. Ломоносов связывал с законом сохранения энергии (количества движения). Он рассматривал эти законы в единстве как все общий закон природы. Ломоносов писал:
«Все перемены в натуре случающиеся такого суть состояния, что, сколько чего у одного тела отнимается, столько присовокупится к другому. Так, ежели где убудет несколько материи, то умножится в другом месте. Сей всеобщий естественный закон простирается и в самые правила движения: ибо тело, движущее своей силою другое, столько же оные у себя теряет, сколько сообщает другому, которое от него движение получает».
Взгляды Ломоносова были подтверждены современной наукой. В 1905г. А. Эйнштейн показал, что между массой тела (m
) и его энергией (E
) существует связь, выражаемая уравнением:
с
— скорость света в вакууме.
Закон сохранения массы дает материальную основу для составления уравнений химических реакций.
Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атома
1. Формулировка периодического закона Д. И. Менделеева в свете теории строения атома.
Открытие периодического закона и разработка периодической системы химических элементов Д. И. Менделеевым явились вершиной развития химии в XIX веке. Обширная сумма знаний о свойствах 63 элементов, известных к тому времени, была приведена в стройный порядок.
Д. И. Менделеев считал, что основной характеристикой элементов являются их атомные веса, и в 1869 г. впервые сформулировал периодический закон.
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Весь ряд элементов, расположенных в порядке возрастания атомных масс, Менделеев разбил на периоды, внутри которых свойства элементов изменяются последовательно, разместив периоды так, чтобы выделить сходные элементы.
Однако, несмотря на огромную значимость такого вывода, периодический закон и система Менделеева представляли лишь гениальное обобщение фактов, а их физический смысл долгое время оставался непонятным. Лишь в результате развития физики XX века — открытия электрона, радиоактивности, разработки теории строения атома — молодой, талантливый английский физик Г. Мозле установил, что величина зарядов ядер атомов последовательно возрастает от элемента к элементу на единицу. Этим открытием Мозле подтвердил гениальную догадку Менделеева, который в трех местах периодической таблицы отошел от возрастающей последовательности атомных весов.
Так, при ее составлении Менделеев поставил 27 Со перед 28 Ni, 52 Ti перед 5 J, 18 Аг перед 19 К, несмотря на то, что это противоречило формулировке периодического закона, то есть расположению элементов в порядке увеличения их атомных весов.
Согласно закону Мозле заряды ядер
данных элементов соответствовали положению их в таблице.
В связи с открытием закона Мозле современная формулировка периодического закона следующая: свойство элементов, а так же формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов.
2. Связь периодического закона и периодической системы со строением атомов.
Итак, главной характеристикой атома является не атомная масса, а величина положительного заряда ядра. Это более общая точная характеристика атома, а значит, и элемента. От величины положительного заряда ядра атома зависят все свойства Элемента и его положение в периодической системе. Таким образом, порядковый номер химического элемента численно совпадает с зарядом ядра его атома. Периодическая система элементов является графическим изображением периодического закона и отражает строение атомов элементов.
Теория строения атома объясняет периодическое изменение свойств элементов. Возрастание положительного заряда атомных ядер от 1-до 110 приводит к периодическому повторению у атомов элементов строения внешнего энергетического уровня. А поскольку от числа электронов на внешнем уровне в основном зависят свойства элементов; то и они периодически повторяются. В этом физический смысл периодического закона.
В качестве примера рассмотрим изменение свойств у первых и последних элементов периодов. Каждый период в периодической системе начинается элементами атомы, которых на внешнем уровне имеют один s-электрон (незавершенные внешние уровни) и потому проявляют сходные свойства — легко отдают валентные электроны, что обуславливает их металлический характер. Это щелочные металлы — Li, Na, К, Rb, Cs.
Заканчивается период элементами, атомы которых на внешнем уровне содержат 2 (s 2) электрона (в первом периоде) или 8 (s 1 p 6)
электронов (во всех последующих), то есть имеют завершенный внешний уровень. Это благородные газы Не, Ne, Ar, Kr, Xe, имеющие инертные свойства.
Именно вследствие сходства строения внешнего энергетического уровня похожи их физические и химические свойства.
В каждом периоде с возрастанием порядкового номера элементов металлические свойства постепенно ослабева-ют и возрастают неметаллические, заканчивается период инертным газом. В каждом периоде с возрастанием порядкового номера элементов металлические свойства постепенно ослабева-ют и возрастают неметаллические, заканчивается период инертным газом.
В свете учения о строении атома становится понятным разделение всех элементов на семь периодов, сделанное Д. И. Менделеевым. Номер периода соответствует числу энергетических уровней атома,
то есть положение элементов в периодической системе обусловлено строением их атомов. В зависимости от того, какой подуровень заполняется электронами, все элементы делят на четыре типа.
1. s-элементы. Заполняется s-подуровень внешнего уровня (s 1 — s 2). Сюда относятся первые два элемента каждого периода.
2. р-элементы. Заполняется р-подуровень внешнего уровня (р 1 — p 6)-
Сюда относятся последние шесть элементов каждого периода, начиная со второго.
3. d-элементы. Заполняется d-подуровень последнего уровня (d1 — d 10), а на последнем (внешнем) уровне остается 1 или 2 электрона. К ним относятся элементы вставных декад (10) больших периодов, начиная с 4-го, расположенные между s- и p-элементами (их также называют переходными элементами).
4. f-элементы. Заполняется f-подуровень глубинного (треть его снаружи) уровня (f 1 — f 14),
а строение внешнего электронного уровня остается неизменным. Это лантаноиды и актиноиды, находящиеся в шестом и седьмом периодах.
Таким образом, число элементов в периодах (2-8-18-32) соответствует максимально возможному числу электронов на соответствующих энергетических уровнях: на первом — два, на втором — восемь, на третьем — восемнадцать, а на четвертом — тридцать два электрона. Деление групп на подгруппы (главную и побочную) основано на различии в заполнении электронами энергетических уровней. Главную подгруппу составляют s-
и p-элементы, а побочную подгруппу — d-элементы. В каждой группе объединены элементы, атомы которых имеют сходное строение внешнего энергетического уровня. При этом атомы элементов главных подгрупп содержат на внешних (последних) уровнях число электронов, равное номеру группы. Это так называемые валентные электроны.
У элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних (вто-рых снаружи) уровней, в чем и состоит основное различие в свойствах элементов главных и побочных подгрупп.
Отсюда следует, что номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом заключается физический смысл номера группы.
С позиций теории строения атома легко объясняется возрастание металлических свойств элементов в каждой группе с ростом заряда ядра атома. Сравнивая, например, распределение электронов по уровням в атомах 9 F (1s 2 2s 2 2р 5) и 53J
(1s 2 2s 2 2р 6 3s 2 Зр 6 3d
10
4s 2 4р
6
4d
10
5s 2 5p 5) можно отметить, что у них по 7 электронов на внешнем уровне, что указывает на сходство свойств. Однако внешние электроны в атоме йода находятся дальше от ядра и поэтому слабее удерживаются. По этой причине атомы йода могут отдавать электроны или, иными словами, проявлять металлические свойства, что нехарактерно для фтора.
Итак, строение атомов обуславливает две закономерности:
а) изменение свойств элементов по горизонтали — в периоде слева направо ослабляются металлические и усиливаются неметаллические свойства;
б) изменение свойств элементов по вертикали — в группе с ростом порядкового номера усиливаются металлические свойства и ослабевают неметаллические.
Таким образом: по мере возрастания заряда ядра атомов химических элементов периодически изменяется строение их электронных оболочек, что является причиной периодического изменения их свойств.
3. Структура периодической Системы Д. И. Менделеева.
Периодическая система Д. И. Менделеева подразделяется на семь периодов — горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера, и восемь групп — последовательностей элементов обладающих однотипной электронной конфигурацией атомов и сходными химическими свойствами.
Первые три периода называются малыми, остальные — большими. Первый период включает два элемента, второй и третий периоды — по восемь, четвёртый и пятый — по восемнадцать, шестой — тридцать два, седьмой (незавершённый) — двадцать один элемент.
Каждый период (исключая первый) начинается щелочным металлом и заканчивается благородным газом.
Элементы 2 и 3 периодов называются типическими.
Малые периоды состоят из одного ряда, большие — из двух рядов: чётного (верхнего) и нечётного (нижнего). В чётных рядах больших периодов расположены металлы, и свойства элементов слева направо изменяются слабо. В нечётных рядах больших периодов свойства элементов изменяются слева направо, как у элементов 2 и 3 периодов.
В периодической системе для каждого элемента указывается его символ и порядковый номер, название элемента и его относительная атомная масса. Координатами положения элемента в системе является номер периода и номер группы.
Элементы с порядковыми номерами 58-71, именуемыми лантаноидами, и элементы с номерами 90-103 — актиноиды — помещаются отдельно внизу таблицы.
Группы элементов, обозначаемые римскими цифрами, делятся на главные и побочные подгруппы. Главные подгруппы содержат 5 элементов (или более). В побочные подгруппы входят элементы периодов, начиная с четвёртого.
Химические свойства элементов обуславливаются строением их атома, а точнее строением электронной оболочки атомов. Сопоставление строения электронных оболочек с положением элементов в периодической системе позволяет установить ряд важных закономерностей:
1. Номер периода равен общему числу энергетических уровней, заполняемых электронами, у атомов данного элемента.
2. В малых периодах и нечётных рядах больших периодов с ростом положительного заряда ядер возрастает число электронов на внешнем энергетическом уровне. С этим связано ослабление металлических и усиление неметаллических свойств элементов слева направо.
Номер группы, указывает число электронов, которые могут участвовать в образовании химических связей (валентных электронов).
В подгруппах с ростом положительного заряда ядер атомов элементов усиливаются их металлические и ослабляются неметаллические свойства.
Периодическая законность химических элементов.
После открытий Лавуазье понятие о химических элементах и простых телах так укрепилось, что их изучение положено в основу всех химических представлений, а вследствие того взошло и во все естествознание. Пришлось признать, что все вещества, доступные исследованию, содержат очень ограниченное число материально разнородных элементов, друг в друга не превращающихся и обладающих самостоятельною весомою сущностью и что все разнообразие веществ природы определяется лишь сочетанием этих немногих элементов и различием или их самих, или их относительного количества, или при одинаковости качества и количества элементов — различием их взаимного положения, соотношения или распределения. «Простыми» телами должно при этом назвать вещества, содержания лишь один какой-либо элемент, «сложными» — два или более. Но для данного элемента могут существовать многие видоизменения простых тел, ему отвечающих, зависящие от распределения («строения») его частей или атомов, т.е. от того вида изомерии, который называется «аллотропией». Так углерод, как элемент, является в состоянии угля, графита и алмаза, которые (взятые в чистом виде) дают при сжигании один и тот же углекислый газ и в том же количестве. Для самих же «элементов» ничего подобного не известно. Они видоизменениям и взаимным превращениям не подвергаются и представляют, по современным воззрениям, неизменную сущность изменяющегося (химически, физически и механически) вещества, входящую как в простые, так и в сложные тела.
Весьма, в древности и до ныне, распространенное представление о «единой или первичной» материи, из которой слагается все разнообразие веществ, опытом не подтверждено, и все попытки, к сему направленные, оказались его опровергающими. Алхимики верили в превращение металлов друг в друга, доказывали это разными способами, но при поверке все оказалось или обманом (особенно в отношении к производству золота из других металлов), или ошибкой и неполнотой опытного исследования. Однако, нельзя не заметить, что если бы завтра оказалось, что металл А превращается целиком или отчасти в другой металл В, то из этого вовсе не будет еще следовать, что простые тела способны друг в друга превращаться вообще, как, например, из того, что долгое время закись урана считали за простое тело, а она оказалась содержащей кислород и действительный металлический уран — вовсе не следует делать никакого общего заключения, а можно только в частности судить о бывшей и современной степенях знакомства с ураном, как самостоятельным элементом. С этой точки зрения должно взглянуть и на оповещенное Емменсом (Stephen — Н. Emmeus) превращение мексиканского серебра отчасти в золото (май-июнь 1897 г.), если справедливость наблюдений оправдается и Argentaurum не окажется подобным алхимистическим оповещением подобного же рода, не раз бывшим и также прикрывавшемся покровом секрета и денежного интереса. Что холод и давление могут содействовать перемене строения и свойств — давно известно, хотя бы по примеру олова Фрицше, но нет фактов, позволяющих предполагать, что изменения эти идут столь глубоко и доходят не до строения частиц, а до того, что ныне считается атомами и элементами, а потому утверждаемое Емменсом превращение (хотя бы и постепенно) серебра в золото будет оставаться сомнительным и мaлозначущим даже в отношении к серебру и золоту, пока, во-первых, «секрет» не будет на столько раскрыт, что опыт может быть всеми воспроизведен, и во-вторых, пока обратный переход (при накаливании и уменьшении давления?) золота в серебро не будет установлен, или пока не будет установлена фактическая его невозможность или трудность. Легко понять, что переход спирта углекислоты в сахар труден, хотя обратный идет легко, потому что сахар бесспорно сложнее спирта и углекислоты. И мне кажется очень мало вероятным переход серебра в золото, если обратно — золото не будет переходить в серебро, потому что атомный вес и плотность золота чуть не в два раза более, чем серебра, из чего должно, по всему известному в химии, заключить, что если серебро и золото произошли из одного материала, то золото сложнее серебра и должно превращаться в серебро легче, чем обратно. Поэтому я думаю, что г. Емменсу для убедительности не только следовало бы раскрыть «секрет», но и попробовать, да и показать, если можно, превращение золота в серебро, тем более, что при получении из дорогого металла другого, в 30 раз более дешевого, денежные интересы будут, очевидно, на далеком плане, а интересы правды и истины окажутся явно на первом, теперь же дело представляется, на мой взгляд, с обратной стороны.
Д. Менделеев
(окт. 1897).
При таком представлении о химических элементах — они оказываются чем-то отвлеченным, так как в отдельности мы их не видим и не знаем. К такому почти идеалистическому представлению столь реалистическое знание, как химия, пришло по совокупности всего доныне наблюденного, и если это представление можно отстаивать, то лишь как предмет глубоко укоренившегося убеждения, доныне оказавшегося совершенно согласным с опытом и наблюдением. В этом смысле понятие о химических элементах имеет глубоко реальное основание во всей науке о природе, так как, например, углерод нигде, никогда, никем и нисколько не превращен в какой-либо другой элемент, тогда как простое тело — уголь превращено в графит и алмаз и, быть может, когда-нибудь можно будет превратить его и в вещество жидкое или газообразное, если удастся найти условия упрощения сложнейших частиц угля. Главное понятие, с которым возможно приступить к объяснению П. законности, состоит именно в коренном различии представлений об элементах и о простых телах. Углерод — элемент, нечто неизменное, содержащееся, как в угле, так и в углекислом газе или в светильном, как в алмазе, так и в массе изменчивых органических веществ, как в известняке, так и в дереве. Это — не конкретное тело, а весомое (материальное) вещество с суммой свойств. Как в парах воды или в снеге нет конкретного тела — жидкой воды, а есть то же весомое вещество с суммой ему одному принадлежащих свойств, так во всем углеродистом содержится материально-однородный углерод: не уголь, а именно углерод. Простые тела суть вещества, содержащие только один какой-либо элемент, и понятие о них становится прозрачно-ясным только тогда, когда признается укрепившееся представление об атомах и частицах или молекулах, из которых слагаются однородные вещества; причем понятию об элементе отвечает атом, а простому телу — частица. Простые тела, как и все тела природы, составлены из частиц: вся их разница от сложных тел состоит лишь в том, что частицы сложных тел содержат разнородные атомы двух или многих элементов, а частицы простых тел — однородные атомы данного элемента. Все, что излагается далее, должно относить именно к элементам, т.е. напр. к углероду, водороду и кислороду, как составным частям сахара, дерева, воды, угля, кислородного газа, озона и т.п., но не простым телам, элементами образуемыми. При этом, очевидно, является вопрос: как же можно находить какую-либо реальную законность в отношении к таким предметам, как элементы, существующие лишь как представления современных химиков, и что же реально осуществимое можно ожидать, как следствие из расследования каких-то отвлеченностей? Действительность отвечает на подобные вопросы с полною ясностью: отвлечения, если они правдивы (содержат элементы истины) и соответствуют реальности, могут служить предметом точно такого же исследования, как и чисто материальные конкретности. Так химические элементы, хотя суть отвлеченности, подлежат расследованию совершенно такому же, как простые или сложные тела, которые можно накалить, взвесить и вообще подвергать прямому наблюдению. Сущность дела здесь в том, что у химических элементов, на основании опытного исследования простых и сложных тел, ими образуемых, открываются свои индивидуальные свойства и признаки, совокупность которых и составляет предмет исследования. Мы и обратимся теперь к перечислению некоторых из особенностей, принадлежащих химическим элементам, чтобы затем показать П. законность химических элементов.
Свойства химических элементов должно разделить на качественные и количественные, хотя бы первые из них и сами по себе подлежали измерению. К числу качественных прежде всего принадлежит свойство образовать кислоты и основания. Хлор может служить образцом первых, так как и с водородом, и кислородом образует явные кислоты, способные с металлами и основаниями давать соли, начиная с первообраза солей — поваренной соли. Натрий же поваренной соли NaCl может служить образцом элементов, дающих только основания, так как кислотных окислов с кислородом он не дает, образуя или основание (окись натрия), или перекись, обладающую характерными признаками типической перекиси водорода. Все элементы суть более или менее кислотные или основные, с явными переходами от первых ко вторым. Это качественное свойство элементов электрохимики (с Берцелиусом во главе) выразили, отличив сходных с натрием, на основании того, что первые при разложении током являются на аноде, а вторые на катоде. Тоже качественное различие элементов выражается отчасти и в различении металлов и металлоидов, так как основные элементы относятся к числу таких, которые в виде простых тел дают настоящие металлы, а кислотные элементы образуют в виде простых тел металлоиды, не имеющие вида и механических свойств настоящих металлов. Но во всех этих отношениях не только невозможно прямое измерение, позволяющее устанавливать последовательность перехода от одних свойств к другим, но и нет резких различий, так что есть элементы в том или ином отношении переходные или такие, которые можно отнести и в тот, и в другой разряд. Так алюминий, по внешнему виду явный металл, отлично проводящий гальв. ток, в своем единственном окисле Аl2O3 (глинозем) играет роль то основную, то кислотную, так как соединяется и с основаниями (напр. Na2O, MgO и др.), и с кислотными окислами, например образуя серноглиноземную соль A12(SO4)3=Al2O33O3; и в том, и в другом случае он обладает слабо выраженными свойствами. Сера, образуя несомненный металлоид, во множестве химических отношений сходна с теллуром, который по внешним качествам простого тела всегда относился к металлам. Такие случаи, очень многочисленные, придают всем качественным признакам элементов некоторую степень шаткости, хотя и служат к облегчению и, так сказать, оживлению всей системы знакомства с элементами, указывая в них признаки индивидуальности, позволяющей предугадывать еще не наблюденные свойства простых и сложных тел, образующихся из элементов. Эти сложные индивидуальные особенности элементов придавали чрезвычайный интерес открытию новых элементов, не позволяя никоим образом сколько-нибудь предвидеть сумму физических и химических признаков, свойственных веществам, ими образуемым. Все, чего можно было достигать при изучении элементов, ограничивалось сближением в одну группу наиболее сходных, что уподобляло все это знакомство с систематикою растений или животных, т.е. изучение было рабским, описательным и не позволяющим делать какие-либо предсказания по отношению к элементам, еще не бывшим в руках исследователей. Ряд иных свойств, которые мы назовем количественными, выступил в надлежащем виде для химических элементов только со времени Лорана и Жерара, т.е. с 50-х годов текущего столетия, когда была подвергнута исследованию и обобщению способность взаимного реагирования со стороны состава частиц и укрепилось представление о двуобъемных частицах, т.е. о том, что в парообразном состоянии, пока нет разложения, всякие частицы (т.е. количества веществ, вступающие в химическое взаимодействие между собою) всех тел занимают такой же объем, какой занимают два объема водорода при той же температуре и том же давлении. Не входя здесь в изложение и развитие начал, укрепившихся при этом, ныне общепринятом представлении, достаточно сказать, что с развитием унитарной или частичной химии в последние 40 или 50 лет получилась твердость, прежде не существовавшая, как в определении атомных весов элементов, так и в определении состава частиц простых и сложных тел, ими образуемых, и стала очевидною причина различия свойств и реакций обыкновенного кислорода О2 и озона O3, хотя оба содержат только кислород, как и разность маслородного газа (этилена) C2h5 от жидкого цетена С16Н32, хотя оба содержат на 12 весовых частей углерода по 2 весовых части водорода. В эту многознаменательную эпоху химии выступило в ней для каждого хорошо обследованного элемента два более или менее точных количественных признака или свойства: вес атома и тип (форма) состава частиц соединений, им образуемых, хотя ничто не указывало еще ни на взаимную связь этих признаков, ни на соотношение их с другими, особенно качественными, свойствами элементов. Вес атома, свойственный элементу, т.е. неделимое, наименьшее относительное количество его, входящее в состав частиц всех его соединений, особенно был важен для изучения элементов и составлял их индивидуальную характеристику, пока чисто эмпирического свойства, так как для определения атомного веса элемента надобно узнать не только эквивалент или относительный весовой состав некоторых его соединений с элементами, вес атома которых известен из иных определений, или условно принят известным, но и определить (по реакциям, плотностям паров и т.п.) частичный вес и состав хоть одного, а лучше многих из соединений, им образуемых. Этот путь опыта столь сложен, длинен и требует такого совершенно очищенного и тщательно изученного материла из числа соединений элемента, что для многих, особенно для редких в природе элементов, при отсутствии особо понудительных причин, оставалось много сомнений относительно истинной величины атомного веса, хотя весовой состав (эквивалент) некоторых соединений их и был установлен; таковы, напр., были уран, ванадий, торий, бериллий, церий и др. При чисто эмпирическом значении веса атома не было и особого интереса углубляться в этот предмет для элементов, редко подвергаемых исследованию, тем не менее для большой массы обыкновеннейших элементов величины атомных весов можно было уже в начале 60-х годов считать твердо установленными, особенно после того, как Канницаро твердо установил для многих металлов, напр. Са, Ва, Zn, Fe, Сu и т.п. явное их отличие от К, Na, Ag и т.п., показав, что частицы напр. хлористых соединений первых из них содержат вдвое более хлора, чем вторых, т.е. что Са, Ва, Zn и т.д. дают CaCI2, BaCI2 и т.д., т.е. двуатомны (двуэквивалентны или двувалентны), тогда как K, Na и т.п. одноатомны (одноаквивалентны), т.е. образуют KCI, NaCI и т.п. В эпоху около середины текущего столетия вес атома элементов послужил уже одним из признаков, по которым стали сличать сходственные элементы групп.
Другой из важнейших количественных признаков элементов представляет состав частиц высших соединений, им образуемых. Здесь более простоты и ясности, потому что Дальтонов закон кратных отношений (или простоты и цельности числа атомов, входящих в состав частиц) уже заставляет ждать только немногих чисел и разобраться в них было легче. Обобщение выразилось в учении об атомности элементов или их валентности. Водород есть элемент одноатомный, ибо дает по одному соединению HX с другими одноатомными же элементами, представителем которых считался хлор, образуя НСl. Кислород двуатомен, потому что дает h3O или соединяется вообще с двумя X, если под Х подразумевать одноатомные элементы. Так получают НСlO, Сl2О и т.д. В этом смысле азот считается трехатомным, так как дает Nh4, NCl3; углерод четырехатомным, потому что образует СН4, СО2 и т.д. Сходные элементы одной группы, напр. галоиды, дают и сходные частицы соединений, т.е. имеют одну и ту же атомность. Через все это изучение элементов очень сильно двинулось вперед. Но было немало трудностей разного рода. Особую трудность представили соединения кислорода, как элемента двуатомного, способного замещать и удерживать X2, в силу чего совершенно понятно образование Cl2O, HClO и т.п. соединений с одноатомными элементами. Однако, тот же кислород дает не только НСlO, но и HClO2, НСlO3 и НСlO4 (хлорная кислота), точно также как не только h3O, но и h3O2 (перекись водорода). Для объяснения пришлось признать, что кислород, в силу своей двуатомности, обладая двумя сродствами (как говорят), способен втиснуться в каждую частицу и встать между всякими двумя атомами, в нее входящими. Трудностей при этом получилось много, но остановимся на двух, по-моему, важнейших. Во-первых, оказалась как бы грань О4 для числа кислородных атомов, входящих в частицу, а этой грани нельзя ждать на основании допущенного. При том, приближаясь к грани, получались часто соединения не менее, а более прочные, чего уже вовсе нельзя допустить при представлении о втиснутых атомах кислорода, так как чем более их взойдет, тем вероятнее было иметь непрочность связей. А между тем НСlO4 прочнее НСlO3, эта последняя прочнее НСlO2 и НСlO, тогда как НСl опять тело химически очень прочное. Грань же О4 выступает в том, что водородным соединениям разной атомности:
НСl, H 2 S, Н 3 Р и H 4 Si
отвечают высшие кислородные кислоты:
НСlO 4 , H 2 SO 4 , Н 3 РО 4 и H 4 SiO 4 ,
в которых одинаково содержатся четыре атома кислорода. Из этого даже выходит тот неожиданный вывод, что считая Н — одно-, а О — двуатомными элементами, по кислороду способность к соединению выходит обратная, чем по водороду, т.е. по мере того как у элементов увеличивается свойство удерживать атомы водорода или возрастать в атомности, уменьшается способность удерживать кислород; хлор, так сказать, одноатомен по водороду и семиатомен по кислороду, а фосфор или аналогический с ним азот трехатомен в первом смысле, а во втором — пятиатомен, что видно и по другим соединениям, например NH 4 CI, POCl 3 , РСl 5 и т.п. Во-вторых, все, что знаем, явно указывает на глубочайшее различие в присоединении кислорода (втискивании его, судя по представлению об атомности элементов) в том случае, когда образуется перекись водорода, от того, когда происходит напр. из H 2 SO 4 (сернистая кисл.) серная кислота H 2 SO 4 , хотя h3O2 отличается от Н2O точно также атомом кислорода, как h3SO4 от h3SO3, и хотя раскислители в обоих случаях переводят высшую степень окисления в низшую. Разность в отношении к реакциям, свойственным h3O2 и h3SO4, особенно выступает по той причине, что серной кислоте отвечает своя перекись (надсерная кислота, аналог которой надхромовая недавно изучена Wiede и содержит, по его данным, h3CrO5), обладающая совокупностью свойств перекиси водорода. Значит, есть существенная разность в способе присоединения кислорода в «солеобразных» окислах и настоящих перекисях и, значит, простым втискиванием атомов кислорода между другими выражать все случаи присоединения кислорода недостаточно, а если выражать, то скорее всего это следует применять к перекисям, а не к образованию, так сказать, нормальных соединений кислорода, приближающихся к RHnО4, где n, число атомов водорода, не бывает более 4, как и число атомов кислорода в кислотах, содержащих один атом элементов R. Приняв сказанное во внимание и означая вообще через R атом элементов, вся совокупность сведений о солеобразных окислах приводится к тому выводу, что число самостоятельных форм или видов окислов очень не велико и ограничивается следующими восемью:
R2O2 или RO, напр. CaO, FeO.
Эта стройность и простота форм окисления вовсе не вытекает из учения об атомности элементов в его обычной форме (при определении атомности по соединению с Н или Сl) и есть дело прямого сличения кислородных соединений самих по себе. Вообще учение о постоянной и неизменной атомности элементов заключает в себе трудности и несовершенства (не насыщенные соединения, подобные СО, пересыщенные, подобные JCl3, соед. с кристаллизационною водою и т.п.), но оно в двух отношениях имеет и поныне важное значение, а именно с ним достигнута простота и стройность выражения состава и строения сложных органических соединений, и в отношении к выражению аналогии сродственных элементов, так как атомность, по чему бы ее не считали (или состав частиц сходственных соединений), в таком случае оказывается одинаковою. Так напр. сходные между собою во многом ином галоиды или же металлы данной группы (щелочные, напр.) оказываются всегда обладающими одинаковою атомностью и образующими целые ряды сходных соединений, так что существование этого признака есть уже до некоторой степени указатель аналогии.
Чтобы не усложнять изложения, мы оставим перечисление других качественных и количественных свойств элементов (напр. изоморфизма, теплот соед., показ, преломления и т.п.) и прямо обратимся к изложению П. закона, для чего остановимся: 1) на сущности закона, 2) на его истории и приложении к изучению химии, 3) на его оправдании при помощи вновь открытых элементов, 4) на приложении его к определению величины атомных весов и 5) на некоторой неполноте существующих сведений.
Сущность П. законности. Так как из всех свойств химических элементов атомный их вес наиболее доступен для численной точности определения и для полной убедительности, то исходом для нахождения законности химических элементов всего естественнее положить веса атомов, тем более, что в весе (по закону сохранения масс) мы имеем дело с неуничтожаемым и важнейшим свойством всякой материи. Закон есть всегда соответствие переменных, как в алгебре функциональная их зависимость. Следовательно, имея для элементов атомный вес как одну переменную, для отыскания закона элементов следует брать иные свойства элементов, как другую переменную величину, и искать функциональной зависимости. Взяв многие свойства элементов, напр. их кислотность и основность, их способность соединяться с водородом или кислородом, их атомность или состав их соответственных соединений, теплоту, выделяемую при образовании соответственных, напр. хлористых соединений, даже их физические свойства в виде простых или сложных тел сходного состава и т.п., можно подметить периодическую последовательность в зависимости от величины атомного веса. Для того, чтобы это выяснить, приведем сперва простой список всех, хорошо ныне известных определений атомного веса элементов, руководясь недавним сводом, сделанным F.W. Clarke («Smithsonian Miscellaneous Collections», 1075: «A recalculation of the atomic weights», Вашингтон, 1897, стр. 34), так как его ныне должно считать наиболее достоверным и содержащим все лучшие и новейшие определения. При этом примем, вместе с большинством химиков, условно атомный вес кислорода равным 16. Подробное исследование «вероятных» погрешностей показывает, что примерно для половины приведенных результатов погрешность чисел менее 0,1%, но для остальных она доходит до нескольких десятых, а для иных, быть может, и до процентов. Все атомные веса приведены по порядку их величины.
Ряды O=16 Атомный вес
1 Водород Н 1,008
Литий Li 7,03
2 Берилий, Gl или Be 9,08
Углерод C 12,01
Азот, Az или N 14,04
Кислород O 16
Фтор F 19,06
3 Натрий Na 23,05
Магний Mg 24,28
Алюминий Al 27,11
Кремний Si 28,40
Фосфор P 31,02
Сера S 32,07
Хлор Cl 35,45
4 Калий K 39,11
Кальций Ca 40,07
Скандий Sc 44,12
Титан Ti 48,15
Ванадий V 51,38
Хром Cr 52,14
Марганец Mn 54,99
Железо Fe 56,02
Кобальт Co 58,93
Никель Ni 58,69
5 Медь Cu 63,60
Цинк Zn 65,41
Галлий Ga 69,91
Германий Ge 72,48
Мышьяк As 75,01
Селен Se 79,02
Бром Br 79,95
6 Рубидий Rb 85,43
Стронций Sr 87,61
Иттрий Y 89,02
Цирконий Zr 90,40
Ниобий, Cb или Nb 93,73
Молибден Mo 95,99
Рутений Ru 101,68
Родий Rh 103,01
Палладий Pd 106,36
7 Серебро Ag 107,92
Кадмий Cd 111,95
Индий In 113,85
Олово Sn 119,05
Сурьма Sb 120,43
Теллур Te 127,49
Часть 8 ряда Цезий Cs 132,89
Барий Ba 137,43
Лантан La 138,64
Церий Ce 140,20
Часть 10 ряда Иттербий Yb 173,19
Тантал Ta 182,84
Вольфрам W 184,83
Осмий Os 190,99
Иридий Ir 193,12
Платина Pt 194,89
Часть 11 ряда Золото Au 197,23
Ртуть Hg 200,00
Таллий Tl 204,15
Свинец Pb 206,92
Висмут Bi 208,11
Часть 12 ряда Торий Th 232,63
Уран U 239,59
В этом сопоставлении уже намечена П. законность и она выражена в рядах, каждый из которых содержит до некоторой степени явное периодическое повторение одних и тех же количественных и качественных свойств элементов, особенно примечаемое тогда, когда взять целые периоды (большие), содержащие один четный ряд и следующий за ним нечетный. Так, ряд 2-ой начинается Li — металлом щелочным и в соединении с рядом 3-м образует период, кончающийся галоидом С1 с явно кислотными свойствами представителя металлоидов. Точно также в следующем большом периоде, содержащем 4-ый и 5-ый ряды, началом служит щелочной металл К, а концом галоид Вr; в периоде, содержащем 6 и 7 ряды, опять в начале щелочной металл Rb, а в конце галоид йод. Следующий период, начинаясь опять явно щелочно-металлическим цезием, очевидно не полон, а в следующих периодах известны лишь некоторые средние элементы, но ни начальные щелочные металлы, ни конечные галоиды неизвестны. Если взять один из полных периодов, напр. (4 и 5 ряды), начинающийся калием и кончающийся бромом: то можно здесь подметить прежде всего содержание двух рядов с возрастающею, судя по кислородным соединениям, атомностью входящих элементов. При том это возрастание, по отношению к кислороду, идет в каждом ряде совершенно последовательно для высших солеобразных окислов.
В первых группах — основания, в последних кислоты, в середине промежуточные по характеру, слабоосновные и слабокислотные окислы, примером которых лучше всего могут служить ZnO и TiО2. Важнее всего обратить внимание на повторение свойств в рядах и периодах и на существование в более полных из периодов между четным рядом и следующим нечетным 3-х элементов, относимых к VIII группе. Таковы Fe, Со и Ni между 4 и 5 рядом. Ru, Rh и Pd между 6 и 7 рядами и Os, lr и Pt между 10 и 11 рядами.
Начиная с водорода, первые с наименьшим атомным весом элементы до Na представляют не мало своих особенностей, как примечено давно во всех подобных рядах и сложных тел. Напр., первые члены ряда предельных спиртов СnН2n+2O будут, при n=0 и n=1, вода h3O и древесный спирт СН4O и в них известно много особенностей. Эти легчайшие элементы, от Н до Na, называются типическими, ибо в них выражены, как в образцах и в наиболее ясной форме, все виды и свойства, но и со своими особенностями. Взяв затем остальные элементы, мы видим, что в одной строке, то есть на одном месте в периоде, встречаются ближайшие, давно установленные аналоги. напр. К, Rb и Cs; Ca, Sr и Ва; Сu, Ag и Au; P, As и Sb; S, Se и Те; Cl, Вr и J. Следовательно, П. законность показывает связь, существующую между ближайшими аналогами, сближает их и вызывает признание не подмечавшихся аналогий, примером которых могут служить аналогии: Hg с Мg, Zn и Cd, V с Nb и Та, Се с Zr и Ti, Pt и Pd с Ni, Pb с Sn и т.п.
В каждом большом периоде между начальным четным и конечным нечетным рядами помещаются элементы VIII группы, где известно 9 элементов: Fe, Со и Ni, Ru, Rh и Pd, и Os, lr и Pt, которые характеризуются особою совокупностью самобытных свойств, для чего достаточно упомянуть, напр., о соединениях Ni и Pt с окисью углерода, о столь характерных двойных синеродистых металлах, как те, которые содержат Fe, Pt и т.п., а особенно о том, что только для элементов этой группы, а именно Os и Ru, известны окислы состава OsO4. Притом элементы эти во всех отношениях представляют свойства переходные от последних членов четных рядов к первым членам нечетных, напр. Fe, Со и Ni представляют переход от Cr и Mn к Сu и Zn. Таким образом сопоставление элементов по величине их атомного веса раскрывает или показывает главнейшие их взаимные качественные отношения и аналогии и в то же время отвечает изменению в них способности к соединениям, что видно не только по правильности в составе окислов, но и во множестве других случаев. Напр., по отношению к водороду только в типических элементах 2-го ряда и только в последних группах нечетных рядов существует способность образовать летучие и газообразные соединения. В том же ряде понятий уясняется и образование предельного насыщения кислородом O4. В самом деле, если С дает СО2, то ее высший гидрат (ортоугольная кислота) и должен иметь состав С(НО)4=Сh5O4 а хлор, если дает Cl2O7 и HCl, как видно по его месту в периодической системе элементов, то и гидрат высшего окисла будет ClO3(OH)=СlНО4: тоже и для элементов V и VI групп. Такого же рода простота и правильность открываются и для чисто физических свойств и отношений, отвечающих аналогическим соединениям или состояниям элементов. Так, напр., удельные веса (а след. и удельные объемы или частные от деления веса атома на уд. вес) в твердом и жидком виде (не говоря уже о газообразном, потому что он прямо зависит от атомного веса и числа атомов в частице) как для самих простых тел, так и для их аналогических соединений в данном ряде последовательно изменяются по мере изменения атомного веса или при переходе от одной группы к другой, т.е. по мере постепенного возрастания ат. веса здесь уд. вес явно, но постепенно уменьшается, а уд. объем увеличивается. При переходе же от конечного галоида к начальному (для следующего периода) щелочному металлу (здесь от J к Cs) сразу совершается скачек, а именно напр. для Cs уд. вес 2,37, уд. объем 56, т.е. слишком вдвое, чем для йода. Наибольшая плотность и наименьший уд. объем отвечают в периодах элементам VIII группы (Ni, Ru, Os), а между типическими элементами, образующими как бы свой особый период, среднему из элементов бору (уд. вес 2,5, уд. объем 4,4). Подобная же этой волнообразная (периодическая), если можно так выразиться, зависимость, отвечающая П. законности, замечается и для иных свойств, напр. для темп. плавления простых тел. для темп. кипения соответствующих (напр. металлоорганических) соединений, для уд. их веса и т.п. физических свойств, прямо определяемых наблюдением и не содержащих уже в себе — как атомность — никаких отвлеченных представлений. Входить здесь в подробности всех этих отношений мне кажется неуместным.
Всю совокупность соотношений, замечаемых при подобных сличениях. можно формулировать в следующем положении: химические и физические свойства соединений, образуемых элементами, находятся в периодической зависимости от величины атомного веса элементов. Это и составляет сущность П. законности. Нельзя при этом не остановить внимания на том, что возрастание атомного веса состоит в увеличении массы, а при увеличении массы во всех обычных случаях идет все время последовательное изменение (напр. возрастает, при прочих равных обстоятельствах, притяжение, объем и т.п.) в определенную сторону, здесь же это замечается только до известного предела (напр. до перехода от одного периода к другому или до VIII группы в периоде и т.п.), после которого или совершается обратное изменение, или начинается повторение прежнего, как в пиле повторяются зубья и имеются высшие и низшие точки. Эта сторона дела придает П. законности общий своеобразный интерес новизны и заставляет думать, что замеченная законность может послужить к объяснению природы химических элементов, которые поныне составляют последнюю грань постижения химических превращений.
История и приложение П. законности. Первые, но слабо обработанные замечания о связи между величиною ат. веса элементов и свойствами их соединений явились при изучении ат. весов, напр. у Дюма, Гладстона, Кремерса, Петтенкофера, Ленсена, Л. Мейера и др., заметивших правильность изменения ат. веса в группах сходственных элементов. Первые попытки расположить все элементы в ряды по величине их ат. веса встречаются у Шанкуртуа (vis tellurique) и Ньюландса (Lav of octavos), но хотя при этом и было подмечено совпадение с известными до тех пор аналогиями, но взаимное соответствие и последовательность групп не служили предметом наблюдения, носившего характер отрывочной неполноты, и все изложение, как всякие первые попытки, было лишено такого значения, чтобы обратить на себя внимание. Только в 1869 г. Д. Менделеев, не имея в виду сопоставлений Шанкуртуа и Ньюландса, а вновь подметив общность соотношения и периодичность зависимости свойств элементов от их веса атомов, в Рус. Химич. Общ. точно формулировал П. закон, вывел много новых из него следствий и показал такую важность предмета, что к нему обратились многие, а затем полнее развил П. законность как в своем сочинении «Основы химии», так и в статьях, помещенных в «Liebig»s Anualen» и в «Журнале Рус. Хим. Общества» (1871), где с определенностью вывел необходимость изменить ат. веса Се, U, Be, In, Y и др., исправить определения ат. веса Ti, Os, Ir, Pt, Au и др. и ждать совершенно определенной совокупности свойств от неоткрытых еще элементов, из числа которых особенно остановился на свойствах тогда неизвестных, а ныне уже полученных аналогов — бора (описанного под названием экабора, а ныне названного скандием), алюминия (ныне называемого галлием) и кремния (ныне германия). То, что касается церия, Менделеев сам проверил, определив его теплоемкость, а затем подтвердил Браунер в Праге. Роско в Англии, Циммерман в Германии и др. оправдали требуемое П. законностью и указанное Менделеевым удвоение принятого прежде ат. веса урана. Торпе в Лондоне оправдал требуемый П. законностью ат. вес титана, а исследования Зейберта, Крюсса, Маллета и др. подтвердили то соображение, вытекавшее из П. законности, что величина ат. веса в ряде Os, Ir, Pt, и Au должна идти возрастая, тогда как прежние данные показывали обратное. Особенное же внимание привлекли к себе исследования, касающиеся величины ат. веса бериллия, и оправдание П. законности свойствами новооткрытых элементов, о чем говорится далее (III и IV). Вместе с тем стали прилагать П. законность к изучению разных свойств простых и сложных тел (от изоморфизма до парамагнитности и теплот соединения) и везде находили оправдание общих начал, законом установленных, т.е. свойства стояли в П. зависимости от ат. веса элементов, что и повело к общему признанию П. законности, чему много содействовали труды и статьи особенно Роско, Браунера, Торпе, Лаури, Пиччини и К. Винклера, причем исходом признания и оправдания П. законности считалась обыкновенно статья Менделеева, помещенная в «Liebig»s Annalen», Supplementband, VIII, 1871 г., хотя на русском языке все основное, вышеизложенное и явилось ранее, а именно в 1869 и 1870 гг. Вообще П. законность, как и всякий иной закон природы, получает вес, значение и силу не с момента его появления и формулирования, а от того только, что его проверка и оправдание придает новый интерес науке, что он дает возможность видеть то, что помимо его остается неизвестным, не отыскиваемым и неожиданным и только тогда, когда ожидаемое по закону оправдывается в действительности, что и случилось с П. законностью, как показано далее несколько подробнее в двух примерах.
Оправдание П. законности новооткрытыми элементами. До П. законности ничто, кроме прямого опыта, не указывало вперед на необходимость существования каких-либо еще неизвестных элементов, ни тем более — на свойства неизвестных элементов и их соединений. Это было прямым эмпиризмом, как видно, напр., из того, что Rb, Cs. Тl и In, открытые с помощью спектральных исследований, оказались со свойствами совершенно не ожидавшимися и заставившими изменить многие из предвзятых мнений, ранее господствовавших, напр. когда тяжелый (удельный вес 11,8), как свинец (уд. вес 11,3), таллий оказался дающим в воде растворимую закись Тl2O, гидрат которой ТlНО многим напоминает щелочи. С П. законностью дело сильно изменилось, так как, во-первых, в системе элементов оказались сразу такие промежутки между известными элементами, заполнения которых должно было ждать при помощи вновь открываемых элементов, а во-вторых — и это всего важнее — для этих неизвестных элементов, судя по их месту в системе, должно было ждать не только определенных атомных весов и данных окислов и др. соединений, но и совершенно ясно предвидимых свойств для множества их соединений. Свойства эти легко выводить на основании П. законности для неизвестных элементов, если они окружены уже известными. Так, в 1869 г., когда был установлен П. закон, не было известно элемента, ныне называемого германием, в IV группе 5-го ряда. Его место пустовало также, как и место рядом с ним в III группе. Не видя и ничего не испытывая в лаборатории, можно таким образом иметь полное понятие о свойствах таких элементов, которых еще никто не имел под руками, и в 1871 г. этим способом были указаны в подробностях свойства трех элементов, которые все затем были открыты и ныне известны под именами: 1) галлия Ga, открытого во Франции в 1875 г. Лекок-де-Буабодраном в цинковой обманке из Пиеррефита и тожественного с ожидавшимся экаалюминием: 2) скандия Sc, открытого Нильсоном в Швеции в 1879 г. между церитовыми металлами и оказавшегося равным предугаданному экабору; 3) германия Ge, извлеченного 1886 г. К. Винклером во Фрейберге, в Германии, из саксонского минерала аргиродита и оказавшегося в точности воспроизводящим предвиденный экасилиций. Во всех трех случаях предвиденные по П. закону свойства совершенно подтвердились и этим путем П. законность в сравнительно краткое время совершенно оправдалась. Здесь нельзя не указать на то, что для неизвестных элементов, вблизи или, так сказать, вокруг которых нет известных, нельзя бывает так подробно предвидеть свойства, как это оказалось возможным для Ge, Ga и Sc. Можно, напр., сказать, что при открытии галоида Х с атомным весом большим, чем йод, он все же будет образовать КХ, КХО3 и т.п., что его водородное соединение HХ будет газообразной, очень непрочной кислотою, что атомный вес будет или около 170 или около 215, но ни для галоида из 9-го ряда, ни для галоида из 11-го ряда нельзя уже предвидеть многие подробности свойств, так как тут близко нет хорошо известных элементов. Далее можно думать, что в том первом ряде, где ныне известен лишь водород, будут открыты свои элементы, также как в VIII группе между F и Na, но здесь не только край системы, но и типические элементы, а потому можно ждать своеобразия и особенностей. Быть может, недавно (1895) открытые гелий и аргон (Релей и Рамзай) отвечают указанным местам, но так как до сих пор не удалось ввести ни один из них в соединения, то всякие суждения о их отношении к другим элементам ныне должно считать преждевременными, тем более, что и вес атома их нельзя считать совершенно уверенно установленным.
Приложение П. законности к определению величины атомного веса. Аналитические исследования состава соединений данного элемента Z могут дать только эквивалент его в различных формах или степенях его окисления или вообще соединения, но ничего не могут дать по отношению к величине атомного веса, т.е. наименьшего числа эквивалентов, входящих в частицы элемента. Особенно ясно это, когда Z дает не одну, а несколько степеней окисления или форм соединения с О, С1 и др. Так железо дает с 16 весовыми частями кислорода или закись, содержащую 56 вес. частей железа, или окись с 37,33 част. железа, или ангидрид железной кислоты с 18,67 железа, а потому сравнительно с 1 вес. частью водорода (судя по составу воды) эквивалент железа в первом случае 28, во втором 18,67, в третьем 9,33. Сколько же эквивалентов разного рода содержится в атоме железа? Ответ дают: изоморфизм, плотность паров, теплоемкость и аналогии, что здесь не уместно рассматривать и что приводить для железа, напр., к тому, что за его атомный вес необходимо признать 56, т.е. два эквивалента первого рода, 3 — второго и 6 эквивалентов третьего рода. Когда открывается новый элемент — эквивалент узнается сравнительно легко, дело же определения веса атома, как очень трудное и требующее многих сведений, решается часто наугад по случайным наблюденным сходствам, а потому к эпохе появления П. законности еще много элементов, эквиваленты которых были более или менее хорошо известны, имели очень сомнительные атомные веса. Сюда относились в 1869 г. не только столь редкие элементы как La, Di; Y и их спутники, но и Be, In, Се, Th, V, Nb и U, для которых состав, свойства, реакции и формы соединений были, однако, хорошо известны, но не давали категорических данных для определения числа эквивалентов, содержащихся в атоме. П. законность оказалась здесь, очевидно, полезною и стала важным новым руководительным началом, потому что периодичности подлежат не эквиваленты, а веса атомов. Чтобы видеть в чем здесь дело, остановимся на двух крайних примерах, а именно вкратце над ураном и несколько подробнее над бериллием, для которых (как для Се, Y, In, La и др.) вес атома установлен благодаря П. законности. Уран дает две главные степени окисления: низшую — закись (ныне UO2) и высшую — окись (ныне UO3), в первой эквивалент (по водороду)=60, во второй=40. По закону кратных отношений и по сущности дела очевидно, что в атоме урана будет содержаться целое число эквивалентов. то есть U=n60=m40. Очевидно, что m=n11/2 и что приняв n=2, получим m=3, т.е. m и n тогда будут, как и следует, целыми числами. При этом простейшем допущении вес атома уранае120, формула закиси UO, окиси U2O3. Так это все и принимала, вслед за Пелиго, до П. законности. Но ныне, при П. законности, признать этого нельзя, потому что тогда урану нет подходящего места между элементами, так как у Sb ат. вес немного более 120, а у Sn немного менее и, судя по месту в системе, элемент с ат. весом около 120 должен давать высший солеобразный окисел состава RO2 или R2O5, т.е. с высшим чем у урана содержанием кислорода или с меньшим эквивалентом. Из равенства U=n.60=m.40 следует, что n должно быть четным числом, если m и n суть целые числа, и после невозможности признания n=2, проще всего было принять n=4, так как тогда закись будет UO2 окись UO3 и U=240, признать же n=6 и m=9 — невероятно, потому что тогда закись получит состав UO3, окись U2O9 (при U=360), а этот последний состав для солеобразных окислов, R2O5, совершенно невероятен и по П. законности существовать не может. Признав же n=4, т.е. U=240 и придав поэтому высшей окиси состав UO3, тотчас находим для U место в системе, в VI группе, аналогично с хромом, дающим СrO3 молибденом, образующим MoO3, и вольфрамом, высший окисел которого WO3. Тогда уран становится в 12-й ряд вслед за торием из IV группы с ат. весом 232. Эта уверенность подтверждена затем Роско, Циммерманом и др. при помощи определений теплоемкости, плотности пара и аналогий разного рода, которые здесь не место подробнее излагать. Ныне общепринят именно этот атомный вес U=240, установленный (мною в 1871 г.) по П. законности. Быстро приняты были и другие, вызванные П. законностью, перемены в весе атомов нек. др. элементов, но долго и с разных сторон не признавался для бериллия (или глиция) требуемый П. законностью вес атома Be=9, дающий ему при эквиваленте 4,5 место во 2 ряде и U группе, особенно по той причине, что у единственной солеобразной окиси бериллия есть много несомненных пунктов сходства с глиноземом, что и заставляло приписывать окиси Be состав глиноземный, т.е. Ве2O3, т.е. считать атом содержащим 3 эквивалента и равным Be=13,5. Масса работ была сделана для оправдания этого последнего веса атома бериллия, который тогда не находил вовсе места в периодической системе. Интерес к делу возрос именно из-за его связи с П. законностью. Считалось всеми в эпоху начала 80-х годов, что если будет доказана формула Ве2O3 и придется признать Be=13,5 — П. закон надо будет оставить, как недостаточный (ибо законы природы, в отличие от грамматических правил, исключений не допускают и ими опровергаются), если же оправдается формула ВеО и Be=9, надо будет признать общность П. закона. Здесь следует, однако, указать на то, что Авдеев еще в 1819 г., то есть задолго до П. законности, исследуя окись бериллия, счел ее аналогом магнезии MgO и придал ей состав ВеО, требуемый П. законностью. Значит, были и ранее основания к этому допущению, так что все дело было очень спорным. Наиболее горячее участие в защите формулы Вe2O3 долго (в начале 80-х годов) принимали упсальские ученые Нильсон и Петерсон, но они же затем определили при высотой темп. плотность паров хлористого бериллия и тем оправдали формулу Авдеева и П. законности, что и признали открыто и что представляет один из поучительных примеров разрешения научного недоразумения при твердом стремлении к достижению истины. Дело тут вот в чем. Если окись бериллия есть Ве2O3 и вес атома Ве=13,5, то хлористый бериллий должен представлять в парах (без разложения) частицу ВеСl3 или ее полимер, т.е. вес частицы тогда будет около 119,5 или 120 или в целое число раз более (напр. Be2Cl6, как у аналогов нередко бывает), след. по водороду плотность паров хлористого бериллия будет тогда =60 или n60 (так как плотность пара по водороду = половине частичного веса, считая атом водорода за 1 или кислорода за 16). Если же окись бериллия имеет состав магнезиальный ВеО и Be=9, то частица хлористого бериллия ВеСl2 будет весить около 79 или 80 и плотность пара будет около 40 (или n40). Опыт Нильсона и Петерсона оправдал это последнее число. Humpidge тогда же (1884) подтвердил его. Этим подтвердилось предположение Авдеева и вновь оправдалась П. законность. Но нельзя не указать здесь на то, что и после 80-х годов у очевидно неверной гипотезы об атомном весе бериллия и о сходстве состава его окиси с составом Al2O3 осталось некоторое число упорных приверженцев, следующих за оставленным, между которыми за последнее время особо выступил в Париже Вырубов, который (в 1896 г.) не раз говорил против всей П. законности и, исследуя кремневольфрамовые соли, пришел к заключению, что бериллий совершенно аналогичен в них с трехэквивалентными (Ве=13,5), а не двуэквивалентными (Be=9) металлами. Вследствие подобных сомнений, вновь высказанных, А. Rosenheim and P. Woge в 1897 г. («Zeitschr. f. Anorganische Chemie», стр. 283) очень подробно вновь исследовали многие (молибденовые, сернистые, щавелевые и др.) двойные соли бериллия и применили бекмановский способ (по температ. кипения растворов) к определению частичного веса хлористого бериллия, причем пришли вновь к категорическому выводу, что «согласно с П. законностью бериллий есть элемент двуэквивалентный». Для понимания П. закона очень важно обратить внимание на то, что он не был признан сразу всеми, имел много противников и лишь постепенно выступал, как истинный, по мере накопления фактов и по мере оправдания следствий, из него вытекающих. Здесь виден пример того, с какими трудами добываются новые истины и как в науке обеспечивается их утверждение.
Дальнейшие исследования по П. законности. Хотя все вышеуказанное и многое еще мною не приведенное ясно оправдывает П. законность и не позволяет сомневаться в том, что сравнительно недавно открытый закон этот уже имеет немаловажное значение для основных химических представлений, и хотя и не подлежит сомнению, что дальнейшая разработка П. законности будет совершаться, тем не менее считаю не излишним указать на некоторые из общих и частных вопросов, тесно связанных с П. законностью и требующих по его смыслу опытного разрешения. Между частными вопросами мне кажутся особо интересными вопросы об атомном весе Со, Ni, Те и J с одной стороны, а с другой о перекисях. Есть много оснований полагать, что между столь близкими элементами, как Со и Ni, первый из них ближе к железу, а второй к меди, т.е. по величине ат. веса ставить ряд по возрастающим весам: Fe, Со, Ni, Сu, как это и принято выше. А между тем большинство данных, существующих доныне, говорит за то, что ат. вес Со более, чем Ni, а потому желательно, чтобы новые, возможно точные определения решили этот предмет окончательно при помощи опытов сравнительных и параллельных для Ni и Со. Если же окажется и при этом, что Со весит более Ni, т.е. что надо писать ряд: Fe, Ni, Со, Сu, то желательно дальнейшее исследование аналогий Со и Ni с Rh и Pd, с Ir и Pt, для чего особенно важны сложные двойные соли и соединения подобные Ni(CO)4. Что же касается ат. весов Те и J, то по всему смыслу П. законности должно думать, что ат. вес йода более теллура, но так как определения Браунера, всегда защищавшего и подтверждавшего П. законность, дают Те=127,5, а опред. Стаса — J=126,85, т.е. противное требованию П. закон., то прежде чем вновь перерешать трудный вопрос о чистоте Те или искать в нем более тяжелых подмесей (как думает Браунер), мне кажется, следует вновь определить, после всевозможного очищения йода, величину его эквивалента, так как, несмотря на предосторожности, принятые столь сильным исследователем, каков был Стас, все же можно еще думать, что в его йоде могла оставаться подмесь хлора и брома, которые должны уменьшать вес атома йода. С своей стороны, я не придаю большого веса и настоятельности вопросу об атомных весах Со, Ni, Те и J по той причине, что здесь идет дело лишь о малых разностях и частностях, изучение которых представляет глубокие практические трудности, чему придет свое время в будущем. Притом, если и окажется, что Со тяжелее Ni, придется лишь усовершенствовать одну частность П. закона, и его судьба не связана с этою переменою. Гораздо важнее отношение йода к теллуру, и здесь нужнее новые точные исследования, особенно же над атомн. весом йода.
Сложнее и много поучительнее вопрос о перекисях в его связи с П. законностью. При начале распространения понятий, сюда относящихся, число истинных перекисей, обладающих характерными реакциями перекиси водорода и связанных с нею взаимными переходами, было сравнительно невелико, и все известные (напр. NaO, КО2, BaO2, AgO и т.п.) относились к настоящим металлам, кислот не дающим. Поэтому могло казаться, что общий тип окисления, по мере увеличения кислорода, будет такой: недокиси, основные окиси, перекиси и кислотные ангидриды, т.е. что перекиси составляют переход от основных окислов к кислотным. Это предубеждение совершенно пропало в последнее время, когда стали известны надсерная кислота S2h3O8 ей отвечающий ангидрид S2O7 и ей соответствующие многие иные кислоты (надазотная, надхромовая, надтитановая, надугольная и т.п.), все обладающие реакциями h3O2, из нее часто происходящие и в нее нередко переходящие. Эти открытия наделали много переполоха в представлениях многих химиков, не видевших, следуя за понятиями Берцелиуса, глубокой разницы между так наз. перекисью марганца и типическою перекисью бария. При этом посыпались, даже со стороны просвещеннейших химиков, нарекания на П. законность. Говорили напр. так: П. законность требует для серы, как элемента из VI группы, высшего окисла состава SO3, а оказывается, что она дает сверх того S2O7, как элементы VII группы, что нарушает стройность соответствий П. законности. На это прежде всего следует заметить, что считать настоящие перекиси, подобные ВаO2 или S2O7, стоящими в том же отношении к элементам, в каком стоят «солеобразные» окислы, нет никакого основания, что при самом установлении П. законности было видно и указано (1869-1871 гг.), потому, например, что и тогда была известна перекись натрия NaO, представляющая состав окислов элементов II группы, натрий же по всем своим отношениям, равно как и по составу своей «высшей солеобразной» окиси Na2O, несомненно, есть металл I группы, как барий II группы, хотя дает перекись ВаO2 такого же состава, как у высших солеобразных окислов IV группы. Мало того, П. законность, выставив вышеприведенное естественное соображение, давала возможность ждать и для всех элементов, как для Н, Na и Ва, своих перекисей, содержащих более кислорода, чем у высших, настоящих солеобразных окислов, кислотного ли или основного характера, но отвечающих по типу, по реакциям и по превращениям воде, тогда как настоящие перекиси отвечают типу, реакциям и превращениям (особенно же легкому выделению части кислорода) перекиси водорода. И эта сторона дела оправдалась, потому что вслед за надсерною кислотою исследования показали образование перекисных степеней окисления для множества разнообразных элементов. Упомянем, для примера о перекисях: углерода С2O5, хрома Cr2O7 или CrO4 (Wiede, 1897), олова SnO3 (Спринг, 1889), титана TiO3 (Пиччини, Веллер), молибдена Мо2О7, вольфрама W2O7, урана UO4 и др. Здесь и является вопрос о системе перекисных форм окисления и на основании общности П. законности можно ждать, что и в перекисях по группам и рядам элементов откроется П. правильность, что, по мнению моему, представляет одну из весьма интересных тем для дальнейших опытных исследований. Таким образом «перекиси», в истинном смысле понимаемые (тогда МnO2 и PbO2 — уже не суть перекиси, а их представители суть: h3O2, NaO и S2O7), не только не колеблют П. закона, но его оправдывают, показывая, что истинные перекиси всегда содержат более кислорода, чем «высшие солеобразные окислы», как в h3O2 более, чем в Н2O, и по реакциям отвечают h3O2, если высшие солеобразные окислы отвечают Н2O.
Но не эти и многие другие частные вопросы особенно важны для определения дальнейшей роли П. закона в химии, а многие общие, законом этим возбуждаемые. Среди них, я думаю, важнее всех нахождение точного соответствия между числами, выражающими атомные веса элементов, местом их в системе и специальными (индивидуальными) свойствами элементов, так как при всем параллелизме свойств элементов в величине их атомных весов нет однообразия в отношениях ни арифметических, ни геометрических. Так, напр., взяв лишь O=16; С=12,01; F=19,06; S=32,07; Si=28,40; Cl=35,45, получаем арифметические разности: Si-C=l6,39; S-O=16,()7 и Cl-F=16,39 не тожественные, причем нельзя думать, что S=32,39, как можно бы полагать, если бы допустить равенство разностей. Точно также разности между членами больших периодов, напр. Rb-К, Мо-Cr, Ru-Fe, Sb-As, J-Вr и т.п. то близки между собою, то представляют небольшие, но несомненные уклонения в разные стороны. В геометрических отношениях как аналогов разных периодов, так и членов рядов представляются подобного же рода не обобщенные неравенства, причину которых, мне кажется, можно будет со временем (когда более точно будет известно большее, чем ныне, число атомных весов и будет известна возможная погрешность в их определении) сопоставить, а затем закономерно связать, с индивидуальными особенностями элементов. Уже многие исследователи, особенно же Ридберг, Базаров, Гаугтон, Чичерин, Флавицкий, Милльс и др., старались с разных сторон подойти к точному выражены П. законности, но до сих пор предмет этот не поддавался точным и общим выводам, хотя обещает очень много не только для увеличения степени точности сведений об атомных весах, но и для постижения как причины П. законности так и самой природы элементов. При этом считаю необходимым обратить внимание на то, часто из виду упускаемое, обстоятельство, что выражением П. закона не могут служить обычные «сплошные» функции, напр. от синусов, потому что элементы более всего характеризуются «разрывами», как видно напр. из того, что между К=39 и Са=40 нельзя мыслить — без нарушения законов Дальтона (целых кратных отношении в числе атомов, напр. КСl и СаСl 2) — беспредельного числа промежутков, как нет между 1 и 2 ни одного промежуточного целого числа. Поэтому мне кажется, что для П. закона можно искать или геометрического выражения в точках пересечения двух «сплошных» кривых или аналитического выражения в «теории чисел». Попытки же выразить его «сплошными» кривыми, что делалось доныне, едва ли обещают успех, так как природе элементов, очевидно, мало соответствуют. Отсутствие до сих пор строго аналитического выражения для П. закона, по моему мнению, определяется тем, что он относится к области еще очень новой для математической обработки. Что же касается до отсутствия какого-либо объяснения сущности рассматриваемого закона, то причину тому должно искать прежде всего в отсутствии точного для него выражения. Он рисуется ныне в виде новой, отчасти только раскрытой, глубокой тайны природы, в которой нам дана возможность постигать законы, но очень мало возможности постигать истинную причину этих законов. Так, закон тяготения известен уже два столетия, но все попытки его объяснения — доныне мало удачны. Эти тайны природы составляют высший интерес точных наук, кладут на них особый отпечаток и делают изучение естествознания — в отличие от классического приема знаний — залогом умения сочетать и подчинять реально понятное с идеально вечным и общим, а потому и кажущимся непонятным. Словом, широкая приложимость П. закона, при отсутствии понимания его причины — есть один из указателей того, что он очень нов и глубоко проникает в природу химических явлений, и я, как русский, горжусь тем, что участвовал в его установлении.
Закон постоянства состава вещества является одним из главных законов химии. Он вытекает из атомно-молекулярного учения. Его суть заключается в том, что вещества состоят из одних и тех же молекул, потому и состав таких веществ постоянен.
Общие сведения
Француз Ж. Пруст – ученый, открывший закон постоянства состава химического соединения. Произошло это в 1808 году.
Рис. 1. Портрет Жозефа Луи Пруста
Современная формулировка закона заключается в следующем: всякое чистое вещество независимо от способа его получения имеет постоянный качественный и количественный состав.
Чистое вещество в данном случае – вещество, в котором отсутствует даже малое количество примеси.
Рис. 2. Формула закона постоянства состава вещества
Данный закон правдив лишь для элементов с молекулярной структурой.
При образовании из двух элементов нескольких соединений атомы этих элементов соединяются друг с другом в молекулы различного, но определенного состава. Например, азот с кислородом образует шесть соединений.
Закон постоянства состава вещества имеет значимое практическое значение. Он позволяет выводить химические формулы.
Соединения постоянного и переменного состава
Русский ученый Н.С. Курнаков в начале XX века обнаружил соединения переменного состава при изучении сплавов металлов. В них на одну единицу массы элемента может приходиться различная масса другого элемента. При рассмотрении соединения висмута с таллием на 1 единицу массы таллия приходится от 1,24 до 1,82 единиц массы висмута.
Курнаков предложил соединения постоянного состава назвать дальтонидами, а соединения переменного состава – бертоллидами.
Рис. 3. Вещества по составу
Дальтониды были названы в честь английского ученого Дальтона, а бертоллиды – в честь французского химика Бертолле, который предвидел такие соединения.
Во второй четверти 20 века обнаружилось, что соединения переменного состава могут встретиться не только среди соединений металлов друг с другом, но и среди других твердых тел, например оксидов, сульфидов, карбидов и т.д.
Уточненная формулировка закона постоянства вещества
Для многих бертоллидов существуют границы, в пределах которых может изменяться их состав. Например,
оксид урана (IV) имеет состав от UO 2,5 до UO 3 , оксид ванадия (II) – от VO 0,9 до VO 1,3 .
Таким образом, имеет смысл внести уточнения в существующую формулировку закона постоянства состава:
Состав соединений молекулярной структуры, т.е. состоящих из молекул, является постоянным независимо от способа получения. Если состав соединений имеет немолекулярную структуру (а, например, атомную, ионную), то он не является постоянным и зависит от условий получения.
Что мы узнали?
В учебнике химии 8 класса кратко раскрывается определение закона постоянства состава вещества, дается его четкая формулировка, а также рассматриваются соединения переменного и постоянного состава. В данной теме раскрываются все эти аспекты, а также дается определение дальтонидам и бертоллидам.
Тест по теме
Оценка доклада
Средняя оценка: 4.4
. Всего получено оценок: 147.
Один из основных законов химии, открытый в 1799 г. Ж. Л. Прустом; согласно этому закону определённое химически чистое соединение независимо от способа его получения состоит из одних и тех же хим. элементов, имеющих постоянные состав и свойства,… … Большая политехническая энциклопедия
закон постоянства состава
— pastoviųjų santykių dėsnis statusas T sritis fizika atitikmenys: angl. law of constant proportions; law of definite composition vok. Gesetz der konstanten Gewichtsverhältnisse, n; Gesetz der konstanten Proportionen, n; Gesetz der konstanten… … Fizikos terminų žodynas
закон постоянства состава
— закон паёв … Cловарь химических синонимов I
ПОСТОЯНСТВА СОСТАВА ЗАКОН: каждое химическое соединение независимо от способа его получения, состоит из одних и тех же элементов, причем отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических… … Большой Энциклопедический словарь
ПОСТОЯНСТВА СОСТАВА ЗАКОН: каждое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причем отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических… … Энциклопедический словарь
В каждом определенном хим. соед., независимо от способа его получения, соотношения масс составляющих элементов постоянны. Сформулирован в нач. 19 в. Ж. Прустом: Соединение есть привилегированный продукт, которому природа дала постоянный состав.… … Химическая энциклопедия
Один из основных законов химии: каждое определённое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны, а относительные количества их атомов выражаются… … Большая советская энциклопедия
Один из осн. законов химии, заключающийся в том, что каждое хим. соединение, независимо от способа его получения, состоит из одних и тех же хим. элементов, соединённых друг с другом в одних и тех же отношениях (по массе). П. с. з. был установлен… … Большой энциклопедический политехнический словарь
Каждое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических соединений может быть и… … Энциклопедический словарь
Каждое хим. соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллич. соед. может быть и неременным (см.… … Естествознание. Энциклопедический словарь
Уже к началу XIX в. накопилось много данных
о составе отдельных веществ и их
изменениях. Развитие техники количественных
измерений и методов химического анализа
позволило определять соотношения
элементов в соединениях. Французский
химик Ж. Пруст (1754–1826) после тщательнейших
экспериментов с рядом веществ установил
закон постоянства состава
– один
из основных законов химии.
Согласно закону постоянства состава,
всякое чистое вещество, независимо
от способов его получения и нахождения
в природе, имеет постоянный качественный
и количественный состав
.
Это означает, что все соединения содержат
элементы в строго определенных весовых
пропорциях, независимо от способа
получения, Так, например, сернистый газ,
полученный сжиганием серы, или действием
кислот на сульфиты, или любым другим
способом, всегда содержит одну весовую
часть серы и одну весовую часть кислорода.
Закон постоянства состава веществ был
установлен в результате семилетнего
спора между Прустом и его оппонентом,
французским химиком К. Бертолле
(1748–1822), утверждавшим, что состав
соединений зависит от способа их
получения.
Бертолле в результате анализа растворов,
которые он считал химическими соединениями,
сделал общий вывод о существовании
химических соединений переменного
состава. Получалось, что два элемента
могут образовать непрерывный ряд
соединений с изменяющимися свойствами
и составом.
Пруст утверждал, что состав чистого
вещества всегда один и тот же, любое
химическое вещество имеет всегда одни
и те же свойства, одинаковую температуру
плавления, кипения, удельный вес. Пруст
заявлял, что природа даже через посредство
людей никогда не производит соединений
иначе, как только по весу и мере. Одни и
те же соединения имеют всегда тождественный
состав. Внешний их вид может быть
различен, но свойства – никогда. Нет
разницы между окисью железа из южного
полушария и из северного, хлористое
серебро из Перу совершенно тождественно
хлористому серебру из Сибири; во всем
мире имеется только один хлористый
натрий, одна селитра и т.д. Проделав в
течение 1799–1887 гг. массу анализов, Пруст
доказал справедливость своих выводов.
Дальнейшее развитие химии показало,
что закон постоянства состава характеризует
соединения с молекулярной структурой,
состав же соединений с немолекулярной
структурой (атомной, ионной и металлической
решеткой) не является постоянным и
зависит от условий получения.
В начале XX в. русский химик Курнаков,
изучая сплавы металлов, открыл соединения
переменного состава. В дальнейшем было
выяснено, что соединения переменного
состава встречаются также среди оксидов,
соединений металлов с серой, азотом,
углеродом, водородом а также – среди
других неорганических веществ, имеющих
кристаллическую структуру. Вещества
переменного состава были названы бертоллидами
,
в отличие от соединений постоянного
состава –дальтонидов
. Для многих
соединений переменного состава
установлены пределы, в которых может
изменяться их состав. Так, в диоксиде
титанаTiO
2
на
единицу массы титана может приходиться
от0,65
до0,67
единиц
массы кислорода, что соответствует
формулеТi O
1,9
– 2,0
( таб.4.1
).
Таблица 4.1
ДАЛЬТОНИДЫ (вещества постоянного состава) примеры соединений | БЕРТОЛЛИДЫ (вещества переменного состава) примеры соединений | ||||
H | C Cl | CO | Ti O | V O | |
Таким образом, закон постоянства состава,
в отличие от закона сохранения массы
вещества, не является столь всеобщим.
Однако для своего времени закон
постоянства состава имел фундаментальное
значение. Он привел к мысли о существовании
молекул и подтвердил неделимость атомов.
В самом деле, почему в сернистом газе
весовое отношение серы и кислорода
всегда 1:1
,
а не1,1:0,9
или0,95:1.05
?
Этот результат легко объяснить, если
предположить, что атомы серы соединяются
с определенным числом атомов кислорода
и образуют частицы сернистого газа (эти
частицы впоследствии были названы
молекулами).
Всякое вещество – от самого
простого
до самого сложного – имеет три различные,
но взаимосвязанные стороны:
свойство, состав, строение…
Б.М.Кедров
Цели
.
Дидактическая
– рассмотреть понятия
«химический элемент», «сложное вещество», а
также состав сложных веществ, его постоянство,
что обозначает химическая формула вещества,
назначение коэффициентов и индексов.
Психологическая
– вызвать интерес к
предмету, выработать умения логически
рассуждать, грамотно выражать свои мысли.
Воспитательная
– развивать умения работать
коллективно, оценивать ответы своих товарищей.
Оборудование
. Кристаллическая
решетка сульфида железа(II), модели молекул воды,
индивидуальные карточки для проверки домашнего
задания, таблички-анаграммы для химической
разминки, шкала для определения эмоционального
состояния ученика.
ХОД УРОКА
В начале и в конце урока проводится
психологическая разминка . Ее цель –
определить эмоциональное состояние учащихся. У
каждого ученика на внутренней стороне обложки
тетради приклеена табличка с шестью лицами –
шкала для определения эмоционального состояния
(рис. 1). Каждый ученик ставит галочку под той
рожицей, чье выражение отражает его настроение.
УЧИТЕЛЬ
. Было бы
замечательно, если бы к концу урока каждому
удалось переместить галочку хотя бы на одну
клетку влево. Для этого нужно задуматься над
вопросами: может ли человек полюбить
неинтересный ему учебный предмет? Что для этого
нужно сделать?
Статья опубликована при поддержке мобильного онлайн переводчика «m-translate.ru ». Удобный и быстрый онлайн перевод с десятка языков, тысячи направлений перевода. Не требует установки, перевод слов, предложений и текстов, бесплатно. Чтобы начать пользоваться сервисом онлайн перевода перейдите на сайт: http://www.m-translate.ru/.
Химическая разминка
.
УЧЕНИК
. Вася и Петя любят составлять и
разгадывать слова-анаграммы (обычно
фантастические), в которых порядок букв
переставлен. Попробуйте разгадать некоторые из
химических анаграмм.
Переставив буквы в каждом слове, надо получить
название химического элемента.
Леодруг
– без этого элемента в печке не будет
огня,
сликодор
– без этого элемента не проживете и
десяти минут,
цинвес
– у этого элемента действительно
большой удельный вес,
мникрей
– этот элемент ищите среди камней,
орребес
– блестит, а не золото.
УЧИТЕЛЬ.
Если вы легко справились с
этим заданием, скажите себе: «Я – умница».
Проверка домашнего задания по теме
«Химические знаки».
Повторить знаки
химических элементов и значения их
относительных атомных масс. Обратить внимание на
различие массы атома (в атомных единицах массы) и
относительной атомной массы (безразмерной
величины) на их общий признак – одинаковое
численное значение. Затем провести фронтальную
самостоятельную работу по индивидуальным
карточкам в течение 5–10 мин.
Карточка 1
. Назовите элементы по их
химическим знакам: N, S, Ag, Al, O, I.
Карточка 2
. Напишите химические знаки
элементов: железо, водород, натрий, бром, цинк,
хлор.
УЧИТЕЛЬ.
Сегодня мы познакомимся с
одним из основных законов химии – это закон
постоянства состава вещества. Мне хочется, чтобы
вы за строгой формулировкой закона увидели
живого, трудолюбивого и любознательного
человека из Франции – Жозефа Луи Пруста. Он в
течение семи лет исследовал множество веществ,
чтобы доказать утверждение, которое в
современной формулировке умещается в три
строчки. Об этом очень красиво сказал в своих
стихах его земляк, малоизвестный у нас
французский поэт Арман Сюлли-Прюдом, лауреат
Нобелевской премии, современник Д.И.Менделеева.
УЧЕНИЦА
«Взор химика пытлив, ему порядок мил,
Среди своих реторт, мензурок и приборов,
Таких загадочных для любопытных взоров,
Стремится он постичь капризы тайных сил.
Он многое из них уже установил,
Следя за их игрой, участник их раздоров,
И скоро он велит, властитель этих споров,
Признать и чтить закон, который он открыл.
Завидую тебе, взыскательный ученый,
Чьи зоркие глаза мир видят обнаженный,
Как в день творения, исток всех прочих дней.
Веди ж меня в загадочное царство!
Я верю: только в нем отыщется лекарство
От всех бесчисленных печалей и скорбей».
УЧИТЕЛЬ.
Чтобы получить сульфид
железа(II), мы смешивали железо и серу в
соотношении 7:4. Если смешать их в другой
пропорции, например 10:4, то химическая реакция
произойдет, но 3 г железа в реакцию не вступит.
Почему наблюдается такая закономерность?
Известно, что в сульфиде железа(II) на каждый один
атом железа приходится один атом серы
(демонстрация
кристаллической решетки, рис. 2). Следовательно,
для реакции нужно брать вещества в таких
массовых соотношениях, чтобы сохранялось
соотношение атомов железа и серы (1:1). Поскольку
численные значения атомных масс
Fe, S и их
относительных атомных масс A r
(Fe), A r
(S)
совпадают, можно записать:
A r
(Fe):A r
(S)
= 56:32 = 7:4.
Отношение 7:4 сохраняется постоянно, в каких бы
единицах массы ни выражать массу веществ
(г, кг, т, а.е.м.). Большинство химических веществ
обладает постоянным составом.
Закон постоянства состава веществ
был
открыт французским ученым Прустом в 1808 г. Вот как
этот закон звучал в его изложении: «От одного
полюса Земли до другого соединения имеют
одинаковый состав и одинаковые свойства. Никакой
разницы нет между оксидом железа из Южного
полушария и Северного. Малахит из Сибири имеет
тот же состав, как и малахит из Испании. Во всем
мире есть лишь одна киноварь».
Современная формулировка закона
:
каждое химически чистое вещество с молекулярным
строением независимо от места нахождения и
способа получения имеет один и тот же постоянный
качественный и количественный состав.
Учащиеся записывают определение в тетрадь.
Затем они выполняют самостоятельную работу
.
Текст заданий заранее написан на доске. Двое
учащихся решают задачи на обратной стороне
доски, остальные решают в тетрадях. После
выполнения работы ученики обмениваются
тетрадями, происходит взаимопроверка. Учитель
может выборочно проверить некоторые тетради.
Вариант 1
. Для получения сульфида железа(II)
взяли 3,5 г железа и 4 г серы. Какое вещество
останется неизрасходованным и какова его масса?
Вариант 2
. Чтобы получить сульфид железа(II),
взяли 15 г железа и 8 г серы. Какое вещество взято в
избытке и какова масса этого избытка?
УЧИТЕЛЬ.
А сейчас послушайте
выступление о знаменитом споре между
французскими учеными Ж.Л.Прустом и К.Л.Бертолле,
который длился около 10 лет на страницах
французских журналов в начале XIX в.
УЧЕНИК.
Да, спор двух французских
химиков длился с 1799 по 1809 г., а затем был продолжен
химиками Англии, Швеции, Италии, России и других
стран. Этот спор можно с полным правом назвать
первой научной дискуссией такого масштаба и по
времени возникновения, и по стратегической
важности обсуждаемых проблем. Эта дискуссия
определила пути развития химии на столетия
вперед.
В 1799 г. профессор Королевской лаборатории в
Мадриде, француз по происхождению, Жозеф Луи
Пруст опубликовал статью «Исследования меди». В
статье подробно освещены анализы соединений
меди и сделан вполне обоснованный вывод, что
химически индивидуальное соединение всегда,
независимо от способа его образования, обладает
постоянным составом. К такому же выводу Пруст
пришел и позже, в 1800–1806 гг., исследуя химические
соединения свинца, кобальта и других металлов.
В 1800–1803 гг. английский химик Джон Дальтон
обосновал этот закон теоретически, установив
атомное строение молекул и наличие определенных
атомных масс элементов. Чисто теоретически
Дальтон пришел к открытию еще одного основного
закона химии – закона кратных отношений,
находящегося в единстве с законом постоянства
состава.
В то же самое время профессор Нормальной школы в
Париже Клод Луи Бертолле, уже знаменитый химик,
опубликовал ряд статей, в которых отстаивал
вывод о том, что состав химических соединений
зависит от способа их получения и часто бывает не
постоянным, а переменным. Бертолле выступил
против законов Пруста и Дальтона, аргументируя
это все новыми и новыми опытами по получению
сплавов, твердых оксидов металлов. Он
воспользовался и данными самого Пруста, указав
на то, что в природных сульфидах и оксидах
металлов содержится избыток серы и кислорода по
сравнению с полученными в лаборатории.
Развитие химии показало, что обе стороны были
правы. Точка зрения Пруста и Дальтона для химии
1800-х гг. была понятна, конкретна и почти очевидна.
Пруст и Дальтон заложили основы атомно-
молекулярного учения о составе и строении
химических соединений. Это была магистральная
линия развития химии. Точка зрения Бертолле была
практически неприемлема для тогдашней химии, т.
к. она отражала химизм процессов, изучение
которых началось в основном лишь
с 1880-х гг. И только будущее показало, что и
Бертолле был прав!
По предложению академика Н.С.Курнакова вещества
постоянного состава были названы дальтонидами (в
честь английского химика и физика Дальтона), а
вещества переменного состава – бертоллидами (в
память о французском химике Бертолле). (Более
подробно об этом можно прочитать в работах .)
УЧИТЕЛЬ.
Подведем итоги сообщения.
Во-первых, известны вещества немолекулярного
строения с переменным составом. Во-вторых, закон
постоянства состава веществ справедлив для
веществ молекулярного строения. В-третьих,
существует категория веществ молекулярного
строения, для которых закон постоянства состава
неверен. Это полимеры, с ними мы познакомимся на
уроках химии позднее.
Что же подразумевается под количественным и
качественным составами веществ? На основе закона
Пруста можно записать химические формулы
веществ при помощи химических знаков.
Рассмотрим в качестве примера состав молекулы
воды. Она состоит из атомов водорода и кислорода
(качественный состав), причем по массе в воде
содержится водорода – 11,19%, а кислорода – 88,81%
(количественный состав). Есть несколько способов
выражения состава воды.
1-й способ
. В состав молекулы воды входят два
атома водорода и один атом кислорода (используем
слова).
2-й
способ
. Эту же мысль можно выразить рисунком
(используем условные обозначения):
3-й способ
. Формула воды –
Н 2 О (используем
химические знаки и индексы).
Индекс
показывает количество атомов
данного элемента в молекуле.
Итак, состав дальтонидов выражается простыми
формулами с целочисленными стехиометрическими
индексами, например
Н 2 О, НСl, СН 4 . Состав
бертоллидов непостоянен, у них дробные
стехиометрические индексы. Так, оксид титана(II)
ТiO в действительности имеет состав от
ТiO 0,7
до ТiO 1,3 .
Ответьте мне на вопрос: что показывает
коэффициент? (Ответ учащихся: число молекул
данного вещества.)
Рассмотрим пример: 3Н 2 О. Какое количество
молекул воды отображает эта запись? Сколько
атомов водорода в одной молекуле воды, в трех
молекулах воды? Сколько атомов кислорода в одной
молекуле воды, в трех молекулах воды?
(Демонстрация моделей молекул воды.) Читаем
формулу: «три-аш-два-о».
Демонстрация увеличенного рисунка 15 на с. 24
учебника «Химия-8» , представляющего запись: 3CuCl 2 ,
5Al 2 O 3 , 3FeCl 2 .
УЧИТЕЛЬ.
Как прочитать формулы
указанных веществ? Сколько молекул данного
вещества отображает химическая формула? Сколько
атомов каждого элемента входит в одну молекулу
данного вещества? Сколько атомов каждого
элемента в трех (пяти) молекулах данного
вещества?
Химическая формула
– это условная
запись состава вещества посредством химических
знаков и индексов.
Ученики записывают определение в тетрадь.
Беседа с учащимися по вопросам.
1. Кем и когда был открыт закон постоянства
состава веществ?
2. Дайте определение этого закона.
3. В чем состояла суть спора между химиками
Прустом, Дальтоном и Бертолле?
4. Что отображает химическая формула вещества?
5. Что показывают коэффициент и индексы в
химической формуле?
6. Есть ли разница в составе веществ, имеющих
формулы: СО и СО 2 , Н 2 О и Н 2 О 2 ?
7. Используя химические знаки, индексы и
коэффициенты, запишите обозначения
двух молекул воды,
трех молекул оксида азота (если известно, что в
молекуле оксида азота на один атом азота
приходится два атома кислорода),
трех молекул сероводорода (в его молекуле на два
атома водорода приходится один атом серы),
четырех молекул оксида фосфора (в каждой
молекуле этого оксида на два атома фосфора
приходится пять атомов кислорода).
Ученики делают записи в тетради, один ученик – на
обратной стороне доски. Проверка: обмен
тетрадями с соседом по парте, сверка по ответу на
доске, анализ ошибок.
Задание на дом.
Учебник «Химия-8» , § 9,
с. 22–23; § 10, с. 24–25. Двум учащимся дается задание
подготовить небольшие сообщения по биографии
Пруста.
Итоги урока
. Объявить оценки за урок
отвечавшим ученикам, поблагодарить всех за
работу на уроке. Провести оценку эмоционального
состояния по шкале (см. рис. 1). Учитель еще раз
напоминает вопросы, над которыми необходимо
подумать для эффективной работы на уроках.
ЛИТЕРАТУРА
1. Соловейчик С.Л.
Час ученичества. М.:
Педагогика, 1986.
2. Леенсон И.А.
Химические элементы и
химические законы. Рабочая тетрадь. М.: Изд-во
гимназии «Открытый мир», 1995.
3. Кузнецов В.И., Рахимбекова X.
Дискуссии в
развитии науки и диалоговая форма обучения.
Химия в школе, 1991, № 6.
4. Кузнецов В.И.
Эволюция представлений об
основных законах химии. М.: Наука, 1967.
5. Рудзитис Г.Е., Фельдман Ф.Г.
Химия-8. М.:
Просвещение, 1991.
Закон постоянства состава — это… Что такое Закон постоянства состава?
- Закон постоянства состава
Закон постоянства состава (Ж.Л. Пруст, 1801—1808гг.) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Это один из основных законов химии.
Закон постоянства состава не выполняется для бертоллидов (соединений переменного состава). Однако условно для простоты состав многих бертоллидов записывают как постоянный. Например, состав оксида железа(II) записывают в виде FeO (вместо более точной формулы Fe1-xO).
См. также
Категории:
- Основные законы в химии
- Стехиометрия
- Количество вещества
Wikimedia Foundation.
2010.
- Порфирины
- Потенциометрия
Смотреть что такое «Закон постоянства состава» в других словарях:
ЗАКОН ПОСТОЯНСТВА СОСТАВА — один из основных законов химии, открытый в 1799 г. Ж. Л. Прустом; согласно этому закону определённое химически чистое соединение независимо от способа его получения состоит из одних и тех же хим. элементов, имеющих постоянные состав и свойства,… … Большая политехническая энциклопедия
закон постоянства состава — pastoviųjų santykių dėsnis statusas T sritis fizika atitikmenys: angl. law of constant proportions; law of definite composition vok. Gesetz der konstanten Gewichtsverhältnisse, n; Gesetz der konstanten Proportionen, n; Gesetz der konstanten… … Fizikos terminų žodynas
закон постоянства состава — закон паёв … Cловарь химических синонимов I
ПОСТОЯНСТВА СОСТАВА ЗАКОН — ПОСТОЯНСТВА СОСТАВА ЗАКОН: каждое химическое соединение независимо от способа его получения, состоит из одних и тех же элементов, причем отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических… … Большой Энциклопедический словарь
ПОСТОЯНСТВА СОСТАВА ЗАКОН — ПОСТОЯНСТВА СОСТАВА ЗАКОН: каждое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причем отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических… … Энциклопедический словарь
ПОСТОЯНСТВА СОСТАВА ЗАКОН — в каждом определенном хим. соед., независимо от способа его получения, соотношения масс составляющих элементов постоянны. Сформулирован в нач. 19 в. Ж. Прустом: Соединение есть привилегированный продукт, которому природа дала постоянный состав.… … Химическая энциклопедия
Постоянства состава закон — один из основных законов химии: каждое определённое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны, а относительные количества их атомов выражаются… … Большая советская энциклопедия
ПОСТОЯНСТВА СОСТАВА ЗАКОН — один из осн. законов химии, заключающийся в том, что каждое хим. соединение, независимо от способа его получения, состоит из одних и тех же хим. элементов, соединённых друг с другом в одних и тех же отношениях (по массе). П. с. з. был установлен… … Большой энциклопедический политехнический словарь
постоянства состава закон{:} — каждое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических соединений может быть и… … Энциклопедический словарь
ПОСТОЯНСТВА СОСТАВА 3AKОH — каждое хим. соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллич. соед. может быть и неременным (см.… … Естествознание. Энциклопедический словарь
Закон постоянства состава вещества — параграф 13 ГДЗ химия 8 Рудзитис
1. Кем и когда был открыт закон постоянства состава вещества? Дайте определение и поясните сущность этого закона с точки зрения представлений об атомах и молекулах.
Закон постоянства состава вещества был сформулирован французским химиком Жозефом Луи Прустом в 1799 — 1806 гг (по данным учебника) или в 1801 — 1808 гг (по данным википедии).
Каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав.
Такая формулировка дана в учебнике. На самом деле, определение несколько шире.
Каждое химически чистое вещество независимо от места нахождения и способа получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.
Однако последний пункт (относительные числа их атомов выражаются целыми числами) исполняется не для всех веществ.
С точки зрения представлений об атомах и молекулах можно сказать так: в состав молекул веществ входит определенное количество атомов химических элементов. И в каком бы месте мы не находились, и каким бы способом мы не получали эти молекулы, состав их всегда будет один и тот же. Вода, полученная изо льда Арктики, будет по химическому составу такой же, как и дождевая вода в Африке, или вода, полученная путем синтеза на международной космической станции.
2. Известно вещество, в котором на 2 атома меди приходится 1 атом серы. В каких массовых отношениях нужно взять медь и серу, чтобы оба вещества полностью вступили в реакцию?
Отношение массы веществ равно отношению их относительных атомных масс (см. § 11. Относительная атомная масса химических элементов):
m (Cu) : m (S) = Ar (Cu) : Ar (S)
По условию задачи на 2 атома меди приходится 1 атом серы, поэтому:
2m (Cu) : m (S) = 2Ar (Cu) : Ar (S) = 2*64 : 32 = 4 : 1
Ответ: массовые отношения меди и серы 4 к 1.
3. Какое практическое значение имеет закон постоянства состава веществ?
На практике этот закон означает, что вещества имеют определенный состав (например, H2O, а не HxOy, где x и y — переменные). А это, в свою очередь, позволяет проводить различные расчеты (массы вещества, необходимого для реакции; массы вещества, получаемого в результате реакции; или даже состав сложного вещества — по массе получаемых из него простых веществ).
Закон постоянства состава веществ. Химические формулы. | Презентация к уроку по химии (8 класс):
Слайд 1
Закон постоянства состава веществ. Химические формулы. Тема урока: Составила: Донгак О. О
Слайд 2
ЦЕЛЬ УРОКА: сформировать представление о законе постоянства состава веществ, рассмотреть понятие химические формулы. ЗАДАЧИ УРОКА: — сформировать понятие о постоянстве состава веществ; -показать, что постоянный состав характерен только для веществ, имеющих молекулярное строение; сформировать понятия о химической формуле, индексе, коэффициенте. продолжать развивать общеучебные умения и навыки, логическое мышление, умение анализировать, делать вывод.
Слайд 3
(справедлив только для веществ молекулярного строения) Жозеф Луи Пруст (1754-1826) Каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВ
Слайд 4
Вода может быть получена в результате следующих химических реакций: 2Н 2 + O 2 = 2Н 2 O Cu(OH) = H 2 O + CuO Са(ОН) 2 + H 2 SO 4 = CaSO 4 + 2Н 2 O
Слайд 5
Чистая (без примесей) вода полученная различными способами всегда состоит из двух атомов водорода и одного атома кислорода.
Слайд 6
Из каких атомов состоит это вещество? FeS Найдите в ПСХЭ значение относительных атомных масс железа и серы. Вычислите соотношение масс железа и серы. Расчёты на основе закона постоянства состава веществ
Слайд 7
Ar (Fe) = 56 Ar (S) = 32 Соотношение масс: Ar (Fe) : Ar(S) = 56 : 32 = 7 : 4 Вывод: Чтобы получить сульфид железа надо смешать железо и серу в массовых соотношениях 7 : 4 Если порошка железа взять 9 г, а серы 4 г, химическая реакция произойдет, избыточные 2 г железа в реакцию не вступят.
Слайд 8
Задание Сколько грамм железа нужно взять, чтобы прореагировало 2г серы?
Слайд 9
Практикум Известно вещество, в котором на 2 атома меди приходится 1 атом серы. В каких массовых отношениях нужно взять медь и серу, чтобы оба вещества полностью вступили в реакцию?
Слайд 10
Находим: 2 Ar(Cu) = 64 х 2 = 128 Ar(S) = 32 Медь и серу необходимо смешать в соотношении 128 : 32 или 4 : 1
Слайд 11
Реши самостоятельно! В каком соотношении масс соединяются водород и сера? (В этом веществе на один атом серы – два атома водорода).
Слайд 12
Проверь себя: Находим Ar (S) и 2 Ar (H) 32 : 2 х 1 32 : 2 16 : 1 В этом веществе элементы соединяются в массовых отношениях 16 :1
Слайд 13
Химическая формула – это условная запись состава вещества посредством химический знаков и индексов. Н 2 О
Слайд 14
ХИМИЧЕСКАЯ ФОРМУЛА ВОДЫ Н 2 О Индекс 2 (обозначает 2 атома водорода в составе молекулы воды). Индекс 1 не пишут (обозначает 1 атом кислорода в составе молекулы воды). Индекс обозначает число атомов элемента, входящих в состав данного вещества.
Слайд 15
ХИМИЧЕСКАЯ ФОРМУЛА ВОДЫ 2 Н 2 О Коэффициент 2 (показывает 2 молекулы воды). Коэффициент обозначает число молекул (или отдельных атомов)
Слайд 16
Химические формулы Коэффициенты 3CuCl 2 5Al 2 O 3 3FeCl 3 Индексы Химическая формула показывает, из атомов каких элементов состоит вещество (т.е. качественный состав вещества) и каково соотношение атомов этих элементов (т.е. количественный состав вещества).
Слайд 17
Подумай, выполни, ответь… Что означают формулы? 3Н 2 О 5 Fe Как читаются эти записи? Напишите следующую формулу : пять молекул воды образованны десятью атомами водорода и пятью атомами кислорода.
Слайд 18
Заполните таблицу Вещество 2CH 4 4FeCl 3 3H 2 O Коэффициенты Индексы
Слайд 19
РЕФЛЕКСИЯ
Слайд 20
Домашнее задание: параграф 13 , 14 стр. 47. Домашнее задание: параграф 13 , 14 стр. 47. Домашнее задание §9 в. 1-3 с.31
Закон постоянного состава | Физико-химические изменения
13.3 Закон постоянного состава (ESADW)
В любом данном химическом соединении элементы всегда сочетаются друг с другом в одинаковых пропорциях. Это закон постоянного состава .
Закон постоянного состава гласит, что в любом конкретном химическом соединении все образцы этого соединения будут состоять из одних и тех же элементов в одинаковой пропорции или соотношении. Например, любая молекула воды всегда состоит из двух атомов водорода и одного атома кислорода в соотношении \ (2: 1 \).Если мы посмотрим на относительные массы кислорода и водорода в молекуле воды, мы увидим, что \ (\ text {94} \% \) массы молекулы воды приходится на кислород, а оставшаяся часть \ (\ text { 6} \% \) — масса водорода. Эта массовая доля будет одинаковой для любой молекулы воды.
Это не означает, что водород и кислород всегда соединяются в соотношении \ (2: 1 \), образуя \ (\ text {H} _ {2} \ text {O} \). Возможны множественные пропорции. Например, водород и кислород могут объединяться в разных пропорциях с образованием \ (\ text {H} _ {2} \ text {O} _ {2} \), а не \ (\ text {H} _ {2} \ text {O} \).{-3} $} \) гидроксид натрия (\ (\ text {NaOH} \))
9 больших пробирок
3 стойки
Метод
Реакция 1: Подготовьте три пробирки с \ (\ text {5} \) \ (\ text {mL} \), \ (\ text {10} \) \ (\ text {mL} \) и \ (\ text {15} \) \ (\ text {mL} \) нитрата серебра соответственно. Используя чистый пропет, добавьте \ (\ text {5} \) \ (\ text {mL} \) хлорида натрия к каждому и посмотрите, что произойдет.
Реакция 2: Подготовьте три пробирки с \ (\ text {5} \) \ (\ text {mL} \), \ (\ text {10} \) \ (\ text {mL} \) и \ (\ text {15} \) \ (\ text {mL} \) нитрата свинца соответственно. Используя чистый пропет, добавьте \ (\ text {5} \) \ (\ text {mL} \) йодида натрия к каждому и посмотрите, что произойдет. Напишите сбалансированное уравнение этой реакции.
Реакция 3: Подготовьте три пробирки с \ (\ text {5} \) \ (\ text {mL} \), \ (\ text {10} \) \ (\ text {mL} \) и \ (\ text {15} \) \ (\ text {mL} \) гидроксида натрия соответственно.Добавьте \ (\ text {5} \) \ (\ text {mL} \) хлорида железа (III) к каждому и посмотрите, что произойдет.
Обсуждение и заключение
Независимо от количества добавленных реагентов образуются одни и те же продукты с одинаковым составом (т.е. осадок, наблюдаемый в реакциях). Однако, если реагенты не добавляются в правильных соотношениях, в конечном растворе останутся непрореагировавшие реагенты вместе с образовавшимися продуктами.
Объемные соотношения в газах (ESADX)
В химической реакции между газами относительные объемы газов в реакции присутствуют в отношении малых целых чисел, если все газы имеют одинаковую температуру и давление.Эта взаимосвязь также известна как закон Гей-Люссака .
Например, в реакции между водородом и кислородом с образованием воды два объема \ (\ text {H} _ {2} \) реагируют с 1 объемом \ (\ text {O} _ {2} \) с образованием воды. изготовить 2 тома \ (\ text {H} _ {2} \ text {O} \).
\ [2 \ text {H} _ {2} \ text {(g)} + \ text {O} _ {2} \ text {(g)} \ rightarrow 2 \ text {H} _ {2} \ text {O (l)} \]
В реакции получения аммиака один объем газообразного азота вступает в реакцию с тремя объемами газообразного водорода с образованием двух объемов газообразного аммиака.
\ [\ text {N} _ {2} \ text {(g)} + 3 \ text {H} _ {2} \ text {(g)} \ rightarrow 2 \ text {NH} _ {3} \ text {(g)} \]
Закон постоянного состава в химии
В химии закон постоянного состава (также известный как закон определенных пропорций) гласит, что образцы чистого соединения всегда содержат одни и те же элементы в одинаковой массовой доле. Этот закон вместе с законом кратных пропорций является основой стехиометрии в химии.
Другими словами, независимо от того, как соединение получено или приготовлено, оно всегда будет содержать одни и те же элементы в одной и той же массовой доле.Например, углекислый газ (CO 2 ) всегда содержит углерод и кислород в массовом соотношении 3: 8. Вода (H 2 O) всегда состоит из водорода и кислорода в массовом соотношении 1: 9.
Закон постоянного состава История
Открытие этого закона приписывают французскому химику Жозефу Прусту, который в результате серии экспериментов, проведенных с 1798 по 1804 год, пришел к выводу, что химические соединения имеют определенный состав. Учитывая, что атомная теория Джона Далтона только начинала объяснять, что каждый элемент состоит из одного типа атома, и в то время большинство ученых все еще считало, что элементы могут сочетаться в любой пропорции, выводы Пруста были исключительными.
Пример закона постоянного состава
Когда вы работаете с химическими задачами, используя этот закон, ваша цель — найти наиболее близкое соотношение масс между элементами. Ничего страшного, если процент меньше нескольких сотых. Если вы используете экспериментальные данные, вариация может быть еще больше.
Например, предположим, что, используя закон постоянного состава, вы хотите продемонстрировать, что два образца оксида меди подчиняются этому закону. Ваш первый образец был 1.375 г оксида меди, который нагревали с водородом, получая 1,098 г меди. Для второго образца 1,179 г меди растворяли в азотной кислоте с получением нитрата меди, который впоследствии сжигали с получением 1,476 г оксида меди.
Чтобы решить эту проблему, вам нужно найти массовый процент каждого элемента в каждом образце. Неважно, выберете ли вы определение процентного содержания меди или кислорода. Вы просто вычтите одно из значений из 100, чтобы получить процент другого элемента.
Запишите, что вы знаете:
В первом примере:
оксид меди = 1,375 г
медь = 1,098 г
кислород = 1,375 — 1,098 = 0,277 г
процент кислорода в CuO = (0,277) (100%) / 1,375 = 20,15%
Для второго образца:
медь = 1,179 г
оксид меди = 1,476 г
кислород = 1,476 — 1,179 = 0,297 г
процент кислорода в CuO = (0,297) (100%) / 1,476 = 20,12%
Образцы подчиняются закону постоянного состава, допускающему значительные цифры и экспериментальную ошибку.
Исключения из закона постоянного состава
Как оказалось, из этого правила есть исключения. Существуют некоторые нестехиометрические соединения, состав которых варьируется от образца к образцу. Примером является вюстит, тип оксида железа, который может содержать от 0,83 до 0,95 железа на каждый кислород.
Кроме того, поскольку существуют разные изотопы атомов, даже нормальное стехиометрическое соединение может иметь вариации в массовом составе, в зависимости от того, какой изотоп атомов присутствует.Обычно эта разница относительно небольшая, но она существует и может быть важной. Примером может служить массовая доля тяжелой воды по сравнению с обычной водой.
Закон постоянной пропорции Пруста
Закон постоянной пропорции, открытый Джозефом Прустом, также известен как закон определенных пропорций. Он отличается от закона множественных пропорций, хотя оба проистекают из закона сохранения массы Лавуазье. Французский химик Жозеф Пруст сформулировал этот закон следующим образом: «Химическое соединение всегда содержит одни и те же элементы, соединенные вместе в одинаковой пропорции по массе.«
Джозеф Пруст
Жозеф Пруст был французским химиком, наиболее известным своими аналитическими способностями. Однажды его рекомендовал на работу профессором химии в Королевской артиллерийской школе Сеговии никто иной, как Антуан Лавуазье! Его эксперименты с неорганическими бинарными соединениями — в основном сульфатами, сульфидами и оксидами металлов — привели его к формулированию Закона постоянного состава. Впервые закон был опубликован в статье об оксидах железа в 1794 году.
Джозеф Луи Пруст (1754-1826)
Закон Пруста подвергся критике со стороны уважаемого французского химика Клода-Луи Бертолле, который не согласился с тем, что химическая комбинация ограничена определенными пропорциями насыщения.Путаница была вызвана определением химического соединения; Бертолле классифицировал растворы как химические соединения, в то время как Пруст старался различать эти соединения и настоящие бинарные соединения. Конфликт продолжался до тех пор, пока английский химик Джон Далтон не выступил с атомной теорией, которая поддерживала закон Пруста. Шведский химик Йонс Якоб Берцелиус установил связь между законом Пруста и теорией Дальтона в 1811 году.
Например, чистая вода, полученная из разных источников, таких как река, колодец, родник, море и т. Д., всегда содержит водород и кислород вместе в соотношении 1: 8 по массе. Точно так же диоксид углерода (CO 2 ) можно получить разными способами, например,
- Сжигание углерода
- Нагрев известняка
- Нанесение разбавленной HCl на мраморные куски
Каждая проба CO 2 содержит углерод и кислород в соотношении 3: 8.
Пример \ (\ PageIndex {1} \): Восстановление оксида меди
Когда 1,375 г оксида меди восстанавливается при нагревании в токе водорода, масса меди остается равной 1.098 г. В другом эксперименте 1,179 г меди растворяют в азотной кислоте, и полученный нитрат меди превращается в оксид меди путем воспламенения. Масса образовавшегося оксида меди 1,476 г. Покажите, что эти результаты иллюстрируют закон постоянной пропорции.
Решение
Первый эксперимент
- Оксид меди = 1,375 г
- Медь левая = 1,098 г
- Наличие кислорода = 1,375 — 1,098 = 0,277 г
\ [\ text {Процент кислорода в CuO} = \ dfrac {(0.277) (100 \%)} {1,375} = 20,15 \% \]
Второй эксперимент
- Взято меди = 1,179 г
- Образовавшийся оксид меди = 1,476 г
- Наличие кислорода = 1,476 — 1,179 = 0,297 г
\ [\ text {Процент кислорода в CuO} = \ dfrac {(0,297) (100 \%)} {1,476} = 20,12 \% \]
Процентное содержание кислорода примерно (в пределах значащих цифр) одинаково в обоих вышеупомянутых случаях. Так проиллюстрирован закон постоянного состава.
Авторы и авторство
Атомная теория материи
2.1: Атомная теория материи
Самое раннее записанное обсуждение основной структуры материи принадлежит древнегреческим философам. Левкипп и Демокрит утверждали, что вся материя состоит из маленьких конечных частиц, которые они назвали atomos , что означает «неделимый». Позже Аристотель и другие пришли к выводу, что материя состоит из различных комбинаций четырех «элементов» — огня, земли, воздуха и воды — и может быть разделена до бесконечности.Интересно, что эти философы считали атомы и «элементы» философскими концепциями, но, по-видимому, никогда не рассматривали возможность проведения экспериментов для проверки своих идей.
Аристотелевский взгляд на состав вещества господствовал более двух тысяч лет, пока английский ученый Джон Дальтон не произвел революцию в химии, выдвинув гипотезу о том, что поведение вещества можно объяснить с помощью атомной теории. Впервые опубликованные в 1807 году, многие гипотезы Дальтона о микроскопических свойствах материи все еще актуальны в современной теории атома.
Вот постулаты атомной теории Дальтона:
- Материя состоит из очень маленьких частиц, называемых атомами. Атом — это наименьшая единица элемента, которая может участвовать в химическом изменении.
- Элемент состоит только из одного типа атомов, масса которого характерна для данного элемента и одинакова для всех атомов этого элемента. Макроскопический образец элемента содержит невероятно большое количество атомов, каждый из которых имеет идентичные химические свойства.
- Атомы одного элемента отличаются по свойствам от атомов всех остальных элементов.
- Соединение состоит из атомов двух или более элементов, объединенных в небольшом целочисленном соотношении. В данном соединении количество атомов каждого из его элементов всегда присутствует в одном и том же соотношении
- Атомы не создаются и не разрушаются во время химического изменения, а вместо этого перестраиваются, чтобы получить вещества, которые отличаются от тех, что присутствовали до изменения.
Дальтон использовал три закона химических реакций в качестве основы своей теории: (1) Закон сохранения массы, (2) Закон определенных пропорций и (3) Закон множественных пропорций.Атомная теория Дальтона дает микроскопическое объяснение многих макроскопических свойств материи.
Закон сохранения массы был открыт французским химиком Антуаном Лавуазье. Он утверждает, что атомы не создаются и не разрушаются во время химического изменения; общая масса вещества, присутствующего при переходе вещества от одного типа к другому, остается постоянной.
Дальтон также знал об экспериментах французского химика Жозефа Пруста, который продемонстрировал, что все образцы чистого соединения содержат одни и те же элементы в одинаковой пропорции по массе.Это утверждение известно как закон определенных пропорций или закон постоянного состава . Предположение, что числа атомов элементов в данном соединении всегда существуют в одном и том же соотношении, согласуется с этими наблюдениями.
Дальтон также использовал данные Пруста, а также результаты своих собственных экспериментов, чтобы сформулировать еще один интересный закон. Закон о множественных пропорциях гласит, что, когда два элемента реагируют с образованием более чем одного соединения, фиксированная масса одного элемента будет реагировать с массами других элементов в соотношении малых целых чисел.
Теория Дальтона предоставила основу, которая позже была расширена, чтобы продемонстрировать, что атом состоит из субатомных частиц и что атомы одного и того же элемента могут различаться по массе, известной как изотопы.
Этот текст адаптирован из Openstax, Chemistry 2e, раздел 2.1: Ранние идеи в теории атома.
% PDF-1.6
%
1014 0 объект>
эндобдж
xref
1014 90
0000000016 00000 н.
0000003343 00000 п.
0000003482 00000 н.
0000003839 00000 н.
0000003892 00000 н.
0000004021 00000 н.
0000004065 00000 н.
0000004201 00000 н.
0000004336 00000 н.
0000004439 00000 н.
0000004884 00000 н.
0000005255 00000 н.
0000246807 00000 н.
0000487033 00000 н.
0000494762 00000 н.
0000495038 00000 н.
0000495112 00000 н.
0000495194 00000 н.
0000495275 00000 п.
0000495323 00000 н.
0000495432 00000 н.
0000495480 00000 н.
0000495589 00000 н.
0000495637 00000 н.
0000495754 00000 н.
0000495802 00000 н.
0000495936 00000 н.
0000496075 00000 н.
0000496123 00000 п.
0000496213 00000 н.
0000496332 00000 н.
0000496380 00000 н.
0000496476 00000 н.
0000496524 00000 н.
0000496679 00000 п.
0000496841 00000 н.
0000496889 00000 н.
0000497027 00000 н.
0000497189 00000 н.
0000497368 00000 н.
0000497415 00000 н.
0000497535 00000 н.
0000497637 00000 н.
0000497684 00000 н.
0000497785 00000 н.
0000497832 00000 н.
0000497886 00000 н.
0000498022 00000 н.
0000498076 00000 н.
0000498187 00000 н.
0000498234 00000 н.
0000498398 00000 н.
0000498452 00000 н.
0000498590 00000 н.
0000498638 00000 п.
0000498751 00000 н.
0000498799 00000 н.
0000498921 00000 н.
0000498974 00000 н.
0000499027 00000 н.
0000499081 00000 н.
0000499256 00000 н.
0000499304 00000 н.
0000499424 00000 н.
0000499478 00000 н.
0000499627 00000 н.
0000499675 00000 н.
0000499865 00000 н.
0000499913 00000 н.
0000500017 00000 н.
0000500071 00000 н.
0000500186 00000 н.
0000500234 00000 п.
0000500349 00000 н.
0000500397 00000 н.
0000500504 00000 н.
0000500558 00000 н.
0000500686 00000 н.
0000500740 00000 н.
0000500851 00000 н.
0000500899 00000 н.
0000501050 00000 н.
0000501098 00000 н.
0000501152 00000 н.
0000501200 00000 н.
0000501346 00000 н.
0000501394 00000 н.
0000501442 00000 н.
0000003141 00000 п.
0000002159 00000 н.
трейлер
] >>
startxref
0
%% EOF
1103 0 obj> поток
«JL / {֬ ‘k #; YSDj`SBpVxs: ܗ Gs4mBe \ TS9?] И др.щ0c_ύzп, ɘ, 9? qXFӽ`1C% av-3rWR [ݸ) 8 ZnV] & Lwz
IX; Сохранение материи и энергии
IX
Сохранение материи и энергии
Представление о том, что во всех разнообразных изменениях, которые мы воспринимаем как происходящие в материальном мире, должны быть постоянные элементы, которые остаются неизменными в течение всех этих изменений, имеет на протяжении всей истории науки была одной из руководящих идей, которые в конечном итоге привели к таким формулировкам, как те, которые содержатся в выражениях «Сохранение материи», «Сохранение веса», «Сохранение массы» и «Сохранение энергии».Принцип постоянства, выраженный в такой формуле, как «ничего не создается и ничего не разрушается», обычно рассматривался как априорный принцип, тесно связанный с принципом причинности. Сама общность этого априорного принципа помешала ему функционировать в качестве эффективного руководства для определения точных элементов перцептивного мира, которым присуща характеристика настойчивости во всех преобразованиях. Таким образом, действительные успехи научных исследований в этом порядке идей заключались в установлении путем эксперимента и соблюдения эмпирических законов закона сохранения массы и закона сохранения энергии.Установлено, что такие эмпирические законы выражают определенные факты, относящиеся к значительному, но ограниченному кругу наблюдаемых явлений, причем сохранение, которое они выражают, носит такой характер, что выражается количественно в числовой форме. Затем законы принимаются в качестве гипотетических принципов в концептуальных теориях, которые относятся к более широкому кругу явлений, чем те, к которым в первую очередь применялась эмпирическая проверка.
Ценность законов в их общей форме должна зависеть от их успеха в выполнении своих функций описания и предсказания в отношении новых классов явлений, к которым они ориентировочно применяются.Принцип a priori в его общей форме, который я назвал метафизическим принципом, выражающим предполагаемую необходимость мышления, не обязательно должен приниматься как часть основ естествознания, независимо от его фактического влияния на умы ученых. следователи в прошлом. Основная трудность в отношении принципа сохранения материи, принципа, согласно которому материя не создается и не уничтожается, заключается в формировании четкого представления о том, что именно сохраняется.Если мы рассматриваем материю как конструкцию, включающую в себя комплекс физических свойств, расширение, цвет, твердость, проводимость тепла и электричества и т. Д., У нас есть достаточные и очевидные доказательства того, что эти свойства не остаются неизменными, но подвержены самым большим изменениям в том, что мы считаем одним и тем же та же материальная система. Что тогда следует понимать под утверждением, что материю нельзя ни создать, ни уничтожить; то есть по принципу сохранения материи? Если мы утверждаем, что неизменным остается субстратная субстанция, не отождествляемая ни с одним или всеми этими физическими свойствами, но рассматриваемая как их носитель, мы не только сводим принцип к принципу, зависящему от метафизической теории, но и удаляем из него все возможности. проверки.Тогда это становится чистым философским утверждением, которое не имеет прямого отношения к миру восприятия и, таким образом, находится вне области естествознания. Настоящий научный закон сохранения должен содержать указание на некоторое измеримое качество или свойство материи, которое, как можно убедиться, остается неизменным по величине во время реальных химических и двигательных преобразований, происходящих в физическом мире. Даже то, что считается первичным качеством материи, как протяженность, не сохраняется как измеримая величина, неизменная при всех преобразованиях.
Есть, однако, еще одно свойство, которое мы стали связывать со всей материей с весом; это оценивается по балансу, систематическое использование которого Лавуазье привело к тому, что было описано как революция в химической науке. Если, однако, мы понимаем сохранение материи как сохранение веса, мы сразу же сталкиваемся с трудностью, заключающейся в том, что вес того, что мы считаем одним и тем же предметом, при оценке с помощью пружинных весов, изменяется в зависимости от широты места, в котором он находится. это измеряется.Более того, в соответствии с теорией гравитации, вес сильно изменился бы, если бы вещество было перенесено на другую планету. Однако в химических превращениях, происходящих в какой-либо одной местности, проверка принципа сохранения материи состоит в проверке принципа сохранения веса. Для разных местностей различия в весе одного и того же объекта устраняются в соответствии с ньютоновской и галилеевой динамикой путем деления веса на ускорение свободного падения; это деление дает меру массы тела.Таким образом, теперь под сохранением материи понимается сохранение массы.
С понятием массы я уже более подробно разбирался в связи с Dynamics. Фактическая масса тела может рассматриваться как качество, которое может быть измерено как производное от двух измерений веса и ускорения. То, что масса тела — это количество вещества в нем, является тавтологическим утверждением, которое может использоваться только для обозначения того, что значение, приписываемое термину количество материи, состоит в том, что это масса, рассматриваемая как измеримое качество тела.Принцип сохранения материи, рассматриваемой как масса, имеет, однако, гораздо более широкий смысл, чем то, что она неизменна для одного и того же тела, в каком бы положении оно ни находилось, ни как бы оно ни двигалось. Он включает утверждение, что масса как измеримая величина не изменяется по количеству на протяжении всех химических и термических изменений, которые могут иметь место в изолированной материальной системе.
Таким образом, принцип подразумевает, что материя, как бы она ни была подразделена, фактически или концептуально может рассматриваться как имеющая качество, массу или количество вещества, которое поддается измерению и остается неизменным в общем количестве во время всех движений и всех химических термических или других превращений.Единственное средство, которое у нас есть в абстрактной концептуальной схеме для представления этого предполагаемого качества, — это использование чисел по отношению к концептуальным телам в геометрическом пространстве. В своей абстрактной форме принцип утверждает неизменное свойство суммы таких чисел для концептуальных элементов ограниченной системы. Лишь в ограниченной степени этот общий закон был подтвержден экспериментально; поскольку трудности измерения и обеспечения полной изоляции веществ, которые подвергаются химическому превращению, очень велики и подвержены ошибкам, которые трудно полностью учесть.Более того, сохранение массы при всех движениях может быть только косвенной проверкой в связи с проверкой адекватности конкретной динамической схемы.
Соответственно, этот принцип следует рассматривать как гипотезу, которая была приблизительно проверена в большом количестве случаев и, как полагают химик и физик, сохраняет силу как описывающая отношения в большом диапазоне реальных явлений, но в зависимости от возможных опровержение в случаях, когда используются более совершенные методы измерения в связи с электромагнитными или другими явлениями.
В новой электронной теории материи, о которой я расскажу позже, масса занимает совершенно иное положение, чем то, которое ей приписывают в механической теории, которая здесь обсуждалась. В соответствии с электронной теорией механические массы тел больше не постоянны, но имеют ощутимое изменение, когда тела приходят в движение со скоростями, сравнимыми со скоростью света.
Набросок истории доктрины сохранения материи достаточно, чтобы показать, что установление принципа сохранения массы в современной форме было результатом постепенной эволюции.Древние атомисты, не обладая принципом инерции, не делали различия между массой и весом. В этом они согласуются с широко распространенной точкой зрения, существующей даже сегодня. Например, Лукреций, следуя Демокриту в этом порядке идей, по-видимому, рассматривал вес как неизменную характеристику всей материи; в его стихотворении атомы движутся из-за своего веса; и это включает отождествление их массы с их весом. С другой стороны, школа Аристотеля радикально противоположна почти во всех отношениях взглядам атомистов, не считая, что вся материя имеет вес.У аристотелистов понятия материи и веса совершенно отличны друг от друга; вес рассматривается как случайное качество материи, например цвет или температура. По их мнению, вес является результатом двух противоположных качеств — тяжести и легкости. У огня нет тяжести, у земли нет легкости. У воды и воздуха один преобладает в воде, а другой — в воздухе. Платон заметил, что четыре элемента постоянно переходят друг в друга; таким образом, воздух и огонь связаны с преобразованием материи, например, когда вода кипит или когда горит дерево.
В средние века аристотелевские взгляды на материю были преобладающими, хотя можно найти следы влияния древних атомистов. Некоторые алхимики использовали рассуждения, основанные на учете веса; но они не придавали веса первостепенной важности, которой он стал обладать позже, и не верили в его неизменность во время преобразований. Действительно, некоторые из них прямо упоминают изменение веса как происходящее при трансмутации материи. Так, например, пишет Гебер (? Восьмой век А.Д.): «Своим искусством мы легко делаем серебро из свинца; при трансформации последний не сохраняет свой вес, а превращается в новый вес ». Этот взгляд алхимиков не может быть объяснен как включающий просто ссылку на изменение удельного веса или на изменение веса, вызванное поглощением вещества из воздуха или огня; действительно, удельный вес и абсолютный вес постоянно путали друг с другом даже в семнадцатом веке. Пока вес тела считался просто случайным качеством, как и его цвет, было вполне естественно предположить, что его можно изменить без добавления или вычитания материи.Даже Бэкон придерживался взглядов, не сильно отличавшихся от взглядов алхимиков. В некоторых заявлениях он утверждал, что существуют абсолютно легкие тела и что изменение веса может сопровождать изменение состояния; но в других утверждениях, вероятно, следуя идеям атомистов, он утверждал постоянство веса. Всегда следует помнить, что у алхимиков и вообще у тех, кто находился под влиянием аристотелевской концепции субстанциальных форм, вопрос, оставался ли вес количественно постоянным во время трансформации, казался вопросом второстепенного значения; малейшее изменение качества представляло в их глазах гораздо больший интерес.Знание количественных отношений не имеет большого значения для приверженцев философской доктрины субстанциальных форм, поэтому вряд ли возможно рассматривать понятие постоянства массы, рассматриваемое в количественном отношении, как часть запаса идей тех, кто находился в подчинении у власти. влияние аристотелевских концепций. Ибо понятие материи как основной субстанции, отличающейся от случайного качества веса, не допускало количественного измерения, хотя субстанция рассматривалась как в некотором смысле сохраняющаяся при всех изменениях.По мере постепенного освобождения от аристотелевских концепций концепция массы прояснилась. Это было сформулировано с терпимой ясностью Кеплером, а также Декартом, хотя у последнего, как и у аристотелевцев, вес оставался случайным свойством, которым не обладал весь вопрос. То, что воздух имеет вес, было общепризнанным во времена Декарта, но огонь все еще считался лишенным веса. Поскольку материя Декарта была полнотой, количество материи определялось ее объемом; таким образом, он утверждает, что «когда кувшин полон золота или свинца, он не содержит больше вещества, чем когда мы думаем, что он пустой.Но он считал земную материю единственным видом, который следует учитывать в механическом воздействии, и поэтому в действительности он проводил различие между массой и объемом — массой, присущей только земной материи. Однако он не осознавал, что масса и вес находятся в фиксированном соотношении; фактически, название одной из глав его Принципов звучит так: « Что их вес не всегда одинаково пропорционален их материи» , и здесь материю следует понимать как земную материю.В течение долгого периода после времен Декарта представление о том, что вес является случайным качеством материи, препятствовало всеобщему признанию сохранения веса, хотя мнения по этому поводу отнюдь не были единодушными даже во времена Декарта. Жан Рей в своих эссе, опубликованных до фактического появления Принципов Декарта, пытался дать a priori демонстрацию того, что вес сохраняется при каждой трансформации. Более того, он дал экспериментальное доказательство того, что воздух тяжелый и что при образовании извести увеличение веса происходит из-за материала, взятого из воздуха.Упорное неверие в неизменность веса проявляется в высказываниях многих писателей даже до конца восемнадцатого века. Таким образом, Гоббс заявляет, что «все случайности, кроме величия или расширения, могут быть порождены или уничтожены», тем самым не оставляя места для сохранения веса или массы. Лейбниц, у которого было четкое представление о механической массе, утверждает, что «вода содержит в равном объеме столько же вещества, что и ртуть, только к веществу, принадлежащему воде, добавляется постороннее нетяжелое вещество, которое находится между ее порами», поскольку это странная фантастика, чтобы все стало тяжелым.
Ньютон, не допускавший существования невесомой материи, экспериментально показал, что вес пропорционален массе тела; и Гюйгенс определенно утверждал, что количество материи измеряется ее весом. Раздельные направления работы физиков и химиков затрудняют выяснение взглядов физиков семнадцатого и восемнадцатого веков на природу химических явлений. Почти единственным исключением из этого разделения была работа Роберта Бойля, физика и химика, который, кажется, признает принцип сохранения веса, но не формулирует его явно.В семнадцатом веке, хотя в целом признавалось, что воздух имеет вес, не всегда считалось, что это справедливо для огня. Однако в восемнадцатом веке мы обнаруживаем, что Беркли рассматривал увеличение веса некоторых металлов при нагревании, например, в случае сурьмы, как результат огня в солнечных лучах; он заметил, что мы не знаем веса солнечного луча. Дидро заявил, что «огонь в наших печах значительно увеличивает вес некоторых веществ, таких как кальцинированный свинец.
Особой формой, которую понятие невесомой субстанции приняло в умах химиков того периода, была теория флогистона, вещества, изобретенного для объяснения тепловых явлений. Флогистон был наделен отрицательным весом, и, поскольку он вмешивался во все химические реакции, нетрудно было понять, что его примесь с веществом препятствует сохранению веса при химическом превращении. Как мало внимания химики уделяли всем вопросам, касающимся количеств, иллюстрируется тем фактом, что один из главных французских химиков того времени Маккер, узнав, что Лавуазье готовит атаку на теорию флогистона, заявил, что его беспокоит момент, но успокоился, когда узнал, что возражения Лавуазье основаны исключительно на количественных соображениях.Определенное установление принципа сохранения материи путем систематического использования весов в основном принадлежит Лавуазье и может быть датировано его мемуарами о году «Превращение воды в землю» , опубликованными Французской академией в 1773 году. 1774 г. работой, в которой, используя баланс, он выбрал конкурирующие теории Блэка и Мейера относительно того, что происходит при химических превращениях. Во-первых, применение принципа без явного указания «любая материя не может дать ничего в эксперименте, кроме полной ее массы», а затем «определение веса материалов и их продуктов до и после экспериментов является основой всего полезного и точного в химии.«В каждой операции есть равное количество вещества до и после операции».
В 1774 году Лавуазье описал начало своих фундаментальных открытий, касающихся горения. Он подтвердил, что различные металлы при нагревании в закрытом сосуде увеличиваются в весе и что количество воздуха в сосуде уменьшается; он показал, что потеря веса воздуха почти эквивалентна увеличению веса металла. Небольшое увеличение веса всего сосуда он правильно объясняет внешним отложением из-за пожара.Таким образом, он опровергает идею вмешательства стихии огня и показывает, что увеличение веса может происходить только с воздуха. Даже после того, как стал известен состав воды и явление, которое мы называем окислением, новые концепции Лавуазье только медленно восторжествовали. Похоже, они не были полностью приняты Пристли или Кавендишем. Шееле считал тепло соединением флогистона и кислорода; Он считал их обоих тяжелыми, но полагал, что вместе они дают начало неуловимой субстанции.Тепло, соединенное с очень небольшим количеством флогистона, превращается в свет, но соединенное с большим количеством, становится легковоспламеняющимся воздухом, то есть водородом. Даже Лавуазье показывает следы аналогичных представлений. Он считал кислород результатом сгорания весомого вещества и невесомого жидкого теплоносителя. Он рассматривал тепло как материальный элемент, содержащийся в газе, и его представление о газах было связано с помощью промежуточных гипотез с концепцией невесомых жидкостей.
После описанных мною превратностей принцип сохранения материи, измеряемой динамической массой, стал принят как эмпирический закон, применимый в широком диапазоне явлений, хотя некоторые химики утверждали, что возможно обнаруживать отклонения от закона, которые нельзя отнести к результату инструментальных погрешностей или мешающим факторам, которые трудно полностью учесть.Более того, поток света, который недавно был брошен на свойства радиоактивных веществ, подсказал взгляды, согласно которым динамическая масса больше не занимает своего прежнего положения как фундаментального и несводимого. Действительно, было высказано предположение, что в соответствии с электрической теорией материи не было бы ничего удивительного в изменении веса из-за химических реакций.
Принцип сохранения энергии намного более современен, чем принцип сохранения материи.В своей общей форме принцип сохранения энергии восходит к середине девятнадцатого века, но в своей ограниченной форме как принцип механики в более узком смысле слова он находится в идеях Декарта Лейбница и особенно Гюйгенса. что мы находим его происхождение. Представление о материи сформировано здравым смыслом, но понятие энергии было создано Наукой для ее особых целей. Поэтому кажется вполне естественным, что доктрина сохранения энергии должна была возникнуть на гораздо более позднем этапе истории науки, чем доктрина сохранения материи, по крайней мере в грубой форме.Представление о работе, измеряемой произведением силы на смещение в направлении силы тела, на которое она действует, принадлежит Галилею, который показал, что в простых механических машинах работа сопротивления при смещении равна что власти. Он пришел к выводу, что с помощью таких машин невозможно создать работу, но он не показал, что работа не может быть уничтожена. Для случая падающего тела он дал формулу, которая выражает принцип энергии.
Следующий шаг в направлении установления общего принципа, относящегося к движению тел, был сделан Декартом, который попытался установить принцип сохранения движения при всех изменениях в физическом мире.В этой попытке он совершил ошибку, взяв сумму произведений масс на их скорости вместо квадратов скоростей как представление сохраняемой величины. На эту ошибку указал Лейбниц в трактате под названием : «Краткая демонстрация замечательной ошибки Декарта и других в отношении Закона природы, согласно которой, по их мнению, Творец всегда сохраняет одну и ту же величину движения; этим, однако, полностью извращается наука о механике. Лейбниц различал простое давление (vis mortua) и силу движущегося тела (vis viva) , но он перепутал вопрос о правильной мере силы с вопросом о постоянстве количества движения и кинетической энергии тела. система. Ни декартова, ни лейбницевская мера эффективности движущегося тела не отождествляется, как заметил Лейбниц, с ньютоновской мерой силы. Лейбниц, как и Декарт, рассматривал сформулированный им принцип как охватывающий все явления Вселенной.Он оправдал принцип сохранения vis viva апелляцией к принципу причинности в том виде, в котором следствие равно причине.
Попытка продемонстрировать этот закон (он пишет) затруднила бы его понимание. В самом деле, каждый считает бесспорной аксиомой, что каждая действенная причина не может исчезнуть полностью или частично, не вызвав эффекта, равного потере. Представление о vis viva в том виде, в каком оно существует в движущемся теле, является чем-то абсолютно независимым и позитивным; что он остается в теле, даже если остальная часть Вселенной будет уничтожена.Тогда ясно, что если vis viva тела уменьшается или увеличивается при столкновении с другим телом, vis viva этого другого тела должна изменяться, увеличиваться или уменьшаться на ту же величину.
Его взгляд на масштабы принципа ясно виден в следующем отрывке:
Я утверждал, что в мире сохраняются активные силы. Высказывались возражения, что два мягких или неупругих тела при столкновении теряют часть своей силы. Отвечаю, что это не так. Верно, что «целое» теряет его в отношении своего полного движения, но части получают его, внутренне взволнованные силой столкновения.Таким образом, потеря наступает только внешне. Силы не уничтожены, а рассеяны по мельчайшим частям. Это не значит, что они были потеряны, это похоже на превращение больших монет в мелкие.
Истинность принципа ранее была продемонстрирована Гюйгенсом, который, однако, сформулировал его, не указав на большую общность его объема. В своем утверждении он проводил различие между сохранением vis viva и сохранением количества движения:
Количество движения, которым обладают два тела, может быть увеличено или уменьшено при их столкновении; но всегда остается одна и та же величина на той же стороне, если мы вычитаем количество противоположного движения.Сумма произведений каждого твердого тела, умноженная на квадрат его скорости, всегда одинакова до и после столкновения.
Следует заметить, что и для Декарта, и для Лейбница мир состоит только из движущейся материи и не существует действия на расстоянии. Следовательно, они не допускали существования того, что мы называем потенциальной энергией, так что для них принцип энергии заключался в постоянстве полной кинетической энергии. Следует также отметить, что Лейбниц в отрывке, который я процитировал, говоря о диссипации молярной энергии между мельчайшими частицами тела, по-видимому, не считал это преобразование эквивалентным выделению тепла.
В восемнадцатом веке представление о тепле как о веществе постепенно развивалось на основе картезианской идеи теплового движения. Предполагалось, что количество этого вещества сохранится при переходе от одного тела к другому. Когда оно перестало проявляться с помощью термометра, тепло считалось Блэком все еще присутствующим, но как скрытое тепло, способное проявляться в определенных условиях, и поэтому его концепция скрытого тепла была аналогична нашей концепции потенциальной энергии.Даже изобретение паровой машины не произвело немедленного изменения в этой концепции субстанции тепла. Ватт и его последователи не смогли прийти к выводу, что тепловые изменения указывают на какую-либо связь между теплотой и механическим движением. Однако к концу века Лавуазье и Лаплас предварительно связали производство тепла трением с концепцией теплового движения и определили количество тепла как сумму произведений масс молекул на квадраты их скоростей.
В начале девятнадцатого века Рамфордом и Хамфри Дэви были получены прямые экспериментальные доказательства преобразования движения в тепло. Концепция скрытого vis viva , названная Понселе работой , была сформулирована (1803) Лазаром Карно; эта концепция теперь известна как потенциальная энергия. В 1839 году инженер Сеген в работе о строительстве железных дорог заметил, что:
Однако, поскольку теория, принятая в настоящее время, может привести к этому результату (вечный двигатель), мне кажется более естественным предположить, что определенное количество калорий исчезает в акт создания механической силы или мощности и наоборот; и что два явления связаны друг с другом условиями, которые приписывают им неизменные отношения.
Тем не менее, похоже, что до Сегена принцип эквивалентности тепла и механической энергии в общих чертах был задуман Сади Карно, который вычислением получил оценку механического эквивалента тепла. В своей более ранней работе Карно использовал материальную теорию тепла, и его более поздняя формулировка современной теории сохранилась только в рукописных заметках, которые оставались неопубликованными до 1871 года. Но именно экспериментальные исследования Джоуля, опубликованные в 1843 году, сделали вид для научного мира. теория эквивалентности тепловой и механической энергии.Полученные ранее Джоулем оценки количества шагов работы, эквивалентных теплу, необходимому для повышения температуры фунта воды на один градус по Фаренгейту, сильно расходились и варьировались от 742 до 1040; но в результате более поздней серии экспериментов он получил 770 шагов в качестве эквивалента; и это не сильно отличается от принятого сейчас значения. Однако Джоуль не сомневался, что значение эквивалента существует как определенное число, несмотря на значительные различия в его экспериментальных определениях.Его уверенность в этом была проистекала из его убежденности в априорной необходимости.
Мы могли бы предположить, что a priori (он пишет) 1 , что такое абсолютное разрушение жизненной силы не может иметь места, потому что явно абсурдно предполагать, что силы, которыми Бог наделил материю, могут быть уничтожены не более, чем это они могут быть созданы мужской волей; но не только этот аргумент остается решающим, как это должно быть для любого непредвзятого мнения.Работа Дж. Р. Майера о сохранении энергии, появившаяся за год до первой публикации экспериментов Джоуля, была самой ранней публикацией по этой теме в ее современной форме. В 1843 г. на эту же тему вышла работа датского ученого А. Колдинга. Работы Майера в основном основывались на его философских идеях и не включали никаких экспериментальных проверок принципа, подобных тем, которые были у Джоуля. Он апеллирует к старой идее о том, что силы — это причины и что причина равна следствию.Его определение эквивалента тепла расчетом предполагает существование постоянного отношения эквивалентности, как это было в случае аналогичного расчета, сделанного Сади Карно. Колдинг предполагает, что энергия существует как нерушимая нематериальная субстанция. Так, он пишет: 2 :
Поскольку силы являются духовными и нематериальными существами, поскольку они являются сущностями, которые известны нам только своей властью над природой, эти сущности, несомненно, должны быть намного выше всех существующих материальных вещей; и поскольку очевидно, что только силами проявляется мудрость, которую мы воспринимаем, и что мы восхищаемся природой, эти силы должны быть связаны с духовной нематериальной и интеллектуальной силой, которая направляет ход природы; но если это так, то совершенно невозможно представить себе, чтобы эти силы были чем-то смертным или бренным.Следовательно, несомненно, они должны рассматриваться как абсолютно нетленные.
До сих пор область действия принципа сохранения энергии ограничивалась механической областью и эквивалентностью механической энергии и тепла, но в хорошо известном трактате, опубликованном Гельмгольцем в 1847 году, последовательно развивалось учение о том, что Сохранение энергии применимо ко всем физическим факультетам. Эта работа дает достаточно доказательств того, что такие авторы, как Джоуль Майер и Колдинг, первоначально считали этот принцип тем, который следует из принципа причинности.
В очень интересном отрывке во введении к своему трактату Гельмгольц пишет:
Целью этих наук (физических наук) является поиск законов, по которым различные процессы в природе сводятся к общим правилам и из них правила могут быть определены заново. Эти правила, например, законы преломления или отражения света и законы Мариотта и Гей-Люссака для объема газов, очевидно, являются не чем иным, как общими понятиями, которыми охватываются все рассматриваемые явления.Их поиск — дело экспериментальной части нашей науки. Их теоретическая часть, с другой стороны, пытается найти неизвестные причины процессов по видимым эффектам; он пытается подчинить их закону причинности. Мы вынуждены и уполномочены делать это по тому принципу, что каждое изменение в природе должно иметь достаточную причину. Непосредственные причины, которым мы приписываем явления, могут быть неизменными или переменными; в последнем случае тот же принцип заставляет нас искать другие причины этой изменчивости и так далее, пока мы не придем к конечным причинам, которые действуют согласно неизменному закону, который, следовательно, каждый раз при одних и тех же внешних условиях производит одно и то же действие.Таким образом, конечной целью теоретических наук является поиск конечных неизменных причин процессов в природе. Здесь не может быть решено, могут ли все процессы быть сведены к таким (причинам), то есть является ли природа полностью понятной или есть ли в ней изменения, которые не подчиняются закону необходимой причинности и поэтому попадают в область спонтанности или свободы. Совершенно очевидно, что наука, цель которой — постичь природу, должна исходить из гипотезы о том, что она постижима, и должна исследовать и делать выводы в соответствии с этой гипотезой до тех пор, пока неопровержимые факты заставят ее признать пределы гипотезы.
Можно заметить, что мнения Гельмгольца относительно поиска эффективной причинности в природе, являющейся функцией теоретических частей естествознания, расходятся с точкой зрения, которую я придерживался в этих лекциях. Однако очень интересно отметить, что позднее Гельмгольц заявил, что он изменил мнения, выраженные в процитированном мною отрывке. Фактически, в примечании, приложенном к более позднему изданию его работы, он говорит:
Философские дискуссии во введении находились под более сильным влиянием эпистемологических взглядов Канта, чем я в настоящее время считаю правильными.Позже я пояснил себе, что принцип причинности на самом деле есть не что иное, как гипотеза о том, что все природные явления подчиняются закону.
Из этого утверждения следует, что Гельмгольц освободился от идеи, что эффективная причинность может быть найдена в природе с помощью науки, и что он, наконец, идентифицировал термин причинность с признанием неизменности последовательностей явлений.
Оставляя в стороне предполагаемую демонстрацию принципа энергии с помощью принципа причинности a priori , можно вывести принцип из классической системы механики, если предположить, что все явления движения регулируются центральные силы; в этом случае они образуют так называемую консервативную систему.В соответствии с этим предположением силы, действующие между каждой парой корпускул системы вдоль соединяющей их линии, равны по величине и противоположны по направлению; и величина такой силы зависит исключительно от расстояния между частицами. Таким образом, вся энергия такой системы состоит из двух частей: кинетической энергии или энергии движения системы и потенциальной энергии или энергии положения, которая представляет способность сил системы совершать механическую работу.Тот принцип в форме, что сумма кинетической энергии и потенциальной энергии системы постоянна для такой системы во время ее движения, следует как математическое следствие динамической схемы, было продемонстрировано Гельмгольцем в его трактате. Но что касается применения этого принципа в общей физике, следует отметить, что крайне сомнительно, можно ли в молекулярной или субмолекулярной области ограничить силы силами центрального типа. Например, не представляется возможным рассматривать явления остаточной деформации и кристаллизации как связанные только с такими силами.
Мы уже видели, что желание создавать графические образы механических явлений привело к нежеланию принимать понятие сил, действующих на расстоянии, как часть механической схемы. Та же самая тенденция привела к попыткам объяснить, что является явно потенциальной или скрытой энергией, как действительно сводимой к кинетической энергии небольших частей тел или среды, и, таким образом, в конечном итоге устранить различие между кинетической и потенциальной энергией; последнее рассматривается как менее конкретное или наглядное, чем первое.Но в соответствии с точкой зрения на характер концептуальных схем, принятой в этих лекциях, концепция потенциальной энергии как измеримой величины действительно находится на том же основании, что и концепция кинетической энергии; и, следовательно, даже если сведение двух концепций к одному все еще кажется желательным упрощением, такое сокращение уже не имеет такой же актуальности, как для тех, кто чувствует себя обязанным более реалистичную интерпретацию концепций динамической науки.
Принцип энергии часто рассматривался как следствие принципа невозможности вечного двигателя.Было предпринято очень много попыток, многие из которых были очень изобретательными, чтобы сконструировать машины, которые должны реализовывать вечный двигатель. Убеждение в невозможности вечного двигателя, однако, постепенно стало очень сильным среди ученых. Это было подтверждено Леонардо да Винчи Галилео Стевинусом и Лейбницем, последний из которых использовал его для установления принципа vis viva. В 1775 году Французская академия наук постановила, что представленные в Академию решения проблемы дублирования куба, трисекции угла, квадратуры окружности и конструкции машин, использующих вечное движение, больше не должны рассматриваться.В случае последней проблемы Академия основывала свое решение на априори основаниях, заявленных следующим образом:
Построение вечного двигателя абсолютно невозможно: даже если трение и сопротивление среды в конечном итоге не разрушили сопротивление среды. движущая сила эта сила может производить только эффект, равный ее причине; если тогда желательно, чтобы действие конечной силы продолжалось бесконечно, необходимо, чтобы сила была бесконечно малой за конечное время.Если абстрагировать трение и сопротивление телом, на которое когда-то было нанесено движение, оно всегда будет сохраняться; но это было бы, если бы не воздействовать на другие тела, и единственное вечное движение, возможное на основе этой гипотезы (которое, к тому же, не может быть реализовано в природе), было бы абсолютно бесполезным для объекта, к которому стремятся конструкторы вечного движения.
Гельмгольц показал, что принцип энергии выводится из принципа невозможности вечного движения. Однако эту невозможность он расценил как факт опыта, установленного многочисленными тщетными попытками построить вечный двигатель . Однако Пуанкаре указал, что только в случае обратимых явлений сохранение энергии следует из невозможности вечного движения. Общий принцип сохранения энергии изолированной системы во всех ее различных формах посредством всех физических и химических изменений, которым может подвергаться система, может рассматриваться только как гипотетический принцип, который можно использовать в качестве ориентировочного руководства в наших попытках описать концептуально различные процессы в трансформациях.Тот факт, что у нас нет уверенности в том, что нам известны все возможные формы энергии, которые могут возникать в физических явлениях, делает невозможным представить себе, что этот принцип допускает что-либо вроде полной эмпирической проверки.
История науки свидетельствует об открытии различных форм энергии, ранее не известных. В частности, наши знания о явлениях электричества, за исключением простых тривиальных проявлений, восходят только к исследованиям Гилберта три столетия назад.Недавние открытия за последние несколько десятилетий; рентгеновские лучи и радиоактивные вещества волн Герца познакомили нас с формами энергии, о существовании которых раньше и не подозревали. Уверены ли мы даже сейчас, что знакомы со всеми формами энергии, которые могут быть обнаружены в солнечном излучении и которые могут выходить за известные пределы светящихся тепловых и актинических лучей? Открытие рентгеновских лучей — одна из иллюстраций того факта, что форма энергии может долгое время оставаться неоткрытой, когда она, так сказать, находится у нас на глазах; Крукс’трубки использовались за четверть века до открытия Рентгеном лучей, которые они вызывают.Мы видели, что в случае системы, состоящей из частиц, между которыми действуют центральные силы в зависимости только от их относительных расстояний, принцип энергии принимает простую форму, согласно которой сумма кинетической энергии и потенциальной энергии постоянна; первая зависит только от скоростей частиц, а вторая — от их положения, но не от их скоростей; так что полную энергию можно только одним способом разделить на сумму двух компонентов. Но если, как в случае закона Вебера о взаимодействии двух электрических молекул, взаимное действие зависит не только от их расстояния, но также от их скоростей и от их ускорений, вторая часть энергии будет зависеть от скоростей и может содержать члены в зависимости от квадратов скоростей.В таком случае у нас нет средств различать члены, принадлежащие соответственно двум частям полной энергии. Пуанкаре указал 1 , что тогда у нас нет средств для определения энергии системы, потому что, если полная энергия системы постоянна, то это также и любая функция этой полной энергии; и такая функция могла бы быть заменена самой энергией и легла в основу измененного определения энергии системы. В таком случае не существует способа зафиксировать точное определение энергии как таковое, чтобы ее можно было разделить на две части, каждая из которых имеет определенную форму.Более того, если принцип энергии должен быть полезен, необходимо учитывать различия между механической энергией молярных тел и другими формами энергии, такими как тепловая, химическая и электрическая энергия. Это может быть сделано только в том случае, если можно разделить всю энергию системы на части, абсолютно разные по форме; часть, включающая только квадраты скоростей тел, другая часть, не зависящая от этих скоростей и теплового и электрического состояний системы, и третья часть, не зависящая от скоростей и положений тел и зависящая только от их внутреннего состояния.Но случая электрической энергии за счет взаимного электрического действия тел достаточно, чтобы показать невозможность этого разделения на такие отдельные части. Ведь электростатическая энергия зависит не только от электрических зарядов тел, но и от их положения. Если тела находятся в движении, их электродинамическая энергия зависит не только от их состояний и положений, но и от их скоростей. Поэтому у нас нет очевидных средств выбора и разделения различных частей общей энергии желаемым образом.Вывод, сделанный Пуанкаре из этих соображений, состоит в том, что когда делается попытка расширить принцип сохранения энергии так, чтобы он охватил все явления, с которыми приходится иметь дело физике, мы сталкиваемся с трудностью определения энергии системы. уникальным образом, так что различные его части могут быть идентифицированы как относящиеся к различным явлениям, которые происходят в системе. Он отмечает, что, когда эта крайняя общность направлена на то, как кажется, от принципа не остается ничего, кроме высказывания: «есть нечто постоянное», и что в этой форме принцип выходит за рамки эксперимента и сводится к своего рода тавтологии.
Эта критика уместна в отношении попытки Оствальда и других создать энергетическую науку, основанную на Принципе Энергии и Принципе Наименьшего Действия (или каком-либо другом подобном принципе), с целью избежать трудностей, связанных с гипотеза о существовании атомов. Фундаментальная концепция Энергетики состоит в том, что каждое изменение в изолированной системе регулируется двумя законами. Во-первых, сумма кинетической и потенциальной энергий постоянна при всех преобразованиях системы.Во-вторых, если система переходит от одной конфигурации в одно время к другой конфигурации в другое время, переход всегда происходит таким образом, что среднее значение разности двух видов энергии в интервале времени между двумя указанное время — минимум.
Уроки, которые следует извлечь из истории различных концепций, которые возникали в разное время в связи с постоянными усилиями, которые были предприняты для достижения ясных представлений о том, что именно сохраняется в материи и ее различных преобразованиях, в основном заключаются в следующем: о неадекватном характере априорных концепций, таких как принцип причинности, и о частичном характере эмпирической проверки принципов.Похоже, что когда будет достигнута максимальная четкость формулировки этих принципов как концептуальных законов, остается элемент сомнения, неуверенности и предположительности в отношении диапазона применимости как на практике, так и в теории этих законов в их функции. описания реальных изменений и преобразований в воспринимаемом мире.
Элементы и (первые) принципы в химии
Теперь, когда мы проследили APE через историю химии, мы можем обсудить его эпистемический статус.Это правда, согласно современной химии? Если это что-то, что можно узнать сейчас, когда это стало известно? Когда стало известно, были ли основания априори или апостериори? Современная химия однозначно подтверждает APE: элементы выживают в своих соединениях, потому что ядерный заряд, элементарное свойство, благодаря которому химия индивидуализировала элементы с 1923 года, сохраняется при химических изменениях (см. Обсуждение в Hendry 2006). Footnote 5 Поскольку факты, подтверждающие истинность APE, были открыты только в двадцатом веке, это должно считаться эмпирическим открытием.
Если APE истинно, то в принципе это может быть известно, но очень трудно сказать, что Лавуазье мог знать, что APE истинен. Трудно даже сказать, что он этому верил. Его теории, его методы (включая гравиметрию) и его способы описания химических изменений могут включать в себя презумпцию их истинности, но это не означает, что он утверждал бы это, если бы на него настаивали. Нельзя также сказать, что у него было бы какое-либо оправдание для утверждения его истинности, если бы оно подтверждалось фактами, которые стали известны только в двадцатом веке.Поэтому можно было бы сказать, что APE был доступен Лавуазье как негласное рабочее предположение о том, как должна работать теория композиции, но это не то же самое, что сказать, что он знал, что это правда. Такое предположение было бы «оправданным» только в том смысле, что его допустимо было делать при выполнении его программы исследования композиции. Это не то же самое, что оправдание в более традиционном эпистемологическом смысле (достаточное основание для веры). В поисках такого обоснования рабочего предположения в исследовательской программе до того, как эта программа запущена, телега ставится впереди лошади.Какое бы там ни было оправдание, оно появилось бы благодаря эмпирическому успеху программы.
APE — это, безусловно, естественный способ понять химический состав и изменения. Это может быть даже психологически естественным допущением — так же, как это естественно для младенцев после определенного этапа их когнитивного развития, — структурировать свой мир на основе постоянства объекта. Все это не означает, что APE может быть известен априори. Если предположить, что APE — это только психологическая тенденция, то дальнейшие размышления могут позволить ему противостоять.Я думаю, что дальнейшие размышления действительно показывают, что APE можно сопротивляться: учение Аристотеля о химической комбинации отрицает APE, но все же является совершенно последовательным.
Согласно Аристотелю, элементы потенциально присутствуют только тогда, когда они объединены в смесь. Footnote 6 Аристотель развил свою точку зрения в противоположность атомизму, согласно которой основные компоненты вещей сохраняются неизменными в более сложных телах, а различия между вещами объясняются их различным расположением.Аристотель утверждал, что если элементы объединяются для образования новой субстанции, а не просто сопоставляются, продукт должен быть однородным. Однако, если предполагается, что атомы неизменны, тогда (он утверждал) атомизм может допускать только сопоставление, и поэтому не может распознавать различие между простым сопоставлением и подлинной комбинацией (Needham 2009). Положительное контрпредложение Аристотеля состоит в том, чтобы генерировать элементы из противоположных пар свойств: горячего и холодного, влажного и сухого. Элементы соответствуют максимальным степеням совместимости пар этих свойств: воздух — это горячее и влажное, вода — это холодное и влажное, огонь — горячее и сухое, а земля — холодное и сухое.В сочетании основные свойства элементов смешиваются, так что смесь будет иметь субмаксимальную степень тепла или холода, влажности или сухости. Поскольку смесь однородна, элементы фактически не присутствуют в смеси, потому что никакая часть смеси не обладает существенными свойствами каких-либо элементов. Что сохраняется? Нидхэм интерпретирует точку зрения Аристотеля как принимающую непрерывные изменения как части материи, обладающие свойствами вещества, включая способность снова проявлять элементарные свойства (2009).Только в этом смысле — потенциальности — можно сказать, что элементы находятся «в смеси».
Если APE является конституирующим принципом, который может быть известен априори, то что он конституирующий? Понятие элемента? Разборчивость (для нас) объяснения композиции Аристотеля является (опровержимым) свидетельством того, что это представление связно. Если объяснение Аристотеля логично, то оно не нарушает никаких рациональных ограничений на применение концепции элемента. В этом случае APE можно согласованно отрицать, и он не является составляющей нашей концепции элемента.Теперь вместо этого можно было бы увидеть применимость концепции элемента в зависимости от непрерывности химических изменений: химические реакции включают изменение, но последовательное изменение требует непрерывности, что серия химических изменений имеет постоянный субъект , с которым это происходит. Это тоже было бы недостаточным оправданием для APE. Согласно Нидхему, у Аристотеля материя является продолжением: химические изменения — это вещи, которые происходят с частями материи. Следовательно, даже если непрерывность химических изменений является требованием для надлежащей применимости концепции химического элемента, ее можно удовлетворить, не предполагая, что элементы выживают в своих соединениях. Footnote 7
Этот аргумент можно было бы оспорить, указав, что концепции элементов радикально изменились на протяжении истории науки. Даже если рассказ Аристотеля понятен современному философу или ученому, возможно, он не был для Лавуазье. Мне не известно о положительном текстуальном обосновании этого утверждения в собственной работе Лавуазье. Рассмотрим по аналогии предположение Лавуазье о том, что кислотность обеспечивается присутствием кислорода. Должны ли мы сказать, что это предположение ложно или что это часть концепции кислотности Лавуазье? Если мы можем считать, что Лавуазье способен рассуждать о кислотах, то мы можем считать, что он ошибался в отношении природы кислот (я думаю, что можем).Тогда мы можем сказать, что предположение Лавуазье о кислотности оказалось ложным, как и все последующие теории, согласно которым свойство кислотности обеспечивается присутствием определенного элемента (см. Hendry 2005, 2010). Теперь Лавуазье рассуждает об элементах и их роли в химических изменениях способами, которые хорошо известны современной науке. APE ограничивал его рассуждения, но они могли оказаться ложными, поэтому более правдоподобно рассматривать это как фактическое предположение даже в системе Лавуазье.Это не нокдаун-аргумент, поскольку он основан на предшествующей позиции: исторические философы и ученые могут (иногда) рассуждать о том же самом мире, в котором мы находимся, и могут ошибаться в этом. Эта позиция может быть оспорена конкретными текстовыми доказательствами: что Лавуазье рассматривал кислород как концептуально (а не материально) составляющую кислотности, или что он рассматривал APE как концептуально составляющую
элемент. Такие доказательства (насколько мне известно) полностью отсутствуют.
Вместо априорного регулирующего принципа я бы сказал, что APE следует рассматривать как метафизический принцип, который, тем не менее, мог играть важную регулирующую и эвристическую роль в развитии теорий химического состава и структуры с восемнадцатого века. века и позже. Под «метафизическим» я имею в виду «относящийся к существованию или реальности или относящийся к ним». Метафизический принцип — это общее или абстрактное утверждение о том, каковы вещи, а не условность или необходимое предварительное условие для знания в какой-либо конкретной области.«Метафизичность» в этом смысле не означает непроверяемости или непроверяемости. Метафизические принципы может быть трудно проверить или проверить, и может быть даже невозможно проверить или проверить самостоятельно, но то же самое верно и для многих научных теорий. Метафизичность не исключает возможности быть неотъемлемой частью науки. Действительно, метафизические принципы часто четко формулируются учеными (рассмотрим, например, приверженность Ньютона абсолютному времени и пространству), но часто они не сформулированы, даже если они регулируют выводы ученого о категориях, которыми они управляют.Достоинство понимания APE как метафизического принципа как раз в том, что его можно непрерывно проследить на протяжении истории химии, от того времени, когда он не был сформулирован (в работе Лавуазье), до времени, когда он был признан явно (в работе Менделеева). ).
Начиная с 1950-х годов философы Лондонской школы экономики разработали противоположные мнения о том, как это может работать. Можно сказать, что проект определения роли метафизики в науке сам по себе был исследовательской программой в рамках широко реалистической философии науки, поддерживаемой (и сам по себе поддерживающей) широким взглядом на то, что единицы оценки в науке должны быть исследовательскими программами (т. Е. , серии теорий, а не отдельных теорий, разработанных в рамках таких программ).Поэтому в оставшейся части этого раздела я буду критически исследовать, примерно в хронологическом порядке, предложения Карла Поппера, Дж. У. Н. Уоткинса, Имре Лакатоса и Эли Захара.
Чтобы быть достойным своего имени, реалистическое описание роли метафизики в науке должно основываться на следующих общих принципах. Во-первых, метафизические теории или принципы должны рассматриваться как фактические утверждения: они (или, по крайней мере, некоторая их абстрактная часть) должны интерпретироваться реалистично, чтобы семантически соответствовать другим теоретическим утверждениям в науке, и их предполагаемые роль в науке должна зависеть от этой интерпретации.Во-вторых, роль метафизических теорий или принципов не должна сводиться к просто психологической роли в приведении конкретной проверяемой теории в сознание конкретного ученого. Утверждается, что наблюдение за падением яблока в его доме в Вулсторпе сыграло определенную роль в возникновении закона всемирного тяготения Ньютона. Сноска 8 Дремая перед огнем, Август Кекуле, как утверждается, увидел в видении змею, которая схватила свою собственную историю, приняв форму кольца, которое, как он позже сказал, подсказало ему его знаменитую шестиугольную формулу. для бензола (см. Rocke 2010, глава 7).Согласно реалистической концепции, роль метафизических теорий не должна быть просто наводящей на размышления, как яблоко и змея для Ньютона и Кекуле. Чтобы поддержать реалистический вывод, эвристическая и регулирующая роль должна зависеть от содержания метафизического принципа, истолкованного буквально. В-третьих, если такие теории или принципы семантически наравне с проверяемыми научными утверждениями, и они могут играть роль в развитии теорий, которая не просто наводит на размышления, тогда в принципе можно оценить роль конкретных метафизических теорий или принципов в конкретных научных разработках, во многом так же, как абстрактным, но все же научным принципам в физике приписывается эмпирический успех в теоретических разработках, в которых они играют важную роль.
Это предполагает взгляд на роль метафизики в науке, близкий по духу научному реализму, но требует большего. Не каждый научный реалист может захотеть дать реалистическое описание роли метафизики в науке. Можно быть реалистом в отношении науки, но думать, что метафизика оказывает на нее только вредное воздействие. Или можно допустить, что метафизические принципы могут (иногда) играть роль, но никогда так, чтобы обосновать аргумент в пользу их истинности. Я думаю, что метафизические принципы могут сыграть роль в эмпирической науке, а действительно позволяют им получить положительную поддержку.Осталось описать, как это вообще возможно.
В коротком, но хорошо известном отрывке в постскриптуме к «Логике научных открытий » Поппер попытался сформулировать роль метафизики в науке, но название раздела ясно дает понять, что эта роль ограничена и не соответствует два из наших трех критериев реалистической концепции роли метафизики в науке: «Почему даже псевдонауки могут иметь смысл». Метафизические программы для науки »(1983, стр.189–93). Его обсуждение начинается с повторения его фальсификационистского критерия демаркации, который «выделяет те теории, которые могут быть серьезно обсуждены с точки зрения опыта» (1983, с. 189). Но ученый рискует пренебречь изучением псевдонаучных и метафизических теорий, которые не соответствуют этому критерию, из которого можно извлечь «что-то действительно интересное». Он утверждал, что пренебрежение к астрологии, например, может скрыть от ученого астрономические возможности, такие как влияние Луны на приливы и отливы, и признал, что Кеплер «принадлежал к астрологической традиции», хотя он «никогда не уставал выдвигать свои гипотезы. к остроумным и очень критическим тестам »(1983, с.190). Центральным примером «чрезвычайно важной метафизической теории» Поппера (1983, стр. 191) является атомизм:
Метафизический характер «корпускулярной теории», во всяком случае до Авогадро, ясен. Не было возможности опровергнуть это. Неспособность обнаружить тельца или какие-либо доказательства их существования всегда можно объяснить, указав на то, что они слишком малы для обнаружения. Только теория, которая привела к оценке размера молекул, была более или менее заблокирована, так что опровержение стало в принципе возможным.(Поппер, 1983, с. 191)
Согласно Попперу, атомизм является метафизической теорией не только потому, что он не поддается проверке, но и потому, что он «задумал мир в терминах обширного обобщения в высочайшем масштабе» (1983, p. 191), и « объяснил. известное в терминах неизвестного : оно сконструировало неизвестный и невидимый мир за нашим известным миром »(1983, с. 192). Для Поппера ее ценность для науки заключалась в том, что ее можно было дополнить дальнейшими предположениями, чтобы ее можно было проверить (1983, с.191). Следовательно, было бы «грубым заблуждением называть это бессмысленным; и очень рискованно отвергать его сразу, как это сделал Мах »(1983, с. 191). Конечно, став поддающимся проверке, атомизм стал научной теорией, но даже непроверяемая теория может« указать направление наших поисков, и своего рода объяснение, которое могло бы нас удовлетворить ». (1983, стр. 193). Таким образом, неопровержимое экзистенциальное утверждение «существует философский камень» (1983, стр. 193) «оказалось многообещающим и даже плодотворным в истории науки» (предположительно, благодаря его влиянию на алхимию), несмотря на то, что что это «никогда не проверялось и теперь никто не верит» (1983, с.193).
Из обсуждения Поппера стоит отметить три вещи. Во-первых, он никогда не отличает метафизику от лженауки. Оба они неопровержимы, и термины, в которых он характеризует метафизику (большая общность, объясняющая известное в терминах неизвестного или невидимого), несколько расплывчаты и едва ли отличаются от метафизики. Как признает Поппер, эти черты разделяют и многие научные теории. Во-вторых, ненаучная теория может иметь ценность для науки двумя способами.Атомизм стал поддающимся проверке, когда он был расширен, чтобы стать проверяемым. Поступив так, она перестала быть метафизической, но другие теории остались непроверяемыми и, тем не менее, наводили на мысль об эмпирической работе. Поппер не указывает, сделали ли они это, предлагая проверяемые гипотезы, но даже если бы они это сделали, эта роль позволила бы отнести их к (психологическому) контексту открытия. Об отношении Кеплера к астрологии он отмечает: «Здесь, как часто… важные гипотезы могут происходить из поистине фантастических идей: происхождение не имеет значения, пока гипотеза поддается проверке.'(1983, с. 191). В-третьих, если метафизические теории могут стать научными теориями, когда они дополнены дополнительными предположениями, то, похоже, статус теории как метафизической ей не присущ. Это кажется особенно верным, если, как в случае атомизма, дополнительные требования являются относительно низкими, например, оценка размера молекулы. Теперь Поппер фактически неверно определяет, как атомизм стал частью науки: проверяемые оценки физических свойств атомов стали доступны только в двадцатом веке в результате процесса триангуляции, задуманного Жаном Перреном (см. Nye 1972).Это произошло через много лет после того, как атомизм стал частью науки: широко атомистические теории молекулярной структуры можно было проверить, по крайней мере косвенно, химическими средствами с 1860-х годов, с помощью процесса, который Алан Рок назвал «подсчетом изомеров» (см. Rocke 2010, глава 7). ). Как и многие философы науки двадцатого века, Поппер имел тенденцию игнорировать химию.
По основной логической точке, что метафизическое (потому что непроверяемое) может стать научным (потому что проверяемым) просто соединяясь с другими утверждениями , Поппер явно прав.Более того, в двадцатом веке нужно было указать на это. Но следствием признания этой важной истины является то, что различие между научными и метафизическими теориями немедленно становится контекстуальным и, следовательно, исторически случайным, а не вневременной чертой их содержания или логической формы, потому что это зависит от того, была ли предложена конкретная теория. наряду с другими утверждениями, вместе с которыми это подразумевает некоторые эмпирически проверяемые последствия.Фактически, кажется, что различие между метафизикой и наукой полностью исчезает. Footnote 9 Другие теории, которые Поппер считал однозначно научными, такие как механика Ньютона, также не поддавались проверке в отдельности, требуя дополнения вспомогательными предположениями, и он явно охарактеризовал теорию эволюции Дарвина, которая для большинства других философов является частью науки, как «программа метафизических исследований» (1974, стр. 133–143).
Поппер справедливо отверг значение как аспект, по которому наука должна отличаться от ненаучной.Более того, идея о том, что метафизическая теория может стать проверяемой (и, следовательно, научной) путем дополнения, поддерживает наше первое условие: семантическое равенство метафизики и науки. Трудно понять, как добавление дополнительных посылок может волшебным образом превратить метафизику в науку, если эти две вещи существенно различаются по природе своего содержания или их логической форме. Однако для Поппера метафизическая теория, которая остается непроверяемой, не может быть частью науки. Несмотря на то, что кто-то может назвать его «важным», трудно понять, чем его суггестивная роль отличается от роли яблока Ньютона или змеи Кекуле, поскольку, как мы видели, он также считал, что происхождение проверяемой теории «никогда имеет значение’.Эта странная и несколько противоречивая позиция относительно роли метафизики в науке навязана Попперу из-за того, что он придерживался фальсификационистского критерия демаркации. Метафизические принципы не могут быть полностью частью науки, потому что они не поддаются проверке.
Уоткинс использовал игрушечный пример — «доктрины призрачной вселенной» (1958, стр. 344) — для описания роли метафизики в науке, которая все еще в целом попперовская, но более тонкая, чем собственная точка зрения Поппера. Рассмотрим замок, который считается населенным привидениями.Поскольку оно включает экзистенциальное утверждение (« что-то есть » (стр. 344)), это убеждение неопровержимо, хотя оно также может быть «драматично, хотя и не окончательно подтверждено жутким опытом» (стр. 344). Некоторые метафизические теории являются или влекут за собой утверждения о тесно связанной форме, утверждает Уоткинс: те, которые «утверждают о завуалированном существовании чего-то во вселенной, о чем мы можем уловить подтверждающие проблески» (стр. 344). Поскольку они неопровержимо подтверждаемы, но неопровержимы, они «пользуются особой привилегией в борьбе идей за существование» (стр.344). Они «вненаучные», но могут влиять на развитие научных теорий.
Логическая форма типичной «доктрины вселенной с привидениями» включает в себя как универсальную, так и экзистенциальную количественную оценку (1958, стр. 346), относительно низкоуровневый пример из химии, заключающийся в том, что «для любого металла существует кислота, которая растворяет его». (1958, с. 346). Детерминизм часто понимается как утверждение, что «каждое событие имеет причину» (1958, стр. 348). Исходя из предположения, что причинное утверждение, такое как «X вызывает Y», требует наличия закона природы, который включает взаимосвязь между ними, детерминизм предписывает ученым искать законы природы (1958, стр.356). Точно так же механизм, понимаемый как утверждение, что «или каждое физическое изменение существуют смежные и одновременные факторы, вызывающие это изменение» (1958, стр. 350), предписывает ученым никогда не принимать «оккультные качества, действие на расстоянии, мгновенную передачу». или любые другие отклонения от принципа действия путем контакта »(1958, стр. 356).
Теперь может быть так, что каждой метафизической доктрины может быть выражено в этой форме или влечет за собой утверждение, которое может быть выражено в этой форме.Утверждение, что все метафизические утверждения в науке могут быть истолкованы как имеющие эту форму (то есть доктрины призрачной вселенной), могло бы быть вполне тривиальным, если бы не было никаких ограничений в отношении того, какие классы сущностей могут быть введены для кванторов. Интересно, что это более сильное утверждение само по себе имеет ту же логическую форму, что и доктрины вселенной с привидениями, хотя и с кванторами второго порядка: для каждой метафизической теории существует класс сущностей, которые при количественной оценке позволяют сформулировать эквивалентное утверждение: форма вселенной с привидениями.Однако Уоткинс совершенно разумно никогда не предлагает, чтобы все метафизических утверждений могли быть выражены таким образом, делая лишь более слабое утверждение, что «эта структура является общей для ряда вненаучных идей, которые серьезно повлияли на развитие науки» (1958). , с. 344).
Суть композиционной программы в химии можно переформулировать в соответствии с предложением Уоткинса: для каждого составного вещества есть элементарные вещества, из которых оно (материально) состоит.Это утверждение, однако, является следствием более логически более сильного утверждения, которое химики после Лавуазье также поддержали бы: существуют элементарные вещества, из которых (материально) состоит каждое химическое вещество. По отдельности эти утверждения неопровержимы, но подтверждаемы, и работы химиков с 1790-х годов, заполнившие таблицу простых веществ Лавуазье, подтвердили их конкретными примерами. Попутно некоторые из простых веществ, придуманных Лавуазье, были удалены (калорийность, легкость), а требования к индивидуальному составу были пересмотрены (было принято, что кислота морской соли не содержала кислорода).Более того, как указывает Захар (2007, с. 139), метафизический характер доктрин вселенной Уоткинса проистекает не из содержащихся в них концепций или ненаблюдаемой природы сущностей, которые они количественно оценивают, а из их логической формы: «ибо каждая субстанция есть некоторая субстанция, в которой она растворяется » включает наблюдаемое отношение » x растворяет y », и тем не менее является столь же явно метафизическим (потому что не поддающимся анализу), как ‘каждое событие имеет причину’. Идея доктрины вселенной с привидениями кажется искренней чтобы осветить композиционную программу в химии и метафизический характер ее основных утверждений: экзистенциальное утверждение мотивирует поиск своего творца истины, которым может быть призрак, растворитель или несколько химических элементов.
Однако принятие Уоткинсом фальсификационистского критерия разграничения науки и ненаучности означает, что его точка зрения сталкивается с той же фатальной трудностью, что и точка зрения Поппера. Метафизика остается чем-то иным, чем наука: «между царством аналитических истин и царством эмпирических утверждений находится ничейная земля доктрин вселенной с привидениями» (1958, стр. 359). Это жесткое разделение влечет за собой, что даже там, где доктрина вселенной с привидениями играет важную роль в науке, это не может служить простым аргументом в пользу ее истинности, потому что (i) разные части науки могут поддерживать разные метафизические теории; (ii) эмпирические теории, поддерживающие метафизические теории, позволили бы им препятствовать конкуренции (1958, стр.363–365). Нельзя не думать, что если метафизические теории просто принять как часть науки, эти трудности исчезнут или, по крайней мере, представляют собой не больше трудностей, чем логические столкновения между успешными научными теориями.
Поппер рассматривал методологию программ научных исследований Лакатоса как развитие его идеи программы метафизических исследований. Footnote 10 Это несправедливо во многих отношениях, но для нашего настоящего обсуждения есть одно действительно важное различие между ними.В обзоре собранных статей Лакатоса Ян Хакинг отметил, что Лакатос совершил «отход от демаркационной проблемы Поппера» (1979, стр. 384):
Поппер пришел к неявному разделению на науку, метафизику и гадость. Метафизика — это серьезное предположение, которое когда-нибудь может привести к положительной науке. У логических позитивистов была наука и метафизика — гадость, но Поппер имел в виду лучший набор различий, о чем свидетельствует тот факт, что гадость теперь организовалась как нечто, отличное от умозрительной метафизики.Лакатос теперь готов объединить метафизику, которая становится наукой, с самой наукой, потому что это часть более широкого роста знания, которое его беспокоит. Таким образом, наука-метафизика противостоит гадости. (Взлом, 1979, стр. 384–385)
Здесь стоит сделать два комментария. Во-первых, идея о том, что «наука-метафизика противостоит гадости», требует фиксированной метафизики не больше, чем фиксированной науки. Лакатос был убежденным фаллибилистом. Изменения возможны в любой области науки, включая метафизику.Исследовательская программа со связанной метафизикой может быть заменена в любое время более успешной исследовательской программой с совершенно иной метафизикой. Наука qua наука не имеет метафизических основ. Во-вторых, даже фраза «метафизика — наука противостоит дерьму» предполагает слишком большой контраст между наукой и метафизикой. Комментируя попперианцев Джозефа Агасси и Джона Уоткинса, Лакатос замечает
Я пошел намного дальше, чем они, в стирании разграничения между [Поппером] «наукой» и [Поппером] «метафизикой»: я даже больше не использую термин «метафизический».Я говорю только о научных исследовательских программах, твердое ядро которых неопровержимо не обязательно из-за синтаксиса, но, возможно, из-за методологических причин, не имеющих ничего общего с логической формой. (1970, стр.184) Сноска 11
По мнению Лакатоса и Захара, метафизические допущения следует искать в самом сердце науки, в твердом ядре исследовательской программы (Захар 1989, стр. 21; 2007, стр. 138). В этом смысле они выше эмпирической схватки, но в то же время способны играть эвристическую и регулирующую роль в развитии конкретных научных теорий за счет их «предписывающего значения» структуры физических законов и объяснений (1989, с.21). Таким образом, согласно Захару, «Специальная теория относительности основана на метафизическом утверждении, что не существует привилегированной инерциальной системы отсчета». Это приводит к предписанию, согласно которому все теории должны принимать одну и ту же форму во всех инерциальных системах отсчета »(1989, с.
